Method Article
마우스 난모세포에서 세포질 미세소관 조직 센터의 다광자 레이저 제거
요약
근적외선 펨토초 레이저를 사용하여 중기 I 동안 마우스 난 모세포에서 세포질 미세 소관 조직 중심의 고갈을 가능하게하는 최적화 된 프로토콜이 제시됩니다.
초록
난 모세포 감수 분열의 충실도는 발달 적으로 유능한 유배체 알을 생성하는 데 중요합니다. 포유류에서 난 모세포는 첫 번째 감수 분열의 I 단계에서 긴 정지를 겪습니다. 사춘기 이후와 감수 분열이 재개되면 핵막이 분해되고 (핵 외피 파괴) 스핀들은 주로 난 모세포 중심에서 조립됩니다. 초기 중앙 스핀들 위치는 비정상적인 키네토코어-미세소관(MT) 부착물 및 이수성으로부터 보호하는 데 필수적입니다. 중앙에 위치한 스핀들은 시간에 민감한 방식으로 피질쪽으로 이동하며, 이는 작은 극체를 압출하는 데 필요한 과정입니다. 유사분열 세포에서 스핀들 위치는 중심체 매개 아스트랄 MT와 세포 피질 사이의 상호 작용에 의존합니다. 반대로, 마우스 난 모세포는 고전적인 중심체가 부족하고 대신 수많은 중심 MT 조직 센터 (MTOC)를 포함합니다. 중기 I 단계에서 마우스 난 모세포는 두 가지 다른 MTOC 세트를 가지고 있습니다 : (1) 스핀들 폴 (극성 MTOC)을 조립하기 위해 클러스터링되고 분류 된 MTOC와 (2) 세포질에 남아 있고 스핀들 형성에 직접 기여하지는 않지만 스핀들 위치 및시기 적절한 스핀들 이동을 조절하는 데 중요한 역할을하는 중기 세포질 MTOC (mcMTOC). 여기서, Cep192-eGfp 리포터 마우스로부터 수집된 난모세포에서 내인성으로 표지된 mcMTOCs를 선택적으로 고갈시키기 위한 다광자 레이저 절제 방법이 설명된다. 이 방법은 포유류 난 모세포에서 스핀들 위치 및 이동의 기초가되는 분자 메커니즘의 이해에 기여합니다.
서문
반수체 배우자 (정자 및 난 모세포)는 감수 분열을 통해 생성되며, 이는 수정 전에 염색체 수 감소에 필요한 두 번의 DNA 복제 후 두 번의 연속 분열을 수반합니다. 포유류에서 초기 태아 생활 동안 난 모세포는 첫 번째 감수 분열의 전상 I의 디 플로 텐 단계 인 발아 소포 (GV) 단계에서 긴 정지 (사춘기까지)를 겪습니다. 감수 분열 재개 후, GV 난 모세포는 핵 외피 파괴 (NEBD)를 거치고, 스핀들은 주로 난 모세포 중심 1,2,3에서 조립된다. 나중에 F- 액틴에 의해 구동되는 스핀들은 난 모세포 중심에서 피질로 적시에 이동하여 고도로 비대칭 인 분열을 보장하여 작은 극체 (PB)4,5,6을 가진 알을 만듭니다.
유사분열 세포에서, 중심체는 페리센트린, γ-튜불린, Cep152 및 Cep1927과 같은 중심주위 물질 성분(PMC)에 의해 둘러싸인 한 쌍의 중심체로 구성된다. 이러한 중심체 함유 중심체는 양극성 스핀들 형성의 충실도에 기여합니다8. 그러나 중심소체는 설치류9를 포함한 다양한 종에서 초기 난자 생성 동안 손실됩니다. 따라서 마우스 난모세포는 수많은 중심체 미세소관(MT) 조직 센터(MTOC)를 사용하여 중심심 독립적 방추 조립 경로를 채택합니다9,10. 감수 분열이 재개되면, 핵 주위 MTOC는 많은 수의 더 작은 MTOC로 재 응축, 스트레칭 및 단편화의 세 가지 뚜렷한 단계를 거친다. 그런 다음 조각화된 MTOC를 클러스터링하고 정렬하여 양극성 스핀들10,13,14를 구성합니다. MTOC의 또 다른 풀은 NEBD 동안 세포질에 위치합니다. 이러한 세포질 MTOC 중 일부는 이동하여 스핀들 극(극성 MTOC, pMTOC)을 형성합니다.10,11. 최근에, 방추 극 형성에 기여하지 않지만 중기 I (Met I) 동안 난 모세포 세포질에 남아있는 중기 세포질 MTOC (mcMTOC)라고 불리는 세포질 MTOC의 또 다른 하위 집합이 발견되었습니다.15. 다광자 레이저 제거에 의해 mcMTOC를 고갈시키거나 자가포식 억제에 의해 이들의 수를 비정상적으로 증가시키면 스핀들 위치 지정 및 이동이 교란되고 중기 II 난모세포에서 이수성 발생률이 증가합니다15.
흥미롭게도 mcMTOC는 여러 측면에서 pMTOC와 다릅니다15. 예를 들어, 주로 핵 주위 MTOC에서 유래하는 pMTOC와 달리 mcMTOC는 난 모세포 피질에서 유래합니다. 스핀들이 여전히 난모세포 중심에 있을 때, mcMTOC는 PB 압출(15)을 위해 스핀들이 이동하는 측면에 비대칭적으로 반대 방향으로 국한된다. 아스트랄 유사 MT는 상대적으로 큰 난 모세포 세포의 피질에 도달 할 수 없습니다. 따라서 이러한 mcMTOC는 MT를 핵으로 만들어 스핀들 (아스트랄 유사 MTOC를 통해 )을 피질에 고정시킵니다. 이러한 발견은 mcMTOC 핵 MT 힘이 피질쪽으로 스핀들 이동을 유도하는 F- 액틴 매개 힘을 상쇄하는 모델을 시사합니다. 이 두 가지 반대되는 힘 사이의 균형은 중앙 스핀들 위치 지정과 시기 적절한 스핀들 이동(15)을 조절하는 데 필수적입니다.
현재까지 검사된 모든 PMC 단백질(페리센트린, g-튜불린, Cep192 및 오로라 키나아제 A)은 mcMTOC 및 pMTOC15의 두 MTOC 풀에 국한됩니다. 따라서 pMTOC를 교란하지 않고 mcMTOC를 선택적으로 교란시키는 화학적 또는 유전적 접근은 없습니다. 이러한 제한은 레이저 제거로 mcMTOC를 선택적으로 표적으로 삼음으로써 피할 수 있습니다. 미세 제거를 위해 개발 된 레이저 기반 기술 중 펄스 다광자 펨토초 레이저는 초점면에 국한된 정밀 충격, 근적외선의 높은 침투 깊이, 세포16,17,18에 대한 광독성 및 열 손상 감소로 인해 큰 잠재력을 보여줍니다. 이 연구는 도립 현미경에 결합 된 다중 광자 레이저를 사용하여 마우스 난 모세포에서 mcMTOC를 제거하는 선택적 접근법을 설명합니다.
프로토콜
여기에 설명 된 모든 방법은 미주리 대학교 (동물 관리 품질 보증 참조 번호 9695)의 승인을 받았습니다. Cep192-eGFP 리포터 6-8주령의 암컷 마우스를 본 연구에 사용하였다. Cep192-eGFP 리포터 마우스를 생성하기 위해, CRISPR/Cas9-매개 상동성-지향 복구를 사용하여 EGFP 리포터 유전자를 CF-1 마우스 게놈 내로 통합하였다. EGFP 리포터는 Cep192(MTOC의 필수 구성 요소)15의 C-말단에서 융합되었습니다. 마우스 콜로니를 유지하기 위해, 동형접합체 Cep192-eGfp 리포터 마우스를 사용하였다. 모든 동물은 21 ° C 및 55 % 습도의 케이지 (최대 4 마리 동물 / 케이지)에서 유지되었으며, 12 시간의 명암 사이클과 음식과 물에 대한 자유로운 접근이 이루어졌습니다.
1. 마우스 난모세포 수집
- 배양 배지(Chatot, Ziomek, 및 Bavister, CZB19, 재료 표 참조)를 준비하고, 이를 37°C 및 5%CO2 에서 밤새 배양하였다.
참고: CZB 배지는 4°C에서 1개월 동안 보관할 수 있습니다(배지 구성에 대한 보충 파일 1 참조). - CZB 배지에 글루타민 (1mM)과 밀리논 (2.5mM) (CZB + M) ( 재료 표 참조)을 보충하고 인큐베이터에 넣습니다.
참고: 밀리논은 전단계 I에서 정지된 난모세포를 유지하고 감수 분열 재개20을 예방하는 포스포디에스테라제 억제제입니다. - 3mg/mL 폴리비닐피롤리돈(PVP), 25mM hepes(pH 7.3)(보충 파일 1) 및 밀리논(2.5mM)(MEM/PVP + M, 재료 표 참조)을 포함하는 수집 배지(중탄산염이 없는 최소 필수 배지, MEM)를 준비합니다.
- 수집 및 배양 접시를 준비하고 60mm 및 35mm 페트리 접시에 각각 4개의 마이크로방울(100μL)의 수집 배지(MEM/PVP + M)와 2개의 마이크로방울(CZB+M) 배지(CZB+M)를 만들고 미네랄 오일로 덮습니다( 재료 표 참조). 수집 접시를 슬라이드 상에 따뜻하게 유지하고, 배양 접시를 37°C 및 5%CO2에서 배양기에 넣는다.
- 난모세포 채취 44-48시간 전에 성적으로 성숙한(6-8주령) Cep192-eGFP 리포터 암컷 마우스에 임신한 암말의 혈청 성선 자극호르몬(PMSG, 재료 표 참조) 5IU를 복강 주사합니다.
- 자궁 경부 탈구로 마우스를 희생시키고, 난소21을 확인 및 제거하고, 37 ° C에서 예열 된 수집 배지 (MEM / PVP + M)가 들어있는 시계 유리로 옮깁니다.
- 시계 유리 바닥에 1mL 주사기를 대고 함께 묶인 재봉 바늘을 사용하여 여러 번(난소당 ~40회) 구멍을 뚫어 난모세포를 배지로 방출하여 난소를 고정합니다.
- 플라스틱 이송 피펫을 사용하여 단계 1.7의 적운-난모세포 복합체(COC)가 포함된 모든 배지를 빈 100mm 플라스틱 페트리 접시에 옮깁니다.
- 실체 현미경으로 파스퇴르 유리 피펫을 사용하여 COC를 수집하고 MEM/PVP + M이 포함된 수집 접시로 옮깁니다.
- 좁은 파스퇴르 유리 피펫(직경 약 100μm)을 사용하여 부드럽고 반복적인 피펫팅으로 난모세포를 기계적으로 탈퇴시킨 다음 CZB+M 배양 접시로 옮기기 전에 (100μL) MEM/PVP + M(수집 접시)의 4개 마이크로드롭으로 옮기고 세척합니다.
- 탈질된 난모세포를 공기 중의 5%의CO2 와 함께 37°C에서 1시간 동안 배양한다.
2. 난모세포 미세주입
- 250μL 떨어뜨린 MEM/PVP + M을 100mm 플라스틱 페트리 접시 뚜껑에 넣고 미네랄 오일로 덮습니다.
알림: 페트리 접시 덮개에는 마이크로 매니퓰레이터를 조정할 수 있는 더 많은 공간을 제공하는 하단 림이 있습니다. - 미세 주입 시스템을 켭니다 ( 재료 표 참조).
- 현미경의 온난화 단계(37°C)에 미세 주입 접시를 놓습니다.
- 마이크로로더 피펫 팁(재료 표 참조)을 사용하여 0.5μL의 mCh-Cep192cRNA를 주사 바늘에 로드하고 주사 바늘을 마이크로 매니퓰레이터에 고정합니다.
- 탈질된 난모세포(단계 1.11)를 250 μL 마이크로드롭(단계 2.1)으로 옮깁니다.
- 20x 또는 40x 대물 렌즈 아래에서 난모세포 위치에 따라 주사 바늘과 고정 바늘의 위치와 초점을 조정합니다(그림 1).
- 미세주입 장치를 설정하고 주입 압력(pi), 보상 압력(pc) 및 주입 시간(ti)을 5-10pl의 mCh-Cep192 cRNA를 주입할 수 있도록 설정합니다(MTOC를 외인성 표지하기 위해).
- 조심스럽게 핵을 건드리지 않고 난 모세포를 주입하십시오.
- 모든 난모세포가 주입되면 CZB+M의 3개의 마이크로드롭으로 세척하고 배양 접시(CZB+M)로 옮긴 다음 mCh-Cep192 발현을 허용하기 위해 37°C에서 3시간 동안 배양합니다.
3. 난모세포 성숙
- 적어도 3 시간 동안 공기 중 5%CO2 로 인큐베이터에서 미리 평형화된 CZB 배지에 글루타민(1 mM)을 첨가하여 성숙 배지를 준비한다.
- 35mm 페트리 접시에 두 개의 마이크로 방울 (100μL)의 성숙 배지를 만들고 미네랄 오일 (성숙 접시)로 덮으십시오.
- 100 μL 밀리논이 없는 CZB 마이크로드롭에서 프로상 I-체포된 난모세포를 최소 3회 세척하여 밀리논을 완전히 제거하고 감수 분열 재개를 허용합니다.
- 난 모세포를 성숙 접시로 옮기고 37 ° C의 공기 중에서 5 %CO2 로 가습 된 인큐베이터에서 5 시간 (prometaphase I 단계) 동안 배양합니다.
4. 절제 및 영상화를 위한 난모세포 제제
- 전구상 I 난모세포(단계 3.4)를 광유가 함유된 100μL의 성숙 배지(단계 3.1)를 함유하는 유리 바닥 배양 접시로 옮깁니다.
5. 절제를위한 현미경 준비
- 절제 최소 30분 전에 스테이지 인큐베이터의 온도 컨트롤러( 재료 표 참조)를 켜고 37°C로 설정합니다.
- CO2 컨트롤러를 켜고 5 % CO2로 설정하십시오.
- 40x 오일 이멀젼 아포크로매틱 대물렌즈를 선택하고 액침 오일을 소량 떨어뜨립니다.
- 난모세포가 있는 유리 바닥 배양 접시를 스테이지 탑 인큐베이터에 장착하고 인큐베이터를 가스 뚜껑으로 덮습니다.
- 이미지 수집 소프트웨어( 재료 표 참조)에서 여러 스테이지 위치를 저장할 수 있는 옵션을 선택합니다(예: "마크 정의 및 실험 찾기"). 투과광 명시야 조명을 사용하여 개별 난 모세포를 중심으로하고 위치를 저장합니다.
- 이미지 수집 소프트웨어에서 XYZ 스캔 모드를 선택하고 이미지 형식을 256 x 256 픽셀로 설정하고 줌 계수를 2.5x - 3.0x로 설정하고 스캔 주파수를 600Hz로 선택합니다. 이는 약 1.6μs의 픽셀 체류 시간에 해당합니다.
- 레이저 출력의 약 10%(샘플 레벨에서 4.0μW에 해당)에서 488nm 여기 레이저 라인을 설정하고( 재료 표 참조) 500-550nm의 스펙트럼 대역폭을 사용하여 MTOC의 GFP 신호를 관찰합니다. mCherry 태그가 붙은 Cep192에서 형광을 동시에 관찰하려면 레이저 출력의 약 8%(샘플 수준에서 10.7μW에 해당)에서 585nm 여기 레이저 라인을 설정하고 595-645nm의 스펙트럼 대역폭으로 설정된 다른 검출기를 사용합니다.
참고: 난모세포 경계를 동시에 감지하기 위해 컨포칼 현미경의 투과광 검출기(TLD)를 사용하는 것이 좋습니다. - 라이브 스캔 모드와 z-드라이브의 수동 제어를 사용하여 난모세포에서 MTOC를 스크리닝합니다.
- mcMTOC가 감지되면 그 주위에 정사각형 관심 영역(ROI)을 그립니다.
6. mcMTOC의 제거
- 펨토초 레이저를 740nm 파장으로 설정합니다.
참고: 레이저 파장은 현미경과 레이저 조건에 따라 변경될 수 있습니다. - 다광자 현미경의 전기 광학 변조기( 재료 표 참조)를 사용하여 레이저 출력을 샘플 평면에서 70-80mW 전력에 해당하는 60%-70%로 설정합니다.
알림: 레이저에 펨토초 펄스 보상기가 장착된 경우 이를 사용하여 그룹 지연 분산(GDD)을 보정합니다. GDD 보정은 효율적인 mcMTOC 제거에 필요한 레이저 출력의 양을 줄이고 난 모세포의 광 손상을 최소화합니다. GDD 제어는 일반적으로 상용 다광자 현미경의 이미지 획득 소프트웨어와 통합됩니다. - 5.6단계와 동일한 이미지 형식, 확대/축소 비율 및 스캔 빈도를 사용합니다. 선 및 프레임 평균 매개 변수를 1로 설정합니다.
- 소프트웨어에서 스캔 버튼을 클릭하여 선택한 ROI의 단일 레이저 스캔 을 수행하여 mcMTOC의 제거를 수행합니다.
- 5.7단계의 채널 설정을 사용하여 다광자 레이저 노출 전후에 촬영한 GFP 표지 구조의 이미지를 비교하여 제거 결과를 검토합니다. 절제가 성공하면 표적 mcMTOC에서 GFP 형광의 강도가 백그라운드에서 관찰된 수준으로 감소합니다.
- GFP-표지 구조의 일부 단편이 남아 있는 경우, mcMTOC의 다양한 z 평면에 초점을 맞추어 6.4단계를 한 번 이상 반복한다.
- 5.7단계의 채널 설정을 사용하여 mcMTOC 관련 mCherry 신호(mCh-Cep192)의 완전한 손실에 의한 제거 효율을 확인합니다.
- 난모세포의 모든 MTOC(다양한 초점면에서)가 제거될 때까지 5.8단계에서 6.7단계를 반복합니다.
참고: 이 프로토콜은 다광자 레이저 노출 후 mcMTOC 고갈을 확인하고 GFP 광퇴색으로 인해 GFP 형광 손실이 발생할 가능성을 배제하기 위한 전략으로 mCh-Cep192 미세 주입을 사용합니다. 그러나 이 프로브의 미세 주입은 선택 사항이며 절제 절차에는 필요하지 않습니다.
결과
다광자 레이저 절제는 세포 내 구조를 선택적으로 제거하는 효율적인 방법을 제공합니다. 현재 연구는 마우스 난 모세포에서 mcMTOC를 선택적으로 고갈시키기 위해 다광자 레이저 제거를 사용했습니다. 레이저 제거는 표적 mcMTOC의 내인성 GFP 형광이 배경과 유사한 수준으로 감소하는 것으로 나타난 바와 같이 mcMTOC를 효율적으로 고갈시켰습니다. 표적 mcMTOC의 외인성 mCh-Cep192도 레이저 절제 후 폐지되었습니다. mcMTOC의 레이저 제거는 난모세포 내의 모든 mcMTOC가 고갈되도록 난모세포 내의 다른 초점면(mcMTOC가 있는 곳, 그림 2)에서 수행해야 합니다(그림 3).
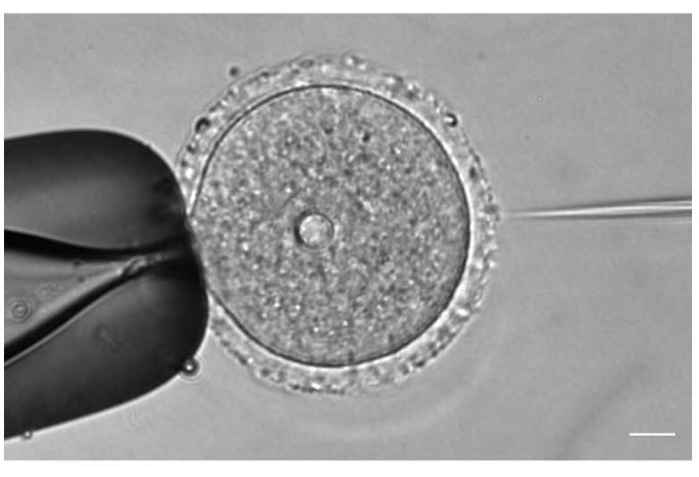
그림 1: 난모세포 미세 주입. mCh-Cep192 cRNA를 갖는 전상 I- 체포 마우스 난 모세포의 미세 주입. 스케일 바: 10 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
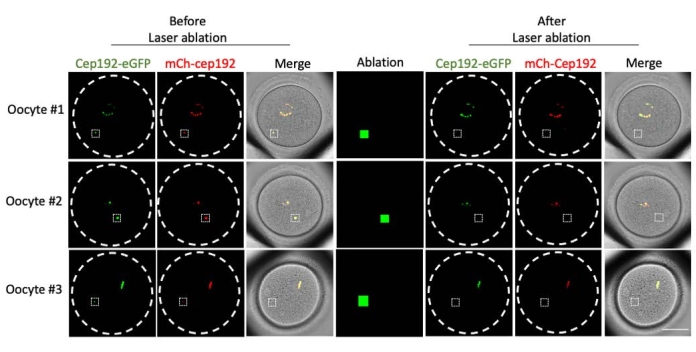
그림 2: 마우스 난모세포에서 mcMTOC의 고갈. 단일 초점면의 대표 이미지. 흰색 사각형은 다광자 레이저 제거 전후의 mcMTOC를 나타냅니다. 스케일 바: 40 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
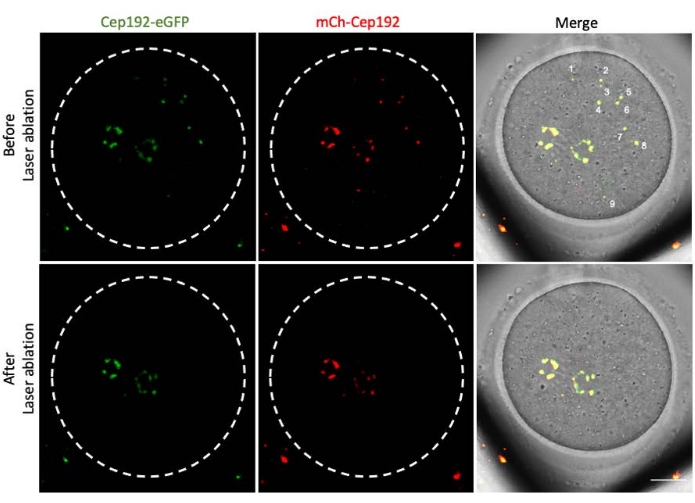
그림 3: 마우스 난모세포의 다른 초점면에서 mcMTOC의 고갈. mcMTOC 절제 마우스 난모세포의 대표적인 최대 투영 이미지. 스케일 바: 20 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 1 : Chatot, Ziomek 및 Bavister (CZB) 및 중탄산염이없는 최소 필수 배지 (MEM / PVP)의 조성물. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
세포내의 세포골격-관련 구조를 교란시키는 상이한 방법들이 존재한다 22,23,24,25. 그러나 세포 생존력을 손상시키지 않고 표적 구조를 선택적으로 교란시키는 효율적인 기술을 찾는 것은 어려운 일입니다. 여기에 제시된 다광자 레이저 절제 방법은 난모세포 생존력을 변경하지 않고 난모세포 내의 mcMTOC에 선택적 기계적 섭동을 유도하는 효율적인 전략입니다.
레이저 절제는 유사분열 및 감수 분열 22,23,26,27 동안 염색체 분리를 제어하는 분자 메커니즘을 이해하는 데 광범위하게 사용되었습니다. 체세포(28)에 비해 상대적으로 큰 크기(직경 >80mm)로 인해 포유동물 난모세포(28)의 세포 내 구조의 절제는 도전을 나타냅니다. 더욱이, 중기 I 난모세포의 평균 mcMTOC 부피는 ~20μm15이며, 이는 추가적인 도전을 나타낸다. 이러한 문제를 극복하기 위해 더 깊은 조직 침투를 제공하는 효율적인 방법을 채택해야 합니다. 절제를 위해 다광자 레이저를 사용하는 주요 이점은 오프 타겟 효과(29)를 최소화하면서 세포 깊숙이 도달 할 수있는 능력이다.
표적 구조를 고갈시키는 레이저 절제 방법의 효능과 효율성을 검증하려면 형광 표지 단백질을 사용하여 시간이 지남에 따라(절제 전후) 표적 구조를 식별하는 것이 좋습니다23. 레이저 제거는 구조로서 전체 mcMTOC를 고갈시키며, 더 작은 mcMTOC는 단일 레이저 노출만 고갈시키면 되지만 더 큰 mcMTOC는 다른 초점면에서 둘 이상의 레이저 노출이 필요할 수 있습니다. 또한 mcMTOC 절제의 효율성을 추가로 확인하기 위해 MTOC 마커(예: γ-튜불린, 페리센트린 또는 Cep192)를 사용하여 대조군 및 mcMTOC 절제 난모세포의 하위 집합을 고정하고 면역 표지하는 것이 좋습니다. 대조 난 모세포에서 mcMTOC에 인접하지만 겹치지 않는 세포질 영역이 레이저에 노출됩니다.
이 실험은 난 모세포 내의 다른 초점면 사이를 이동하는 동안 여러 mcMTOC 제거가 필요합니다. 따라서 실험 시간을 최소화하여 난모세포 생존력을 높이기 위해 실험을 실행하기 전에 이 기술을 여러 번 연습하는 것이 좋습니다. 또한, 난모세포 생존력에 영향을 미치지 않으면서 mcMTOC를 고갈시키기에 충분한 최소 레이저 출력을 사용하는 것이 중요합니다.
이 기술에는 몇 가지 제한 사항이 있습니다. 첫째, 다광자 컨포칼 현미경은 일반 컨포칼 현미경보다 상대적으로 비쌉니다. 둘째, 서로 다른 초점면에서 모든 mcMTOC를 교란하는 것은 화학적 또는 유전적 섭동보다 시간이 많이 걸립니다. 셋째, 이 프로토콜은 가능한 한 최단 시간에 모든 mcMTOC를 제거할 수 있는 기술적 기술이 필요합니다. 그러나 일단 숙달되면 다광자 레이저의 사용은 mcMTOC를 포함한 마우스 난 모세포의 여러 세포 내 구조를 교란시키는 훌륭한 전략을 제공하여 스핀들 위치를 조절하는 분자 메커니즘과 포유류 난 모세포에서의 적시 이동에 대한 이해에 기여합니다.
공개
저자는 경쟁 이익이 없다고 선언합니다.
감사의 말
저자는 귀중한 도움과 토론에 대해 Balboula 실험실의 모든 구성원에게 감사드립니다. 저자는 mCherry-Cep192 구조를 친절하게 공유해 준 Melina Schuh에게 감사드립니다. 이 연구는 R35GM142537 (NIGMS, NIH)에서 AZB로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 4 IN thinwall GL 1.0 OD/.75 ID | World precision instrument | TW100F-4 | Injection needles |
| Borosilicate glass | Fisherbrand | Cat# 13-678-20D | |
| Borosilicate glass capillarities | World Precision Instrument | Cat# TW100-6 | Holding needles |
| Bovine serum albumine | MilliporeSigma | Cat# A4503 | |
| Cage incubator for Leica DMI6000 B microscope | Life Imaging Services GmbH | ||
| Calcium chlrode dihydrate | MilliporeSigma | Cat# C7902 | |
| CO2 controller | Pecon | # 0506.000 | |
| CO2 Cover HP | Pecon | # 0506.020 | |
| DL-Lactic acid | MilliporeSigma | Cat# L7900 | |
| DMi8 | Leica | N/A | Microscope |
| EDTA | MilliporeSigma | Cat# E5134 | |
| Femtojet 4i | Eppendorf | N/A | Microinjector |
| Femtotips Microloader | Fisher scientific | E5242956003 | |
| Gentamicin | MilliporeSigma | Cat# G1272 | |
| Gentamycin | MilliporeSigma | Cat# 1272 | |
| Glass bottom dish | Mat Tek Corporation | Cat# P35G-1.0-20-C | |
| Hepes | MilliporeSigma | Cat# H3784 | |
| Hepes Sodium Salt | MilliporeSigma | Cat # H3784 | |
| Hera Cell vios 160i | Thermo | N/A | CO2 incubator |
| Leica TCP SP8 spectral laser scanning confocal micorscope with inverted stand DMI6000 B | Leica Microsystems, Inc | N/A | |
| L-Glutamine | MilliporeSigma | Cat#G8540 | |
| Magnesium sulfate dihydrate | MilliporeSigma | Cat# M7774 | |
| MaiTai DeepSee Ti-Sapphire femtosecond laser | Spectra-Physics | N/A | |
| mCH-Cep192 cRNA | N/A | ||
| Medium Essential Medium Eagle - MEM | MilliporeSigma | Cat #M0258 | |
| Milrinone | MilliporeSigma | Cat# M4659 | |
| Mineral oil | MilliporeSigma | Cat# M5310 | |
| Minimum essential medium eagle (MEM) | MilliporeSigma | Cat# M0268 - 1L | |
| Mouse: Cep192-eGFP reporter CF-1 | N/A | ||
| Petri dish (100 mm) | Fisherbrand | Cat# FB0875712 | |
| Petri dish (35 mm) | Corning | Cat# 430165 | |
| Petri dish (60 mm) | Falcon | Cat# 351007 | |
| Phenol Red | MilliporeSigma | Cat# P5530 | |
| Polyvinylpyrolidone | MilliporeSigma | Cat# P2307 | |
| Polyvinylpyrolidone (PVP) | MilliporeSigma | Cat# P2307 | |
| Potassium chloride | MilliporeSigma | Cat# P5405 | |
| Potassium phosphate monobasic | MilliporeSigma | Cat# P5655 | |
| Pregnant mare´s serum gonadotropin | Lee BioSolutions | Cat# 493-10-10 | |
| Pyruvic acid | MilliporeSigma | Cat# P4562 | |
| Pyruvic acid | MilliporeSigma | Cat# P4562 | |
| Sewing needles | D.M.C | N/A | N° 5 * 16 Needles |
| Sodium bicarbonate | MilliporeSigma | Cat# S5761 | |
| Sodium chloride | MilliporeSigma | Cat# S5886 | |
| Stage-top heating insert P | Pecon | # 0426.300 | |
| Sterezoom S9i | Leica | N/A | Stereomicroscope |
| Syringe 1 mL | BD company | Cat# 309597 | |
| Taurine | MilliporeSigma | Cat# T0625 | |
| Temperature controller Tempcontrol 37-2 digital | Pecon | # 0503.000 | |
| The Cube temperature controller for the cage incubator | Life Imaging Services GmbH |
참고문헌
- Bennabi, I., Terret, M. E., Verlhac, M. H. Meiotic spindle assembly and chromosome segregation in oocytes. Journal of Cell Biology. 215 (5), 611-619 (2016).
- Hashimoto, N., Kishimoto, T. Regulation of meiotic metaphase by a cytoplasmic maturation-promoting factor during mouse oocyte maturation. Development Biology. 126 (2), 242-252 (1988).
- Kitajima, T. S., Ohsugi, M., Ellenberg, J. Complete kinetochore tracking reveals error-prone homologous chromosome biorientation in mammalian oocytes. Cell. 146 (4), 568-581 (2011).
- Azoury, J., Verlhac, M. H., Dumont, J. Actin filaments: Key players in the control of asymmetric divisions in mouse oocytes. Biology of the Cell. 101 (2), 69-76 (2009).
- Li, H., Guo, F., Rubinstein, B., Li, R. Actin-driven chromosomal motility leads to symmetry breaking in mammalian meiotic oocytes. Nature Cell Biology. 10 (11), 1301-1308 (2008).
- Schuh, M., Ellenberg, J. A new model for asymmetric spindle positioning in mouse oocytes. Current Biology. 18 (24), 1986-1992 (2008).
- Pimenta-Marques, A., Bettencourt-Dias, M. Pericentriolar material. Current Biology. 30 (12), 687-689 (2020).
- Hinchcliffe, E. H. The centrosome and bipolar spindle assembly: Does one have anything to do with the other. Cell Cycle. 10 (22), 3841-3848 (2011).
- Szollosi, D., Calarco, P., Donahue, R. P. Absence of centrioles in the first and second meiotic spindles of mouse oocytes. Journal of Cell Science. 11 (2), 521-541 (1972).
- Schuh, M., Ellenberg, J. Self-organization of MTOCs replaces centrosome function during acentrosomal spindle assembly in live mouse oocytes. Cell. 130 (3), 484-498 (2007).
- Clift, D., Schuh, M. A three-step MTOC fragmentation mechanism facilitates bipolar spindle assembly in mouse oocytes. Nature Communications. 6, 7217 (2015).
- Luksza, M., Queguigner, I., Verlhac, M. H., Brunet, S. Rebuilding MTOCs upon centriole loss during mouse oogenesis. Developmental Biology. 382 (1), 48-56 (2013).
- Balboula, A. Z., et al. Haspin kinase regulates microtubule-organizing center clustering and stability through Aurora kinase C in mouse oocytes. Journal of Cell Science. 129 (19), 3648-3660 (2016).
- Breuer, M., et al. HURP permits MTOC sorting for robust meiotic spindle bipolarity, similar to extra centrosome clustering in cancer cells. Journal of Cell Biology. 191 (7), 1251-1260 (2010).
- Londoño-Vásquez, D., Rodriguez-Lukey, K., Behura, S. K., Balboula, A. Z. Microtubule organizing centers regulate spindle positioning in mouse oocytes. Developmental Cell. 57 (2), 197-211 (2022).
- Konig, K., Riemann, I., Fischer, P., Halbhuber, K. J. Intracellular nanosurgery with near infrared femtosecond laser pulses. Cellular and Molecular Biology. 45 (2), 195-201 (1999).
- Galbraith, J. A., Terasaki, M. Controlled damage in thick specimens by multiphoton excitation. Molecular Biology of the Cell. 14 (5), 1808-1817 (2003).
- Maghelli, N., Tolic-Norrelykke, I. M. Laser ablation of the microtubule cytoskeleton: Setting up and working with an ablation system. Methods in Molecular Biology. 777, 261-271 (2011).
- Chatot, C. L., Ziomek, C. A., Bavister, B. D., Lewis, J. L., Torres, I. An improved culture medium supports development of random-bred 1-cell mouse embryos in vitro. Journal of Reproduction and Fertility. 86 (2), 679-688 (1989).
- Tsafriri, A., Chun, S. Y., Zhang, R., Hsueh, A. J., Conti, M. Oocyte maturation involves compartmentalization and opposing changes of cAMP levels in follicular somatic and germ cells: Studies using selective phosphodiesterase inhibitors. Developmental Biology. 178 (2), 393-402 (1996).
- Greaney, J., Subramanian, G. N., Ye, Y., Homer, H. Isolation and in vitro culture of mouse oocytes. Bio Protocol. 11 (15), 4104 (2021).
- Khodjakov, A., Cole, R. W., Rieder, C. L. A synergy of technologies: Combining laser microsurgery with green fluorescent protein tagging. Cell Motility and the Cytoskeleton. 38 (4), 311-317 (1997).
- Pavin, N., Tolic, I. M. Mechanobiology of the mitotic spindle. Developmental Cell. 56 (2), 192-201 (2021).
- Khodjakov, A., Cole, R. W., Oakley, B. R., Rieder, C. L. Centrosome-independent mitotic spindle formation in vertebrates. Current Biology. 10 (2), 59-67 (2000).
- Aist, J. R., Liang, H., Berns, M. W. Astral and spindle forces in PtK2 cells during anaphase B: a laser microbeam study. Journal of Cell Science. 104, 1207-1216 (1993).
- Bennabi, I., Manil-Segalen, M. Laser Ablation of microtubule-chromosome attachment in mouse oocytes. Methods in Molecular Biology. 1818, 153-161 (2018).
- Milas, A., Jagric, M., Martincic, J., Tolic, I. M. Optogenetic reversible knocksideways, laser ablation, and photoactivation on the mitotic spindle in human cells. Methods in Cell Biology. 145, 191-215 (2018).
- Warzych, E., Lipinska, P. Energy metabolism of follicular environment during oocyte growth and maturation. Journal of Reproduction and Development. 66 (1), 1-7 (2020).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유