Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Визуализация живых клеток личинки Drosophila melanogaster третьего возраста
В этой статье
Резюме
Здесь мы обсуждаем рабочий процесс подготовки, препарирования, монтажа и изображения живого мозга эксплантата личинок третьего возраста Drosophila melanogaster для наблюдения за клеточной и субклеточной динамикой в физиологических условиях.
Аннотация
Нервные стволовые клетки дрозофилы (нейробласты, далее NB) подвергаются асимметричному делению, регенерируя самообновляющийся нейробласт, а также образуя дифференцирующую ганглионарную материнскую клетку (GMC), которая претерпевает одно дополнительное деление, чтобы дать начало двум нейронам или глии. Исследования NB раскрыли молекулярные механизмы, лежащие в основе полярности клеток, ориентации веретена, самообновления и дифференцировки нервных стволовых клеток. Эти асимметричные клеточные деления легко наблюдаются с помощью визуализации живых клеток, что делает личинки NB идеально подходящими для исследования пространственно-временной динамики асимметричного деления клеток в живой ткани. При правильном препарировании и визуализации в среде, обогащенной питательными веществами, NB в мозге эксплантата надежно делятся в течение 12-20 часов. Ранее описанные методы технически сложны и могут быть сложными для новичков в этой области. Здесь описан протокол подготовки, вскрытия, монтажа и визуализации живых эксплантатов личинок третьего возраста с использованием добавок жирового тела. Также обсуждаются потенциальные проблемы и приводятся примеры того, как можно использовать эту технику.
Введение
Асимметричное деление клеток (ACD) - это процесс, при котором субклеточные компоненты, такие как РНК, белки и органеллы, неравномерно распределяются между дочерними клетками 1,2. Этот процесс обычно наблюдается в стволовых клетках, которые подвергаются ACD, чтобы дать начало дочерним клеткам с различными судьбами развития. Дрозофила NB делятся асимметрично, образуя один NB, который сохраняет свою стволовость, и одну ганглионарную материнскую клетку (GMC). GMC подвергается дальнейшим делениям с образованием дифференцирующих нейронов или глии3. Асимметрично делящиеся NB в изобилии присутствуют в развивающемся мозге личинок третьего возраста, которые легко наблюдаются с помощью микроскопии. На личиночной стадии третьего возраста в каждой центральной доле мозга присутствует примерно 100 NB 3,4,5,6.
Асимметричное деление клеток является высокодинамичным процессом. Протоколы визуализации живых клеток использовались для измерения и количественной оценки динамики полярности клеток 7,8,9,10, ориентации веретена 11,12,13, динамики коры актомиозина 14,15,16,17,18, биологии микротрубочек и центросом 19,20,21,22,23,24,25,26,27, а также мембрана 10,28 и динамика хроматина29. Качественные и количественные описания ACD основаны на надежных методах и протоколах для визуализации деления NB в интактном живом мозге. В следующем протоколе описываются методы подготовки, вскрытия и визуализации личиночной мозга третьего возраста для визуализации живых клеток in vivo с использованием двух различных подходов к монтажу. Эти методы лучше всего подходят для исследователей, заинтересованных в пространственно-временной динамике делений стволовых клеток, а также делений в других клетках мозга, поскольку они позволяют проводить краткосрочные и долгосрочные наблюдения за клеточными событиями. Кроме того, эти методы легко доступны для новичков в этой области. Мы демонстрируем эффективность и адаптивность этого подхода с личиночным мозгом, экспрессирующим флуоресцентно меченные микротрубочки и корковые слитые белки. Кроме того, мы обсуждаем методы анализа и соображения по применению в других исследованиях.
протокол
ПРИМЕЧАНИЕ: На рисунке 1 показаны материалы, необходимые для проведения этого исследования.
1. Соображения и подготовка к эксперименту
- Не допускайте переполнения личинок.
ПРИМЕЧАНИЕ: Качество мозга эксплантата личинок напрямую связано со здоровьем и качеством личинок до вскрытия. Личинки, которые недоедают из-за перенаселенности, обычно дают мозг более низкого качества30.- Убедитесь, что на одно блюдо с крышкой для еды приходится не более 20-30 личинок, чтобы избежать недоедания. Примеры этого можно увидеть на рисунке 2.
- Перед использованием отфильтруйте и аликвотируйте средство Schneider.
- Для каждого вскрытия подготовьте свежую среду для визуализации и вскрытия, дополнив аликвотированную среду насекомых Шнайдера 1% сывороткой роста крупного рогатого скота (BGS). Объем 5 мл среды для вскрытия и визуализации обычно достаточен для эксперимента с визуализацией.
- Перед использованием нагрейте добавленную среду до комнатной температуры (RT).
- Учитывайте продолжительность фильма, который необходимо собрать, и используйте ее для учета дополнения носителя изображения, подхода к монтажу и настроек сбора данных микроскопа.
ПРИМЕЧАНИЕ: В оптимальных условиях NB в мозге, дополненном только BGS, будут надежно делиться в течение более 3 часов.- Дополните среду визуализации, добавив ткани тела с личиночным жиром в среду для визуализации, чтобы поддерживать деление более 4 часов при проведении экспериментов, требующих более длинных фильмов.
ПРИМЕЧАНИЕ: Жировые тела выделяют митогены, которые поддерживают пролиферацию NB31, а цельных жировых тел из 10 личинок достаточно для поддержки четырех-пяти мозгов. Кроме того, было показано, что образцы, изображенные с помощью связанного с мембраной предметного стекла, делятся более 10 ч13,32, в то время как образцы, изображенные с помощью многолуночного предметного стекла, обычно делятся реже (неопубликованные наблюдения). - В качестве альтернативы можно реализовать более сложный носитель изображений для более длинных видеороликов, как описано ранее33. Минимизируйте фотоповреждения, регулируя время экспозиции, мощность лазера и частоту дискретизации для достижения наилучших результатов.
- Дополните среду визуализации, добавив ткани тела с личиночным жиром в среду для визуализации, чтобы поддерживать деление более 4 часов при проведении экспериментов, требующих более длинных фильмов.
2. Постановка и сбор личинок (рис. 2)
- Скрещивайте 1-5-дневных самок девственных мух с 1-7-дневными взрослыми самцами, чтобы получить потомство с желаемым генотипом. Для оптимального урожая скрещивайте 10-15 девственниц с 5-10 самцами. Поместите этих мух в клетку для мух с крышкой для еды (рис. 2A-C) и инкубируйте при 25 ° C.
- Ежедневно меняйте крышку от еды. Это предотвращает переполнение крышек еды личинками, что снижает качество рассеченного мозга.
- Если крышка для еды в значительной степени покрыта личинками (т. е. >30), разделите эту крышку для еды пополам и замените одну половину свежей крышкой для еды, которая также была разрезана пополам. В качестве альтернативы меняйте крышки для приема пищи на более частой основе (т.е. каждые 12 часов вместо каждых 24 часов). Примеры перенаселенных шапок для еды можно увидеть на рисунке 2E, F.
- Инкубируйте шапочку с личинками при температуре 25 °C, пока личинки не достигнут желаемого возраста.
3. Вскрытие жирового тела личинок (рис. 3)
ПРИМЕЧАНИЕ: В этом протоколе описывается вскрытие с использованием 3-луночного вскрытия.
- Пипетка ~ 400 мкл среды для вскрытия и визуализации в каждую лунку 3-луночной диссекционной чашки.
- Вымойте десять 72-96-часовых сытых личинок дикого типа, осторожно удерживая их щипцами для рассечения и погружая и вынимая из раствора для вскрытия в самый нижний лунок, пока все частицы пищи не будут смыты. После полоскания переместите чистых личинок в среднюю лунку.
- С помощью одного набора пинцетов удерживайте личинку за крючки для рта. Другим набором пинцета разорвите одну сторону кутикулы личинки.
- Этот разрыв приведет к тому, что жировые тела выльются из личинки. Жировые тела грязно-белые и полупрозрачные и будут иметь решетчатую структуру (рис. 3I). Жировые тела также будут иметь тенденцию прилипать к себе и пинцету для рассечения. После идентификации соберите как можно больше жирового тела от каждой личинки и перенесите его щипцами в самую верхнюю лунку с 400 мкл среды для диссекции RT.
4. Вскрытие личинок головного мозга (рис. 3)
- Вымойте экспериментальных личинок в среде для вскрытия и визуализации, как указано выше, чтобы освободить их от остатков пищи. Для достижения наилучших результатов избегайте хранения непрепарированных личинок в растворе для препарирования. Это приведет к тому, что личинки «утонут» и негативно скажется на качестве препарированного мозга.
- С помощью одного набора пинцетов удерживайте личинку за крючки для рта. Используя другой набор пинцета, аккуратно отрежьте/оторвите примерно 1/3 личинки с задней стороны (рис. 3A). Это приведет к тому, что элементы пищеварительного тракта, жировые тела, соединительная ткань и нервная система «вырвутся» из разорванной стороны личинки (рис. 3Б).
- С помощью одного набора пинцетов удерживайте личинку за крючки для рта. Другим набором пинцетов аккуратно расчешите кутикулу по направлению к крючкам для рта, «проталкивая» внутрь пинцетом, удерживая крючки для рта, пока вся личинка не будет вывернута наизнанку. Это движение похоже на выворачивание носка «наизнанку» (рис. 3C, D).
- Инвертируйте личинку так, чтобы центральная нервная система и другие ткани были обращены наружу, оставаясь при этом соединенными с кутикулой. На этом этапе найдите центральную нервную систему (ЦНС), чтобы избежать случайного удаления. С помощью пинцета аккуратно удалите всю ткань, не относящуюся к ЦНС, оставив только ЦНС и мозг, прикрепленные к кутикуле (рис. 3E).
- Мозг будет прикреплен к кутикуле с помощью аксональных соединений. Используя ножницы для микродиссекции, разрежьте эти аксональные связи, чтобы освободить мозг от кутикулы. Для этого сначала аккуратно прорежьте под ним доли мозга (рис. 3F). Повторите то же самое с соединениями под вентральным нервным тяжем.
ПРИМЕЧАНИЕ: Этот шаг можно выполнить пинцетом, если ножницы для микродиссекции недоступны. Будьте особенно осторожны при использовании пинцета, чтобы гарантировать, что мозговая ткань не будет чрезмерно растянута во время удаления кутикулы, потому что механический стресс негативно скажется на здоровье мозга. - Перенесите рассеченный мозг в лунку со средой для вскрытия и визуализации. Для экспериментов с визуализацией продолжительностью более 3 часов используйте среду для вскрытия и визуализации, дополненную жировыми телами, как описано выше. Препарируйте личинок партиями, чтобы время вскрытия не превышало 20 минут.
5. Монтаж и визуализация (рис. 4)
- Для визуализации с помощью мембранного предметного стекла34:
- Соберите как препарированные мозги, так и изолированные жировые тела в последнем лунке вскрытия.
- Соберите половину предметного стекла, поместив газопроницаемую мембрану на заднюю часть предметного стекла, и вдавите разъемное кольцо в центр, удерживая его на месте (рис. 4A-C).
- Используя микропипетку объемом 200 мкл, перенесите на мембрану до 10 рассеченных мозгов и как можно больше жирового тела (см. Выше) в ~130-140 мкл среды для вскрытия и визуализации. Убедитесь, что среда с образцами осаждается в центре газопроницаемой мембраны (рис. 4D, E).
- Ориентируйте мозг на популяцию NB, которые будут визуализироваться, и на тип используемого микроскопа (рис. 4E). Расположите образец как можно ближе к объективу микроскопа. Например, чтобы получить изображение NB в центральных долях мозга, сориентируйте мозг так, чтобы доли мозга были ближе всего к объективу (рис. 4H).
- Как только мозг сориентируется, аккуратно поместите стеклянное стекло поверх раствора на мембране. Это приведет к тому, что раствор, содержащий мозг и жировые тела, распространится по всей мембране (рис. 4F).
- Промокните излишки раствора, поднеся лабораторную ткань близко к краю покровного стекла. Оптимальное количество раствора достигается, когда мозги касаются покровного стекла, не раздавливаясь. Если на этом этапе требуется переориентация, осторожно переместите покровное стекло, чтобы переместить мозги.
- Обездвижите покровное стекло, нанеся расплавленный вазелин по краям покровного стекла кистью. Дайте желе застыть (рис. 4G).
- Для визуализации с помощью многолуночного предметного стекла (рис. 4):
- Добавьте 400 мкл визуализирующей среды в лунку многолуночного предметного стекла (в эксперименте, проведенном здесь, использовался камерный 8-луночный микро[μ]-слайд; Рисунок 4I). Перенесите в эту лунку ранее рассеченные жировые тела (см. шаг 3.4).
- Поместите до 10 мозгов в кластер недалеко от центра скважины (рис. 4J).
- Сориентируйте мозг для популяции NB, подлежащих визуализации, и для типа используемого микроскопа, как описано на шаге 5.1.4 (рис. 4K). Расположите образцы так, чтобы они были близко друг к другу. Это минимизирует расстояние, на которое столик должен перемещаться между образцами, что уменьшает дрейф образца во время сбора.
- После того, как мозг сориентировался в лунке, дайте мозгу успокоиться в течение 2-5 минут. Это повышает их стабильность во время транспортировки / визуализации. Подготовьте микроскоп к съемкам в течение этого времени.
- Накройте μ-предметное стекло крышкой предметного стекла и перенесите его на микроскоп. Начните сбор данных с минимально возможной мощности лазера и времени экспозиции, чтобы свести к минимуму фотообесцвечивание.
6. Лучшие практики обработки и управления данными
- Обрабатывайте данные по мере необходимости в соответствии с доступным программным обеспечением для анализа.
- В приведенном здесь примере сохраните полученные данные с помощью программного обеспечения SlideBook в виде файла изображения SlideBook (.sld).
- Чтобы преобразовать файл в проприетарный тип файла Imaris (.ims) с помощью конвертера файлов Imaris, откройте конвертер файлов Imaris в отдельном окне. Нажмите и перетащите файлы .sld в раздел «Ввод» конвертера файлов Imaris.
- Определите желаемое место вывода преобразованных файлов и нажмите «Начать все».
- После преобразования просмотрите и аннотируйте данные в программном обеспечении Imaris.
ПРИМЕЧАНИЕ: Вместо ImaRIS можно использовать альтернативы для анализа изображений, такие как Fiji (https://hpc.nih.gov/apps/Fiji.html), Aivia (https://www.aivia-software.com/), Volocity (https://www.volocity4d.com/) или другие.
- Сохраняйте как можно больше исходных данных для правильного ведения учета. Например, если программное обеспечение для сбора данных сохранено в одном формате файла, но преобразовано в другой формат для анализа, сохраните полученную версию данных.
- Для анализа данных ведите учет как можно большего количества сведений о выборке и параметрах сбора данных. Ключевая информация, которую необходимо сохранить, включает генотип препарированных личинок, возраст личинок до вскрытия, состояние шапки для еды, в которой они были выращены, мощность лазера, используемую во время визуализации, время экспозиции, продолжительность сбора и временное разрешение.
7. Пример количественной оценки длины клеточного цикла (рис. 5)
ПРИМЕЧАНИЕ: в этом примере были изображены личинки, экспрессирующие маркер полярности Pins (Pins::EGFP16) и связывающий микротрубочки белок Jupiter25 (cherry::Jupiter13). Последующий анализ проводился с помощью программного обеспечения Imaris.
- Откройте фильм с помощью выбранного программного обеспечения для анализа изображений. Прокрутите фильм по длине, чтобы определить разделительные NB, и пометьте их для дальнейшего использования. Определите делительные NB по их отчетливым митотическим веретенам (рис. 5C-E).
- Определите эталонную стадию клеточного цикла, чтобы определить длину клеточного цикла. В этом примере метафаза используется в качестве эталона.
- Вручную определите количество кадров между последовательными метафазами и преобразуйте его в минуты или часы, чтобы определить время, необходимое для завершения одного клеточного цикла.
- Сделайте это, взяв временное разрешение фильма и умножив его на количество кадров между метафазами. Например, если временное разрешение фильма составляет один кадр каждые 5 минут, а метафазы наблюдаются в кадре 13 и кадре 35, время между этими метафазами будет составлять 110 минут ([35 − 13] × 5).
- Нанесите данные на график с помощью любого соответствующего программного обеспечения. Данные, показанные здесь, были построены с использованием программного обеспечения PRISM.
8. Пример количественного определения выравнивания шпинделя ячеек (рис. 5)
ПРИМЕЧАНИЕ: В этом примере анализ выполняется с помощью программного обеспечения Imaris.
- Откройте файл фильма в Imaris или другом программном обеспечении по вашему выбору. Прокрутите фильм по длине, чтобы определить разделительные NB, и пометьте их для дальнейшего использования.
- Определите вектор, образованный полюсами веретена, используя апикальную и базальную центросомы (представленные m), следующим образом:
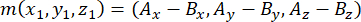
где Ax, Ay и Az — координаты апикальной центросомы, а Bx, By и Bz — координаты базальной центросомы. Точно так же ось вектора деления (представленная n) образована средней точкой апикального полумесяца Pins::EGFP и базальной корой: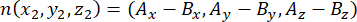
где Ax, Ay и Az — координаты средней точки полумесяца Pins::EGFP, а Bx, By и Bz — координаты средней точки базальной коры. - Определим величину векторов m и n:
Магнитуда м: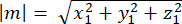
Величина n: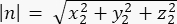
- Определите скалярное произведение (представленное k) m и n:
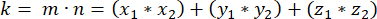
- Используя скалярное произведение k и векторные величины m и n, определите угол между векторами:
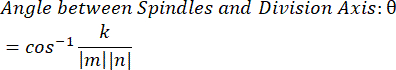
- Нанесите данные на график в выбранном программном обеспечении. Данные, показанные здесь, были подготовлены в Microsoft Excel и визуализированы в PRISM.
Результаты
Вскрытие и визуализация НБ центральной доли мозга, экспрессирующих Pins::EGFP и Cherry::Jupiter
Чтобы продемонстрировать этот протокол, личинки экспрессируют управляемый UAS Cherry::Jupiter13 и эндогенно помеченные Pins::EGFP16 (w; worGal4, UAS-cherry::jupiter/CyO; Pins::EGFP/TM6B, Tb) визуализирова...
Обсуждение
В этом протоколе изложен один из подходов к визуализации живого мозга эксплантатов личинок Drosophila melanogaster . Описанный здесь протокол позволяет наблюдать за мозгом эксплантата в течение 12-20 часов в правильных экспериментальных условиях. Особое внимание должно быть уделено подготов?...
Раскрытие информации
У авторов нет финансовой информации, которую они могли бы декларировать.
Благодарности
Это исследование поддерживается R35GM148160 (C.C.) и Национальным институтом здравоохранения (NIH) Training Grant T32 GM007270 (R.C.S.)
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 µm polyethersulfone (PES) Membrane | Genesee | 25-231 | Vacuum-driven filters |
| Agar | Genesee | 20-248 | granulated agar |
| Analytical Computer | Dell | NA | Intel Xeon Gold 5222 CPU with two 3.80 GHz processors running Windows 10 on a 64-bit operating system |
| Bovine Growth Serum | HyClone | SH30541.02 | |
| Chambered Imaging Slides | Ibidi | 80826 | |
| Confocal Microscope | Nikon | NA | |
| Custom-machined metal slide | NA | NA | See Cabernard and Doe 2013 (Ref. 34) for specifications |
| Dissection Dishes | Fisher Scientific | 5024343 | 3-well porcelain micro spot plate |
| Dissection Forceps | World Precision Instruments | Dumont #5 | |
| Dissection Microscope | Leica | NA | |
| Dissection Scissors | Fine Science Tools (FST) | 15003-08 | |
| Embryo collection cage | Genesee | 59-100 | |
| Flypad with access to CO2 to anesthetize adult flies | Genesee | 59-172 | |
| Gas-permeable membrane | YSI | 98095 | Gas-permeable membrane |
| Glass Cover Slides | Electron Microscopy Sciences | 72204-03 | # 1.5; 22 mm x 40 mm glass coverslips |
| Imaris | Oxford Instruments | NA | Alternatives: Fiji, Volocity, Aivia |
| Imaris File Converter | Oxford Instruments | NA | |
| Instant Yeast | Saf-Instant | NA | |
| Molasses | Genesee | 62-117 | |
| Petri dish | Greiner Bio-One | 628161 | 60 mm x 15 mm Petri dish |
| Petroleum Jelly | Vaseline | NA | |
| Schneider's Insect Medium with L-glutamine and sodium bicarbonate liquid | Millipore Sigma | S0146 | |
| SlideBook acquisition software | 3i | NA | |
| Vacuum-Driven Filtration Unit with a 0.22 µµm PES membrane filter | Genesee Scientific, GenClone | 25-231 |
Ссылки
- Delgado, M. K., Cabernard, C. Mechanical regulation of cell size, fate, and behavior during asymmetric cell division. Current Opinion in Cell Biology. 67, 9-16 (2020).
- Sunchu, B., Cabernard, C. Principles and mechanisms of asymmetric cell division. Development. 147 (13), (2020).
- Homem, C. C. F., Knoblich, J. A. Drosophila neuroblasts: A model for stem cell biology. Development. 139 (23), 4297-4310 (2012).
- Gallaud, E., Pham, T., Cabernard, C. Drosophila melanogaster neuroblasts: A model for asymmetric stem cell divisions. Results and Problems in Cell Differentiation. 61 (1489), 183-210 (2017).
- Loyer, N., Januschke, J. Where does asymmetry come from? Illustrating principles of polarity and asymmetry establishment in Drosophila neuroblasts. Current Opinion in Cell Biology. 62, 70-77 (2020).
- Pollington, H. Q., Seroka, A. Q., Doe, C. Q. From temporal patterning to neuronal connectivity in Drosophila type I neuroblast lineages. Seminars in Cell & Developmental Biology. 142, 4-12 (2023).
- Oon, C. H., Prehoda, K. Asymmetric recruitment and actin dependent cortical flows drive the neuroblast polarity cycle. eLife. 8, e45815 (2019).
- Ramat, A., Hannaford, M., Januschke, J. Maintenance of miranda localization in Drosophila neuroblasts involves interaction with the cognate mRNA. Current Biology. 27 (14), 2101-2111 (2017).
- Oon, C. H., Prehoda, K. E. Phases of cortical actomyosin dynamics coupled to the neuroblast polarity cycle. eLife. 10, e66574 (2021).
- LaFoya, B., Prehoda, K. E. Actin-dependent membrane polarization reveals the mechanical nature of the neuroblast polarity cycle. Cell Reports. 35 (7), 109146 (2021).
- Siller, K. H., Doe, C. Q. Lis1/dynactin regulates metaphase spindle orientation in Drosophila neuroblasts. Developmental Biology. 319 (1), 1-9 (2008).
- Siller, K. H., Cabernard, C., Doe, C. Q. The NuMA-related Mud protein binds Pins and regulates spindle orientation in Drosophila neuroblasts. Nature Cell Biology. 8 (6), 594-600 (2006).
- Cabernard, C., Doe, C. Q. Apical/basal spindle orientation is required for neuroblast homeostasis and neuronal differentiation in Drosophila. Developmental Cell. 17 (1), 134-141 (2009).
- Cabernard, C., Prehoda, K. E., Doe, C. Q. A spindle-independent cleavage furrow positioning pathway. Nature. 467 (7311), 91-94 (2010).
- Connell, M., Cabernard, C., Ricketson, D., Doe, C. Q., Prehoda, K. E. Asymmetric cortical extension shifts cleavage furrow position in Drosophila neuroblasts. Molecular Biology of the Cell. 22 (22), 4220-4226 (2011).
- Tsankova, A., Pham, T. T., Garcia, D. S., Otte, F., Cabernard, C. Cell polarity regulates biased myosin activity and dynamics during asymmetric cell division via Drosophila rho kinase and protein kinase N. Developmental Cell. 42 (2), 143-155 (2017).
- Montembault, E., et al. Myosin efflux promotes cell elongation to coordinate chromosome segregation with cell cleavage. Nature Communications. 8 (1), 326 (2017).
- Roubinet, C., et al. Spatio-temporally separated cortical flows and spindle geometry establish physical asymmetry in fly neural stem cells. Nature Communications. 8 (1), 1383 (2017).
- Januschke, J., et al. Centrobin controls mother-daughter centriole asymmetry in Drosophila neuroblasts. Nature Cell Biology. 15 (3), 241-248 (2013).
- Januschke, J., Llamazares, S., Reina, J., Gonzalez, C. Drosophila neuroblasts retain the daughter centrosome. Nature Communications. 2 (1), 243 (2011).
- Rebollo, E., et al. Functionally unequal centrosomes drive spindle orientation in asymmetrically dividing Drosophila neural stem cells. Developmental Cell. 12 (3), 467-474 (2007).
- Januschke, J., Gonzalez, C. The interphase microtubule aster is a determinant of asymmetric division orientation in Drosophila neuroblasts. The Journal of Cell Biology. 188 (5), 693-706 (2010).
- Rusan, N. M., Peifer, M. A role for a novel centrosome cycle in asymmetric cell division. The Journal of Cell Biology. 177 (1), 13-20 (2007).
- Lerit, D. A., et al. Interphase centrosome organization by the PLP-Cnn scaffold is required for centrosome function. Journal of Cell Biology. 210 (1), 79-97 (2015).
- Gallaud, E., et al. Dynamic centriolar localization of Polo and Centrobin in early mitosis primes centrosome asymmetry. PLoS Biology. 18 (8), e3000762 (2020).
- Ramdas Nair, A., et al. The microcephaly-associated protein Wdr62/CG7337 is required to maintain centrosome asymmetry in Drosophila neuroblasts. Cell Reports. 14 (5), 1100-1113 (2016).
- Singh, P., Nair, A. R., Cabernard, C. The centriolar protein Bld10/Cep135 is required to establish centrosome asymmetry in Drosophila neuroblasts. Current Biology. 24 (13), 1548-1555 (2014).
- LaFoya, B., Prehoda, K. E. Consumption of a polarized membrane reservoir drives asymmetric membrane expansion during the unequal divisions of neural stem cells. Developmental Cell. 1534 (23), 00159 (2023).
- Sunchu, B., et al. Asymmetric chromatin retention and nuclear envelopes separate chromosomes in fused cells in vivo. Communications Biology. 5 (1), 953 (2022).
- Oliveira, A. C., Rebelo, A. R., Homem, C. C. F. Integrating animal development: How hormones and metabolism regulate developmental transitions and brain formation. Developmental Biology. 475, 256-264 (2021).
- Britton, J. S., Edgar, B. A. Environmental control of the cell cycle in Drosophila: nutrition activates mitotic and endoreplicative cells by distinct mechanisms. Development. 125 (11), 2149-2158 (1998).
- Lee, C. -. Y., et al. Drosophila Aurora-A kinase inhibits neuroblast self-renewal by regulating aPKC/Numb cortical polarity and spindle orientation. Genes & Development. 20 (24), 3464-3474 (2006).
- Homem, C. C. F., Reichardt, I., Berger, C., Lendl, T., Knoblich, J. A. Long-term live cell imaging and automated 4D analysis of Drosophila neuroblast lineages. PLoS ONE. 8 (11), e79588 (2013).
- Cabernard, C., Doe, C. Q. Live imaging of neuroblast lineages within intact larval brains in Drosophila. Cold Spring Harbor Protocols. 2013 (10), 970-977 (2013).
- Karpova, N., Bobinnec, Y., Fouix, S., Huitorel, P., Debec, A. Jupiter, a new Drosophila protein associated with microtubules. Cell Motility and the Cytoskeleton. 63 (5), 301-312 (2006).
- Loyer, N., Januschke, J. The last-born daughter cell contributes to division orientation of Drosophila larval neuroblasts. Nature Communications. 9 (1), 3745 (2018).
- Bostock, M. P., et al. An immobilization technique for long-term time-lapse imaging of explanted Drosophila tissues. Frontiers in Cell and Developmental Biology. 8, 590094 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены