Method Article
Удаление бактериофагов из инфицированных культур сальмонеллы
В этой статье
Резюме
Бактериофаги, повсеместно распространенные и разнообразные на Земле, заражают и размножаются внутри бактериальных хозяев, играя решающую роль в микробных экосистемах. Несмотря на их важность, их наличие может нарушить производственные процессы. Нами разработан метод с использованием бактериальных липополисахаридов для элиминации бактериофагов из культур сальмонелл .
Аннотация
Бактериофаги, или просто фаги, играют жизненно важную роль в микробной среде, влияя на популяции бактерий и формируя их эволюцию и взаимодействие. Эти организмы представляют собой вирусы, которые заражают и реплицируются внутри бактериальных хозяев. Фаги распространены на Земле повсеместно, очень разнообразны и очень многочисленны. В то время как бактериофаги играют важную роль в различных средах и являются ключевой областью исследований в микробиологии и экологии, их присутствие может быть нежелательным в определенных промышленных процессах или продуктах. Учитывая обилие и повсеместное распространение бактериофагов на Земле, разработка процедур удаления бактериофагов из бактериальных культур имеет решающее значение в различных лабораторных и промышленных приложениях для сохранения целостности культур и обеспечения точных экспериментальных результатов или качества продукции. Здесь мы отработали протокол уничтожения бактериофагов из инфицированных культур Salmonella enterica , используя стратегию, основанную на использовании липополисахаридов (ЛПС), расположенных во внешней мембране грамотрицательных бактерий. Бактериальный ЛПС играет важную роль в распознавании хозяина фагами, и мы используем это свойство для разработки эффективной процедуры удаления фагов, использующих ЛПС в качестве рецептора, в культурах бактерий сальмонеллы .
Введение
Микробные популяции сталкиваются с многочисленными проблемами в естественной среде, и особенно серьезной угрозой является возможность заражения бактериофагами, вирусами, которые заражают бактерии1. Эти вирусы широко распространены на планете, демонстрируя большое разнообразие и многочисленность 2,3,4,5. Хотя бактериофаги различаются по размеру, морфологии и геномной организации, все они имеют одну и ту же структуру: геном ДНК или РНК оболочен капсидом, образованным фагами-кодируемыми белками. Бактерии развили разнообразный набор защитных механизмов против них7. Ключевым аспектом бактериофаговой инфекции, который имеет значение как для характеристики, так и для обнаружения, являются рецептор-связывающие домены, присутствующие на волокнах хвоста. Бактериофаги имеют на своей поверхности белки, называемые рецептор-связывающими белками или хвостовыми волокнами, для распознавания и связывания с определенными рецепторными участками на поверхности бактериальной клетки. В случае грамотрицательных бактерий распознавание поверхностных структур, таких как липополисахариды (ЛПС), белки наружной мембраны, пили и/или жгутики, участвует во взаимодействии фаго-бактерий8. Это взаимодействие между бактериофагами и бактериями очень специфично и зависит в основном от их способности прикрепляться к поверхностям хозяина. О-антиген липополисахарида является широко используемым рецептором9.
Исследование взаимодействия бактериофагов и бактерий не только увлекательно с биологической точки зрения, но и имеет практическое применение в таких областях, как фаготерапия и биотехнология. В то время как бактериофаги играют важную роль в различных контекстах, например, при изменениимикробных популяций, их присутствие может быть нежелательным в определенных промышленных процессах. В фармацевтике, биотехнологии и производстве продуктов питания присутствие бактериофагов может повлиять на качество и безопасность конечных продуктов, что делает их удаление необходимым для соблюдения стандартов качества. В биопроцессах и биопроизводстве, где бактериальные культуры используются для производства различных соединений (например, белков, ферментов или антибиотиков), присутствие бактериофагов может привести к нарушению производственных процессов из-за их способности балансировать популяцию бактерий в каждой общей среде. Фаги иногда могут превращать профессиональную жизнь промышленного микробиолога в кошмар. Разработка эффективных процедур удаления фагов имеет решающее значение для обеспечения стабильного и надежного производства, повышая эффективность процесса. Помимо этих промышленных аспектов, в условиях исследовательской лаборатории, где точность и воспроизводимость имеют решающее значение, элиминация бактериофагов имеет важное значение для получения точных и надежных результатов. Кроме того, удаление фагов также может быть использовано для моделирования изменяющихся сред для проверки различныхгипотез. Удаление фагов также может быть очень полезным в исследовательской среде, поскольку многие исследования на основе фагов, такие как подсчет бактерий после применения фагов, выиграют от этапа удаления фагов для получения гораздо более надежных жизнеспособных подсчетов.
Удаление фагов на основе выделения колонии займет несколько дней, чтобы убедиться, что колонии свободны от фагов, в то время как описанная здесь процедура позволяет получать культуры без фагов за несколько часов. Этот протокол позволяет нам следить за эволюцией бактериальных культур, не останавливая их в изоляции колоний. В этом смысле можно моделировать флуктуирующие среды (наличие и/или отсутствие фагов) для проверки различных гипотез. Кроме того, этот протокол позволяет проводить качественный и количественный анализ присутствия фагов в бактериальной культуре.
Таким образом, разработка экономически эффективных процедур удаления бактериофагов имеет решающее значение для поддержания качества продукции, безопасности и эффективности процессов в различных отраслях промышленности, а также для прогресса в фундаментальных и прикладных исследованиях. В данной статье мы описываем высокоэффективный протокол, основанный на использовании ЛПС для удаления бактериофагов, использующих ЛПС в качестве рецептора, из инфицированных культур сальмонеллы , что является эффективным по времени и требует минимального оборудования.
протокол
ПРИМЕЧАНИЕ: Перед проведением процедуры элиминации фагов мы описываем приготовление культуры сальмонеллы , зараженной бактериофагами 9NA. На рисунке 1 показано общее представление полной процедуры удаления бактериофагов из бактериальных культур.
1. Подготовка культур сальмонеллы , зараженных бактериофагами
- Подготовка бактериальных культур
ПРИМЕЧАНИЕ: В данном исследовании использовался штамм Salmonella enterica subsp. enterica serovar Typhimurium ATCC 14028 opvAB::lacZ (SV8011)13 .- Медленно разморозьте флакон, извлеченный из -80 °C, который содержит интересующий штамм S. enterica , положив его на лед.
- Выведите штамм S. enterica из размороженного запаса диметилсульфоксида на планшет Леннокса (LB) (10 г/л триптона, 5 г/л NaCl, 5 г/л дрожжевого экстракта и 15 г/л агара, см. Таблицу материалов). Инкубируйте планшет при температуре 37 °C в течение 24 ч.
- С помощью иглы для инокуляции перенесите колонию из планшета S. enterica и введите ее в 5 мл жидкого LB в стеклянной пробирке. Инкубировать при 37 °C в течение 24 ч с аэрацией путем встряхивания при 200 об/мин.
- Препарат бактериофагов
Примечание: В данном протоколе использовался бактериофаг 9NA, принадлежащий к семейству Siphoviridae (отряд Caudovirales)14. Примечательно, что могут быть использованы другие бактериофаги Salmonella enterica , которые используют О-антиген липополисахарида в качестве рецептора.- Приготовьте бульон бактериофагов, добавив 0,1 мл концентрированного лизата бактериофага в смесь из 100 мл питательного бульона (NB; 5 г/л пептона и 3 г/л дрожжевого экстракта), 2 мл 50x солей E (38,78 мл MgSO47 H2O, 520,5 мМ лимонной кислоты H2O, 2,87 M K2безводного и 829 мМ NaNH4HPO44 H2O) и 0,4 мл 50% глюкоза. Тщательно перемешайте методом инверсии.
- Репрезентативным примером концентрации бактериофага может быть10-9 PFU/мл (единицы образования бляшек/мл), но более низкие концентрации могут быть использованы с аналогичными результатами (см. Таблицу материалов). Оцените концентрацию бактериофагов после шага 1.2.3.
- Приготовьте лизат, выполнив описанные ниже действия.
- Приготовьте инокулюм S. enterica в 5 мл LB (10 г/л триптона, 5 г/л NaCl и 5 г/л дрожжевого экстракта). Инкубировать при 37 °C и 200 об/мин в течение 24 часов.
- Смешайте 4 мл отвара бактериофага с 1 мл ночной культуры S. enterica. Инкубируйте смесь при температуре 37 °C и 200 об/мин в течение 8 часов.
- Чтобы отличить бактерии от бактериофагов, центрифугируйте смесь при давлении 2 377 x g в течение 20 минут. Восстановите надосадочную жидкость в стеклянной пробирке, добавьте 800 мкл хлороформа (см. Таблицу материалов) и сделайте его вихревым слоем. Убедитесь, что вы передаете только верхнюю фазу при использовании смеси с хлороформом.
ПРИМЕЧАНИЕ: Важно предотвратить перенос остаточного хлороформа, который может повлиять на эффективность процедуры. Стадия хлороформа широко используется как в протоколах выделения, так и в протоколах размножения в качестве способа максимизации высвобождаемых фагов. Однако хлороформ может инактивировать некоторые фаги или разрушать их инфекционную способность15. Поэтому этот шаг применим только к фагам, устойчивым к хлороформу. - Выдержите лизаты при комнатной температуре в течение 2 часов, а затем храните их при температуре 4 °C.
- Титруйте лизат для количественного определения количества бактериофагов/количества БОЕ на мл, присутствующих в приготовленном лизате. Для этого выполните технику наложения, описанную ниже.
- Приготовьте 5 мл LB инокулюма для S. enterica. Инкубировать при 37 °C в течение 24 ч с аэрацией путем встряхивания при 200 об/мин.
- Выполняйте последовательные разведения лизата в LB для получения счетного количества PFU/мл. Для определения необходимых коэффициентов разведения определяют исходный лизат бактериофага в концентрате. В качестве репрезентативного примера концентрации бактериофага на уровне около 109 БОЕ/мл коэффициенты разведения, которые приводят к счетному количеству бляшек, находятся в диапазоне от 106 до10 10.
- Добавьте 100 мкл соответствующего разбавления лизата и 60 мкл ночной культуры S. enterica , приготовленной накануне, в 5 мл мягкого агара LB, приготовленного путем смешивания жидкого LB и LB-агара в пропорции 1:1 и поддержания при температуре 56 °C во избежание затвердевания. Тщательно перемешивайте, не допуская образования пузырьков.
- Вылейте каждую смесь в верхнюю часть пластины LB и держите на скамейке, пока среда не застынет.
- Инкубируйте планшеты в течение 24 часов при 37 °C. Подсчитайте количество табличек на каждой пластине. Чтобы определить количество БОЕ/мл, умножьте количество бляшек каждой пластины на коэффициент разведения (FD). Для обеспечения эффективной фаговой инфекции необходимо 109-10 12 БОЕ/мл.
БОЕ/мл= Нет. бляшки в пластине х FD
- Приготовьте бульон бактериофагов, добавив 0,1 мл концентрированного лизата бактериофага в смесь из 100 мл питательного бульона (NB; 5 г/л пептона и 3 г/л дрожжевого экстракта), 2 мл 50x солей E (38,78 мл MgSO47 H2O, 520,5 мМ лимонной кислоты H2O, 2,87 M K2безводного и 829 мМ NaNH4HPO44 H2O) и 0,4 мл 50% глюкоза. Тщательно перемешайте методом инверсии.
- Заражение культур сальмонелл бактериофагами
- Разведите ночную культуру S. enterica до 1:100 в конечном объеме 5 мл LB и добавьте 0,1 мл лизата (в концентрации 109-10 12 БОЕ/мл). Инкубировать при 37 °C и 200 об/мин в течение 24 часов.
- Определение титра фагов в качестве БОЕ в планшетном анализе
- Чтобы количественно оценить количество бактериофагов в инфицированной культуре, выполните анализ в планшетах для определения титра фага в виде БОЕ/мл, как описано ниже.
- Переложите 1 мл культуры в пробирку. Центрифугируйте при 17,115 х г в течение 2 мин и перелейте надосадочную жидкость в новый флакон с маркировкой.
- Добавьте в флакон 100 μL хлороформа и вортекс, чтобы удалить бактериальный мусор из раствора. Выполните шаг 1.2.3.
- Чтобы количественно оценить количество бактериофагов в инфицированной культуре, выполните анализ в планшетах для определения титра фага в виде БОЕ/мл, как описано ниже.
2. Удаление бактериофагов из инфицированных культур Salmonella enterica (см. Рисунок 2)
ПРИМЕЧАНИЕ: Для контроля процесса удаления бактериофагов на протяжении всего протокола очистки отбираются различные аликвоты для титрования. В общей сложности существует восемь аликвот, подтверждающих, что количество БОЕ/мл уменьшается на протяжении всего процесса очистки до полного устранения.
- Удаление бактериофага в суспензии
- Разбавьте бактериальную культуру, содержащую фаги, до соотношения 1:100 в 5 мл фильтрованного LB массой 0,22 мкм в конической центрифужной пробирке объемом 50 мл. Точка титрования 1: Это первая аликвота для титрования (начальная зараженная культура сальмонеллы ).
- Центрифугируйте суспензию в течение 10 мин при 2,377 x g. Осторожно удалите надосадочную жидкость. Не используйте пипетку; Залить трубку. Постарайтесь оставить на дне конической центрифужной пробирки некоторый объем, чтобы обеспечить наличие ячеек.
- Промойте бактериальные клетки 10 мл среды, отфильтрованной 0,22 мкм. Повторите этапы центрифугирования и промывки 3 раза. Ресуспендируйте гранулу в 5 мл 0,22 мкм, отфильтрованного LB. Точка титрования 2: Это вторая аликвота для титрования.
- Пропустите 50 мкл вышеуказанной бактериальной суспензии через стерильный фильтр 0,45 мкм (см. Таблицу материалов) с помощью системы вакуумной фильтрации. Промойте фильтр 100 мл фильтрованного LB 0,22 мкм.
ПРИМЕЧАНИЕ: Размер головки бактериофага 9NA составляет 0,067 мкм. Сальмонелла , напротив, имеет длину 2-5 мкм и ширину 0,5-1,5 мкм. Таким образом, если использовать мембраны размером 0,45 мкм, большинство бактерий не пройдут, потому что их размер превышает 0,45 мкм, в то время как большинство фагов пройдут через фильтрующие поры размером 0,45 мкм.
- Удаление бактериофага, содержащегося внутри клеток сальмонеллы
- Чтобы облегчить высвобождение фагов из клеток бактерий, инкубируйте фильтр размером 0,45 мкм в течение 2 ч при 37 °C внутри инкубатора, не разбирая систему.
Примечание: Этот этап инкубации необходим для стимулирования лизиса инфицированных бактерий и высвобождения внутриклеточных фагов в фильтр. - Промойте фильтр 0,45 мкм с помощью вакуумной системы фильтрации, промыв фильтр 100 мл 0,22 мкм отфильтрованного LB.
- Извлеките бактериальные клетки из фильтра в 2 мл 2x LB (20 г/л триптона, 10 г/л NaCl, 10 г/л дрожжевого экстракта; см. Таблицу материалов). Для этого нужно перенести фильтр 0,45 мкм в колбу с помощью стерильных щипцов. Затем добавьте 2 мл 2x LB на фильтр и несколько раз проведите пипетку, чтобы освободить клетки от фильтра.
- Центрифугируйте 1 мл этой суспензии в течение 2 мин при 10,354 х г. Выбросьте надосадочную жидкость и промойте бактериальные клетки 3 раза 1 мл отфильтрованной среды LB. Ресуспендируйте клетки в 1 мл 2x LB. Точка титрования 3: Это третья аликвота для титрования.
ПРИМЕЧАНИЕ: Настоятельно рекомендуется использовать более концентрированный LB (2x LB), поскольку, как описано ниже, будет добавлен коммерческий липополисахарид (ЛПС), и этот ЛПС растворяется в воде, тем самым разбавляя среду.
- Чтобы облегчить высвобождение фагов из клеток бактерий, инкубируйте фильтр размером 0,45 мкм в течение 2 ч при 37 °C внутри инкубатора, не разбирая систему.
- Избегайте повторного заражения, вводя бактериофагов, высвобождаемых из бактериальных клеток, коммерческим липополисахаридом, как описано ниже.
- Инкубируют 20 мкл бактериальной суспензии в присутствии коммерческого липополисахарида S. enterica (ЛПС; см. Таблицу материалов) до конечной концентрации 3,75 мг/мл в 1 мл 0,22 мкм, отфильтрованного LB, в течение 2 ч при 37 °C с встряхиванием при 200 об/мин.
Фаги, высвобождаемые из клеток в среду, могут связываться с коммерческим ЛПС S. enterica вместо бактериального ЛПС. - После 2 ч инкубации переложите 1 мл культуры в микроцентрифужную пробирку и центрифугируйте суспензию в течение 2 мин при давлении 10,354 x g. Точка титрования 4: Используйте надосадочную жидкость в качестве четвертой аликвоты для титрования.
- Промойте гранулы 3 раза с 1 мл фильтрованной среды LB.
- После промывки повторно суспендируйте гранулу в 1 мл 2x LB. Инкубируйте 20 μL этой смеси в 1 мл 0,22 μm-фильтрованного LB с 0,8 мг/мл коммерческого LPS в течение 2 часов при 37 °C с встряхиванием при 200 об/мин. Точка титрования 5: Используйте оставшуюся часть бактериальной суспензии для пятого титрования.
- После 2 ч инкубации переложите 1 мл культуры в микроцентрифужную пробирку и гранулируйте путем центрифугирования в течение 2 мин при давлении 10,354 x g. Пункт титрования 6: Используйте надосадочную жидкость в качестве шестой аликвоты для титрования, наливая надосадочную жидкость в новую пробирку.
- Промойте бактериальные клетки 3 раза отфильтрованным LB. После промывки ресуспендируйте собранные клетки в 1 мл 0,22 мкм отфильтрованного LB.
- Пропустите 1 мл бактериальной суспензии через стерильный фильтр 0,45 мкм с помощью вакуумной системы фильтрации. Промойте фильтр 100 мл фильтрованного LB 0,22 мкм.
- Восстановите клетки из фильтра 0,45 мкм в 2 мл среды 2x LB. Для этого перенесите фильтр 0,45 мкм в колбу с помощью стерильных щипцов. Затем добавьте 2 мл 2x LB на фильтр и несколько раз проведите пипетку, чтобы попытаться освободить клетки от фильтра.
- Гранулировать 1 мл клеток центрифугированием в течение 2 мин при 10,354 х г. Промойте 3 раза фильтрованным LB 0,22 мкм. После промывки ресуспендируйте собранные клетки в 1 мл 2x LB. Точка титрования 7: Это седьмая аликвота для титрования. Эта аликвота будет информировать об эффективности удаления фагов в бактериальных культурах.
- Инкубируют 20 мкл бактериальной суспензии в присутствии коммерческого липополисахарида S. enterica (ЛПС; см. Таблицу материалов) до конечной концентрации 3,75 мг/мл в 1 мл 0,22 мкм, отфильтрованного LB, в течение 2 ч при 37 °C с встряхиванием при 200 об/мин.
3. Приготовление культуры сальмонеллы без бактериофагов после удаления бактериофагов
- Приготовьте инокулюм, не содержащий фагов. Добавьте 100 мкл клеток из бактериальной суспензии к 900 мкл ЛБ, содержащей 0,45 мг/мл ЛПС. Инкубировать при 37 °C в течение 24 ч с встряхиванием при 200 об/мин.
- Точка титрования 8: Подготовьте восьмую аликвоту для титрования (последнюю потенциальную неинфицированную культуру). Этот момент должен подтвердить отсутствие повторного заражения фагом.
Результаты
Salmonella enterica и другие грамотрицательные бактерии имеют внешнюю мембрану, содержащую ЛПС. О-антиген ЛПС является широко используемым рецептором бактериофагов 9NA для инфицирования культур сальмонелл 16,17.
Учитывая специфическое сродство бактериофагов к О-антигену или основным полисахаридным областям ЛПС, мы хотели изучить, можно ли использовать коммерческий ЛПС Salmonella enterica в качестве приманки для исключения бактериофагов 9NA. Для этого мы смешали известные концентрации коммерческого ЛПС и лизата 9NA с последующим титрованием. Коммерческие бактериофаги ЛПС и 9NA смешивали в общем объеме 200 мкл и инкубировали в течение 2 ч при 37 °С без встряхивания. Для титрования 100 мкл смеси LPS-9NA и 60 мкл ночной культуры добавляли к 5 мл мягкого агара LB и выливали на верхнюю часть планшета LB. Планшеты инкубировали в течение 24 ч при 37 °С. Как показано на рисунке 3, титр лизата пропорционально уменьшается при увеличении концентрации коммерческого ЛПС S. enterica . Эти результаты указывают на то, что коммерческий ЛПС правильно функционирует в качестве приманки для бактериофагов 9NA.
Интересно, что время, необходимое фагу 9NA для лизирования клеток сальмонеллы и высвобождения фагов, облегчается количеством бактерий и фагов (рис. 4). Чтобы изучить, как этот аспект может повлиять на протокол удаления фагов, мы протестировали различные бактерии: соотношения фагов (1:1, 1:10, 1:100 и 1:1000). Как видно на рисунке 4, через 1,5-2,5 ч после добавления фага 9NA наблюдается падение наружного диаметра культуры на600 нм . Близкие к нулю значения наружного диаметра600 нм указывают на то, что культура бактерий лизируется18. По этой причине время инкубации в этом протоколе было определено как 2 часа, чтобы обеспечить достаточное время для того, чтобы фаг, содержащийся в клетках сальмонеллы , лизировал бактерии и высвободился. Это время должно быть оценено для каждой хост-фаговой системы перед выполнением этого протокола.
После того, как мы определили, что коммерческий ЛПС работает в качестве приманки, и время лизиса для инфицированных 9NA бактерий, мы выполнили описанный протокол очистки инфицированных культур сальмонеллы от бактериофагов (рис. 1 и рис. 2). Для того чтобы контролировать присутствие бактериофагов на каждом этапе протокола, мы проводили анализ бляшек для расчета инфекционности полученных культур в 100 мкл полученной смеси в разных точках (рис. 5). Мы можем наблюдать, что повторная промывка и фильтрация недостаточны для элиминации бактериофагов из культур (точки титрования 1-3); однако количество фагов уменьшается, как только мы применяем стадию инкубации с коммерческими ЛТС (точка титрования 4). Решающим этапом для полного удаления бактериофагов в бактериальной культуре является вторая инкубация с коммерческим ЛПС (точка титрования 6). Этот шаг необходим для успешного удаления бактериофага 9NA в культурах сальмонелл .
Интересным аспектом этого протокола было бы знание уровня фаговой резистентности после этапов удаления фагов. Процедура, которая отделяет фаги от фаг-резистентных бактерий, не имеет никакой пользы. По этой причине крайне важно выявить, что бактерии, оставшиеся в культуре, чувствительны к фагам. Чтобы продемонстрировать, что чувствительные фаговые клетки остаются в культурах после процедуры, мы использовали пластинчатый анализ Эванса на основе голубого уранина (EBU) для скрининга фагового загрязнения19. Планшеты EBU изготавливали из среды LB с добавлением 10 мл/л K2HPO4 25%, 5 мл/л глюкозы 50%, 2,5 мл/л флуоресцеина 1%, 1,25 мл/л Evans Blue 1% и 15 г/л агара. Для различения фагорезистентных и фаг-чувствительных изолятов на пластинах EBU с фагом 9NA использовали перекрестные полосы (рис. 6). Бактериальные культуры, полученные в конце протокола очистки, были использованы для получения изолированных колоний, которые были проверены на фаговую контаминацию (рис. 6B). Мы можем наблюдать существование как резистентных, так и чувствительных клеток. Этот протокол не способствует отбору фаг-резистентных клеток; Он только уничтожает бактериофаги.
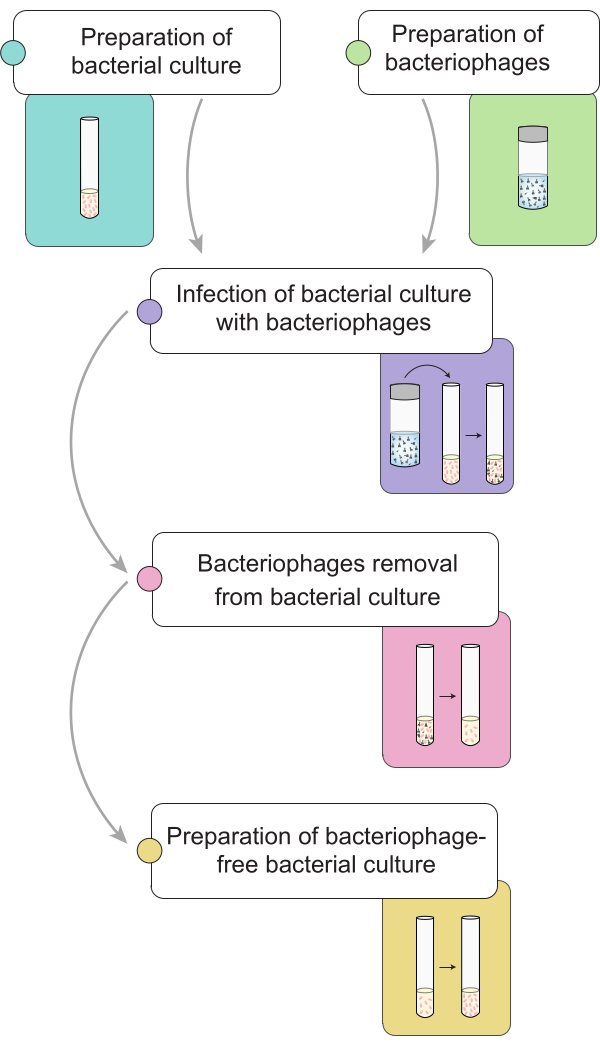
Рисунок 1: Краткое описание процедуры элиминации бактериофагов в культурах сальмонелл . Рабочий процесс разделен на несколько этапов: приготовление бактериальной культуры и лизата, заражение бактериальной культуры бактериофагами, удаление бактериофагов из инфицированных бактериальных культур и приготовление бесфагового бактериального посева. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
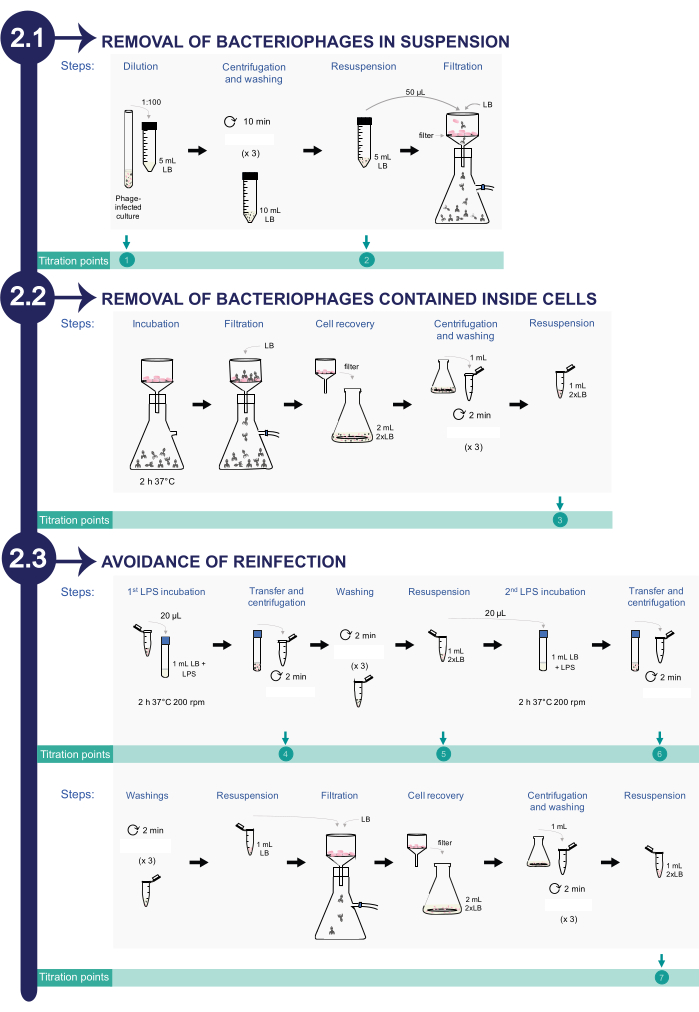
Рисунок 2: Процедура удаления бактериофагов из инфицированных сальмонелл при попадании вкультуры ica. Процесс состоит из трех этапов: 1) Удаление бактериофагов в суспензии, 2) Удаление фагов, содержащихся внутри бактериальных клеток, и 3) Предотвращение повторного заражения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
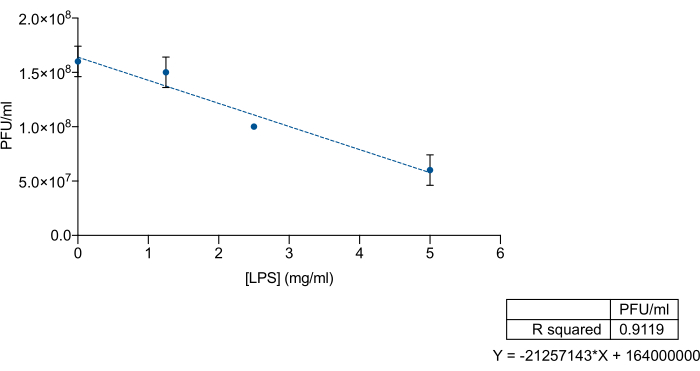
Рисунок 3: Анализ ЛПС-приманки для измерения эффективности коммерческого ЛПС Salmonella enterica для связывания бактериофагов. Титрование лизата 9NA (БОЕ/мл) при возрастающих концентрациях коммерческого ЛПС Salmonella enterica . Эксперимент проводился в трех экземплярах. Представлены среднее значение и стандартное отклонение. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
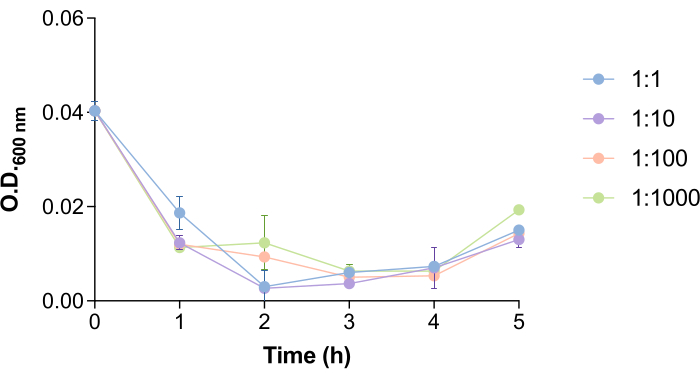
Рисунок 4: Время лизиса бактериофага 9NA в культурах сальмонелл . Кривые роста культур Salmonella enterica в присутствии бактериофага 9NA при соотношении бактерий:фагов 1:1, 1:10, 1:100 и 1:1000. Эксперимент проводился в трех экземплярах. Представлены среднее значение и стандартное отклонение. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
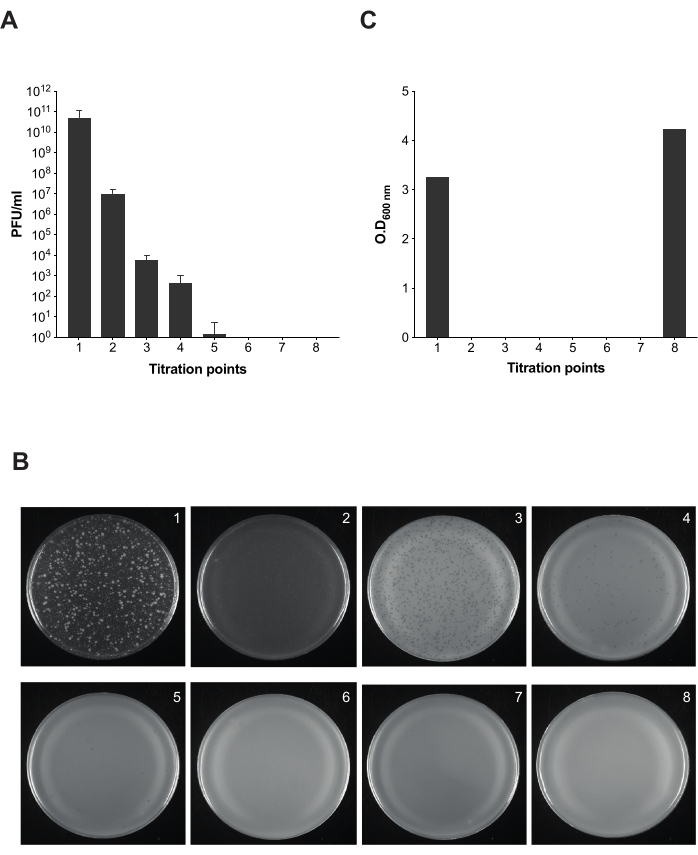
Рисунок 5: Анализ бляшек для тестирования на инфекционность во время удаления бактериофагов в культурах сальмонеллы . (A) Титрование восьми аликвот проводилось в разных точках протокола (точки титрования 1-7 отмечены на рисунке 2). Для этого эксперимента использовали штамм Salmonella enterica serovar Typhimurium ATCC 14028 opvAB::lacZ (SV8011) и бактериофаг 9NA. Эксперименты проводились в трех экземплярах, и были показаны средние и стандартные отклонения. (B) Мягкие агаровые пластины с Salmonella enterica были получены методом наложения с использованием аликвот из восьми точек титрования. Пластины соответствуют слева направо точками титрования 1-8. (C) Оптическая плотность бактериальной культуры на длине волны 600 нм в разное время действия протокола фагового удаления. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
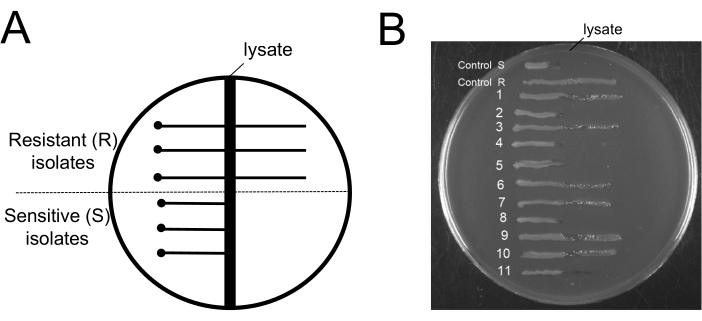
Рисунок 6: Тестирование на фаговые устойчивые бактерии после процедуры удаления бактериофага. (A) Принципиальная схема типичной агаровой пластины EBU, используемой для анализа агара с поперечными прожилками: вертикальная темная область в центре представляет зону лизата 9NA. Точкой обозначено место, где тестируемые клетки инокулируются на безопасном расстоянии от зоны лизата, а горизонтальные сплошные линии представляют либо фагорезистентные клетки, растущие через зону лизата, либо фаговые чувствительные клетки, которые не растут за пределами зоны лизата. (B) В конце протокола удаления были получены анализы на пластинах EBU для тестирования 11 колоний. Control R и S являются примерами фагорезистентных и фаг-чувствительных изолятов соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Бактериофаги используют различные стратегии для распознавания и заражения бактериальных хозяев. В качестве фаговых рецепторов могут выступать различные молекулярные структуры на поверхности бактерий: белковые, полисахаридные, липополисахариды (ЛПС) и углеводныефрагменты20. У грамотрицательных бактерий ЛПС является распространенным рецептором для фагов. Кроме того, другими рецепторами являются белки внешней мембраны, пили и жгутики21.
Специфическое взаимодействие между бактериофагами и бактериями, основанное на распознавании LPS8 , было использовано в данной работе для разработки высокоэффективного протокола элиминации бактериофагов в инфицированных бактериальных культурах (рис. 1 и рис. 2). Наш протокол не отдает предпочтение отбору фаг-резистентных клеток; он уничтожает только бактериофаги (рис. 6). Как фаг-чувствительные, так и фагорезистентные клетки остаются в бактериальной культуре после выполнения этого протокола удаления фагов.
Традиционной стандартной практикой при возникновении фаговой инфекции является попытка удалить весь загрязненный материал с последующей очисткой и стерилизацией22. Процедура обеззараживания включает в себя воздействие на бактериальную культуру стрессовых условий, таких как высокие температуры, с целью частичного или полного уничтожения бактериальных клеток. Как описано в репрезентативных результатах, решающим этапом в этом протоколе является инкубация инфицированных фагами бактериальных культур с коммерческим ЛПС, безвредным веществом для бактериальных культур. Это помогает сохранить жизнеспособность бактериальных культур и дает значительные преимущества для промышленного применения в ферментерах и биореакторах.
Время инкубации в этом протоколе составляет 2 ч, чтобы обеспечить достаточное время для фагового лизиса бактериальных клеток. Если предполагается использование различных штаммов бактерий и бактериофагов, этот параметр должен учитываться и определяться пользователем. В этом случае перед началом эксперимента следует провести анализ, аналогичный описанному на рисунке 4 .
Интересно, что эффективность этого протокола очистки также может быть проанализирована с помощью анализа, который отслеживает содержание фагов в данном образце. В этом смысле эпигенетические биосенсоры являются новым инструментом для обнаружения бактериофагов. Хорошо известным фаговым биосенсором, способным обнаруживать колифаги, использующие ЛПС в качестве рецептора, является система opvAB::gfp 13,18,23,24. Этот фаговый биосенсор обнаруживает увеличение субпопуляции OpvABON в присутствии фагов, использующих О-антиген в качестве рецептора. В этом смысле мы могли бы использовать слияние opvAB::gfp для мониторинга LPS-связывающих фагов на различных этапах этого протокола и/или в различных средах и условиях. Эти подходы могут быть полезны при определении сроков и мест, в которых может потребоваться эффективный протокол.
В то время как распознавание ЛПС является распространенным явлением, фаги также могут использовать множество других поверхностных рецепторов на бактериальных клетках для прикрепления и инфекции. Здесь мы использовали грамотрицательную сальмонеллу в качестве репрезентативной энтеробактерии и бактериофаг 9NA, который использует ЛПС в качестве рецептора и триггера выброса генома. Другие фаги энтеробактерий (например, Escherichia coli T5) слабо связываются с ЛПС и требуют белка внешней мембраны для инъекции генома. Описанный протокол применим к бактериофагам, которые распознают и нуждаются в О-антигене ЛЛС для успешной инфекции, таким как 9NA, Det7 и P22 13,25,26,27. Соответственно, успешная реализация данного протокола для фаговой деконтаминации бактериальных культур включает в себя определение того, требует ли источник фаговой инфекции распознавания ЛПС в организме хозяина.
В заключение, несмотря на потенциальные ограничения протокола, наши репрезентативные результаты ясно демонстрируют, что этот метод является мощным инструментом для очистки культур бактериальной сальмонеллы от бактериофагов, которые используют ЛПС в качестве рецептора и триггера выброса генома.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим д-ра Кармен Р. Беузон и Росио Карвахаль-Ольгеру за полезные обсуждения и предложения. Эта работа была поддержана грантом PID2020-116995RB-I00, финансируемым MICIU/AEI/10.13039/5011100011033 и VI Plan Propio de Investigación y Transferencia от Университета Севильи.
Материалы
| Name | Company | Catalog Number | Comments |
| 20 mL syringe | BD Discardit II | 300296 | No special requirements |
| 50 mL conical tubes | Avantor | 525-0610 | No special requirements |
| 90 x 14 mm Petri dishes | Deltalab | 200209 | No special requirements |
| Agar | Sigma-Aldrich | A1296 | No special requirements |
| Bacteriophage lysate | Minimal concentration: 109 PFU/mL | ||
| Centrifuge | Eppendorf | No special requirements | |
| Chloroform | Panreac | 131252 | No special requirements |
| Citric acid · H2O | Merck | 1.00247 | |
| Colony counter | No special requirements | ||
| Evans Blue | Sigma-Aldrich | E-2129 | |
| Flasks | No special requirements | ||
| Fluorescein sodium salt | Sigma-Aldrich | F-6377 | |
| Forceps | No special requirements | ||
| Glass tubes | No special requirements | ||
| Glass tubes for lysate | No special requirements | ||
| Glucose | Sigma-Aldrich | G7021 | |
| K2HPO4 | Merck | 1.05104.1000 | |
| K2HPO4 anhydrous | Merck | 1.05104 | |
| Lipopolysaccharide from Salmonella enterica serotype Typhimurium | Sigma-Aldrich | L6511-25 mg | Dissolved in sterile water |
| Membrane 0.45 µm | MF-Millipore | HAWP02500 | No special requirements |
| MgSO4 · 7 H2O | Merck | 1.05886 | |
| NaCl | Sigma-Aldrich | S9888 | No special requirements |
| NaNH4HPO4 · 4 H2O | Sigma-Aldrich | S9506 | |
| Peptone | iNtRON | Ba2001 | No special requirements |
| Syringe Filter 0.22 µm | Millex | SLGSR33SB | No special requirements |
| Toothpicks | No special requirements | ||
| Tryptone | Panreac | 403682.1210 | No special requirements |
| Vacuum pump | Thermo Scientific | No special requirements | |
| Yeast extract | iNtRON | 48045 | No special requirements |
Ссылки
- Kasman, L. M., Porter, L. D. . Bacteriophages. , (2024).
- Lawrence, D., Baldridge, M. T., Handley, S. A. Phages and human health: More than idle hitchhikers. Viruses. 11 (7), 587 (2019).
- Beller, L., Matthijnssens, J. What is (not) known about the dynamics of the human gut virome in health and disease. Curr Opin Virol. 37, 52-57 (2019).
- Roux, S., Hallam, S. J., Woyke, T., Sullivan, M. B. Viral dark matter and virus-host interactions resolved from publicly available microbial genomes. eLife. 4, 08490 (2015).
- Wommack, K. E., Colwell, R. R. Virioplankton: Viruses in aquatic ecosystems. Microbiol Mol Biol Rev. 64 (1), 69-114 (2000).
- Louten, J. Virus structure and classification. Essentl Human Virol. , 19-29 (2016).
- Egido, J. E., Costa, A. R., Aparicio-Maldonado, C., Haas, P. J., Brouns, S. J. J. Mechanisms and clinical importance of bacteriophage resistance. FEMS Microbiol Rev. 46 (1), 048 (2022).
- Rakhuba, D. V., Kolomiets, E. I., Dey, E. S., Novik, G. I. Bacteriophage receptors, mechanisms of phage adsorption and penetration into host cell. Polish J Microbiol. 59 (3), 145-155 (2010).
- Lindberg, A. A. Bacteriophage receptors. Ann Rev Microbiol. 27 (1), 205-241 (1973).
- Koskella, B., Meaden, S. Understanding bacteriophage specificity in natural microbial communities. Viruses. 5 (3), 806-823 (2013).
- Marcó, M. B., Moineau, S., Quiberoni, A. Bacteriophages and dairy fermentations. Bacteriophage. 2 (3), 149-158 (2012).
- Fernández-Fernández, R., et al. Evolution of a bistable genetic system in fluctuating and non-fluctuating environments. bioRxiv. , (2024).
- Cota, I., Blanc-Potard, A. B., Casadesús, J. STM2209-STM2208 (opvAB): a phase variation locus of Salmonella enterica involved in control of O-antigen chain length. PloS one. 7 (5), e36863 (2012).
- Kropinski, A. M., Mazzocco, A., Waddell, T. E., Lingohr, E., Johnson, R. P. Enumeration of bacteriophages by double agar overlay plaque assay. Methods Mol Biol. 501, 69-76 (2009).
- Ackermann, H. W. Tailed bacteriophages: The order Caudovirales. Adv Virus Res. 51, 135-201 (1998).
- Wilkinson, R. G., Gemski, P., Stocker, B. A. D. Non-smooth mutants of Salmonella typhimurium: Differentiation by phage sensitivity and genetic mapping. J Gen Microbiol. 70 (3), 527-554 (1972).
- Casjens, S. R., Leavitt, J. C., Hatfull, G. F., Hendrix, R. W. Genome sequence of Salmonella Phage 9NA. Genome Announc. 2 (4), e00531 (2014).
- Cota, I., et al. Epigenetic control of Salmonella enterica O-antigen chain length: A tradeoff between virulence and bacteriophage resistance. PLoS Genet. 11 (11), e1005667 (2015).
- Chan, K., Botstein, D., Watanabe, T., Ogata, Y. Specialized transduction of tetracycline resistance by phage P22 in Salmonella typhimurium. Virology. 50, 883-898 (1972).
- Bertozzi Silva, J., Storms, Z., Sauvageau, D. Host receptors for bacteriophage adsorption. FEMS Microbiol Lett. 363 (4), 002 (2016).
- Sørensen, M. C. H., et al. Bacteriophage F336 recognizes the capsular phosphoramidate modification of Campylobacter jejuni NCTC11168. J Bacteriol. 193 (23), 6742-6749 (2011).
- Ogata, S., Hongo, M. Bacteriophages of the Genus Clostridium. Adv Appl Microbiol. 25, 241-273 (1979).
- Olivenza, D. R., Casadesús, J., Ansaldi, M. Epigenetic biosensors for bacteriophage detection and phage receptor discrimination. Environ Microbiol. 22 (8), 3126-3142 (2020).
- Olivenza, D. R., et al. A portable epigenetic switch for bistable gene expression in bacteria. Sci Rep. 9 (1), 862 (2019).
- Walter, M., et al. Structure of the receptor-binding protein of bacteriophage Det7: a Podoviral tail spike in a Myovirus. J Virol. 82 (5), 2265-2273 (2008).
- Davies, M. R., Broadbent, S. E., Harris, S. R., Thomson, N. R., vander Woude, M. W. Horizontally acquired Glycosyltransferase operons drive Salmonellae lipopolysaccharide diversity. PLoS Genet. 9 (6), e1003568 (2013).
- Wahl, A., Battesti, A., Ansaldi, M. Prophages in Salmonella enterica: a driving force in reshaping the genome and physiology of their bacterial host. Mol Microbiol. 111 (2), 303-316 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены