Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Синтез гранул с высоким содержанием масла черного тмина, альгината, чувствительных к pH с использованием метода электронапыления
В этой статье
Резюме
Представлена методика с использованием высокого электрического напряжения и целенаправленной эмульсии, наполненной активными ингредиентами, для получения pH-чувствительных, однородных микрогранул.
Аннотация
Масло черного тмина (BSO), полученное из семян растения Nigella sativa , привлекло внимание благодаря своим потенциальным противораковым свойствам, особенно в контексте рака толстой кишки. Его активное соединение, тимохинон, может помочь ингибировать рост раковых клеток и индуцировать апоптоз в клетках рака толстой кишки. Кроме того, противовоспалительное и антиоксидантное действие масла черного тмина может способствовать улучшению окружающей среды кишечника, потенциально снижая риск развития рака. Таким образом, в этом исследовании были синтезированы pH-чувствительные альгинатные гранулы для доставки BSO в толстую кишку контролируемым образом без высвобождения препарата при pH 1,2 (желудок), тем самым обеспечивая четко определенную схему высвобождения при pH 6,8. Использование технологии электрораспыления улучшает производительность процесса, упрощая составление мелких, однородных гранул с более высокой скоростью набухания и диффузии в желудочно-кишечной среде.
Разработанные гранулы характеризовались тестом на прочность мукоадгезивного слоя ex-vivo , размер гранул, фактор сферичности (SF), эффективность инкапсуляции (EE), сканирующий электронный микроскоп (SEM), поведение набухания in vitro (SB) и высвобождение препарата in vitro в кислых и буферных средах. Все эти изготовленные бусины показали скромные размеры 0,58 ± 0,01 мм и сферическую форму 0,03 ± 0,00 мм. Рецептура показала многообещающие плавающие и высвобождающие свойства in vitro. При очень низком кумулятивном проценте гранул, ЭЭ масла 90,13% ± 0,93% было высоким, а исследование выпуска показало более 90% pH 6,8 с хорошим плавающим характером в желудке. Кроме того, бусины были равномерно распределены по всему кишечнику. Подход к электрораспылению, используемый в этом протоколе, может быть воспроизводимым, что дает стабильные результаты. Таким образом, этот протокол может быть использован для крупномасштабного производства в целях коммерциализации.
Введение
Черный тмин, и особенно БСО, веками использовался для лечения широкого спектра заболеваний благодаря своим хорошо известным лечебным свойствам. Тимохинон, пожалуй, является одним из самых важных фитохимических веществ, обнаруженных в BSO1. В последние годы исследователи изучали потенциальные терапевтические преимущества тимохинона in vivo и in vitro, получив эмпирические доказательства в поддержку использования BSO. Антигипертензивные, антибактериальные, антигистаминные, противогрибковые, обезболивающие, антидиабетические, гиполипидемические и противовоспалительные свойства были продемонстрированы в этих исследованиях для БСО, которые могут быть использованы для лечения таких симптомов, как экзема, высокое кровяное давление, астма, кашель, головная боль, грипп, лихорадка, противораковые средства, головокружение и активность 2,3.
Нанесение относительно тонких покрытий на мелкие капли жидкостей и дисперсий или частиц твердого материала известно как микрокапсулирование. Когда дело доходит до масла, микрокапсулированное масло обычно довольно ценно, потому что некоторые формы масла, такие как BSO, считаются питательными продуктами и обладают лечебнымисвойствами. Однако добавление масел непосредственно в матрицу пищи может привести к испарению, что может быстро привести к исчезновению активности в результате воздействия кислорода и ультрафиолетового излучения5. Кроме того, отсутствие контроля над скоростью выделения масел приводит к немедленному и кратковременному эффекту. Создание полимерного покрытия вокруг эфирного масла с помощью микрокапсулирования или микросферификации является одним из методов преодоления этих недостатков6.
Микрокапсулы, также известные как микросферы, защищают масла от вредных условий окружающей среды7. Этот процесс широко используется для повышения эффективности лекарств, сохранения содержания лекарств, обеспечения возможности выпуска таблеток с замедленным высвобождением, улучшения маскировки вкуса, уменьшения потери вкуса в течение срока годности продукта, продления вкусовых ощущений во рту и отделения несовместимых ингредиентов в одной дозировке8. Микрокапсулирование также помогает поддерживать метаболическую абсорбцию, контролировать скорость выделения масла и поддерживать соответствующие концентрации для получения желаемого результата в определенном месте9.
Электрогидродинамическая инкапсуляция является простым и адаптируемым методом. Активное вещество находится во внутреннем ядре микрокапсулы, которая состоит из внешней оболочки. В связи с этим он имеет достаточно прочную матрицу, гарантирующую более эффективную диссеминацию активного компонента, а не четко определенного ядра. Перед сферициклизацией активное вещество и полимерный раствор должны быть соединены для получения микросфер9. С другой стороны, поскольку масло летучее, его микрокапсулирование может быть чрезвычайно сложным и требует тщательного контроля температуры.
Существуют различные методы капсулирования масел. Например, некоторые масла необходимо инкапсулировать при низких температурах, чтобы предотвратить разрушение или испарение их биологически активных компонентов. Для создания микро- и наноразмерныхструктур исследователи широко изучали электрогидродинамическую распыленность (ЭГДА). В этом смысле условия обработки, которые включают скорость потока, приложенное напряжение и размер сопла, а также свойства расстояния сбора полимерного раствора, являются двумя основными факторами, которые должны быть приняты во внимание для получения желаемого размера или морфологии частиц11,12.
В этом исследовании альгинаты — тип встречающихся в природе полисахаридов, пригодных для перорального приема внутрь — были использованы для инкапсуляции BSO. Бурые водоросли содержат альгинат, анионный полимер, который встречается в природе. Он состоит из двух мономерных структур: α-L-гулуроновой (G) и 1-4βD-маннуроновой (M) кислоты13. Его полимер не токсичен14, имеет высокую степень биосовместимости, недорог и эффективно разлагается15. Поэтому он часто используется в биотехнологическом и инженерном секторах.
Альгинаты являются предпочтительным материалом для инкапсуляции методом ионного гелеобразования, поскольку они могут создавать сшитую структуру между G-группами различных альгинатных цепей, образуя ионные связи с двухвалентными катионами, такими как ионы Sr2+, Ca2+ или Zn2+. Процесс гелеобразования можно адекватно охарактеризовать с помощью модели яйцеклетки, которая ограничивает двухвалентный катион двумя карбоксильными группами на параллельных молекулах альгината. Было высказано предположение, что гидрогелевые характеристики гранул альгината натрия могут регулировать высвобождение макромолекул и малых молекул. Гранулы альгината натрия могут прилипать к слизистой оболочке кишечника в течение длительного периода времени благодаря своим слизисто-адгезивным свойствам. Кроме того, альгинат представляет собой защитный экран, который может защищать масла от внешних элементов, таких как кислые среды16, и переносить масла в каналы доставки желудочно-кишечного тракта17. С тех пор он был использован в исследованиях для помощи в местно-специфическом введении лекарственного препарата в ткани слизистых оболочек18,19.
Электрогидродинамический подход был использован в данном исследовании для изучения жизнеспособности эмульгирования коммерческих масел для создания капсул20. Здесь был использован электрогидродинамический подход для генерации и анализа микросфер20, нагруженных альгинат-BSO. В этом исследовании оценивался ряд других факторов, включая SF микросфер, ex-vivo, слизистые адгезивные свойства, EE%, внешний вид, распределение по размерам и дзета-потенциал; инфракрасная спектроскопия с аттенуированным полным отражением и преобразованием Фурье (ATR-FTIR) была использована для проверки химической совместимости20.
протокол
1. Приготовление эмульсии альгинат-БСО
- Диспергируйте 10% по мас.% BSO в 1% по мас.v раствору альгината натрия, содержащему 1, 3 и 5% по объему лецитина, в стакане объемом 50 мл.
- Получить наноэмульсию можно с помощью ультразвукового гомогенизатора. Установите уровень мощности на 20%. Запустите гомогенизатор в течение 55 с, нажав кнопку «Пуск », чтобы завершить процесс.
2. Характеристика альгинат-BSO эмульсии
- Анализ дзета-потенциала и распределения частиц по размерам
- Возьмите 0,1 мл свежеприготовленной эмульсии в стеклянную мензурку объемом 25 мл и разбавьте ее 9,9 мл дистиллированной воды.
- Возьмите 2,5 мл этого разбавленного раствора в кварцевую кювету объемом 3 мл и поместите кювету в измерительную камеру.
- Откройте крышку и поместите кювету внутрь устройства, убедившись, что кювета правильно ориентирована по отношению к траектории светового луча. Нажмите на значок измерения .
- Выньте кювету. Извлеките образец или утилизируйте его надлежащим образом.
- Сохраните данные в виде pdf-файла в личной папке для дальнейшего использования.
- Определение стабильности эмульсии (ES)
- Возьмите 5 мл свежеприготовленной эмульсии в центрифужных пробирках объемом 10 мл. Центрифугируйте эмульсии (n = 3) в течение 5 мин при 894 × г.
- С помощью уравнения (1) определите ЭС на основе положения раздела раздела фаз.
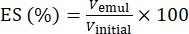 (1)
(1)
Где Vemul – объем оставшейся эмульсии после центрифугирования, а Vinitial – объем исходной эмульсии.
- Подготовка швов
- Альгинатные бусины БСО
- Приготовьте альгинатные шарики BSO с помощью технологии электронапыления, называемой EHDA. Используйте массовую эмульсию BSO, состоящую из 10% BSO, 1% альгината натрия и 3% раствора лецитина.
- Используя шприцевой насос для регулирования скорости потока, загрузите эмульсию в пластиковый шприц объемом 10 мл и протолкните ее через иглу 22 G. Прикрепите кончик иглы к положительному электроду высоковольтного источника питания.
- В качестве коллектора используйте заземленный стакан с 50 мл 1% по мас.мас.хлорида кальция (желирующая ванна). Чередуйте расход капель от 1 мл/мин до 3 мл/мин при напряжениях 3, 5 и 7 кВ, сохраняя расстояние 10 см над поверхностью раствора хлорида кальция.
- Чтобы подтвердить полное гелеобразование, оставьте шарики в желирующей ванне на 30 минут, перемешивая их. Используйте фильтр из нержавеющей стали, чтобы удалить шарики из желирующей ванны, и промойте собранные шарики сверхчистой дистиллированной водой.
- Дайте шарикам высохнуть в течение 16 часов при комнатной температуре на лабораторном столе. Используйте Уравнение (2) для расчета процентного выхода бусин.
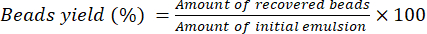 (2)
(2)
- Альгинатные шарики без BSO
- Приготовьте 1% w/v раствор альгината натрия. Добавьте в раствор лецитин в концентрациях 1%, 3% и 5% мас.v. Тщательно перемешайте раствор до полного растворения лецитина.
- Используйте раствор из шага 2.3.2.1 для приготовления альгинатных шариков, не содержащих BSO, как описано в шагах 2.3.1.2-2.3.1.5. Рассчитайте урожайность с помощью уравнения (2).
- Альгинатные бусины БСО
3. Характеристика швов
- Определение размера и формы
- Чтобы определить размер и форму бусин, используйте анализатор изображений. Сфотографируйте с помощью цифровой камеры влажные и высушенные бусины.
- Затем измерьте диаметр борта с помощью предустановленной шкалы прибора. Используя значения диаметров, рассчитаем SF из полученных значений диаметров с помощью уравнения (3):
СФ =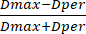 (3)
(3)
Где Dmax представляет собой наибольший диаметр, проходящий через центр бусины (в мм), в то время как Dper относится к диаметру, который перпендикулярен Dmax и проходит через центр бусины (в мм).
ПРИМЕЧАНИЕ: Нулевое значение SF обозначает идеально сферическую бусину, а возрастающие значения SF означают большее отклонение от сферической формы. Кроме того, бусины считаются сферическими, если их SF составляет 0,05 или ниже.
4. Определение EE%
- Разложите шарики в фосфатно-солевом буфере (PBS), чтобы вернуть их в эмульсию. Измерьте поглощение полученной эмульсии на длине волны 600 нм с помощью УФ-видимого спектрофотометра.
- Используйте значение абсорбции для представления мутности эмульсии. Создайте стандартную кривую с использованием известного количества BSO в эмульсии.
- Рассчитаем EE% с помощью уравнения (4):
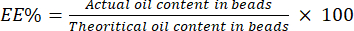 (4)
(4)
5. Сканирующая электронная микроскопия (СЭМ)
ПРИМЕЧАНИЕ: Используйте SEM для наблюдения за микроструктурой и морфологией поверхности альгинатных шариков BSO.
- Чтобы осмотреть внутреннюю часть высушенных бусин, отрежьте несколько из них. Нанесите нарезанные бусины на алюминиевые пряди и наклейте их с помощью углеродных клейких лент.
- Нанесите покрытие на шарики с помощью модуля напыления углерода в вакуумном испарителе в атмосфере аргона. Нанесите на углеродное покрытие толщиной 100 Å и 50 Å.
- Получение изображений покрытых валиков в условиях высокого вакуума с помощью ускорителя напряжения от 10 кВ до 15 кВ.
6. Определение лекарственного взаимодействия со вспомогательным веществом с помощью ATR-FTIR
- Установите значения инструментальной волны в диапазоне от 4 000 см-1 до 400 см-1 , используя окружающий воздух в качестве фона и разрешение 1 см-1. Смотрите Дополнительный файл 1.
- Запишите спектры БСО, альгината натрия, лецитина, хлорида кальция, гранул без БСО, гранул альгината-БСО и физической смеси активного ингредиента и вспомогательных веществ (альгината натрия, лецитина, хлорида кальция и БСО) отдельно.
- Поместите образец (5-10 мг) на место отбора проб. Отрегулируйте 20 сканирований, разрешение 4, усилие 80, прижимной рычаг с плоским наконечником. Убедитесь, что для параметра Автоприращение по-прежнему установлено значение Пусто , чтобы спектр автоматически сохранялся в нужной папке.
- Чтобы начать измерение образца, нажмите кнопку [Образец] . После выбора [Образец], поскольку периода ожидания нет, убедитесь, что образец готов, а давление зажима уменьшено. Анализируйте все образцы по отдельности. Индивидуально анализируйте все записанные спектры с помощью программного обеспечения для спектроскопии.
7. Дифференциальная сканирующая калориметрия (ДСК)
ПРИМЕЧАНИЕ: Термические свойства и совместимость шариков, загруженных BSO, были исследованы с помощью DSC (Дополнительный файл 1).
- Запечатайте бусины весом ~3,20 мг в обычную алюминиевую кастрюлю. Образцы нагревают со скоростью 10 °С/мин при анализе в диапазоне температур 50-350 °С под потоком азота, протекающего со скоростью 20 л/мин.
8. Характеристики набухания бусин
- Приготовьте 100 мг высушенных шариков альгината-BSO.
- Приготовьте имитированную кишечную жидкость (SIF) и имитированную желудочную жидкость (SGF) в чистом сухом емкости для смешивания подходящего размера - 6 л, 10 л или 25 л. Добавьте очищенную воду примерно на 33% от требуемого объема - 2 л, 3 л или 8 л, и перелейте содержимое флакона с концентратом в сосуд. Промойте бутылку очищенной водой и добавьте ополаскиватели и очищенную воду в емкость для смешивания для получения необходимого объема; Тщательно перемешайте. Измерьте pH и действуйте, если это не соответствует спецификации; При необходимости отрегулируйте pH.
- Погрузите шарики в 50 мл среды, содержащей имитированную кишечную жидкость (SIF) и имитируемую желудочную жидкость (SGF). Поддерживать условия в течение 2 ч при температуре 37 ± 0,5 °C.
- Удалите надутые шарики и отфильтруйте их через металлическую сетку с заранее заданными интервалами 0, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110 и 120 минут или более. Используйте бумажное полотенце, чтобы удалить лишнюю жидкость из набухших шариков.
- Измерьте вес вытертых бусин с помощью электронных аналитических весов. Определите процент индекса набухания (%СИ) с помощью уравнения (5):
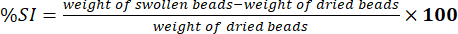 (5)
(5)
Результаты
Приготовление альгинатных микрогранул с нагрузкой на BSO
На рисунке 1 представлена экспериментальная установка для получения альгинатных микрогранул, загруженных BSO. Количество используемого лецитина оказывало значительное влияние на ста...
Обсуждение
С помощью процесса EHDA были созданы альгинатные микрогранулы, загруженные BSO, в качестве pH-чувствительного носителя. Сеть шариков демонстрировала pH-зависимое набухание и поведение высвобождения лекарств из-за обильного присутствия групп карбоновых кислот. Было выявл...
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Это исследование было поддержано Университетом принцессы Нуры бинт Абдулрахман Исследователи Проект поддержки проекта (PNURSP2024R30), Университет принцессы Нуры бинт Абдулрахман, Эр-Рияд, Саудовская Аравия. Это исследование было профинансировано Проектом поддержки исследователей No (RSPD2024R811), Университет короля Сауда, Эр-Рияд, Саудовская Аравия.
Материалы
| Name | Company | Catalog Number | Comments |
| 10 mL Centrifuge Tubes | Globe Scientific | 22-171-624 | |
| 22 G needle | Sigma-Aldrich (St.Louis, Missouri, USA). | CAD4172 | |
| 3 mL quartz-cuvette | Sigma-Aldrich (St.Louis, Missouri, USA). | Z276669 | |
| 50 mL beaker | |||
| Aluminum stubs | |||
| An electronic analytical balance | |||
| ATR-FTIR | Bruker Malaysia Sdn Bhd, Kawasan Perindustrian Temasya, 40150 Shah Alam, Selangor, Malaysia. | ||
| Black seed oil | IKOP Pharmaceutical Ltd. (IKOP, Faculty of Pharmacy, IIUM, 25200 Kuantan, Pahang, Malaysia | B182111 | Active ingredient |
| Calcium chloride dehydrate, CaCl2 · 2H2O | Sigma-Aldrich (St.Louis, Missouri, USA). | 21074 | Gelling agent |
| Carbon adhesive tapes | |||
| Centrifuge | |||
| Differential scanning calorimetry | |||
| Digital camera | |||
| Grounded beaker | |||
| High guluronic acid content Sodium alginate (mw. 97,000) with medium viscosity (40 – 100 mPa s) | Sigma-Aldrich (St.Louis, Missouri, USA). | W201502 | Polymer |
| High voltage power supply | |||
| Isopropyl alcohol | Sigma-Aldrich (St.Louis, Missouri, USA). | W292912 | ATR-FTIR cleaning purpose |
| Lecithin | Sigma-Aldrich (St.Louis, Missouri, USA). | P7568 | Surfactant |
| Microscope | |||
| Paper towel | |||
| Scanning electron microscopy | |||
| Simulated gastric fluid | Sigma-Aldrich (St.Louis, Missouri, USA). | 1651 | Release media and swelling media |
| Simulated intestinal fluid | Sigma-Aldrich (St.Louis, Missouri, USA). | 84082-64-4 | Release media and swelling media |
| Spectroscopy software | |||
| Stainless-steel filter | |||
| Syringe pump | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Ultrapure distilled water | Supplied by institutional lab | ||
| Ultrasonic homogenizer | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| UV-vis spectrophotometer. | |||
| Vacuum evaporator | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Voltage accelerator | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Zetasizer Nano-ZS | (Malvern Zetasizer Nano series Nano-S and Nano-Z, Malvern Instruments Ltd., Worcestershire, UK) |
Ссылки
- Benavides, S., Cortés, P., Parada, J., Franco, W. Development of alginate microspheres containing thyme essential oil using ionic gelation. Food Chem. 204 (8), 77-83 (2016).
- Agbaria, R., Gabarin, A., Dahan, A., Ben-Shabat, S. Anticancer activity of Nigella sativa (black seed) and its relationship with the thermal processing and quinone composition of the seed. Drug Des Devel Ther. 9 (1), 3119 (2015).
- Wang, D., Qiao, J., Zhao, X., Chen, T., Guan, D. Thymoquinone inhibits IL-1β-induced inflammation in human osteoarthritis chondrocytes by suppressing NF-κB and MAPKs signaling pathway. Inflammation. 38 (7), 2235-2241 (2015).
- Beyki, M., et al. Encapsulation of Mentha piperita essential oils in chitosan-cinnamic acid nanogel with enhanced antimicrobial activity against Aspergillus flavus. Ind Crop Prod. 54 (3), 310-319 (2014).
- Hosseini, S. M., et al. Incorporation of essential oil in alginate microparticles by multiple emulsion/ionic gelation process. Inter J Biol Macromol. 62 (11), 582-588 (2013).
- Banerjee, S., et al. Influence of process variables on essential oil microcapsule properties by carbohydrate polymer-protein blends. Carbohydr Polym. 93 (2), 691-697 (2013).
- Sebe, I., Szabó, E., Zelkó, R. Advances in drug delivery via electrospun and electrosprayed formulations. In Emerging Drug Delivery and Biomedical Engineering Technologies. , 71-104 (2023).
- Akram, N., et al. Fabrication and characterization of PVA-WPI based nanofiber mats for improved viability of Lactobacillus rhamnosus GG. Foods. 12 (21), 3904 (2023).
- Azad, A. K., Sinan, M. A. A., John, F. K., Bappaditya, C., Hriday, B. Electro-hydrodynamic assisted synthesis of lecithin-stabilized peppermint oil-loaded alginate microbeads for intestinal drug delivery. Int J Biol Macromol. 185 (8), 861-875 (2021).
- Chan, E. S. Preparation of Ca-alginate beads containing high oil content: Influence of process variables on encapsulation efficiency and bead properties. Carbohydr Polym. 84 (4), 1267-1275 (2011).
- Xie, J., Jiang, J., Davoodi, P., Srinivasan, M. P., Wang, C. H. Electrohydrodynamic atomization: A two-decade effort to produce and process micro-/nanoparticulate materials. Chem Eng Sci. 125 (3), 32-57 (2015).
- Zamani, M., Prabhakaran, M. P., Ramakrishna, S. Advances in drug delivery via electrospun and electrosprayed nanomaterials. Int J Nanomed. 8 (8), 2997 (2013).
- Husain, O., Lau, W., Edirisinghe, M., Parhizkar, M. Investigating the particle to fibre transition threshold during electrohydrodynamic atomization of a polymer solution. Mater Sci Eng. C. 65 (8), 240-250 (2016).
- Wan, L. Q. Calcium concentration effects on the mechanical and biochemical properties of chondrocyte-alginate constructs. Cell Mol Bioeng. 1 (3), 93-102 (2008).
- Baimark, Y., Srisuwan, Y. Preparation of alginate microspheres by water-in-oil emulsion method for drug delivery: Effect of Ca2+ post-cross-linking. Adv Powder Technol. 25 (5), 1541-1546 (2014).
- Paques, J. P., Sagis, L. M. C., van Rijn, C. J. M., van der Linden, E. Nanospheres of alginate prepared through w/o emulsification and internal gelation with nanoparticles of CaCO3. Food Hydrocoll. 40 (10), 182-188 (2014).
- Suksamran, T. Biodegradable alginate microparticles developed by electrohydrodynamic spraying techniques for oral delivery of protein. J Microencapsul. 26 (7), 563-570 (2009).
- Wang, H., et al. Characterization, release, and antioxidant activity of curcumin-loaded sodium alginate/ZnO hydrogel beads. Int J Biol Macromol. 121 (1), 1118-1125 (2019).
- Bera, H., Boddupalli, S., Nayak, A. K. Mucoadhesive-floating zinc-pectinate-sterculia gum interpenetrating polymer network beads encapsulating ziprasidone HCl. Carbohydr Polym. 131 (10), 108-118 (2015).
- Azad, A. K., et al. Encapsulation of black seed oil in alginate beads as a pH-sensitive carrier for intestine-targeted drug delivery: In vitro, in vivo and ex vivo study. Pharmaceutics. 12 (3), 219 (2020).
- Azad, A. K., et al. A dataset of microstructure features of electro-hydrodynamic assisted 5-fluorouracil-grafted alginate microbeads and physicochemical properties for effective colon targeted carriers drug delivery. Data in Brief. 53 (4), 110202 (2024).
- Danaei, M., et al. Impact of particle size and polydispersity index on the clinical applications of lipidic nanocarrier systems. Pharmaceutics. 10 (2), 57 (2018).
- Piornos, J. A., Burgos-Díaz, C., Morales, E., Rubilar, M., Acevedo, F. Highly efficient encapsulation of linseed oil into alginate/lupin protein beads: Optimization of the emulsion formulation. Food Hydrocoll. 63 (2), 139-148 (2017).
- Morales, E. Alginate/Shellac beads developed by external gelation as a highly efficient model system for oil encapsulation with intestinal delivery. Food Hydrocoll. 70 (9), 321-328 (2017).
- Nikoo, A. M., Kadkhodaee, R., Ghorani, B., Razzaq, H., Tucker, N. Electrospray-assisted encapsulation of caffeine in alginate microhydrogels. Int J Biol Macromol. 116 (9), 208-216 (2018).
- Shao, L., et al. Effect of cold-spray parameters on surface roughness, thickness and adhesion of copper-based composite coating on aluminum alloy 6061 T6 substrate. Processes. 11 (3), 959 (2023).
- Li, W., et al. Effects of spraying parameters and heat treatment temperature on microstructure and properties of single-pass and single-layer cold-sprayed Cu coatings on Al alloy substrate. Surf Coat Technol. 30 (490), 131184 (2024).
- . . US Pharmacopoeia National Formulary, USP 23/NF 18. , (2000).
- Chen, Y. -. C., Ho, H. -. O., Liu, D. -. Z., Siow, W. -. S., Sheu, M. -. T. Swelling/floating capability and drug release characterizations of gastroretentive drug delivery system based on a combination of hydroxyethyl cellulose and sodium carboxymethyl cellulose. PLoS One. 10 (1), e0116914 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены