Method Article
特定细胞群的净化荧光激活细胞分选(FACS)
摘要
许多科学研究需要的细胞群的生物和化学分析,细胞必须在高纯度的状态。荧光激活细胞分选(FACS)是一种高级的方法,在其中获得纯的细胞群。
摘要
实验和临床研究,往往需要高度纯化的细胞群。流式细胞仪是一种选择的技术来净化称为表型的细胞群。净化等大宗方法包括平移,补充枯竭和磁珠分离。然而,流式细胞仪已超过其他可用的方法有几个优点。流式细胞仪是首选的方法时,需要非常高的纯度所需的人口,目标细胞群时,表示一个非常低的水平,识别标记或细胞群时,要求分离的基础上差标记密度。此外,流式细胞仪是唯一可用的净化技术来隔离内部染色或细胞内蛋白质的表达的细胞,如转基因荧光蛋白标记。流式细胞仪允许的大小,粒度和荧光的单个细胞的纯化。为了净化细胞的利益,他们是先染色与荧光标记的单克隆抗体(mAb),识别所需的细胞群(1)的特异性表面标志。未染色细胞的阴性选择也是可能的。流式细胞仪净化要求与排序能力和相应的软件的流式细胞仪。流式细胞仪,细胞悬浮液中通过包含在激光面前的每一个单细胞的液滴流。荧光检测系统检测细胞根据预定的细胞的荧光参数的利益。该仪器适用于一次充电到液滴含有的利益细胞和一个有利于收集到相应的收集管(2)带电液滴的静电偏转系统。染色,从而排序的成功在很大程度上取决于选择的识别标记和单克隆抗体的选择。排序参数,可以调整取决于纯度和产量的要求。虽然流式细胞仪需要专门的设备和人员培训,它是隔离的高度纯化的细胞群的首选方法。
研究方案
- 开始之前的过程中,下列项目需要收集和准备:
- 冰
- 15毫升锥形管染色细胞和染色单一的颜色控制的12 × 75毫米流量管。
- 染色缓冲液:磷酸盐缓冲液(PBS)+ 3%小牛血清(FCS)
- 移液器
- FC块(如果需要)和染色抗体。最佳染色抗体需要滴定。
- 补偿珠
- 暂停缓冲:汉克的平衡盐溶液(HBSS)+ 25毫米的HEPES + 3%FCS
- 台盼蓝和血球
- 细胞过滤器(40微米尼龙)
- 收集管:两种类型的收集管,可用于A)12 × 75毫米的聚苯乙烯管(含300μLFCS和25毫米的HEPES)或b)15毫升(含1毫升的FCS + 25毫米的HEPES),锥形管。排序细胞的集合,可用于任何具有丰富的血药浓度高媒介。
- 生成一个起始细胞群的单细胞悬液。
- 可选:充实所需的细胞群,批量纯化方法作为补充枯竭或磁性排序等。浓缩步骤的主要优点是,它减少了排序时间。
- 与染色缓冲液洗涤细胞一次。
- 弃上清,重悬细胞染色浓度的缓冲区,高效染色50 × 10 6。
- 可选:细胞表达高水平的FCR,使用适当的阻塞方法阻止受体。一个选择的方法是使用单克隆抗体结合FcγR冰10-15分钟。这些抗体均为市售。
- 添加适当的人与生物圈计划(在预定的浓度)染色所需的细胞群,并培育20-30分钟冰在黑暗中,两个染色缓冲液洗。可选:一个重要的染料,如碘化丙啶染色,可以辨别死细胞(5)。如果是用于多色染色,单一颜色的控制是必需的。我们使用屋宇署CompBeads准备单一的颜色控制,使用制造商的协议。
- 如果不使用直接标记的抗体,重复步骤7,使用适当的辅助抗体或链霉亲和素共轭。
- 清洗后,重新悬浮培养液中的细胞,并确定使用至关重要的,如台盼蓝染料的细胞浓度。
- 调整细胞浓度为15-20 × 10 6 / ml的。细胞群,形成集群,这可能会阻塞在排序仪器,通过一个过滤器过滤的细胞。
- 设置和优化的细胞分选。设立流式细胞仪取决于制造过程是多种多样的,需要由受过适当训练的的人员执行。
一般建议如下:- 取决于细胞类型进行排序,选择合适的喷嘴。
- 对于无菌各种,消毒仪器。
- 执行与珠激光器的运作,以验证仪器的质量控制,它是准确排序。
- 安装所需的收集装置和侧流。
- 看仪器的激光器和探测器成立,以确定可以使用(我们的BD流式细胞仪唱腔有三个激光头,可以检测多达九种颜色)的荧光标记。
- 一旦确定将荧光标记的细胞分选使用,补偿可以执行(如下所述)。
- 阴性对照样品和单阳性对照进行补偿。补偿是必要的删除两个探测器之间的频谱重叠。这是有关赔偿是不是傻子证明是不利明亮的某些标记染色,从而导致暗淡和消极的人群之间的分辨率较差的低自体荧光的细胞,具有荧光的影响。
为了达到最佳效果,实验设计应包括使用明亮的荧光标记低表达或不具有已知的染色模式。标记之间的细胞群和高效表达提供良好的分离,应使用与二聚体的荧光,如红色或紫色激光器激发的。- 可以进行赔偿与补偿珠,这是聚苯乙烯微粒已耦合到一个特定免疫球蛋白κ轻链从鼠标,大鼠,大鼠/仓鼠的抗体的。珠子很容易染色,有一个强有力的信号,并准备作为实验样品具有相同的荧光团的单染控制提供了一个简单的方法。
- 设置一个模板,其中包括一个二元图显示前向散射(FSC)和侧散射(SSC),和一个直方图每个将要使用的荧光。
- 运行阴性对照管和调整前向散射(FSC)和侧向散射(SSC),以地方的人口规模的兴趣。
- 调整荧光光电倍增管的设置,以地方人口负或直方图的左手部分的自体荧光。
- 记录阴性对照管。
- 运行单阳性对照管,并记录每个管数据。
- 周围画直方图数据的积极部分,另一个直方图的负面部分的间隔门的时间间隔门。
- 手动补偿是通过调整中位数(中位数是更好的集中趋势估计比平均对数刻度)的阳性,直到它等于底片的中位数。这项工作必须为每个实验中所用的荧光标签。
- 要调整中位数,调整光谱重叠值或高或低,直到每个荧光参数匹配的中位数尽可能密切。
- 补偿,也可以自动完成与分析软件。自动补偿使用补偿控制记录的数据来计算所有的实验中所用的荧光团的代数矩阵。使用这些值减去非主要的颜色是原色的探测器出血的贡献。
- 记录实验样品进行排序,并使用门控的工具和子集方法定义感兴趣的人群。
- 用散点图显示FSC与SSC和使用门控工具,多边形,矩形,间隔或象限门的人口的利益,设置实验的模板。散点图显示,这是不同的细胞类型的细胞的物理性质,化学性质。
- 确定荧光浇注战略的最佳方式是使用荧光减一(FMO)的控制。在鱼类统营处控制管实验中所用的所有试剂,包括利益的除外。鱼类统营处有助于区分依稀染色的人口和广阔的负面人口。
- 鱼类统营处管使用的数据记录下来,以确定在何处放置实验管内的门。
- 一旦已经确定盖茨,盖茨可以选择到外部收集管的排序。最多四个门(或群体)可以在同一时间进行排序,取决于仪表。
- 运行实验样品管4 ° C,打开偏转板,样品进行排序。 5 × 10 5 -1.5 × 10 6细胞可以分为12 × 75毫米的管道和1.5 × 10 6 - 4.5 × 10 6细胞可分为15 ml锥形排序。
- 一旦已经得到所需数量的细胞,手动停止排序。
- 执行后的排序分析,以确定排序的细胞群的纯度。
代表性的成果
我们已经表明小鼠的脾B和CD4 T细胞排序(图1)的结果。脾细胞染色与体育得克萨斯红色标记的抗鼠B220,FITC标记的抗鼠TCRβ和Alexafluor - 700 -共轭抗小鼠CD4识别B细胞(B220 +TCRβ)和CD4 T细胞(CD4 +TCRβ+ )。与BD流式细胞仪咏叹调仪器进行排序。排序后的B细胞纯度> 97%的CD4 T细胞纯度> 98%。
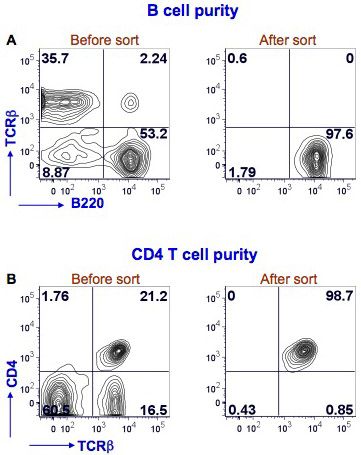
图1。纯度脾B细胞和CD4 T后,流式细胞仪的细胞 。小鼠脾细胞抗鼠B220,TCRβ和CD4抗体染色。 B细胞流式细胞仪上B220浇注使用BD流式细胞仪咏叹调+TCRβ细胞(图1A,左面板中,右下象限)。后的排序进行分析,以确定纯度的B细胞(图1A,右侧面板)。 B220染色显示在X轴和Y轴TCRβ染色。 CD4 T细胞的流式细胞仪进行浇注上使用相同的流式细胞仪TCRβ+ CD4 +细胞(图1B,左侧面板,右上象限)。后排序进行分析,以确定纯度的CD4 T细胞(图1B,右图)。 TCRβ染色上显示的X轴和Y轴染色的CD4。 %的阳性细胞在每一个象限所示。
讨论
流式细胞仪是一个高度复杂的技术,为净化细胞群体的利益,可排序人口的纯度非常高(95-100%)。因此,这种技术是特别重要的实验,其中高纯度的一项基本要求(如微阵列分析)。流式细胞仪是其他可用的方法净化,特别是有利的,当一个细胞的人口需要每周表达的表面标志的基础上得到净化,或当两个或两个以上的人口有相同的表面标志表达的不同层次的需要得到净化。例如,净化边缘区B细胞(B220 + CD21 您好 CD23 INT /低 )和滤泡B细胞(B220 + CD21 INT /低 CD23 您好 )根据CD21和CD23的表达水平。流式细胞仪的另一个增长的应用是单细胞分选,使单个细胞分析(3,4)。流式细胞仪是排序细胞表达荧光蛋白的基因表达,如绿色荧光蛋白标签蛋白(5),也常用来。如果执行无菌排序细胞可以培养的。然而,细胞活力和产量,可能会影响在排序。的可行性,可以改善通过使用排序细胞依赖的最佳温度和处理收集管后立即达到饱和。通过使用聚丙烯收集管,收集血清中丰富的媒体和反相收集管间歇的排序细胞,最佳的温度保持在收集管和离心〜10分钟(http://cyto.mednet.ucla.edu排序的细胞可以增加恢复/ Protocol.htm)。
超高速分拣机的发展扩大,在临床上的应用程序的流量排序的可能性。潜在的流式细胞仪的临床应用,包括达到治疗目的,在肿瘤治疗中的应用,取代羊膜穿刺术排序人类的精子和疾病早期检测(6,7),从人体血液中的造血干细胞的纯化。
多色染色,抗体选择是关键的一步,并为每个特定的仪器检测系统的基础上选择荧光。还有一些销售公司细胞分选机和激光配置各不相同,可根据用户需要。因此,人们不能简单地使用相同的抗体在发表的研究报告使用未经确认的兼容性。为了达到最佳的抗体选择的情况下,应考虑对被检查的蛋白质表达水平。在一般情况下,应该是最亮的可用荧光标记抗体染色隐约表达的表面标志物,可用于高表达的表面标志物(8)的染色,而暗淡的荧光。此外,抗体,应选择以这样的方式在他们的发射光谱重叠是最小的。多色染色,这是极其困难的选择荧光,没有光谱重叠。在这种情况下,执行赔偿。
补偿是必要的,以数学消除之间的排放,是由探测器(8-10)可测量各种荧光光谱荧光重叠。换句话说,是由荧光染料之一荧光重叠排放量的另一种荧光光谱减去。赔偿的计算需要一个不染控制每个荧光和单阳性对照,用于多色染色(9,10)。补偿可以进行细胞或珠子。珠子很容易染色,有一个强有力的信号,并准备作为实验样品有相同的荧光基团的单染控制提供了一个简单的方法。补偿珠时特别有利的表达和细胞表面蛋白的兴趣是在低水平的细胞群体的利益时是在初始的细胞群的限制。
一旦抗体已被选定,它们的活动应该优化执行滴定分析。如果流式细胞仪机具有非常强大的激光器,这一点尤为重要。最理想的染色抗体浓度的使用可能会导致分离所需的细胞群的细胞总人口的贫困。使用高浓度抗体,增加抗原的非特异性染色的机会。因此,抗体滴定将使抗体浓度的选择,给出了积极的人口和最小的背景染色(8)的最大亮度。
流式细胞仪现在是一个细胞亚群的净化标准技术。它可用于任何类型的细胞在单细胞悬液,可产生抗体,以确定所需的细胞群分开。流式细胞仪是首选的方法,当Highly纯的细胞群是必需的。
致谢
我们要感谢他在使用流式细胞仪的核心支持条例草案Cashdollar博士。
参考文献
- Herzenberg, L. A., De Rosa, S. C. Monoclonal antibodies and the FACS: complementary tools for immunobiology and medicine. Immunol Today. 21, 383-390 (2000).
- Givan, A. L. . Flow cytometry first principles. , 273-273 (2001).
- Hewitt, Z., Forsyth, N. R., Waterfall, M., Wojtacha, D., Thomson, A. J., McWhir, J. Fluorescence-activated single cell sorting of human embryonic stem cells. Cloning Stem Cells. 8, 225-234 (2006).
- Walker, A., Parkhill, J. Single-cell genomics. Nat Rev Microbiol. 6, 176-177 (2008).
- Sorensen, T. U., Gram, G. J., Nielsen, S. D., Hansen, J. E. Safe sorting of GFP-transduced live cells for subsequent culture using a modified FACS vantage. Cytometry. 37, 284-290 (1999).
- Diamond, R. A., DeMaggio, S. . In living color: Protocols in flow cytometry and cell sorting. , 800-800 (2000).
- Karabinus, D. S. Flow cytometric sorting of human sperm: MicroSort clinical trial update. Theriogenology. 71, 74-79 (2009).
- Perfetto, S. P., Chattopadhyay, P. K., Roederer, M. Seventeen-colour flow cytometry: unravelling the immune system. Nat Rev Immunol. 4, 648-655 (2004).
- Herzenberg, L. A., Tung, J., Moore, W. A., Parks, D. R. Interpreting flow cytometry data: a guide for the perplexed. Nat Immunol. 7, 681-685 (2006).
- Tung, J. W., Heydari, K., Tirouvanziam, R., Sahaf, B., Parks, D. R., Herzenberg, L. A. Modern flow cytometry: a practical approach. Clin Lab Med. 27, 453-468 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。