Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Подготовка, очистка и характеристика комплексов лантанидов для использования в качестве контрастных агентов для магнитно-резонансная томография
В этой статье
Резюме
Мы демонстрируем металлирование, очистка и характеристика комплексов лантанидов. Комплексы, описанные здесь могут быть сопряженными с макромолекулами включить отслеживание этих молекул с помощью магнитно-резонансной томографии.
Аннотация
Polyaminopolycarboxylate основе лигандов обычно используются для хелатных ионов лантанидов, и в результате комплексы могут использоваться в качестве контрастных агентов для магнитно-резонансной томографии (МРТ). Многие коммерчески доступные лигандов особенно полезны, поскольку они содержат функциональные группы, которые позволяют быстро, высокой чистоты и высокоурожайных конъюгации макромолекул и биомолекул с помощью амин-реактивного активированных эфиров и изотиоцианата групп или тиол-реактивного малеимидов. Хотя металлирование этих лигандов считается общеизвестным в области bioconjugation химии, тонкие различия в металлирование процедуры должны быть приняты во внимание при выборе металла исходных материалов. Кроме того, несколько вариантов для очистки и характеристики существует, и выбор наиболее эффективных процедур частично зависит от выбора исходных материалов. Эти тонкие различия часто пренебрегают в опубликованных протоколах. Здесь, наша цель заключается в демонстрации общих методов металлирование, очистка и характеристика комплексов лантанидов, которые могут быть использованы в качестве контрастных агентов для МРТ (рис. 1). Мы ожидаем, что эта публикация поможет биомедицинских ученые включить лантаноидов реакций комплексообразования в свой репертуар наиболее часто используемых реакций, облегчая выбор исходных материалов и методов очистки.
протокол
1. Металлирование использованием LnCl 3 солей
- Растворите в воде лиганд для получения решения 30-265 мМ. Лиганд 2 - (4-isothiocyanatobenzyl)-диэтилентриамин pentaacetic кислота (р-SCN-Вп-DTPA) была использована в этом видео в концентрации 73 мМ.
- Отрегулируйте рН раствора лиганда в диапазоне от 5,5 до 7,0, добавляя 1 М NH 4 OH. В этом видео, 0,2 мл 1 М NH 4 OH решение было использовано.
- Растворите 1-2 эквивалентами LnCl 3 в воде для получения раствора с концентрацией 5-1000 мМ. В этом видео, EuCl 3 и GdCl 3 были использованы в концентрации 111 мМ. Избыток металла часто используется для дисков металлирование к завершению и, следовательно, упростить очистку.
- Добавить решение LnCl 3 до решения лиганд при перемешивании.
- После добавления LnCl 3, отрегулировать рН полученной реакционной смеси от 5,5 до 7,0 добавлением 0,2 М NH 4 OH. В общей сложности 0,5 мл 0,2 М NH 4 OH решение было использовано в этом видео. Если лиганд содержит кислоту, чувствительных к функциональным группам, отрегулировать рН несколько раз во время этого шага. ВНИМАНИЕ - Если решение становится слишком основных, любая база чувствительных функциональных групп, как изотиоцианата, будет непригодным для сопряжения.
- Монитор реакции с помощью измерения рН. Реакция считается завершенным, когда рН остается постоянным.
2. Повышение рН обследование (не входит в этом видео, но хорошо для лигандов без основания чувствительных функциональных групп)
- Добавить концентрированный NH 4 OH в реакционную смесь для доведения рН до ≥ 11. Этот шаг ускорит любой незакомплексованного металла нерастворимые гидроокиси.
- Фильтры супернатанта через фильтр 0,2 мкм. Если реакционная смесь забивает фильтр, центрифугированием и декантацией до фильтрации рекомендуется.
- Если диализ не будет выполнена, удалите растворитель при пониженном давлении (ротационный испарения или сублимационной сушки рекомендуется).
- Шаги 2.1-2.3 может быть повторена, если свободное лантаноидов остается.
3. Диализ обследование
- Вырезать диализа трубку к соответствующей длины (следовать рекомендациям производителя) провести объем пробы, оставляя дополнительной длины (примерно 10% от объема выборки). В этом видео, 100-500 дальтон молекулярная масса отсечки (MWCO) мембрана была использована, но больше MWCO трубы могут быть использованы в соответствующих случаях, если сопряжение осуществляется до металлирование. Кроме того, диализ кассеты могут использоваться как альтернатива диализа трубы при желании.
- При необходимости на основе руководящих принципов производителя, помочь сократить трубы диализа в воде в течение 15 мин при комнатной температуре.
- Заполните диализа водохранилища (1 л стакан была использована в данном видео) с водой (диализата). Диализата объем должен быть примерно в 100 раз, что в образце.
- Сложите один конец трубки в два раза и безопасной сложенные части трубки с зажимом закрытия диализа. Оберните конец закрытия с резиновой лентой, чтобы убедиться, что он остается закрытым во время диализа.
- Фильтры реакционной смеси через фильтр 0,2 мкм, и загружают фильтрата в открытый конец трубки будьте осторожны, чтобы не разорвать трубы. Не забудьте оставить достаточно места головы, чтобы закрыть трубу.
- Сложите оставшийся открытым концом трубы в два раза, безопасный с закрытием, и оберните закрытия с резинкой, как в пункте 3.4.
- Прикрепить стекла флакон, содержащий воздух зажим на одном конце трубы использованием диализа резинкой. Прикрепить флакон, содержащий песок других зажима. Эти флаконы обеспечения того, чтобы трубка остается погруженным в диализата.
- Место полный труб в диализе резервуар, который содержит диализата.
- Движение диализата использованием магнитных пластин перемешать на медленной скорости (без вортексе) при комнатной температуре.
- Изменение диализата 3x в течение дня (в этом видео, диализата было изменено на уровне 2,5, 6,5 и 11,5 ч), а затем позволить диализа продолжать в течение ночи (в общей сложности 20-28 часов диализа).
- Удалить диализа труб из диализата и осторожно откройте один закрытия для удаления образца. Вымойте диализа трубки 3x с водой и объединить стирок с образцом.
- Удалите воду при пониженном давлении. Сублимационная сушка используется в этом видео.
4. Оценка наличия свободного металла
- Растворите металл комплекса в ацетатный буфер (буфер приготовления: Растворить 1,4 мл уксусной кислоты в 400 мл воды, отрегулировать рН до 5,8 с 1 М NH 4 OH, и добавьте воды, чтобы произвести общий объем 500 мл) и добавить ксиленола оранжевый индикатор (16 мкМ в рН 5,8 буфера). В этом видео, 0,3 мг комплекса растворяли в 0,3 мл буфера и 3 мл раствора индикатора был добавлен.
- Определение наличия свободного металла через наблюдение изменение цвета индикатора от желтого до фиолетового.
- При желании, количество свободного металла может быть определена количественно путем создания калибровочной кривой 1. Кроме того, краситель арсеназо III может быть использован вместо ксиленолового оранжевый 2. Если свободного металла остается, образец следует дополнительно очищают, используя диализ, обессоливания столбца или высокоэффективной жидкостной хроматографии (ВЭЖХ) до характеристику.
5. Определение содержания воды-координационным числом (д)
- Подготовка решения Eu III-содержащих комплекс (~ 1 мм) в H 2 O и другое решение того же концентрации в D 2 O. Перед проведением анализа, D 2 O решение должно быть испаряется и растворяют в D 2 O в три раза, чтобы удалить остатки H 2 O.
- Добавить водный раствор на чистую кювету и поместить кювету в spectrofluorometer.
- Выполните возбуждения и излучения сканирует определить максимумы для каждого (~ 395 нм и ~ 595 нм, соответственно).
- Выполните фосфоресценции времени распада эксперимент с использованием следующих параметров: возбуждения и излучения волн определяется из шага 5.3, возбуждения и излучения щели ширины (5 нм), флэш-счет (100), начальную задержку (0,01 мс), максимальная задержка (13 мс) , а прирост задержки (0,1 мс). Эти условия подходят для большинства комплексов, а максимальная задержка и приращение значения могут быть увеличены или уменьшены для видов с очень длинными или очень короткое время распада.
- Повторите шаг 5,4 с D 2 O раствор, приготовленный в шаге 5.1.
- Из-распада люминесценции данных, полученных в 5,4 и 5,5, участок натуральный логарифм интенсивности в зависимости от времени. Наклон этих линий скорости распада (τ -1) (рис. 2). В этом видео, Microsoft Excel 2007 была использована для природных участков журнал из исходных данных. Используйте скорости распада в уравнении разработан Хоррокс и его коллеги (напр. 1) 3. Если лиганд содержит ОН или NH группы согласуются с металлом, то уравнение должен быть изменен перед использованием 3.
экв 1: 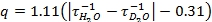
6. Relaxivity измерений
- Выберите нужный режим применения на анализаторе релаксации: T 1 (время продольной релаксации) или Т-2 (время поперечной релаксации).
- Подготовка серии образцов, которые содержат различные концентрации Gd III-содержащего комплекса в водном растворителе. В этом видео, вода была использована в качестве растворителей и растворов 10,0, 5,00, 2,50, 1,25, 0,625 и 0 мМ были подготовлены. Другие водные растворители или буферы могут быть использованы, но важно использовать растворитель, как пустой. Конечный объем пробы, специфичные для инструмента, который используется.
- Место образца в прибор и оставьте на 5 минут, чтобы уравновесить до температуры инструмент (37 ° С в этом видео).
- Определить время релаксации (в единицах ы), регулируя параметры программного обеспечения для получения гладкой экспоненциальная кривая T 1 и T 2 (представитель кривые для T 1 и T 2 показаны на рисунке 3).
- Повторите шаги 6,3 и 6,4 для всех образцов, включая пустые.
- Вычислить обратную измеряется T 1 и T 2 значения в единицах с -1.
- Участок T 1 -1 или Т 2 -1 значений от концентрации Gd III (в единицах мМ). Из-за гигроскопичны характер Б-г III-содержащих комплексов, подтвердить концентрации Gd III с помощью атомно-абсорбционной спектрофотометрии или индуктивно-связанной плазмы масс-спектрометрии. Fit сюжет с прямой линии. Представитель график представлен на рисунке 4.
- Склона оборудована линия relaxivity (R 1 или R 2 для Т 1 и Т 2, соответственно) и имеет размерность мм -1 с -1.
7. Представитель Результаты
Представитель данные шаги в этом протоколе, были включены в Таблицы и рисунки раздела. В дополнение к воде координационным числом и relaxivity характеристики описаны в протоколе, важно для характеристики конечных продуктов с использованием стандартных методов химического вещества. Личность соединение может быть получено с помощью масс-спектрометрии и представитель масс-спектров показывает диагностических характеристиках изотопов к Б-гу III - III и Eu-содержащих комплексов, показаны на рисунке 5. Кроме того, для не-Б-г III лантаноидов содержащих комплексов, ЯМР-спектроскопии может быть использован для идентификации продукта. Для характеристики чистоты комплекса, ВЭЖХ или элементного анализа или оба могут быть использованы.
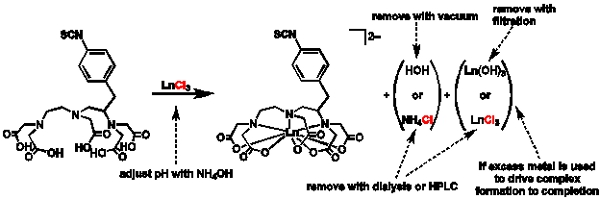
Рисунок 1 Общая схема металлирование и очистки. Схема изображающие общий порядок металлирование и причины для выбора разных маршрутов очистки.
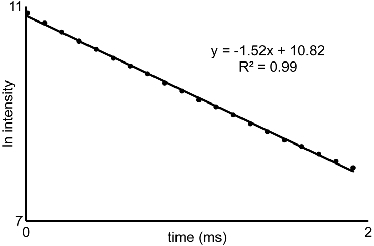
Рисунок 2 Люминесценция интенсивности участка:. Представитель участок натуральный логарифм интенсивности в зависимости от времени из раздела 5. Наклона прямых полученные от подобных кривых, приобретенных для воды и D 2 O решения используются с 1 экв охарактеризовать воды координационное число Eu III-содержащих комплексов.

Рисунок 3 Релаксация время спада кривых:. Репрезентативных данных (слева) и T 1 (справа) T 2 приобретения. Отклонения от этих форм кривой будет производить недостоверных сведений.

Рисунок 4 Relaxivity определения:. Представитель участок 1 / T 1 по сравнению с концентрацией Gd III. Склона оборудована линия relaxivity и единиц мМ -1 с -1.

Рисунок 5 Масс-спектры. Представителю масс-спектров показывает диагностических характеристиках изотопа (слева), Б-г III-содержащих комплексов и (справа) Eu III-содержащих комплексов. Черные пики гауссовский представляют теоретическое распределение изотопов и красные линии являются фактическими данными.
Обсуждение
Учитывая растущее количество публикаций, которые включают лантаноидов основе контрастных веществ 4-14, важно, что приняты меры по подготовке, очистке, и характеризующие продукции, чтобы обеспечить воспроизводимые и сопоставимые результаты. Эти комплексы часто считается сложной, ...
Раскрытие информации
Благодарности
Мы выражаем глубокую признательность запуска средства из Wayne State University (MJA), грант Американского фонда исследований старения (SMV) и Путь к независимости Карьера Переход Award (R00EB007129) из Национального института биомедицинской визуализации и биоинженерии из Национальных институтов здравоохранения (MJA).
Материалы
| Name | Company | Catalog Number | Comments |
| Реактивы и оборудование | Компания | Номер в каталоге | |
|---|---|---|---|
| EuCl 3 • 6H 2 O | Sigma-Aldrich | 203254-5G | |
| р-SCN-Вп-DTPA | Macrocyclics | B-305 | |
| гидроксид аммония | EMD | AX1303-3 | |
| Spectra / Por Biotech эфиров целлюлозы (CE) Диализ Мембрана - 500 D MWCO | Fisher Scientific | 68-671-24 | |
| Millipore IC Millex-LG фильтровальные установки | Fisher Scientific | SLLG C13 NL | |
| ксиленола оранжевый тетранатриевая соль | Альфа Aesar | 41379 | |
| уксусная кислота | Fluka | 49199 | |
| D 2 O | Кембриджский Изотопный Laboratories, Inc | DLM-4-25 | |
| водоочиститель | ELGA | Purelab Ультра | |
| высокоэффективной жидкостной хроматографии и масс-спектрометрии | Shimadzu | LCMS-2010EV | |
| Анализатор время релаксации | Bruker | mq60 minispec | |
| UV-VIS спектрофотометр | Fisher Scientific | 20-624-00092 | |
| замораживание сушилка | Fisher Scientific | 10-030-133 | |
| измеритель pH | Hanna Instruments | HI 221 | |
| spectrofluorometer | HORIBA Jobin Ивон | Fluoromax-4 | |
| Молекулярные версии калькулятора Вес 6,46 Мэтью Монро, скачан 17 октября 2009 | http://ncrr.pnl.gov/software/ | Молекулярная Калькулятор веса |
Ссылки
- Barge, A., Cravotto, G., Gianolio, E., Fedeli, F. How to determine free Gd and free ligand in solution of Gd chelates. A technical note. Contrast Med. Mol. Imaging. 1, 184-188 (2006).
- Nagaraja, T. N., Croxen, R. L., Panda, S., Knight, R. A., Keenan, K. A., Brown, S. L., Fenstermacher, J. D., Ewing, J. R. Application of arsenazo III in the preparation and characterization of an albumin-linked, gadolinium-based macromolecular magnetic resonance contrast agent. J. Neurosci. Methods. 157, 238-245 (2006).
- Supkowski, R. M., Horrocks, W. D. On the determination of the number of water molecules, q, coordinated to europium(III) ions in solution from luminescence decay lifetimes. Inorg. Chim. Acta. 340, 44-48 (2002).
- Menjoge, A. R., Kannan, R. M., Tomalia, D. A. Dendrimer-based drug and imaging conjugates: design considerations for nanomedical applications. Drug Discovery Today. 15, 171-185 (2010).
- Que, E. L., Chang, C. J. Responsive magnetic resonance imaging contrast agents as chemical sensors for metals in biology and medicine. Chem. Soc. Rev. 39, 51-60 (2010).
- Uppal, R., Caravan, P. Targeted probes for cardiovascular MR imaging. Future Med. Chem. 2, 451-470 (2010).
- Major, J. L., Meade, T. J. Bioresponsive, cell-penetrating, and multimeric MR contrast agents. Acc. Chem. Res. 42, 893-903 (2009).
- Datta, A., Raymond, K. N. Gd-hydroxypyridinone (HOPO)-based high-relaxivity magnetic resonance imaging (MRI) contrast agents. Acc. Chem. Res. 42, 938-947 (2009).
- León-Rodríguez, L. M. D., Lubag, A. J. M., Malloy, C. R., Martinez, G. V., Gillies, R. J., Sherry, A. D. Responsive MRI agents for sensing metabolism in vivo. Acc. Chem. Res. 42, 948-957 (2009).
- Castelli, D. D., Gianolio, E., Crich, S. G., Terreno, E., Aime, S. Metal containing nanosized systems for MR-molecular imaging applications. Coord. Chem. Rev. 252, 2424-2443 (2008).
- Caravan, P., Ellison, J. J., McMurry, T. J., Lauffer, R. B. Gadolinium(III) chelates as MRI contrast agents: structure, dynamics, and applications. Chem. Rev. 99, 2293-2352 (1999).
- Lauffer, R. B. Paramagnetic metal complexes as water proton relaxation agents for NMR imaging: theory and design. Chem. Rev. 87, 901-927 (1987).
- Yoo, B., Pagel, An overview of responsive MRI contrast agents for molecular imaging. Front. Biosci. 13, 1733-1752 (2008).
- Pandya, S., Yu, J., Parker, D. Engineering emissive europium and terbium complexes for molecular imaging and sensing. Dalton Trans. 23, 2757-2766 (2006).
- Nwe, K., Xu, H., Regino, C. A. S., Bernardo, M., Ileva, L., Riffle, L., Wong, K. J., Brechbiel, M. W. A new approach in the preparation of dendrimer-based bifunctional diethylenetriaminepentaacetic acid MR contrast agent derivatives. Bioconjugate Chem. 20, 1412-1418 (2009).
- Nwe, K., Bernardo, M., Regino, C. A. S., Williams, M., Brechbiel, M. W. Comparison of MRI properties between derivatized DTPA and DOTA gadolinium-dendrimer conjugates. Bioorg. Med. Chem. 18, 5925-5931 (2010).
- Caravan, P., Das, B., Deng, Q., Dumas, S., Jacques, V., Koerner, S. K., Kolodziej, A., Looby, R. J., Sun, W. -. C., Zhang, Z. A lysine walk to high relaxivity collagen-targeted MRI contrast agents. Chem. Commun. , 430-432 (2009).
- León-Rodríguez, L. M. D., Kovacs, Z. The synthesis and chelation chemistry of DOTA-peptide conjugates. Bioconjugate Chem. 19, 391-402 (2008).
- Boswell, C. A., Eck, P. K., Regino, C. A. S., Bernardo, M., Wong, K. J., Milenic, D. E., Choyke, P. L., Brechbiel, M. W. Synthesis, characterization, and biological evaluation of integrin αVβ3-targeted PAMAM dendrimers. Mol. Pharm. 5, 527-539 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены