このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウス網膜からERG Transretinal·レコーディング:ロッドとコーンの光応答
要約
我々は、無傷のマウス網膜から桿体と錐体の光応答を取得するためのtransretinal電図(ERG)の録音の比較的簡単な方法について説明します。このアプローチは、それらの光反応を分離し、分離されたフラットマウントされている網膜の間に配置フィールド電極を使用してそれらを記録する光受容体からシナプス伝達のブロックを活用しています。
要約
ロッドとコーン:脊椎動物の網膜に結像光受容体の2つの別個のクラスがあります。ロッドは、コーンが急速に明るい光条件の変化の下で継続的に動作するのに対し、光の単一光子を検出することができます。光受容体の外側のセグメントのロッドとコーン特有の視覚的な顔料による光の吸収は、最終的に細胞膜と細胞の過分極における環状ヌクレオチド依存性チャネルの閉鎖につながる光情報伝達カスケードをトリガします。現在および潜在的な膜で、この光誘起変化はどちらか古典的な吸引電極記録手法1,2、または薬理学的にブロックされたシナプス応答コンポーネントを3月5日孤立網膜からtransretinal電図記録(ERG)によって、光応答として登録することができます。後者の方法は、マウスの光受容体からの薬物がアクセス可能な長期的な録音を可能にし、安定した光応答frを得るために、特に便利です。OM乏しいと壊れやすいマウスコーン。円錐の場合には、そのような実験は暗順応6,7の間にコーン感光性回復のプロセスを監視するために、両方の本質的にすべての視覚色素を漂白暗順応条件と、以下の強烈な照明で行うことができます。このビデオでは、ロッドと暗順応マウス網膜からM / L-錐体主導transretinal録音を実行する方法を示します。ロッドの録音は、野生型(C57BL / 6)マウスの網膜を用いて実施される。 8シグナル伝達ロッドを欠くマウスを簡単にするために、コーンの録音は、遺伝子組換えロッドトランスデューシンαサブユニットのノックアウト( - / - Tα)から取得されます。
プロトコル
1。電極を作る
- ガラス電極を準備します。 120mgの寒天を量り、10 mLの蒸留水(最終寒天濃度1.2%)でそれを混ぜる。湯浴中で寒天溶液を溶かす。プラスチックシリンジを用いて寒天溶液を用いて:ガラスキャピラリー(長さ= 100ミリメートル、外径/内径= 1/0.75 mmとし、内部容積= 44μL我々は以下の寸法を使用してWordのPresisionインスツルメンツTW100-4キャピラリーを使用します)を入力します。室温で10分間寒天を固める。したがって、最大約200毛細血管が(寒天混合物の残りの部分は-4℃と、再使用されるいくつかの時点で保存することができます)入力することができます。
- ダイヤモンドナイフを使用して半分に毛細血管を切った。
- 4℃で少なくとも24時間のマウス電極溶液中で得られたガラス電極を浸す4℃で電極を保存し、3〜4ヶ月の期間にわたってそれらを使用します。
2。実験のセットアップ
- 一晩マウスを暗適応します。 (例えば、C野生型を使用します。57Bl / 6)ロッド駆動型transretinal録音とTのα - / -マウスコーンtransretinal録音8シグナリングロッドを欠損したマウス。
- 1リットルの潅流液を、100mLの電極液、20mLのインキュベーション溶液(下記参照)を準備し、灌流液の谷のミリポア0.45μmまたは0.22μmのフィルター(オプション)をフィルタリングします。
- 網膜の平面に配置された光度計を用いた光源(505 nmのLEDやハロゲン電球の光刺激)を校正します。 LED光源の場合には、光の均一性を達成するために、光拡散板を使用しています。
- 実験(チャンバー構造は異なる場合があります)の灌流チャンバーを準備します。私たちの部屋は、小さなプラスチック製のペトリ皿の蓋から作られた底に、3 mmのプレキシグラス製で、〜400μL(L = 25ミリメートル、W = 8ミリメートル、H≈2ミリメートル)の活性灌流量を持っています。 2mMのL-グルタミン酸及び10mM BaCl 2を含む電極溶液をチャンバーの下部電極の空間を埋める。プラスチックのチューブやガラスキャピラリーを用い、下部電極空間内の溶液(チャンバーの底部に取り付けられたプラスチック製のチューブコネクタ製)と電極ホルダーの間の接続を行います。電極には気泡、接続チューブ、または電極ホルダー(必要に応じてプラスチックシリンジを使用してソリューションをパージ)が存在しないことを確認してください。
- 顕微鏡のステージ(:顕微鏡は、防振テーブル上に取り付けられ、機械的、電磁ノイズを最小限に抑えるためにファラデーケージ内に遮蔽することができるオプション)に録音室をマウントします。差動増幅器の正のステージのポール(例えばワーナー·インスツルメンツDP-311アンプ)に下部電極ホルダーを接続します。センターと刺激光スポットで開いてチャンバー下部電極の位置を合わせます。録音室に流線を接続し、灌流をオンにします。
- 95%O 2/5%CO 2のバブル灌流液40にそれをインキュベートしながら°CワットERのお風呂。 CO 2は 7.2に溶液のpHを調整します。解決策は、36から37にそれを再加熱セラミック抵抗体を通過する重力℃にして瓶から録音室に流れる熱損失を低減するために、ヒーターは、理想的には顕微鏡のステージ上で、可能な限り記録室の近くに配置する必要があります。
- フローレギュレータで約1 mL / minの流量を調整します。
- 第二の電極ホルダーを使用して、ステージの第二の(マイナス)極に上部電極を接続します。 O-リングを使用して、上部電極に熱電対プローブをバインドします。電極と熱電対の先端が温度の読み取りが可能な限り、網膜の中心部に近いと解釈されるように、接近していることを確認します。灌流液中の上部電極の先端を浸し、室の中央に配置します。ベースライン安定化のための10-15分を許可します。
- 溶液の温度は36になるようにヒータのDC電圧を調整する -37℃
3。マウスの網膜を分離
- 薄暗い赤い光の下で、CO 2および頸椎脱臼で暗順応マウスを安楽死させる。オプション:焼灼ペンまたは加熱された解剖ピンと強膜の中で最も背点を焼灼することにより、各マウスの眼球上の基準マークを付けます。後続のすべての手順は、解剖顕微鏡に合わせる赤外線画像コンバータを使用して赤外光の下で実行されています。
- 穏やかな圧力を適用し、各眼の両側に皮を延伸することによって湾曲したハサミで目を解剖する。 microscissorsまたはカミソリの刃を使用して、赤外線照明の下で両方の眼球を二等分する。
- 角膜とレンズを外します。できるだけ硝子の限りを削除します。
- 色素上皮層からの最初の網膜剥離及び、必要に応じて、色素上皮の残りの顆粒を削除するには、ピンセットでそれを徹底的に清掃してください。我々は一般的にロッドとコーンtransretの両方に全体の網膜を使用しているinal録音。ただし、特に網膜は、参考として焼灼マークを使用してかみそりの刃またはmicroscissorsとアイカップの腹の部分を削除する剥離する前に、より多くのM / L錐体9を有しているマウスの網膜の背側から録音したい場合。
- インキュベーション溶液小さなペトリ皿の中で第二hemisected眼球を配置し、使用時まで純酸素で飽和した遮光ボックス内の準備をインキュベートします。通常、これらの条件下で二個目のマウスのアイカップは、室温で数時間保存することができ、録音に使用されます。
- ガラスやプラスチック製のピペットを使用してペトリ皿のふたの上灌流溶液の液滴(約300μL)に分離された網膜を転送します。 BaCl 2でプレインキュベート網膜にBaCl 2を含む電極液の5-6小滴を追加します。コーナー塗っ裏面の四角い部分(約5×5 mm)を置きます(私たちはダウコーニング111バルブ潤滑剤とシーラントを使用します)ミリポアろ紙(0.45μmのは、同じソリューションのドロップに、その中心に既製の穴(直径2〜2.5ミリメートル)で)型をHARG。ろ紙の上(最大受光側)に鉗子の位置網膜を使用して、それをフラットマウントするために周囲にその端を押してください。網膜は、ろ紙の開口部を介して中心にする必要があります。
- 鉗子を使用すると、灌流チャンバーに網膜にろ紙を転送し、刺激スポット揃え下部電極空間上に配置します。若干チャンバーと結合、それにろ紙の油を塗ったエッジを押してください。
- 網膜の中心部(少し感光層に触れて)の上に上部電極を配置します。網膜上に上部電極を中心とする信号の振幅(最大〜網膜の端にそれに近い配置に比べて20〜40%)増加します。このような電極の位置がわずかに網膜の小セクタ(その総面積の〜12から15パーセント)に達する効果的な光刺激強度を歪めるが、それはまだ電気を配置する最適な方法です。trode。準備は今transretinal録音の準備ができています。
4。 Transretinal録音
- マウスのライン、LED光源または光刺激から提供されたキャリブレーションさ505nmの光の明るい強度に薄暗いからレコードロッドやM / L-錐体駆動型テストのフラッシュ応答に応じて。当社のLED光源の場合には、フラッシュの強さは、LED入力電圧、切替器、および中性密度フィルタのセット(ここではE-カラーロスコ研究所から#211 0.9 ND膜フィルタを使用してのコンピュータ制御の組み合わせによって制御されます。 )LEDと網膜の間に配置されます。 LEDテストフラッシュ(20 ms)の期間は、コンピュータによって制御されます。ハロゲン電球の光刺激、テスト発光強度と波長を使用している場合は、それぞれ、中立的な密度フィルタおよび狭帯域干渉フィルタのセットによって制御することができます。テスト発光持続時間は、コンピュータ主導のシャッターで制御することができます。
- オプション:効率的な維持のため終日BaCl 2の光応答のグリア細胞成分の抑制は、新鮮な溶液を充填したプラスチックシリンジを使用してそれをパージすることによって(例えば、前のそれぞれの網膜をテストする)時折下部電極のソリューションを変更します。
5。代表的な結果
ソリューション
- マウス網膜灌流液:112.5 mMの塩化ナトリウム、3.6 mMの塩化カリウム、2.4 mMのMgCl 2、1.2mMのCaCl 2を 、10mMのHEPES(pH7.2)を、20mMのNaHCO 3を 、3 mMのコハク酸ナトリウム、0.5mMのナトリウム、グルタミン酸、0.02mMのEDTA、 10 mMグルコース。さらに、このソリューションは、2 mMのL-グルタミン酸と光応答10,11の高次成分をブロックするために、10μMのDL-AP-4を添加され、0.1%MEMビタミンやMEMアミノ酸溶液(Sigma)で網膜を向上させるために可能性。
- マウスの電極液:140mMのNaCl、3.6 mMの塩化カリウム、2.4 mMのMgCl 2、1.2mMのCaCl 2を 、3 mMのHEPES液(pH7.4、NaOH)を。下ELEのソリューションctrodeスペースも光応答3,12のグリア細胞成分を抑制するシナプス伝達10と、さらに、10mMのBaCl 2をブロックするように2mMのL-グルタミン酸を含んでいます。
- 網膜インキュベーション溶液:272 mgのL-15培地(Sigma)および20 mLの脱イオン水に20mgのBSAを溶解する。最後のL-15とBSAの濃度は、それぞれ13.6 mg / mLとし、1 mg / mLのである。 1 M HClでpHを7.4に調整します。
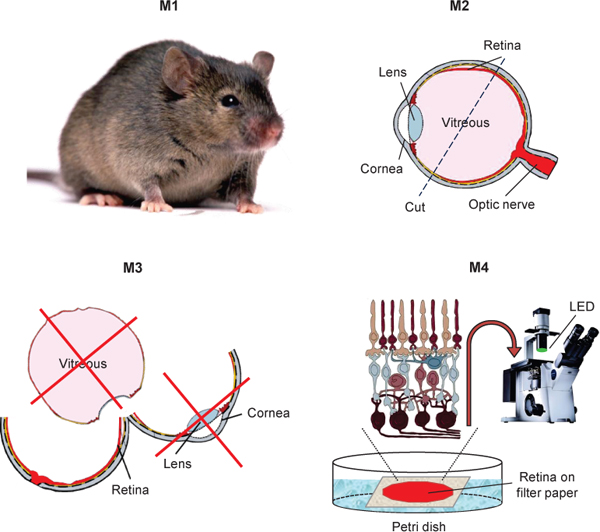
図1。transretinal ERG記録用のマウス網膜の分離を示す模式図。

図2:灌流チャンバーとその所有者と記録電極の写真。赤い矢印は血流の流れ方向を示しています。
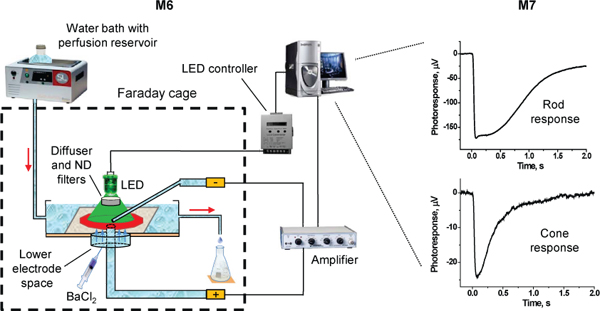
図3。transretinal ERGの記録のための実験セットアップの模式図。赤い矢印は血流の流れ方向を示しています。
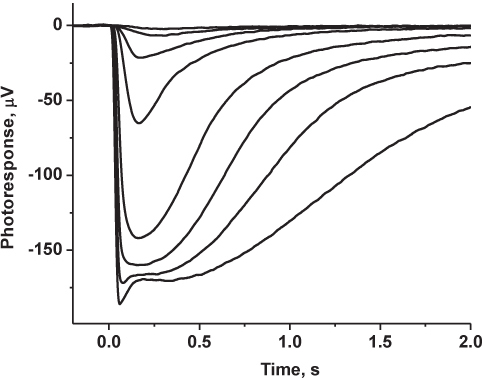
図4代表的な結果:マウスロッド駆動型transretinal応答の記録家族。光応答は、ローパス1 kHzでデジタル化し、さらなる分析のためのコンピュータに保存され、30 Hzの(8極ベッセル)でろ過した。に示すトレースは飽和光強度で薄暗い光強度および2-3応答で5月6日応答の平均を表しています。
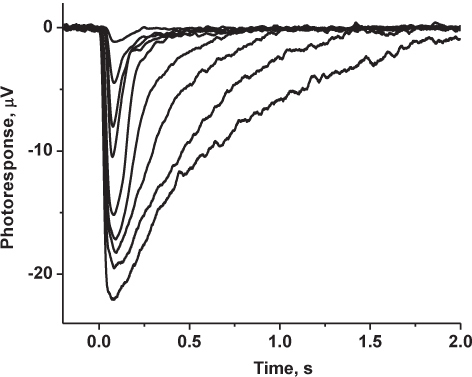
図5代表的な結果:マウスコーン主導transretinal応答の記録家族。光応答は、ローパス1 kHzでデジタル化し、さらなる分析のためのコンピュータに保存され、30 Hzの(8極ベッセル)でろ過した。に示すトレースはアベレージれ飽和光強度で薄暗い光強度および3-5応答で5〜10応答のES。
ディスカッション
ロッドとコーン主導transretinal ERG記録法は、野生型および遺伝子改変動物の両方で、マウスの光受容体の機能を調べるための強力なツールになっている上記の。基本的な光応答特性の簡単な特性に加えて、この単純な手法に近いから無傷の網膜の準備で実行長期的な実験中に大きな応答の安定性を提供します。野生型マウスの暗順応ロッドの最大応答振幅と感光性の両方が録音の開始から少な...
開示事項
著者らは、開示することは何もありません。
謝辞
失明とEY02687(ワシントン大学眼科視覚科学部)を防ぐため失明を防ぐための研究からキャリア開発賞、NIHの助成金EY19312とEY19543(VJK)によって、同様の研究から無制限の助成金によってサポートされています。
資料
| Name | Company | Catalog Number | Comments | |
| 材料名 | タイプ | 会社 | カタログ番号 | コメント |
| DL-AP-4 | バイオサイエンスTOCRIS | 0101 | ||
| すべての他の試薬 | Sigma-Aldrich社 | |||
| ガラスキャピラリー | 世界の精密機器 | TW100-4 | 電極を作るため | |
| ろ紙 | HARG | ミリポア | HABG01300 | |
| 光度計 | UDTインスツルメンツ | S350 | 光キャリブレーションのために | |
| 放射シリコンセンサ | UDTインスツルメンツ | 221 | 光キャリブレーションのために | |
| 防振テーブル | テクニカル·マニュファクチャリング株式会社 | TMC 78から239-02R、TMC63-26012から01 | メカニカルノイズを最小限に抑えるために | |
| エアコンプレッサーパンサーP 15TC | ウェルテルインターナショナル | P 15TC | 防振テーブルに接続 | |
| 実体顕微鏡 | ライカ | MZ9.5 | マウスの眼の解剖のために | |
| 赤外線イメージコンバータ | BEMeyers | ProwlerTM | 実体顕微鏡にバインドされている | |
| 差動増幅器 DP-311 | ワーナー·インスツルメンツ | DP-311 | ||
| 軸索Digidata 1440Aデジタイザ | ; | モレキュラーデバイス | 1440A | |
| デュアルチャネル8極フィルタ | クルーン-HITE株式会社 | 3382 | ||
| セラミック抵抗 | TEの接続 | CGS SBCHE618RJ | 灌流液を加熱するための | |
| 熱電対 | T | Physitempインスツルメンツ | IT-18 | |
| 温度モニター | オメガ | DPi32 | 熱電対に接続 | |
| LEDは505nmの | TTエレクトロニクス/ Optek Technology種類 | Digi-KeyのP / N 365-1185-ND | テストが点滅/漂白ライトを適用するには | |
| 焼灼ペン | Bovie | AA25 | 背の部分をマーキングするためのマウスの眼球の | |
| 10電気生理学的データ収集と解析ソフトウェアをpCLAMP | モレキュラーデバイス |
参考文献
- Yau, K. W., Lamb, T. D., Baylor, D. A. Light-induced fluctuations in membrane current of single toad rod outer segments. Nature. 269, 78-80 (1977).
- Nikonov, S. S., Kholodenko, R., Lem, J., Pugh, E. N. Physiological features of the S- and M-cone photoreceptors of wild-type mice from single-cell recordings. J. Gen. Physiol. 127, 359-374 (2006).
- Nymark, S., Heikkinen, H., Haldin, C., Donner, K., Koskelainen, A. Light responses and light adaptation in rat retinal rods at different temperatures. J. Physiol. 567, 923-938 (2005).
- Heikkinen, H., Nymark, S., Koskelainen, A. Mouse cone photoresponses obtained with electroretinogram from the isolated retina. Vision Res. 48, 264-272 (2008).
- Frank, R. N., Dowling, J. E. Rhodopsin photoproducts: effects on electroretinogram sensitivity in isolated perfused rat retina. Science. 161, 487-489 (1968).
- Wang, J. S., Kefalov, V. J. An alternative pathway mediates the mouse and human cone visual cycle. Curr. Biol. 19, 1665-1669 (2009).
- Kolesnikov, A. V., Tang, P. H., Parker, R. O., Crouch, R. K., Kefalov, V. J. The mammalian cone visual cycle promotes rapid M/L-cone pigment regeneration independently of the interphotoreceptor retinoid-binding protein. J. Neurosci. 31, (2011).
- Calvert, P. D. Phototransduction in transgenic mice after targeted deletion of the rod transducin alpha -subunit. Proc. Natl. Acad. Sci. U.S.A. 97, 13913-13918 (2000).
- Applebury, M. L. The murine cone photoreceptor: a single cone type expresses both S and M opsins with retinal spatial patterning. Neuron. 27, 513-523 (2000).
- Sillman, A. J., Ito, H., Tomita, T. Studies on the mass receptor potential of the isolated frog retina. I. General properties of the response. Vision Res. 9, 1435-1442 (1969).
- Vinberg, F., Koskelainen, A. Calcium sets the physiological value of the dominant time constant of saturated mouse rod photoresponse recovery. PLoS One. 5, e13025-e13025 (2010).
- Bolnick, D. A., Walter, A. E., Sillman, A. J. Barium suppresses slow PIII in perfused bullfrog retina. Vision Res. 19, 1117-1119 (1979).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved