Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Seguimiento de los cambios en la concentración de calcio intracelular y la eficacia sináptica en el molusco
En este artículo
Resumen
Se demuestra cómo los cambios en la concentración de calcio libre intracelular y la eficacia sináptica puede controlarse simultáneamente en una preparación de ganglio Aplysia. Nosotros imagen calcio intracelular usando un colorante fluorescente, naranja calcio, e inducir y controlar la transmisión sináptica con afilados (intracelular) electrodos.
Resumen
Se ha sugerido que los cambios en el calcio intracelular mediar la inducción de un número de importantes formas de plasticidad sináptica (por ejemplo, facilitación, homosináptica) 1. Estas hipótesis pueden ser probadas por monitorizar simultáneamente los cambios en el calcio intracelular y alteraciones en la eficacia sináptica. Se demuestra cómo esto se puede lograr mediante la combinación de imágenes de calcio con técnicas de grabación intracelulares. Nuestros experimentos se llevan a cabo en un ganglio vestibular del molusco Aplysia californica. Esta preparación tiene una serie de características ventajosas experimentalmente: Ganglios puede ser fácilmente eliminado de Aplysia y experimentos utilizar neuronas adultas que hacen conexiones sinápticas normales y tienen una distribución de canales de iones normal. Debido a la baja tasa metabólica del animal y las temperaturas relativamente bajas (14-16 ° C) que son naturales para Aplysia, preparaciones son estables durante largos períodos de tiempo. ent "> Para detectar cambios en el calcio libre intracelular que utilizaremos la versión celular de calcio impermeant Orange 2, que es fácilmente 'cargado' en una neurona a través de iontoforesis. Cuando este tinte fluorescente de longitud de onda larga se une al calcio, aumenta la intensidad de fluorescencia. calcio Orange tiene propiedades cinéticas rápidas 3 y, a diferencia de los tintes proporcional (por ejemplo, la Fura 2), no requiere rueda de filtros para imágenes. Es bastante estable y menos foto fototóxica que otros colorantes (por ejemplo, fluo-3) 2,4. Al igual que todos los no-radiométrico colorantes, Calcium Orange indica cambios relativos en la concentración de calcio. Pero, debido a que no es posible tener en cuenta los cambios en la concentración de colorante debido a la carga y difusión, no puede ser calibrado para proporcionar concentraciones absolutas de calcio.
Una posición vertical, fijo microscopio etapa, el compuesto se utilizó para las neuronas de imagen con una cámara CCD capaz de grabar alrededor de 30 fotogramas por segundo. En Aplysia esta resolución temporales más que suficiente para detectar incluso un único pico de la alteración inducida en la concentración de calcio intracelular. Electrodos afilados se utilizan simultáneamente para inducir y registrar la transmisión sináptica en las neuronas identificadas pre y postsinápticos. Al final de cada ensayo, un script personalizado combina electrofisiología y los datos de imagen. Para asegurar la sincronización adecuada se utiliza un pulso de luz de un LED montado en el puerto de la cámara del microscopio. La manipulación de los niveles de calcio presinápticos (por ejemplo, mediante inyección intracelular EGTA) nos permite poner a prueba hipótesis específicas, en relación con el papel del calcio intracelular en la mediación de las distintas formas de plasticidad.
Protocolo
1. Preparación
- Se anestesia el animal mediante la inyección de 75-100 ml de solución isotónica de cloruro de magnesio. El Aplysia que utilizamos para formación de imágenes son generalmente 150-200 gramos y se obtienen a partir Marinus Scientific.
- Pin el animal anestesiado a un plato cubierto de cera. Agujas de jeringa funcionan bien para este propósito; técnicas estériles no son necesarios. Con unas pinzas y tijeras brutos estándar hacen una incisión en la pata del animal y exponer la masa bucal. Localice el ganglio vestibular. Con unas tijeras y pinzas de resorte fino, cuidadosamente gratis el ganglio cortando todos los nervios vestibulares.
- Retire el ganglio y colóquelo en un plato Sylgard recubierto que contiene agua de mar artificial. Coloque unas pocas pins del insecto a través de los nervios vestibulares para estabilizar el ganglio. Desheath el ganglio vestibular usando fórceps y tijeras ultrafinas de resorte, a fin de exponer las neuronas para el registro intracelular. Después, vuelva a fijar el ganglio utilizando aproximadamente 15 insectos fino (minutien pins). El ganglio debe mantenerse firme en su lugar ya que cualquier movimiento será problemático durante la exploración.
2. Preparar Electrodos
- Tire electrodos utilizando tubería capilar de vidrio con filamento (por ejemplo WPI TW100F-4) y un extractor. Esta configuración debe ser determinado individualmente para crear electrodos de la resistencia requerida. Cuando se llena con 3 M KAc (acetato de potasio) nuestra resistencia del electrodo es generalmente de aproximadamente 10 MOhms si los electrodos están a achaflanar, o aproximadamente 5 MOhms si el paso de biselado se omite.
- Llenar un conjunto de electrodos con una solución que contiene 3 M KCl KAc/30 mM utilizando una jeringa y aguja microfil. Estos electrodos se utilizan para electrofisiología.
- Llenar un segundo conjunto de electrodos con el colorante indicador de calcio mediante la inmersión del extremo posterior del electrodo en tinte, previamente reconstituidos con aprox. 40 l de agua destilada para tinte 500μg. Cuando la punta del electrodo se ha llenado, de nuevo llenar aproximadamente 1/4 pulgadasdel extremo del electrodo con 200 mM KCl para asegurar un buen contacto eléctrico.
- Es beneficioso para biselar los electrodos, ya que esto facilita la inyección de tinte y reduce el daño causado por las penetraciones de membrana múltiples. Usamos un biselador habitual que genera una corriente de una suspensión de sal en polvo agua / alúmina. El electrodo se monta en un soporte y su punta penetra en la corriente en un ángulo de 45 °. La resistencia del electrodo se controla continuamente y se termina el biselado cuando la resistencia alcanza aproximadamente 5 MOhm para electrodos KAC llenos. Los electrodos de tinte llenas están biselados para una cantidad igual de tiempo y típicamente tienen resistencias de MOhm 15-20.
3. Carga del tinte indicador de calcio
- Colocar la preparación en una plataforma de electrofisiología y localizar visualmente la neurona presináptica de interés. Muchos de nuestros experimentos se hacen con una neurona sensorial identificado utilizado durante la alimentación, B21 5, 6. La positio relativamente fijon, el tamaño (~ 100 m), y la forma alargada del soma B21 hacen que sea fácil de localizar.
- Empalar la neurona de interés con un electrodo que contiene el colorante indicador de calcio. Identidad B21 puede ser verificada por empalar el post-sináptica de neuronas B8. La despolarización de B21 con ~ 8 nA actual dará lugar a picos y el resultado en la facilitación de PSPs en B8 7.
- Inyectar material de contraste en la neurona presináptica de interés al pasar impulsos de hiperpolarización (típicamente -15 nA, 1 Hz, 75% del ciclo de trabajo) durante aproximadamente 30 minutos. Si la carga de colorante tiene éxito, el soma de la neurona adquiere un color rosa pálido. Retire el electrodo que contiene el colorante lentamente se retiraba de la neurona.
- Deja preparativos para aproximadamente 30 minutos para permitir que el tinte se difunda en los procesos finos que hacen contacto sináptico con las neuronas del seguidor.
4. El calcio de imágenes y grabación electrofisiológica
- Colocar la preparación en la imagen microscope. El plato de la preparación se lleva a cabo en una plataforma de refrigeración con trozos de cable sellado Permagum que, a diferencia de arcilla, sigue siendo pegajoso cuando está húmedo. El microscopio de platina fija centra moviendo el objetivo. La etapa permanece estacionario, lo que permite fijar manipuladores imán montado. Como la gran amplificación hace vibraciones (movimiento lateral especialmente) un problema, la configuración de imagen completa debe ser colocado en una plataforma de aislamiento de vibraciones.
- Empalar neuronas presinápticas y postsinápticas con electrodos que contienen solución electrolítica normal.
- Seleccione un bloque de filtro adecuado para Calcio imagen Orange (excitación 549 nm, emisión 576 nm) 8 y ajustar la cámara. La mayoría de las cámaras CCD científicos permite al investigador elegir un subconjunto de celdas CCD que se leen. Además, las células se pueden combinar (agrupaciones). Selección de un subconjunto más pequeño aumenta la velocidad, mientras que hurgar en la basura aumenta la sensibilidad. Estas dos configuraciones, junto con el tiempo de exposición, determinarla velocidad de fotogramas es decir, cuántas imágenes se pueden adquirir por segundo. Ajustes adecuados tomará imágenes de un área de 580 x 350 m 2 con 500 x 300 píxeles (usando un lente de 10x y un adaptador de cámara 0.5x). Añadir filtros de densidad neutra para la trayectoria de la luz para ajustar la intensidad de la iluminación a la cantidad mínima que proporciona una exposición correcta con un tiempo de exposición <25 ms. Estos ajustes deben resultar en una velocidad de alrededor de 30 Hz - que en Aplysia es lo suficientemente rápido para una sola imagen pico evocados alteraciones de calcio. Finalmente, cierre la abertura campo de manera que sólo el área de la imagen se ilumina.
- En el software de imágenes de marcar regiones de las neuronas que desea medir. En el software de Elementos AR esto se hace en la "Medición de la hora" mediante la colocación de regiones de interés (ROIs). B21 es una neurona bipolar y el trabajo previo ha demostrado que sus contactos proceso lateral de la neurona postsináptica de interés 9. Por lo general, la imagen principal sostén, secundaria y terciarianches del proceso lateral mediante la colocación de una ROI en cada parte de la neurona. Un ROI adicional junto a la neurona colorante llena se mide para proporcionar un valor de fondo que es posteriormente restado de todos los demás puntos de datos.
- Instruir a la adquisición de electrofisiología (en estos experimentos II Spike) para esperar una señal de activación proporcionada por la "lectura marco" de la señal de la cámara. Inicie la adquisición de la imagen (Elementos AR); Espiga II ahora se inicia automáticamente la grabación cuando la cámara realiza su primer cuadro. También puede utilizar una salida TTL del Poder 1401 a referirme brevemente a un LED montado en el puerto de la cámara del microscopio. Esto proporcionará una señal para sincronizar posteriormente formación de imágenes y datos electrofisiológicos.
- Estimular la neurona presináptica mediante la inyección de una serie de breves pulsos de corriente de despolarización a la frecuencia deseada. Es importante controlar cada pulso (por ejemplo, con un osciloscopio de estímulo desencadena) para determinar si un potencial de acción es successfUlly generado. Mientras que Orange calcio es muy foto-estable en comparación con otros tintes, es una buena idea grabar un ensayo de control sin estimulación para comprobar la cantidad de tinte blanqueamiento ocurre.
- En experimentos en los que las concentraciones de calcio intracelular son manipuladas, un fármaco tal como EGTA se introduce en la neurona presináptica y los pasos de adquisición de estimulación y datos descritos anteriormente se repiten.
5. Análisis de los datos representativos
- Exportar los datos de imágenes (la lista de valores de intensidad medidos para cada ROI) al escribir en un archivo de texto. Un script personalizado de Spike II continuación, puede importar el archivo de texto. Este script también normaliza los valores con zona de la sonda individuo, y resta el valor de la sonda de fondo. Los puntos de datos se representan a continuación junto con los datos de electrofisiología como un "virtual RealWave" canal. El "canal de proceso / función de cambio de hora" de Spike II se utiliza para alinear con precisión los datos de imágenes points, utilizando la señal de LED como referencia.
- Para obtener los valores como porcentaje de cambio, analizar los datos de imagen mediante el cálculo de la variación relativa de la fluorescencia como dF / F o = (FF o) / o F. F O denota el nivel de fluorescencia justo antes del estímulo y F la fluorescencia durante el estímulo.
6. Los resultados representativos
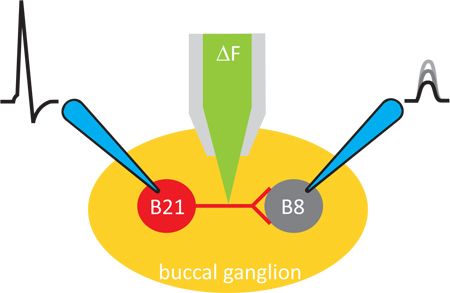
Figura 1. Esquema general del experimento. Los experimentos se llevan a cabo en una preparación de ganglio de Aplysia. Los cambios en el calcio intracelular se crean imágenes con un colorante fluorescente, que se iontoforéticamente introducido en la neurona presináptica. Neuronas pre y postsinápticos son entonces empalado con electrodos afilados de modo que la transmisión sináptica puede inducirse y monitoreados.

Figura 2. imágenes de calcio y registro intracelular de las neuronas identificadas en el ganglio vestibular de Aplysia. (A) Foto de la rama lateral formado la imagen de la neurona B21. El cuadro indica la región medido de interés. (B1) la estimulación intracelular de B21 evoca potenciales de acción (traza inferior) y la facilitación de los potenciales postsinápticos (PSP) en la neurona postsináptica seguidor B8 (centro de seguimiento) provocando que se dispare también los potenciales de acción. El aumento de la fluorescencia de calcio presinápticos se muestra en el trazo superior. (B2) Efecto de EGTA en la facilitación presináptica homosináptica. EGTA se inyectó intracelularmente en B21 ~ 15 minutos antes de la estimulación intracelular. Se cree que EGTA es un quelante de calcio de acción lenta, que en concentraciones bajas no es lo suficientemente rápido para suprimir la transmisión sináptica. Tenga en cuenta la reducción en la señal de calcio generalizada y la correspondiente disminución en la amplitud de PSP. (C) La amplitud de PSP se correlaciona con la calciu presinápticam señal. Haga clic aquí para ampliar la cifra .
Discusión
Demostramos técnicas que se pueden utilizar para monitorear simultáneamente la concentración de calcio intracelular y evaluar la eficacia de la transmisión sináptica. Estas técnicas son útiles para determinar cómo las diversas formas de plasticidad a corto plazo están mediadas.
La formación de imágenes se lleva a cabo con un microscopio de fluorescencia y cámara CCD. Estos requerimientos de equipo son relativamente modestos en comparación a la mayoría de neuroimagen funcional s...
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
A Grant PHS (MH51393) apoya este trabajo. Algunos de los Aplysia que utilizamos son proporcionados por el Nacional de Recursos para Aplysia, de la Universidad de Miami con la subvención RR10294 del Centro Nacional para Recursos de Investigación, NIH.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentario |
| Calcio Orange | Invitrogen | C-3013 | |
| EGTA | Sigma | E-4378 | |
| Calibración de calcio tampón kit | Invitrogen | C-3008MP | útil para probar la sensibilidad y el rango dinámico de la señal |
| Magnesio hexahidrato de cloruro | Sigma | M0250 | utilizado en solución 0,33 M de anestesiar a los animales |
Reactivos Tabla 1. Utilizado.
| Nombre del equipo | Empresa | Comentario |
| FN-1 microscopio de fluorescencia vertical | Nikon Instruments | con Narishige ITS-FN1 etapa |
| NMN-21 manipuladores | Narishige | montado en el escenario con imanes |
| CoolSNAP HQ 2 CCD cámara | Fotometría | |
| NIS elementos AR (Versión 3.22) | Nikon Instruments | software de imágenes utilizados para adquirir datos de fluorescencia |
| 10X/0.3w Plan Fluor objetivo | Nikon Instruments | esta lente de inmersión en agua tiene una muy larga distancia de trabajo de 3,5 mm |
| X-Cite 120 lámpara de halogenuro metálico PC | EXFO | utilizado para las imágenes por fluorescencia |
| LS-DWL lámpara halógena | Sumica | |
| ET-CY3 Juego de filtros | Tecnología Chroma | ; |
| Poder 1401 convertidor A / D | Cambridge Electronic Design | se realizaron muestreos de 3 kHz |
| Espiga II (Versión 7.07) | Cambridge Electronic Design | software utilizado para adquirir datos de electrofisiología |
| SEC-10 LX amplificador | NPI electrónica | se utiliza con un headstage 10 veces |
| Modelo 410 amplificador | Brownlee precisión | utilizados para amplificar y filtrar la señal |
| WS-4 | menos k Tecnología | aislamiento de vibraciones para formación de imágenes |
| mesa de enfriamiento | encargo | placa de latón a través del cual se bombea agua de hielo a una tasa variable |
Tabla 2. Equipo utilizado.
Referencias
- Zucker, R. S., Regehr, W. G. Short-term synaptic plasticity. Annu. Rev. Physiol. 64, 355-405 (2002).
- Eberhard, M., Erne, P. Calcium binding to fluorescent calcium indicators: Calcium green, calcium orange and calcium crimson. Biochem. Biophysical Res. Comm. 180, 209-215 (1991).
- Escobar, A. L., Velez, P., Kim, A. M., Cifuentes, F., Fill, M., Vergata, J. L. Kinetic properties of DM-nitrophen and calcium indicators: rapid transient response to flash photolysis. Eur. J. Physiol. 434, 615-631 (1997).
- Ivanov, A. I., Calabrese, R. L. Modulation of spike-mediated synaptic transmission by presynaptic background Ca2+ in leech heart interneurons. J. Neurosci. 23, 1206-1218 (2003).
- Rosen, S. C., Miller, M. W., Evans, C. G., Cropper, E. C., Kupfermann, I. Diverse synaptic connections between peptidergic radula mechanoafferent neurons and neurons in the feeding system of Aplysia. J. Neurophysiol. 83, 1605-1620 (2000).
- Ludwar, B. C. h., Evans, C. G., Jing, J., Cropper, E. C. Two distinct mechanisms mediate potentiating effects of depolarization on synaptic transmission. J. Neurophysiol. 102, 1976-1983 (2009).
- Evans, C. G., Ludwar, B. C. h., Askansas, J., Cropper, E. C. Effect of holding potential on the dynamics of homosynaptic facilitation. J. Neurosci. 31, 11039-11043 (2011).
- Haugland, R. P. . The Handbook. , (2005).
- Borovikov, D., Evans, C. G., Jing, J., Rosen, S. C., Cropper, E. C. A proprioceptive role for an exteroceptive mechanoafferent neuron in Aplysia. J. Neurosci. 20, 1990-2002 (2000).
- Goldberg, J. H., Yuste, R. Chapter 38: A practical guide: Two-photon calcium imaging of spines and dendrites. Imaging in Neuroscience and Development. , (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados