Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Мониторинг изменений в внутриклеточной концентрации кальция и синаптической эффективности в Моллюск
В этой статье
Резюме
Мы демонстрируем, как изменения во внутриклеточной концентрации свободного кальция и синаптической эффективности могут быть одновременно контролировать в ганглии подготовки Aplysia. Мы изображений внутриклеточного кальция с помощью флуоресцентного красителя, кальций Orange, и вызывать и контролировать синаптической передачи с острыми (внутриклеточные) электроды.
Аннотация
It has been suggested that changes in intracellular calcium mediate the induction of a number of important forms of synaptic plasticity (e.g., homosynaptic facilitation) 1. These hypotheses can be tested by simultaneously monitoring changes in intracellular calcium and alterations in synaptic efficacy. We demonstrate how this can be accomplished by combining calcium imaging with intracellular recording techniques. Our experiments are conducted in a buccal ganglion of the mollusc Aplysia californica. This preparation has a number of experimentally advantageous features: Ganglia can be easily removed from Aplysia and experiments use adult neurons that make normal synaptic connections and have a normal ion channel distribution. Due to the low metabolic rate of the animal and the relatively low temperatures (14-16 °C) that are natural for Aplysia, preparations are stable for long periods of time.
To detect changes in intracellular free calcium we will use the cell impermeant version of Calcium Orange 2 which is easily 'loaded' into a neuron via iontophoresis. When this long wavelength fluorescent dye binds to calcium, fluorescence intensity increases. Calcium Orange has fast kinetic properties 3 and, unlike ratiometric dyes (e.g., Fura 2), requires no filter wheel for imaging. It is fairly photo stable and less phototoxic than other dyes (e.g., fluo-3) 2,4. Like all non-ratiometric dyes, Calcium Orange indicates relative changes in calcium concentration. But, because it is not possible to account for changes in dye concentration due to loading and diffusion, it can not be calibrated to provide absolute calcium concentrations.
An upright, fixed stage, compound microscope was used to image neurons with a CCD camera capable of recording around 30 frames per second. In Aplysia this temporal resolution is more than adequate to detect even a single spike induced alteration in the intracellular calcium concentration. Sharp electrodes are simultaneously used to induce and record synaptic transmission in identified pre- and postsynaptic neurons. At the conclusion of each trial, a custom script combines electrophysiology and imaging data. To ensure proper synchronization we use a light pulse from a LED mounted in the camera port of the microscope. Manipulation of presynaptic calcium levels (e.g. via intracellular EGTA injection) allows us to test specific hypotheses, concerning the role of intracellular calcium in mediating various forms of plasticity.
протокол
1. Подготовка
- Анестезию животного путем введения 75-100 мл изотонический раствор хлорида магния. Aplysia мы используем для работы с изображениями, как правило, 150-200 граммов и получаются из Маринус Scientific.
- Pin наркозом животным воском покрыты блюдо. Шприц иглы хорошо работать для этой цели; стерильные методы не являются необходимыми. Использование валового щипцы и ножницы стандартного сделать разрез в ноге животного и подвергать щечной массы. Найдите щечной ганглия. Использование весной ножницами и щипцами штрафа, тщательно бесплатно ганглий, сокращая все щечные нервы.
- Снимите ганглии и поместить его в Sylgard покрытием блюдо с искусственной морской воде. Поместите несколько контактов насекомого через слизистую нервы, чтобы стабилизировать ганглия. Desheath щечной ганглий использованием ультрадисперсных щипцы и ножницы весной, чтобы разоблачить нейронов для внутриклеточной регистрации. Затем снова прикрепить ганглий использованием около 15 штрафа насекомых (минutien) контакты. Ганглий должны быть прочно удерживается на месте, как любое движение будет проблематично во время съемки.
2. Подготовка электродов
- Потяните электродов с использованием стекла капиллярные трубки с нитью (например, WPI TW100F-4) и съемник. Настройки должны быть индивидуально определены для создания электродов необходимого сопротивления. Когда заполнены 3 М Каца (ацетат калия) наши сопротивление электродов, как правило, около 10 МОм, если электроды должны быть скошенными, или около 5 МОм, если фаски шаг опускается.
- Заполните один набор электродов с раствором, содержащим 3 M KAc/30 мМ KCl с помощью шприца и иглы Microfil. Эти электроды будут использоваться для электрофизиологии.
- Заполните второй комплект электродов с красителем индикатора кальция путем погружения в задней части электрода в краситель, предварительно восстанавливают ок. 40 мкл дистиллированной воды для 500μg красителя. Когда кончик электрода заполнена, спины заполнить около 1/4 дюймаНа конец электрода с 200 мМ KCl для обеспечения хорошего электрического контакта.
- Это выгодно, чтобы конических электродов, так как это облегчает введение красителя и уменьшает урон от нескольких проходов мембраны. Мы используем пользовательский beveler, которая генерирует поток соленой воды / порошка оксида алюминия подвески. Электрод устанавливается в держателе и его кончик входит в поток на угол 45 °. Электрод сопротивление находится под постоянным контролем и фаски прекращается, когда сопротивление достигает около 5 МОм для Каца заполнены электродов. Красителя заполнены электродов скошены на равное количество времени и обычно имеют сопротивление 15-20 МОм.
3. Загрузка краска кальция Индикатор
- Положите препарат на буровой электрофизиологии и визуально определить пресинаптического нейрона интерес. Многие из наших экспериментов сделали с выявленной сенсорных нейронов использовали во время кормления, 5 B21, 6. Относительно фиксированной позиционерап, размер (~ 100 мкм), и продолговатой формы сомы B21 делают его легко найти.
- Прокалывание нейрона интерес электрод, содержащий красителей кальция показатель. Идентичность B21 может быть проверена путем пронзая постсинаптических нейронов B8. Деполяризация B21 с ~ 8 текущем нА вызовет шипы и результат в содействии ГАЭС в B8 7.
- Inject красителя в пресинаптических нейронов интерес, передавая гиперполяризующего импульсов (обычно -15 нА, 1 Гц, 75% рабочего цикла) в течение примерно 30 минут. Если краситель загрузки успешно, сомы нейрона приобретет слабый розовый цвет. Снимите красителя содержащие электрод медленно вывода его из нейронов.
- Оставьте препараты в течение приблизительно 30 минут, чтобы краситель диффундировать в тонких процессов, которые делают синаптические контакты с последователем нейронов.
4. Изображениями кальция и электрофизиологические записи
- Положите препарат на изображение microscОПЕ. Блюдо с подготовки проводится на охлаждение платформы с кусочками шнур уплотнительной Permagum которые, в отличие от глин, остается липким при намокании. Фиксированные столик микроскопа фокусируется путем перемещения цели. Этапе остается неподвижным, что позволяет крепления магнитов с манипуляторами. В большом увеличении делает вибрации (особенно боковое движение) проблема, все настройки изображения должен быть сделан на платформе виброизоляции.
- Прокалывание пресинаптических и постсинаптических нейронов с электродами, содержащие нормальные раствор электролита.
- Выберите фильтр, блок подходит для изображения кальция Orange (возбуждение 549 нм, излучение 576 нм) 8 и настроить камеру. Большинство научных CCD камеры позволяют следователю выбрать подмножество клеток CCD, которые зачитал. Кроме того, клетки могут быть объединены (сегментирования). Выбор меньшего набора увеличивает скорость, а биннинга повышает чувствительность. Эти два параметра, вместе с временем экспозиции, определитьЧастота кадров, т.е. как много изображений могут быть приобретены в секунду. Подходящие параметры будут изображений площадью 580 х 350 мкм 2 с 500 х 300 пикселей (при использовании 10-кратным объективом и 0.5х Адаптер камеры). Добавить фильтры нейтральной плотности на свет путем регулировать интенсивность освещения в минимальном количестве, которое обеспечивает правильную экспозицию с выдержкой времени <25 мс. Эти параметры должны привести частотой кадров около 30 Гц - которые в Aplysia достаточно быстро, чтобы изображение одного всплеска вызвали кальция изменений. И, наконец, закрыть диафрагму поля так, что только отображаемой области горит.
- В визуализация программного обеспечения отмечают регионов нейрона вы хотите измерить. В Elements AR программного обеспечения это делается в программе "Время измерения" раздела путем размещения регионах, представляющих интерес (трансформирования). B21 является биполярного нейрона и предыдущая работа показала, что его боковые контакты процесса постсинаптического нейрона интерес 9. Мы вообще изображение первичных, вторичных и третичных бюстгальтерnches боковой процессе размещения ROI над каждой части нейрона. Дополнительных ROI рядом с красителем заполнены нейронов измеряется, чтобы обеспечить фоновое значение, которое позже вычитается из всех других точек данных.
- Поручить приобретение электрофизиологии (в этих опытах Спайк II) ждать сигнала запуска инструмента "рамка считывания" сигнал с камеры. Начало захвата изображения (Elements AR); Спайк II теперь будут автоматически начинать запись, когда камера берет первый кадр. Вы можете также использовать выход TTL державы, с 1401 по кратко остановиться на светодиодном установлен в порт камеры микроскопа. Это даст сигнал для последующей синхронизации изображения и электрофизиологических данных.
- Стимулировать пресинаптического нейрона путем введения ряда кратких деполяризующих импульсов тока на нужную частоту. Важно следить за каждым импульсом (например, с помощью стимулов вызвало осциллограф), чтобы определить потенциал действия является successfUlly генерируется. В то время как кальций Оранжевый очень фото-стабильным по сравнению с другими красителями, это хорошая идея записать управления судебного разбирательства без стимуляции, чтобы проверить, сколько красить отбеливание происходит.
- В экспериментах, в которых внутриклеточной концентрации кальция манипулируют, наркотиков, таких как EGTA вводится в пресинаптических нейронов и стимулирование сбора данных и описанные выше шаги повторяются.
5. Анализ репрезентативных данных
- Экспорт данных изображения (список измеренных значений интенсивности для каждого ROI), написав его в текстовый файл. Пользовательского сценария в фильме Спайка II можно импортировать в текстовый файл. Этот сценарий также нормализует значения площадью отдельных зондов, и вычитает значение фона зонда. Точек данных, то график наряду с данными электрофизиологии, как "виртуальные RealWave" канал. "Руслового процесса / функция временного сдвига" в Спайка II используется точно выровнять изображение данных POIНТС, используется светодиодный индикатор сигнала в качестве ссылки.
- Для получения значения в процентах изменения, анализировать данные изображения, вычисляя относительное изменение флуоресценции как дР / F о = (FF о) / F о. F O обозначает уровень флуоресценции перед стимул и F флуоресценции во время стимул.
6. Представитель Результаты
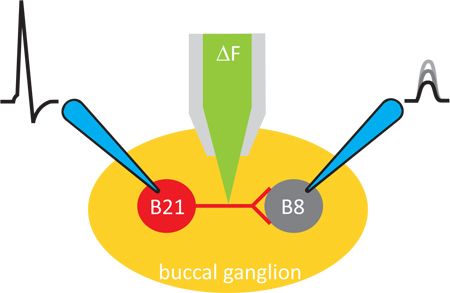
Рисунок 1. Общая схема эксперимента. Эксперименты проводились в ганглии подготовки Aplysia. Изменения внутриклеточного кальция, полученную с флуоресцентным красителем, который iontophoretically введен в пресинаптических нейронов. Пре-и постсинаптические нейроны, которые затем пронзил острым электродов, так что синаптической передачи может быть вызвана и контролироваться.

Рисунок 2. изображений кальция и внутриклеточной регистрации от установленных нейронов в ротовой ганглия Aplysia. (A) Фото отображаемого боковой ветви нейрона B21. Упаковке означает, измеренная области интереса. (B1) Внутриклеточные стимуляции B21 вызывает потенциалы действия (нижний луч) и содействие постсинаптических потенциалов (PSP) в постсинаптической последователем нейрона B8 (средняя линия), заставляя его также уволить потенциалов действия. Увеличивает в пресинаптических флуоресценции кальций показан в верхней следа. (B2) Влияние пресинаптических EGTA на homosynaptic процедур. EGTA был введен в внутриклеточно B21 ~ 15 минут до внутриклеточной стимуляции. Считается, что EGTA это медленно действующий кальция хелат, что при низких концентрациях не достаточно быстро, чтобы подавить синаптической передачи. Обратите внимание на снижение в распространенном сигнал кальция и соответствующее уменьшение амплитуды PSP. (C) амплитуда PSP коррелирует с пресинаптической calciuм сигнал. Нажмите, чтобы увеличить показатель .
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Мы продемонстрируем методы, которые могут быть использованы для одновременного контроля внутриклеточной концентрации кальция и оценить эффективность синаптической передачи. Эти методы полезны для определения того, как различные формы краткосрочного пластичности опосредовано.
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нам нечего раскрывать.
Благодарности
PHS Грант (MH51393) поддержали эту работу. Некоторые из Aplysia которые мы используем, предоставляемых Национальным ресурсов для Aplysia из университета Майами по гранту RR10294 из Национального центра исследовательских ресурсов, NIH.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Реагент Имя | Компания | Номер по каталогу | Комментировать |
| Кальций Оранжевый | Invitrogen | C-3013 | |
| EGTA | Сигма | E-4378 | |
| Кальций калибровки буфера комплект | Invitrogen | C-3008MP | полезно для тестирования чувствительность и динамический диапазон сигнала |
| Гексагидрат Хлорид магния | Сигма | M0250 | использовать в 0,33 М раствора, чтобы обезболить животных |
Таблица 1. Используемых реагентов.
| Название оборудования | Компания | Комментировать |
| FN-1 вертикально флуоресцентного микроскопа | Nikon Instruments | с Narishige ITS-FN1 этапе |
| NMN-21 манипуляторы | Narishige | установлен на сцене с магнитами |
| CoolSNAP HQ 2 CCD камеры | Фотометрия | |
| NIS элементов AR (Версия 3.22) | Nikon Instruments | изображений программное обеспечение используется для получения данных флуоресценции |
| 10X/0.3w Plan Fluor цели | Nikon Instruments | этот объектив погружения в воду имеет очень большое рабочее расстояние 3,5 мм |
| X-Cite 120 PC металлогалогенные лампы | EXFO | используется для флуоресцентной микроскопии |
| LS-DWL галогенные лампы | Sumica | |
| ET-CY3 набор фильтров | Chroma технологии | ; |
| Мощность 1401 A / D конвертер | Cambridge Electronic Design | выборка была сделана на 3 кГц |
| Спайк II (Версия 7.07) | Cambridge Electronic Design | Программное обеспечение используется для получения данных электрофизиологии |
| SEC-10 LX усилителем | НПИ электроники | использовать с 10-кратным headstage |
| Модель 410 Усилитель | Браунли точности | используется для усиления и фильтрации сигнала |
| WS-4 | минус к технологиям | виброизоляции для работы с изображениями |
| охлаждение платформы | заказ | латунные пластины, через которые ледяную воду закачивают с переменной скоростью |
Таблица 2. Оборудования.
Ссылки
- Zucker, R. S., Regehr, W. G. Short-term synaptic plasticity. Annu. Rev. Physiol. 64, 355-405 (2002).
- Eberhard, M., Erne, P. Calcium binding to fluorescent calcium indicators: Calcium green, calcium orange and calcium crimson. Biochem. Biophysical Res. Comm. 180, 209-215 (1991).
- Escobar, A. L., Velez, P., Kim, A. M., Cifuentes, F., Fill, M., Vergata, J. L. Kinetic properties of DM-nitrophen and calcium indicators: rapid transient response to flash photolysis. Eur. J. Physiol. 434, 615-631 (1997).
- Ivanov, A. I., Calabrese, R. L. Modulation of spike-mediated synaptic transmission by presynaptic background Ca2+ in leech heart interneurons. J. Neurosci. 23, 1206-1218 (2003).
- Rosen, S. C., Miller, M. W., Evans, C. G., Cropper, E. C., Kupfermann, I. Diverse synaptic connections between peptidergic radula mechanoafferent neurons and neurons in the feeding system of Aplysia. J. Neurophysiol. 83, 1605-1620 (2000).
- Ludwar, B. C. h, Evans, C. G., Jing, J., Cropper, E. C. Two distinct mechanisms mediate potentiating effects of depolarization on synaptic transmission. J. Neurophysiol. 102, 1976-1983 (2009).
- Evans, C. G., Ludwar, B. C. h, Askansas, J., Cropper, E. C. Effect of holding potential on the dynamics of homosynaptic facilitation. J. Neurosci. 31, 11039-11043 (2011).
- Haugland, R. P. The Handbook. , 10th edition, Invitrogen. (2005).
- Borovikov, D., Evans, C. G., Jing, J., Rosen, S. C., Cropper, E. C. A proprioceptive role for an exteroceptive mechanoafferent neuron in Aplysia. J. Neurosci. 20, 1990-2002 (2000).
- Goldberg, J. H., Yuste, R. Chapter 38: A practical guide: Two-photon calcium imaging of spines and dendrites. Imaging in Neuroscience and Development. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor, NY. (2005).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены