Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesure des variations de la concentration de calcium intracellulaire et de l'efficacité synaptique dans le mollusque
Dans cet article
Résumé
Nous montrons comment les changements dans la concentration de calcium libre intracellulaire et l'efficacité synaptique peut être surveillés simultanément dans une préparation de ganglion Aplysie. Nous l'image de calcium intracellulaire à l'aide d'un colorant fluorescent, orange calcium, et d'induire et de contrôler la transmission synaptique avec tranchants (intracellulaire) électrodes.
Résumé
Il a été suggéré que les changements dans le calcium intracellulaire médiation de l'induction d'un certain nombre d'importantes formes de plasticité synaptique (par exemple, la facilitation homosynaptique) 1. Ces hypothèses peuvent être testées en même temps surveiller les changements dans le calcium intracellulaire et des changements dans l'efficacité synaptique. Nous démontrons comment cela peut être réalisé en combinant l'imagerie calcique avec les techniques d'enregistrement intracellulaire. Nos expériences sont menées dans un ganglion vestibulaire du mollusque Aplysia californica. Cette préparation a un certain nombre de caractéristiques avantageuses expérimentalement: Ganglia peut être facilement retiré de l'aplysie et expériences utilisent neurones adultes qui font de connexions synaptiques normales et ont une distribution normale d'ions canal. En raison de la faible taux métabolique de l'animal et les températures relativement basses (14-16 ° C) qui sont naturels pour l'aplysie, les préparations sont stables pendant de longues périodes de temps. Calcium ent "> Pour détecter les changements dans le calcium intracellulaire libre, nous allons utiliser la version portable imperméant de calcium Orange 2 qui est facilement« chargé »dans un neurone par ionophorèse. Lorsque cette teinture fluorescente grande longueur d'onde se lie au calcium, augmentation de l'intensité de fluorescence. Orange a propriétés cinétiques rapides 3 et, contrairement aux colorants ratiométriques (par exemple, le Fura 2), ne nécessite pas de roue de filtres pour l'imagerie. Il est assez photo stable et moins phototoxique que d'autres colorants (par exemple, fluo-3) 2,4. Comme tous les non-ratiométrique colorants, de calcium Orange indique les changements relatifs à la concentration de calcium. Mais, car il n'est pas possible de tenir compte des changements dans la concentration de colorant dues au chargement et à la diffusion, elle ne peut pas être calibré pour fournir les concentrations de calcium absolus.
Une verticale, microscope fixe composé stade, a été utilisé pour les neurones d'image avec une caméra CCD permet d'enregistrer environ 30 images par seconde. Chez l'aplysie cette résolution temporelleest plus que suffisant pour détecter même un seul pic induit par la modification de la concentration de calcium intracellulaire. Électrodes pointues sont utilisées simultanément pour induire et d'enregistrer la transmission synaptique dans les neurones identifiés pré-et post-synaptiques. À la fin de chaque essai, un script personnalisé combine électrophysiologie et des données d'imagerie. D'assurer une bonne synchronisation on utilise une impulsion de lumière provenant d'une diode montée dans l'orifice de caméra du microscope. La manipulation des niveaux calciques présynaptiques (par exemple via l'EGTA injection intracellulaire) nous permet de tester des hypothèses spécifiques, concernant le rôle du calcium intracellulaire dans la médiation de diverses formes de plasticité.
Protocole
1. Préparation
- Anesthésier l'animal en injectant 75-100 ml solution isotonique de chlorure de magnésium. L'aplysie nous utilisons pour l'imagerie sont généralement 150-200 grammes et sont obtenus à partir Marinus scientifique.
- Pin l'animal anesthésié dans un plat recouvert de cire. Aiguilles de seringues fonctionnent bien à cette fin, les techniques stériles ne sont pas nécessaires. En utilisant des pinces et ciseaux bruts standards faire une incision dans le pied de l'animal et d'exposer la masse buccale. Localisez le ganglion vestibulaire. Avec des ciseaux à ressort et pinces fines, soigneusement gratuitement le ganglion en coupant tous les nerfs buccaux.
- Retirer le ganglion et le placer dans un plat Sylgard enrobé contenant eau de mer artificielle. Placez un peu de broches d'insectes à travers les nerfs buccaux pour stabiliser le ganglion. Desheath le ganglion buccal aide d'une pince à ressort ultrafines et des ciseaux, de manière à exposer les neurones pour l'enregistrement intracellulaire. Puis re-épingler le ganglion en utilisant environ 15 insectes fine (minutien) broches. Le ganglion doit être maintenu fermement en place comme tout mouvement sera problématique lors de l'imagerie.
2. Préparer électrodes
- Tirer électrodes en utilisant un tube de verre capillaire (par exemple avec des filaments de WPI TW100F-4) et un extracteur. Les paramètres doivent être déterminés individuellement pour créer des électrodes de la résistance requise. Lorsqu'il est rempli avec 3 M KAc (acétate de potassium), notre résistance de l'électrode est généralement d'environ 10 MOhms si les électrodes sont à chanfreiner, ou environ 5 MOhms si l'étape de biseautage est omise.
- Remplir une série d'électrodes avec une solution contenant 3 mM de KCl M KAc/30 aide d'une seringue et d'une aiguille Microfil. Ces électrodes seront utilisés pour l'électrophysiologie.
- Remplir un second ensemble d'électrodes avec le colorant indicateur de calcium par trempage de l'extrémité arrière de l'électrode de colorant, préalablement reconstitué avec env. 40 pl d'eau distillée pour la teinture 500 pg. Lorsque la pointe de l'électrode est rempli, le remblai environ 1/4 poucede l'extrémité de l'électrode avec 200 mM KCl pour assurer un bon contact électrique.
- Il est bénéfique pour biseauter les électrodes, ce qui facilite l'injection de colorant et de réduire les dommages causés par des pénétrations multiples membrane. Nous utilisons un beveler personnalisé qui génère un flux d'une suspension de poudre de sel de l'eau / alumine. L'électrode est montée dans un support et sa pointe pénètre dans la circulation à un angle de 45 °. Résistance de l'électrode est surveillée en permanence et le biseautage terminé lorsque la résistance atteint environ 5 MOhm pour électrodes KAC remplis. Les électrodes remplies de colorant sont biseautés pour une quantité égale de temps et ont généralement des résistances de MOhm 15-20.
3. Chargement du colorant indicateur de calcium
- Placez la préparation sur une plate-forme d'électrophysiologie et de localiser visuellement le neurone présynaptique d'intérêt. Beaucoup de nos expériences sont effectuées avec un neurone sensoriel identifié utilisée lors de l'alimentation, B21 5, 6. La positio relativement fixen, la taille (~ 100 um), et la forme allongée de soma B21 le rendent plus facile à localiser.
- Empaler le neurone d'intérêt avec une électrode contenant le colorant indicateur de calcium. B21 identité peut être vérifiée par l'empalement post-synaptique neurone B8. Dépolarisation de B21 avec ~ 8 nA de courant va déclencher les pointes et les résultats pour faciliter les PSP en B8 7.
- Injecter un colorant dans le neurone présynaptique d'intérêt en passant impulsions hyperpolarisants (typiquement -15 nA, 1 Hz, rapport cyclique 75%) pendant environ 30 minutes. Si le chargement colorant est réussie, le soma du neurone va acquérir une couleur rose pâle. Retirer l'électrode contenant un colorant lentement en le retirant du neurone.
- Laisser la préparation pendant environ 30 minutes pour permettre au colorant de se diffuser dans les processus fines qui entrent en contact synaptique avec les neurones suiveurs.
4. Imagerie de calcium et d'enregistrement électrophysiologique
- Placez la préparation sur la Microsc imagerieope. Le plat de la préparation se déroule sur une plate-forme de refroidissement avec des morceaux de cordon d'étanchéité Permagum qui, contrairement à l'argile, reste collant lorsqu'il est mouillé. Le microscope à platine fixe se concentre en déplaçant l'objectif. La scène reste stationnaire, ce qui permet de fixer des manipulateurs montés aimant. Comme le fort grossissement rend vibrations (mouvement latéral en particulier) d'un problème, l'installation d'imagerie entière doit être placée sur une plate-forme d'isolation des vibrations.
- Empaler neurones présynaptiques et postsynaptiques avec des électrodes contenant une solution électrolytique normal.
- Sélectionnez un bloc filtre approprié pour Calcium image Orange (excitation 549 nm, émission 576 nm) 8 et réglez la caméra. La plupart des scientifiques caméras CCD permet à l'enquêteur de choisir un sous-ensemble de cellules CCD qui sont lues. En outre, les cellules peuvent être combinés (mis en cellule). Sélection d'un petit sous-ensemble augmente la vitesse, tout en binning augmente la sensibilité. Ces deux paramètres, ainsi que le temps d'exposition, déterminerle taux de trame à-dire le nombre d'images peuvent être acquises par seconde. Paramètres appropriés sera l'image d'une zone de 580 x 350 um 2 avec 500 x 300 pixels (en utilisant un objectif 10x et un adaptateur pour appareil photo 0.5x). Ajouter des filtres de densité neutre pour la trajectoire de la lumière pour ajuster l'intensité d'éclairage de la quantité minimale qui fournit une exposition correcte avec un temps d'exposition <25 ms. Ces paramètres devraient aboutir à une cadence d'environ 30 Hz - qui chez l'aplysie est assez rapide pour l'image unique pic évoqué des modifications de calcium. Enfin, à proximité de l'ouverture de champ de sorte que seule la zone d'image est éclairée.
- Dans le logiciel d'imagerie marquer régions du neurone que vous voulez mesurer. Dans le logiciel Elements AR cela est fait dans la "Mesure de l'heure» en plaçant des régions d'intérêt (ROI). B21 est un neurone bipolaire et travaux antérieurs ont démontré que ses contacts processus latérales du neurone post-synaptique d'intérêts 9. En général, nous l'image primaire, soutien-gorge secondaire et tertiairenches latérale du processus de mise en place d'une ROI sur chaque partie du neurone. Un retour sur investissement supplémentaire en regard du neurone colorant rempli est mesurée pour fournir une valeur de fond qui est ensuite soustrait de l'ensemble des autres points de données.
- Demandez à l'acquisition d'électrophysiologie (dans ces expériences II Spike) pour attendre un signal de déclenchement fourni par la fonction "Lecture frame" signal de la caméra. Lancement de l'acquisition d'image (Éléments AR); Pointe II va maintenant démarrer automatiquement l'enregistrement lorsque l'appareil photo prend sa première image. Vous pouvez également utiliser une sortie TTL de l'alimentation de 1401 à aborder brièvement sur une LED montée dans le port caméra du microscope. Cela donnera un signal à la suite d'imagerie et de synchroniser des données électrophysiologiques.
- Stimuler le neurone présynaptique par injection d'une série de brèves impulsions de courant de dépolarisation à la fréquence désirée. Il est important de surveiller chaque impulsion (par exemple avec un oscilloscope stimulus déclenché) pour déterminer si un potentiel d'action est successfully générée. Tandis qu'Orange calcium est très photo-stable par rapport à d'autres colorants, c'est une bonne idée d'enregistrer un essai de contrôle sans stimulation pour vérifier combien teindre blanchiment se produit.
- Dans les expériences où les concentrations de calcium intracellulaire sont manipulés, un médicament tel que l'EGTA est introduit dans le neurone présynaptique et les étapes de l'acquisition de stimulation et des données décrites ci-dessus sont répétées.
5. Analyse des données représentatives
- Exporter les données d'imagerie (la liste des valeurs d'intensité mesurées pour chaque ROI) en l'inscrivant dans un fichier texte. Un script personnalisé Spike II peut ensuite importer le fichier texte. Ce script normalise également les valeurs de zone de la sonde individu, et soustrait la valeur de la sonde de fond. Les points de données sont alors tracées à côté des données d'électrophysiologie comme un «virtuel RealWave« canal. Le "canal de processus / fonction time shift" Spike II est utilisé pour aligner avec précision l'imagerie données points, en utilisant le signal de référence en tant que diode.
- Pour obtenir des valeurs que le changement pour cent, d'analyser les données d'imagerie par calcul de la variation relative de fluorescence dF / F o = (ff o) / F o. F o désigne le niveau de fluorescence, juste avant le stimulus et F la fluorescence au cours de la relance.
6. Les résultats représentatifs
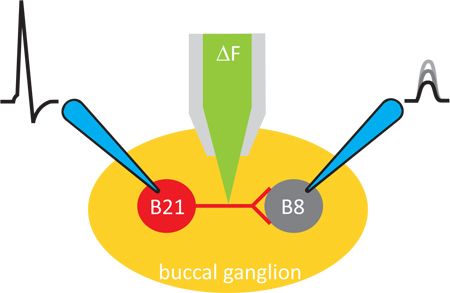
Figure 1. Diagramme d'ensemble de l'expérience. Des expériences sont menées dans une préparation ganglion de l'aplysie. Modifications du calcium intracellulaire sont imagées avec un colorant fluorescent, qui est introduit par iontophorèse dans le neurone présynaptique. Neurones pré-et post-synaptiques sont ensuite empalé avec des électrodes pointues afin que la transmission synaptique peut être induite et contrôlée.

Figure 2. Imagerie calcique et l'enregistrement intracellulaire de neurones identifiés dans le ganglion vestibulaire de l'aplysie. (A) Photo de la branche latérale imagée de neurone B21. La boîte indique la région mesurée d'intérêt. (B1) de stimulation intracellulaire de B21 évoque des potentiels d'action (trace inférieure) et en facilitant les potentiels post-synaptiques (PSP) dans le neurone post-synaptique adepte B8 (milieu de trace) en le faisant aussi tirer des potentiels d'action. Augmentations de fluorescence calcique présynaptique sont présentés dans la trace supérieure. (B2) Effet de l'EGTA sur la facilitation présynaptique homosynaptique. EGTA a été injecté dans intracellulaire B21 ~ 15 minutes avant la stimulation intracellulaire. On pense que l'EGTA est un chélateur de calcium à action lente, qui, à faible concentration n'est pas assez rapide pour supprimer la transmission synaptique. Notez la réduction du signal calcique répandue et la diminution correspondante du PSP amplitude. (C) L'amplitude PSP en corrélation avec le Calciu présynaptiquesignal m. Cliquez ici pour agrandir la figure .
Access restricted. Please log in or start a trial to view this content.
Discussion
Nous démontrons techniques qui peuvent être utilisées pour surveiller simultanément la concentration de calcium intracellulaire et d'évaluer l'efficacité de la transmission synaptique. Ces techniques sont utiles pour déterminer comment les différentes formes de plasticité à court terme sont médiatisés.
La formation d'image est effectuée avec un microscope à fluorescence et une caméra CCD. Ces besoins en équipement sont relativement modestes par rapport à la plupa...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Nous n'avons rien à déclarer.
Remerciements
Un PHS Grant (MH51393) ont soutenu ce travail. Une partie de l'aplysie, nous utilisons sont fournis par le national de ressources pour l'aplysie de l'Université de Miami dans le cadre de la Subvention RR10294 Centre national de recherche sur les ressources, le NIH.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Nom réactif | Entreprise | Numéro de catalogue | Commenter |
| Calcium orange | Invitrogen | C-3013 | |
| EGTA | Sigma | E-4378 | |
| Kit tampon de calcium étalonnage | Invitrogen | C-3008MP | utile pour tester la sensibilité et la gamme dynamique du signal d' |
| Chlorure de magnésium hexahydraté | Sigma | M0250 | utilisé en 0.33 M de solution pour anesthésier des animaux |
Réactifs Tableau 1. Utilisé.
| Nom de l'équipement | Entreprise | Commenter |
| FN-1 microscope droit à fluorescence | Nikon Instruments | avec Narishige ITS-FN1 étape |
| NMN-21 manipulateurs | Narishige | monté sur scène avec des aimants |
| CooISNAP HQ 2 caméra CCD | Photométrie | |
| Éléments NIS AR (Version 3.22) | Nikon Instruments | logiciel d'imagerie utilisé pour acquérir les données de fluorescence |
| 10X/0.3w Plan Fluor objectif | Nikon Instruments | cette lentille à immersion de l'eau a une très longue distance de travail de 3,5 mm |
| X-Cite 120 lampe aux halogénures métalliques PC | EXFO | utilisé pour l'imagerie de fluorescence |
| LS-DWL Lampe halogène | Sumica | |
| ET-CY3 ensemble filtre | Technologie Chroma | ; |
| 1401 puissance convertisseur A / N | Cambridge Electronic Design | échantillonnage a été effectué à 3 kHz |
| Pic II (Version 7.07) | Cambridge Electronic Design | logiciel utilisé pour acquérir des données d'électrophysiologie |
| SEC-10 LX amplificateur | NPI électronique | utilisé avec un headstage 10X |
| Modèle 410 amplificateur | Brownlee précision | utilisé pour amplifier et filtrer le signal d' |
| WS-4 | moins k Technology | isolation des vibrations pour l'imagerie |
| plate-forme de refroidissement | sur mesure | plaque en laiton à travers lequel de l'eau glacée est pompée à un débit variable |
Tableau 2. L'équipement utilisé.
Références
- Zucker, R. S., Regehr, W. G. Short-term synaptic plasticity. Annu. Rev. Physiol. 64, 355-405 (2002).
- Eberhard, M., Erne, P. Calcium binding to fluorescent calcium indicators: Calcium green, calcium orange and calcium crimson. Biochem. Biophysical Res. Comm. 180, 209-215 (1991).
- Escobar, A. L., Velez, P., Kim, A. M., Cifuentes, F., Fill, M., Vergata, J. L. Kinetic properties of DM-nitrophen and calcium indicators: rapid transient response to flash photolysis. Eur. J. Physiol. 434, 615-631 (1997).
- Ivanov, A. I., Calabrese, R. L. Modulation of spike-mediated synaptic transmission by presynaptic background Ca2+ in leech heart interneurons. J. Neurosci. 23, 1206-1218 (2003).
- Rosen, S. C., Miller, M. W., Evans, C. G., Cropper, E. C., Kupfermann, I. Diverse synaptic connections between peptidergic radula mechanoafferent neurons and neurons in the feeding system of Aplysia. J. Neurophysiol. 83, 1605-1620 (2000).
- Ludwar, B. C. h, Evans, C. G., Jing, J., Cropper, E. C. Two distinct mechanisms mediate potentiating effects of depolarization on synaptic transmission. J. Neurophysiol. 102, 1976-1983 (2009).
- Evans, C. G., Ludwar, B. C. h, Askansas, J., Cropper, E. C. Effect of holding potential on the dynamics of homosynaptic facilitation. J. Neurosci. 31, 11039-11043 (2011).
- Haugland, R. P. The Handbook. , 10th edition, Invitrogen. (2005).
- Borovikov, D., Evans, C. G., Jing, J., Rosen, S. C., Cropper, E. C. A proprioceptive role for an exteroceptive mechanoafferent neuron in Aplysia. J. Neurosci. 20, 1990-2002 (2000).
- Goldberg, J. H., Yuste, R. Chapter 38: A practical guide: Two-photon calcium imaging of spines and dendrites. Imaging in Neuroscience and Development. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor, NY. (2005).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon