Method Article
Utilisation de scanners à plat pour collecter haute résolution temps-caduque Images de la réponse gravitropique Arabidopsis racine
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit un procédé pour la collecte rapide d'images de jeunes plants d'Arabidopsis répondant à un stimulus de gravité en utilisant des scanners à plat disponibles dans le commerce. La méthode permet de peu coûteuse, la capture de gros volumes d'images haute résolution qui se prêtent à des algorithmes d'analyse en aval.
Résumé
Les efforts de recherche en biologie exigent de plus en plus recours à des méthodes qui permettent la collecte de gros volumes de données à haute résolution. Un défi laboratoires peuvent faire face est le développement et la réalisation de ces méthodes. Observation des phénotypes dans un processus d'intérêt est un objectif typique des laboratoires de recherche qui étudient la fonction des gènes et ce qui est souvent atteint par la capture d'image. Un procédé particulier qui se prête à l'observation à l'aide des approches d'imagerie est la croissance d'une racine de correction des semis qui ont été déplacés à partir de l'alignement avec le vecteur de gravité. plates-formes d'imagerie utilisées pour mesurer la réponse de gravitropique racine peuvent être coûteux, relativement faible en débit et / ou de main-d'œuvre. Ces questions ont été abordées par le développement d'une méthode de capture d'image à haut débit en utilisant peu coûteux, mais de haute résolution, les scanners à plat. En utilisant cette méthode, les images peuvent être capturées toutes les quelques minutes à 4800 dpi. La configuration actuelle permet la collecte de 216 r individuelleesponses par jour. Les données d'image recueillies sont de grand qualité pour les applications d'analyse d'image.
Introduction
Collecte de données phénotypiques haute résolution est utile dans les études visant à comprendre l'interaction entre la génétique et l'environnement dans la médiation de la fonction organismal 1,2. Les études de cette nature sont aussi intrinsèquement grande échelle, ce qui rend plus nécessaire que les méthodes employées pour mesurer les phénotypes dans ce contexte être riches en débit de 3,4. Dans l'établissement de méthodes de recherche phénomique échelle, compromis entre le débit et la résolution entrent en jeu. Les méthodes qui sont plus élevés en débit ont également tendance à être plus faible dans la résolution, ce qui rend plus difficile la détection de petits effets de la génétique ou de l'environnement 5. Alternativement, les méthodes qui mesurent plus attentivement un phénotype souhaité ont également tendance à être plus faible dans le débit, ce qui rend difficile de sonder les effets génétiques et environnementaux au sens large. En outre, les méthodes manuelles pour les phénotypes de quantifier, y compris l'inspection visuelle, peuvent être sujettes à des variations en raison des différences par l'hommeception 6.
Les technologies d'imagerie peuvent fournir une passerelle utile entre le débit et la résolution pour obtenir des observations phénotypiques 7-9. En général, une image est relativement facile à saisir, ce qui facilite le débit, et lorsqu'ils sont pris avec une résolution suffisante, les phénotypes peuvent être détectés subtiles 1,2,7. Les technologies d'imagerie ont tendance à être modifiables pour s'adapter à un système ou d'un processus d'intérêt et sont généralement évolutive 10-12. Pour cette raison, les technologies d'imagerie sont idéales pour le développement des études à grande échelle de la fonction organismal.
La réponse de la racine primaire à un stimulus de la gravité est un processus physiologique complexe qui se produit dans un organe morphologiquement simple. La réponse implique l'activation des voies qui se propagent à travers l'organe de racine et sa progression est déterminée par des facteurs génétiques et environnementaux, y compris les facteurs génétiques influencées par l'environnement 12-14 signalisation . La réponse de la racine primaire à un stimulus de gravité a été étudié au moins depuis Darwin, mais il ya beaucoup à apprendre sur la façon dont il fonctionne, en particulier dans les événements de signalisation précoces et dans les facteurs de médiation réponse plasticité 12,14,15. Acquérir une compréhension détaillée de la dynamique de cette réponse est important de trouver des façons d'améliorer la capacité des plants à devenir établi avec succès dans un environnement donné 16. En outre, la forme de la racine, il est prête pour les applications de traitement d'image 8,12,17. Dans l'ensemble, la racine réponse gravitropique est un système idéal pour le développement de la technologie d'imagerie à haut débit dans le but de mener des études de génomique niveau de la fonction organismal.
Dans ce rapport, un haut débit, la méthode à haute résolution pour la capture d'image de la réponse de gravitropique racine en utilisant peu coûteux, les scanners à plat disponibles dans le commerce est présenté. La vue d'ensemble de laprotocole est représentée sur la figure 1. Les semis plantés sur des plaques de gélose ont été positionnés sur les scanners à plat orientées verticalement équipés de supports personnalisés en plexiglas de la plaque. Les images ont été recueillies toutes les quelques minutes à 4800 dpi et sauvegardés sur un disque local ou un serveur de données. Métadonnées associées à chaque série d'image sont stockées sur une base de données et les images stockées sont traitées. L'approche utilise le logiciel VueScan pour la capture d'image. VueScan peut être utilisé pour exécuter plus de 2100 scanners différents sur Windows, Mac ou Linux (voir le tableau des matériaux). Une résolution du scanner de 4800 dpi a été utilisé dans cette application pour correspondre à la résolution obtenue dans des études antérieures utilisant des caméras CCD fixes 1,8,12. La flexibilité du logiciel VueScan avec l'interface commune qu'il utilise pour n'importe quel scanner il fonctionne permet aux utilisateurs d'adopter facilement pratiquement n'importe quel matériel de numérisation de la résolution suffisante pour le protocole présenté dans cet article. Le débit de courant permet la collecte d'216 réponses individuelles par jour. La technologie est adaptable et évolutif pour une utilisation dans des établissements allant des écoles secondaires aux universités de recherche. En outre, les images recueillies sont d'une qualité suffisante pour les applications d'analyse d'image.
Protocole
Une. Image Acquisition Protocole
Considérations:
Ce protocole est le plus efficacement réalisée avec deux personnes, mais il est possible pour chacun de travailler seul. Le dispositif fonctionne le mieux dans ce laboratoire était pour une personne pour préparer des plaques pour la numérisation tout autre travaille sur la configuration du scanner, puis les deux travaillent ensemble pour placer les plaques dans les scanners et commencer le processus de numérisation.
Il est également important de noter que les scanners de ce projet sont orientées verticalement avec les couvercles de scanner reposant sur le dos du scanner. Un support personnalisé a été fait pour tenir plats dans cette position verticale et a été apposée sur la surface à plat avec des bandes de commande 3M (figure 2). Le couvercle de document amovible qui vient avec le scanner utilisé dans ce protocole (un Epson V700) était bordée d'un côté de feutre noir. Le couvercle de document a été placé contre la vitre d'exposition avec un cordon élastique àmaintenir les plaques en place et de fournir un contraste d'image (Figure 3).
N'importe quel scanner de résolution suffisante pourrait être utilisé pour la capture d'image. L'Epson Perfection V700 a été choisi en raison de son profil carré (le rendant facile à positionner verticalement), sa haute résolution et les options supplémentaires pour numériser à partir de la fois le lit et le couvercle et d'utiliser le canal infrarouge. Ces options supplémentaires n'ont pas été utilisés dans ce protocole.
Une fois que les plaques ont été retirées de la chambre de croissance, il est impératif que le protocole de continuer jusqu'à la fin.
Préparation de la plaque
Des boîtes de Pétri standard contenant 10 ml de milieu transparent et 9 graines plantées à travers le milieu de chaque plaque ont été utilisées. Procédures pour l'étiquetage de la plaque, la préparation des milieux et la plantation peut être trouvé à: http://www.doane.edu/doane-phytomorph
- Récupérer la première plaque de gélose et absorber la condensation collectées sur le couvercle et rebord du couvercle de la plaque de gélose avec un Kimwipe.
- Appliquer Triton X-100 (un détergent) à couvercle avec un Kimwipe - être généreux.
(Notez que le Triton X-100 permet d'éviter l'accumulation de condensation sur le couvercle de la plaque est balayée. Une application généreuse (assez pour créer un film sur la surface du couvercle) aidera à s'assurer que le couvercle reste transparente tout au long du cycle de scanner .) - Envelopper la plaque avec la bande de micropores pour fixer le couvercle, et pour permettre la ventilation.
Configuration du scanner et de l'image Collection
Ce protocole suppose que plus de 1 scanner est utilisé, et fournit des instructions pour démarrer plusieurs scanners à partir d'un seul ordinateur.
- Créer des dossiers pour stocker des images de chaque scanner. Chaque scanner tiendra deux plaques, donc gardez cela à l'esprit lors de la création de dossiers. Unpourraient choisir d'utiliser les métadonnées comme des composantes du nom de fichier tels que des identifiants uniques pour chaque plaque, l'âge de semis, la taille des graines, et les ID des stocks plantés. Un exemple d'un nom de dossier utilisé dans la collecte de données contenant les métadonnées est "1652-2-sm-9-92-17-1653-2-lg-88-79-161".
- Fixer des minuteries de sortie pour le temps de perception désigné (9 h a été utilisé dans ce laboratoire). Assurez-vous de mettre de temps (une heure ou deux) pour la préparation.
(Notez que les scanners doivent être branchés dans les minuteries de sortie afin de régler le temps d'acquisition. Bien que le logiciel VueScan permet à un utilisateur de recueillir des images à plusieurs reprises, il ne permet pas à l'utilisateur d'indiquer le nombre d'images à recueillir ou combien de temps pour recueillir des images pour .) - Tourner sur le premier scanner et attendre environ 10 secondes pour le scanner de passer par ses initiales échauffement.
- Ouvrez le programme VueScan fois. Version VueScan 9.0.20 a été utilisé dans ce protocole (voir le tableau des matériaux), bien que les versions plus récentes peuvent être utilisés avec peu de modification. Assurez-vous que le bouton «Plus» a été appuyé sur le panneau inférieur de l'interface utilisateur afin d'afficher les options de menu décrites ci-dessous.
- Définissez la répétition automatique: zone de liste déroulante à aucun sous l'onglet d'entrée et sous l'onglet culture indiquée zone de prévisualisation: Maximum (Figure 4). Appuyez sur "Aperçu".
- Créer une zone de culture qui engloberait la région d'intérêt en utilisant la souris pour cliquer et faire glisser à travers la région d'intérêt sur l'image d'aperçu. Les paramètres peuvent être modifiés pour la région d'intérêt dans l'onglet des cultures. Les réglages typiques utilisés pour la boîte de culture étaient: décalage x 0,675; décalage y 1.924 en, si cela a été ajustée pour capturer la zone de semis pour chaque scanner. La taille de la boîte de culture utilisé était 7.246 en large par 1,1 en haut (figure 5).
- Pour déplacer la zone de recadrage, maintenez la touche Maj enfoncée tout en faisant glisser avec la souris. Assurez-vous que la boîte de culture contient tous les plants à analyser ainsi que toutes les métadonnées souhaitée pouvant figurer sur une étiquette (Figure 5).
- Sous l'onglet de la culture, de définir la zone Aperçu: à la boîte de cultures et de la presse de l'Aperçu.
- Allez à l'onglet Sortie et sélectionnez le fichier correct pour le scanner (figure 5).
- Répétez les étapes 1.7 à 1.12 sur tous les scanners pour un ordinateur. Choisissez l'option «oui» lorsqu'on lui a demandé s'il convient d'ouvrir plus d'une instance de VueScan.
- Aller à travers chaque onglet et vérifiez que les paramètres sont corrects. (Notez que toutes les spécifications peuvent être modifiés pour répondre aux besoins d'un laboratoire individuel y compris la couleur de l'image, résolution, etc. Cependant, les paramètres utilisés dans ce protocole peuvent être appliqués directement à la particular balayage matériel d'un laboratoire donné en raison de l'interface commune du logiciel VueScan. Reportez-vous à la liste des spécifications ci-joint pour voir les paramètres utilisés dans ce projet, avec la version 9.0.20 VueScan).
- Sous l'onglet Entrée choisir continu dans la répétition automatique: champ, ou choisir un intervalle plus long entre les images si désiré. L'intervalle de temps est la longueur de temps le scanner s'arrête après l'enregistrement de la dernière image et la perception de l'image suivante début. En mode continu, 3-4 min résolution peut être obtenue à 4800 dpi.
- Répéter les étapes 01.14 à 01.15 pour le reste des scanners reliés à un ordinateur unique.
- Placer les boîtes préparées dans les scanners correctes avec des semis orientées horizontalement (ne pas gravistimulate).
- En placer un noir, feutre fond contre les plaques afin qu'ils ne tombent pas de plexiglas modèle. Répétez l'opération pour tous balayagepartenaires.
(Remarque: Dans ce projet, des morceaux de feutre noir ont été jointes au document couvre fourni avec l'équipement pour éviter l'éblouissement et à offrir un contraste contre le tissu racinaire La couleur de fond spécifique utilisé dépendra de la couleur du tissu imagé.). - Vous avez une personne tourner les plaques à 90 ° (plaques ont été tournés dans le sens antihoraire dans ce protocole) et immédiatement remplacer le fond de feutre.
- L'autre personne doit être debout à l'ordinateur afin qu'ils puissent appuyer immédiatement sur le bouton «Scan».
- Fixez le fond du scanner avec un cordon élastique (figure 3). Vous avez une personne de tenir le fond en place tandis que l'autre positionne le cordon élastique.
(Remarque: Immédiatement après gravistimulation (rotation des plateaux de 90 °) et le placement de l'arrière-plan de feutre, «Scan» doit être enfoncé). - Répétez les étapes 1.17 à 1.21 pour le reste des scanners sur un seul ordier.
- Répétez les étapes 01.06 à 01.22 pour la prochaine série de scanners cas échéant.
- Ne laissez pas les scanners que plusieurs images ont été recueillies pour s'assurer qu'ils économisent correctement.
- Il est idéal pour garder les scanners dans une zone qui sera exempt de perturbations pour le temps de cycle désigné. Il est également prudent de prendre en compte les conditions environnementales dans la zone de balayage pour assurer des réponses phénotypiques idéales.
- Lorsque la collecte des données est terminée, appuyez sur le bouton vert d'abandon sur chaque fenêtre VueScan qui coïncide avec chaque scanner.
- Fermer tous les programmes sur l'ordinateur.
- Redémarrez l'ordinateur et fermez tous les scanners avant de commencer un autre cycle de collecte d'image.
Résultats
Images représentatives
Cette approche permet la production rapide de haute résolution série de temps d'Arabidopsis croissance des semis. Images première et la dernière d'un cycle de scanner sont présentés dans les figures 7A et 7B. Figures 7C et 7D montrent des résultats optimaux à partir de la moitié d'une image complète du scanner. Certaines questions qui peuvent affecter la qualité d'image sont présentés dans les figures 7A et 7B. Ces questions comprennent la variation de la germination, la variation de la trajectoire de croissance des semis au début de la course, et l'accumulation de condensation lors de la numérisation. La condensation peut en grande partie être résolu en augmentant la quantité de Triton X-100 appliqué sur la face intérieure du couvercle de plaque. D'autres facteurs qui pourraient faire obstacle à la collecte de l'image précis sont une mauvaise configuration de la boîte de culture par rapport à la position de la plaque et de positionnement des plaques telles qu'elles sont biaisées par rapport à la zone de recadrage.
Analyse de l'image Application: compression d'image
Une fois une séquence temporelle d'images de scanner a été obtenue, il doit être stocké en toute sécurité d'une manière accessible de réseau pour faciliter l'analyse de l'image. Les fichiers d'image associés à une course de scanner individuel occupent une quantité importante de l'espace disque dur. Un seul fichier TIFF recueillies à 4800 dpi est d'environ 220 Mo et une piste de scanner typique génère 200 fichiers image. Par conséquent, environ 44 Go d'espace disque dur est requise pour l'exécution. Pour réduire les coûts de stockage et de transmission de réseau associés à l'analyse de l'image, il est souhaitable de réduire la quantité d'espace nécessaire pour les données d'image du magasin tout en minimisant en même temps la perte de données. Analyse en aval impliquera l'identification de chaque plant dans des fichiers images suivants associés à un essai expérimental. Par conséquent, la segmentation les semis simples à partir de l'image du scanner peut faciliter l'analyse en aval. Parce que la segmentation de la plantule à partir du reste de the image peut également réduire considérablement le stockage des pixels de fond inutiles, cette approche conduit également à une réduction significative de la taille des données. En outre, si l'analyse en aval est centré sur les tissus des racines, il peut ne pas être nécessaire de conserver des informations de couleurs depuis les racines pixels sont relativement étroites dans leur espace de couleur. Un protocole de traitement d'image de l'ordinateur et du code pour réduire la taille des données à la fois par la segmentation sur des plants individuels et convertir des images en niveaux de gris a été développé. L'approche se traduit par une réduction de 60% des besoins en espace de stockage.
Le flux de travail utilisé pour réaliser cette compression de données est décrit dans les étapes suivantes:
- Commencez par une série de temps de fichiers d'image du scanner dans un seul dossier.
- Pour chaque image, convertir un RVB en niveaux de gris (Figure 8, en haut).
- Diviser l'image en deux moitiés gauche et droite.
- Extrait chaque plant de l'image dans son propre fichier (figure 8).Ceci est réalisé en appliquant un seuil à convertir les pixels en noir ou en blanc et ensuite calculer l'intensité totale des pixels de chaque ligne de l'image. La ligne avec la plus grande intensité est identifié et chaque pixel est classé comme «plante» ou «nonplant» basé sur l'intensité de ses voisins. Le centre de chaque «plante» au sein de cette ligne se trouve et de ce point une boîte de culture d'une taille prédéterminée est établi (Figure 8, en bas).
- Créez un dossier séparé pour chaque côté de l'image (gauche et droite) avec les sous-dossiers séparés pour chaque plant pour le stockage de temps individuel des fichiers d'image de la série.
- Archiver les dossiers résultant dans un fichier compressé ZIP.
Un code qui accomplit ces étapes a été développé en utilisant le langage Python de programmation 20. L'algorithme permet une réduction d'environ 60% de la taille des données et est retenue dans l'ensemble dans l'identification des plants individuels dans 90% de l'imag du scannere fichiers analysés jusqu'ici. Les codes sont disponibles gratuitement pour téléchargement sous la licence GNU General Public License version 3 (voir le tableau des matériaux).
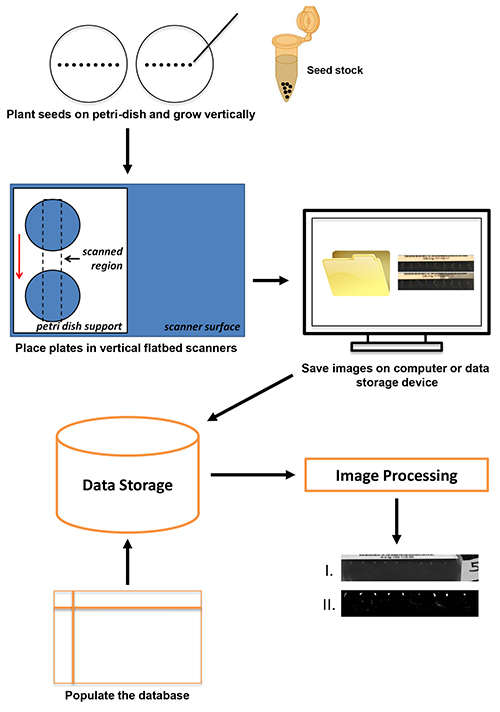
Figure 1. La procédure de numérisation commence avec la plantation de graines (jusqu'à neuf graines d'Arabidopsis par plaque) et se termine avec le stockage de données et de traitement de l'image. Cliquez ici pour agrandir l'image .
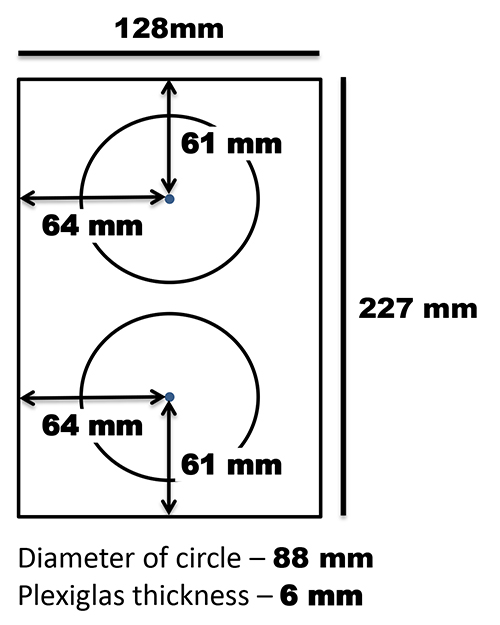
Figure 2. T emplate pour la construction de Petri support de plat. Ple xiglas a été coupé de telle sorte que la largeur correspond le plat (dans ce cas 227 mm) et la longueur est de 128 mm. Deux cercles d'un diamètre de 88 mm ont été découpés de la partie restante de telle sorte qu'ils sont uniformément répartis le long de la largeur et de la longueur du support. Le support est fixé sur le plat avec des bandes de commande 3M. Cliquez ici pour agrandir l'image .

Configuration du scanner Figure 3. Après semis ont été gravistimulated et le couvercle de document placé. C'est la configuration du scanner à l'étape 1.21 de l'installation du scanner et collection d'images."_blank"> Cliquez ici pour agrandir l'image.
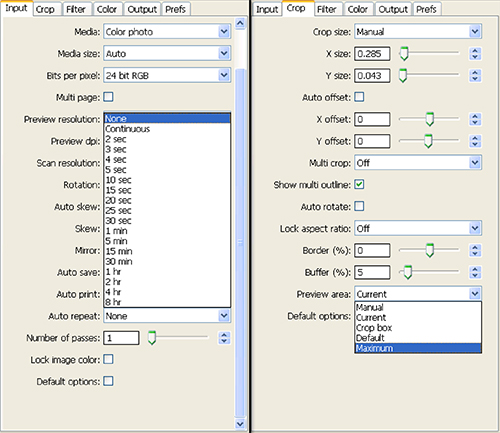
Figure 4. Capture d'écran de paramètres sélectionnés pour l'étape 1.8 de l'installation du scanner et collection d'images. Cliquez ici pour agrandir l'image .

Figure 5. Capture d'écran du logiciel VueScan pendant les étapes 1.9 et 1.10 de l'installation du scanner et Collection de l'image. L'encadré rouge met en évidence l'importance de la récolte alors que la boîte bleue met en évidence les paramètres spécifiques fo r x-et y-offset utilisée afin de capturer les semis et les informations d'étiquette. La région de la vitre d'exposition pour numériser est représenté par une ligne en pointillés dans la zone Aperçu. Cliquez ici pour agrandir l'image .
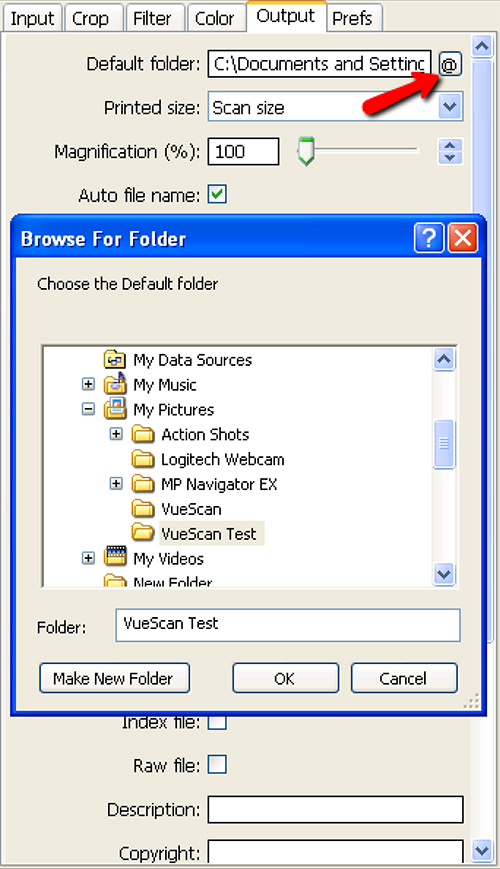
Figure 6. Sélection de dossier de destination pour l'étape 1.12 de l'installation du scanner et Collection de l'image. Appuyez sur la touche @ à côté de la boîte de dialogue de dossier par défaut (flèche rouge) permet à l'utilisateur de sélectionner le dossier de destination approprié. Cliquez ici pour agrandir l'image .
re 7 "fo: contenu width =" 5 po "fo: src =" / files/ftp_upload/50878/50878fig7highres.jpg "src =" / files/ftp_upload/50878/50878fig7.jpg "width =" 600px "/>
Figure 7 (AD). Les images ci-dessus sont des exemples de ceux recueillis à l'aide de la méthode décrite dans le présent document. Panneaux A, B et C, D sont les premières et dernières images, respectivement, à partir d'une seule période de balayage. A, B montrent la pleine zone balayée, tandis que C, D sont une région cultivée de la zone balayée, montrant une seule plaque. Plusieurs incohérences peuvent être observées. Le panneau A montre la variation de la germination et de la trajectoire de croissance. Groupe B (les mêmes plants que l'image A, 9 h plus tard) montre que les plaques peuvent s'accumuler condensation. Les panneaux C et D sont considérés comme de bons résultats en raison de la forte croissance of semis et la qualité d'image tout au long de la course. Cliquez ici pour agrandir l'image .
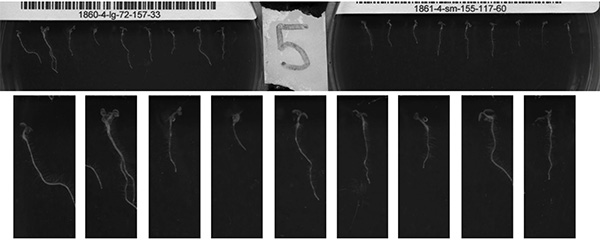
Figure 8. L'algorithme de compression d'image développé convertit une image du scanner de gris (en haut). L'image est divisée en deux moitiés droite et gauche et image frontières sont supprimés (non représenté). Les positions des plants individuels sur chaque moitié sont identifiés par trouver la ligne avec la plus grande intensité de pixels au total. Ces positions sont utilisées pour définir une nouvelle zone de culture, appliquée à tous les semis sur la plaque (en bas). Cliquez ici pour agrandir l'image .
Discussion
Observation phénotypique précise est cruciale pour comprendre les manifestations de la fonction des gènes dans un organisme. Une façon d'acquérir de l'information phénotypique est grâce à la capture de données d'image à haute résolution. La plate-forme scanner développé a permis la collecte de nombreuses images (200 images / période de balayage) à haute résolution (4800 dpi) sur un certain nombre d'heures. En outre, cette plate-forme est facilement adapté à une variété d'environnements de laboratoire et de la classe en raison de la flexibilité du logiciel VueScan à exécuter des milliers de différents scanners utilisant une interface commune 18.
La méthode présentée ici comble un vide en haut débit de capture d'image qui s'étend de grandes installations de phénotypage à grande échelle et des systèmes automatisés réalisables dans un seul laboratoire. Les plates-formes à haut débit actuellement disponibles ont tendance à utiliser le matériel d'imagerie spécialisée, y compris les caméras montés sur des supports robotisés, de capturer des images à haute résolution de primarily-dessus des tissus végétaux au sol (par exemple Centre de technologie végétale intégrative et la ScanAlyzer HTS par LemnaTec) 20,21. Systèmes d'imagerie spécialisés à l'aide de rayons X et IRM technologies ont également été développés à l'image ci-dessous tissus au sol avec une résolution remarquable à mesure qu'ils grandissent dans l'environnement du sol (par exemple Centre de technologie végétale intégrative) 11,22,23. Ce développement de la technologie plus spécialisée est généralement au coût de débit, ce qui rend les études phénotypiques dynamiques plus difficile. Surtout, les besoins en matière de coûts et d'infrastructures pour ces plates-formes haut de gamme en font la plupart du temps impossible la mise en œuvre dans les petits laboratoires.
Plates-formes ont également été développés qui utilisent la technologie de capture d'image plus standard et sont bien adaptés à la mesure des réponses dynamiques tels que la réponse de la racine à un stimulus de gravité. Par exemple, les caméras CCD ont été utilisés pour capturer les réponses individuelles des semis à la lumière et de la gravité à hauterésolution spatiale et temporelle 1,8,12. D'autres systèmes ont été développés permettant la mesure de la pointe de la racine orientation des racines multiples à partir d'une seule image (par exemple RootTipMulti par la iPlant Collaboratif) 17,24. Dans le premier cas, le débit est relativement faible, étant donné que seulement une plantule est imagé par chaque caméra à la fois, alors que dans ce dernier cas, le débit est plus élevé, mais généralement au détriment de la résolution.
La procédure décrite dans ce document présente une plate-forme pour capturer des images haute résolution en haut débit avec des équipements et des logiciels qui sont facilement disponibles et relativement abordable. En utilisant cette configuration, 1080 réponses individuelles profondes peuvent être collectées chaque semaine dans un seul laboratoire équipé d'une banque de six scanners. En 15 mois de collecte une moyenne de 864 réponses individuelles par semaine, un total de 41 625 plants ont été numérisés pour une étude de la génomique. Environ 15% des collections individuelles a échoué en raison d'une erreur de configuration, les réseaéchec rk ou dysfonctionnement de l'équipement. Un autre réponses 22% ont échoué en raison de l'absence de germination ou la croissance des racines insuffisante pour provoquer une réponse de croissance. L'ensemble de données final est constitué de 27 475 réponses individuelles de semis à un stimulus de gravité de 163 lignées recombinantes ainsi que 99 lignes isogéniques. Les données ont été recueillies dans un seul laboratoire, ce qui en fait une approche très haut débit. Même étant donné que le matériel utilisé pour l'acquisition est relativement peu coûteux, il a fonctionné de manière fiable depuis plus de deux ans, même avec un usage intensif.
Bien que ce protocole a été très utile pour les objectifs de recherche de ce groupe, certaines limitations existent toujours. Parce que du débit d'environ 50 Go de données d'image non compressées par jour, il était évident qu'une grande quantité d'espace est nécessaire pour des images de la maison, sauf si les systèmes de compression efficaces pourraient être développés. Le problème de stockage a été temporairement résolu par l'achat de disques durs externes pour chaque ordinateur. En outre, les deux 1Dispositifs de stockage de réseaux associés 0 de la tuberculose ont été achetés. Plus tard, les algorithmes de compression ont été développés, comme décrit ci-dessus, ce qui peut aider à réduire la taille des données d'un maximum de 60% (figure 8). Il est important de noter que la vitesse à laquelle les données peuvent être enregistrées dans un dispositif de stockage associé au réseau est dépendante de la vitesse de la connexion de réseau. systèmes de compression ont également été limitée en raison de la volonté d'empêcher la perte de données d'image.
Autres limitations spécifiques à un système d'imagerie par balayage électronique sont également envisagées. Par exemple, dans une approche fondée scanner plants sont exposés à la lumière de haute intensité dans les plages blanches et potentiellement infrarouges pendant chaque balayage. Cela affecte probablement la croissance des semis, mais les semis peuvent encore être observées à subir des réponses solides à un stimulus de gravité (figure 7). Une amélioration future pourrait impliquer que seuls ces scanners LED infrarouges sont actifs programmation. Une zone en développemen actift est la création d'algorithmes d'analyse adaptée à la résolution et le débit de ces données d'image. Le grand ensemble de données généré à l'aide de cette méthode basée scanner a été idéal pour le développement d'outils robustes pour phénotypage à haut débit d'images de semis. L'algorithme de compression utilisé sur ces images montrées à la figure 7 prend en charge l'affirmation selon laquelle ils se prêtent à des applications d'analyse d'images. En outre, les images générées peuvent être analysées par l'algorithme précédemment publiées, RootTrace 17,24, s'ils sont recueillis à une résolution plus faible (moins de 1 200 points par pouce), et les semis individuels sont segmentés à partir de l'image en utilisant l'algorithme de compression décrit ci-dessus avant l'analyse. données sur la croissance des racines pourraient être extraites des images réduites à 1200 dpi tandis que les données d'angle de pointe pourraient être extraites des images réduites à 900 dpi (observation non publiée).
La procédure décrite dans le présent document s'inscrit dans sa propre niche dans le monde de root imagerie en ce qu'il est à haut débit et haute résolution tout en restant relativement abordable. Un avantage supplémentaire de cette approche est qu'il peut facilement être personnalisé pour répondre aux besoins d'imagerie d'un groupe de recherche particulier.
Déclarations de divulgation
Les auteurs déclarent qu'ils n'ont aucun intérêt financier concurrents.
Remerciements
Ce travail a été financé par une subvention de la National Science Foundation (numéro d'attribution IOS-1031416) et a été menée en collaboration avec Nathan Miller, Logan Johnson et Edgar Spalding de l'Université du Wisconsin et Brian Bockelman, Carl Lundstedt et David Swanson de la Université de Hollande Centre de Calcul du Nebraska.
matériels
| Name | Company | Catalog Number | Comments |
| Epson Perfection V700 Photo Scanners | Epson | B11B178011 | - |
| Plexiglas Scanner Template | - | - | Custom made. See Figure 2. |
| Smart Strap Bungee Cords | SmartStraps | Wal-Mart 1079478 | |
| Brinks Digital Outdoor Timers | Brinks | Wal-Mart 42-1014-2 | |
| VueScan Software | Hamrick Software | http://www.hamrick.com | |
| Segmentation Software | Chris Wentworth, Doane College | https://sites.google.com/a/doane.edu/compphy-doane/projects/root-gravitropism/image-segmentation | |
| 3M Micropore Tape | Fisher Scientific | 19-061-655 | - |
| Holding racks | - | - | Custom made by gluing two cookie racks together. |
Références
- Miller, N. D., Brooks, T. L. D., Assadi, A. H., Spalding, E. P. Detection of a gravitropism phenotype in glutamate receptor-like 3.3 mutants of Arabidopsis thaliana using machine vision and computation. Genetics. 186, 585-593 (2010).
- Clack, N. G. Automated Tracking of Whiskers in Videos of Head Fixed Rodents. PLoS Comp. Biol. 8, (2012).
- Lussier, Y. A., Liu, Y. Computational approaches to phenotyping: high-throughput phenomics. Proc. Am. Thoracic Soc. 4, 18-25 (2007).
- Houle, D. Colloquium Paper: Numbering the hairs on our heads: The shared challenge and promise of phenomics. Proc. Natl. Acad. Sci. U.S.A. 107, 1793-1799 (2009).
- Elwell, A. L., Gronwall, D. S., Miller, N. D., Spalding, E. P., L, T. D. B. Separating parental environment from seed size effects on next generation growth and development in Arabidopsis. Plant Cell Env. 34, 291-301 (2011).
- Silk, W. K. Quantitative Descriptions of Development. Ann. Rev. Plant Physiol. 35, 479-518 (1984).
- Cronin, C. J., Feng, Z., Schafer, W. R. Automated imaging of C. elegans behavior. Methods Mol. Biol. 351, 241-251 (2006).
- Miller, N. D., Parks, B. M., Spalding, E. P. Computer-vision analysis of seedling responses to light and gravity. Plant J. 52, 374-381 (2007).
- Iyer-Pascuzzi, A. S. Imaging and Analysis Platform for Automatic Phenotyping and Trait Ranking of Plant Root Systems. Plant Physiol. 152, 1148-1157 (2010).
- Houle, D., Mezey, J., Galpern, P., Carter, A. Automated measurement of Drosophila wings. BMC Evol. Biol. 3, 25 (2003).
- Jahnke, S. Combined MRI-PET dissects dynamic changes in plant structures and functions. Plant J. 59, 634-644 (2009).
- Durham Brooks, T. L., Miller, N. D., Spalding, E. P. Plasticity of Arabidopsis Root Gravitropism throughout a Multidimensional Condition Space Quantified by Automated Image Analysis. Plant Physiol. 152, 206-216 (2010).
- Perrin, R. M. Gravity signal transduction in primary roots. Ann. Botany. 96, 737-743 (2005).
- Strohm, A. K., Baldwin, K. L., Masson, P. H. Molecular mechanisms of root gravity sensing and signal transduction. Dev. Biol. 1, 276-285 (2012).
- Harrison, B. R., Masson, P. H. ARL2, ARG1 and PIN3 define a gravity signal transduction pathway in root statocytes. Plant J. 53, 380-392 (2007).
- Swarup, R., Bennett, M. J., Beeckman, T. . Root Development. , 157-174 .
- French, A., Ubeda-Tomás, S., Holman, T. J., Bennett, M. J., Pridmore, T. High-throughput quantification of root growth using a novel image-analysis tool. Plant Physiol. 150, 1784-1795 (2009).
- Granier, C. PHENOPSIS, an automated platform for reproducible phenotyping of plant responses to soil water deficit in Arabidopsis thaliana permitted the identification of an accession with low sensitivity to soil water deficit. New Phytol. , 169-623 (2006).
- Walter, A. Dynamics of seedling growth acclimation towards altered light conditions can be quantified via GROWSCREEN: a setup and procedure designed for rapid optical phenotyping of different plant species. New Phytol. 174, 447-455 (2007).
- Gregory, P. J. Non-invasive imaging of roots with high resolution X-ray micro-tomography. Plant Soil. , 255-351 (2003).
- Pierret, A., Kirby, M., Moran, C. Simultaneous X-ray imaging of plant root growth and water uptake in thin-slab systems. Plant Soil. 255, 361-373 (2003).
- Naeem, A., French, A. P., Wells, D. M., Pridmore, T. P. High-throughput feature counting and measurement of roots. Bioinformatics. 27, 1337-1338 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon