Method Article
Utilizzo di Scanner Flatbed per la raccolta ad alta risoluzione e ritardi Immagini della Arabidopsis Root gravitropica risposta
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive un procedimento per la rapida raccolta di immagini di piantine di Arabidopsis rispondono ad uno stimolo gravità utilizzando commercialmente disponibili scanner piani. Il metodo consente di poco costoso, ad alto volume cattura di immagini ad alta risoluzione possono essere sindacate per algoritmi di analisi a valle.
Abstract
Gli sforzi della ricerca nel campo della biologia sempre più richiedono l'uso di metodologie che consentano la raccolta di grandi quantità di dati ad alta risoluzione. Una sfida laboratori possano affrontare è lo sviluppo e il raggiungimento di questi metodi. L'osservazione di fenotipi in un processo di interesse è un obiettivo tipico di laboratori di ricerca che studiano la funzione del gene e questo è spesso raggiunto attraverso l'acquisizione di immagini. Un processo particolare che è suscettibile di osservazione utilizzando approcci di imaging è la crescita correttivo di una radice piantina che è stato spostato dal allineamento con il vettore gravità. Piattaforme di imaging utilizzate per misurare la risposta della radice gravitropica può essere costoso, relativamente basso throughput, e / o alta intensità di manodopera. Questi problemi sono stati affrontati con lo sviluppo di un metodo di cattura delle immagini ad alta velocità utilizzando poco costoso, ma ad alta risoluzione, scanner piani. Utilizzando questo metodo, le immagini possono essere catturate ogni pochi minuti a 4.800 dpi. La configurazione attuale consente la raccolta di 216 r individualeesponses al giorno. I dati di immagine raccolti sono di ampia qualità per le applicazioni di analisi delle immagini.
Introduzione
Raccolta dei dati fenotipici ad alta risoluzione è utile in studi che mirano a capire l'interazione della genetica e dell'ambiente nel mediare funzione organismal 1,2. Studi di questo tipo sono anche intrinsecamente dimensioni elevate, rendendo inoltre necessario che i metodi utilizzati per misurare fenotipi in questo contesto, essere ad alto rendimento 3,4. Nello stabilire i metodi per la ricerca fenomica scala, compromessi tra velocità e risoluzione entrano in gioco. I metodi che sono più alti in velocità tendono anche ad essere più bassi nella risoluzione, il che rende più difficile individuare i piccoli effetti della genetica o dell'ambiente 5. In alternativa, i metodi che misurano più attentamente un fenotipo desiderato tendono anche ad essere più basso throughput, il che rende difficile per il rilievo degli effetti genetici e ambientali in senso lato. Inoltre, i metodi manuali per fenotipi quantificare, anche visivo, possono essere soggetti a variazioni dovute a differenze di ogni umanapercezione 6.
Le tecnologie di imaging in grado di fornire un ponte utile tra throughput e la risoluzione per ottenere osservazioni fenotipiche 7-9. In generale, un'immagine è relativamente facile da catturare, facilitando il throughput, e quando prese a risoluzione sufficiente, fenotipi possono essere avvertiti 1,2,7. Tecnologie di imaging tendono ad essere modificabili per adattarsi a un sistema o un processo di interesse e sono generalmente scalabili 10-12. A causa di questo, tecnologie di imaging sono ideali per lo sviluppo di studi su larga scala della funzione organismal.
La risposta della radice primaria ad uno stimolo gravità è un processo fisiologico complesso che si verifica all'interno di un organo morfologicamente semplice. La risposta comporta l'attivazione delle vie di segnalazione che si propagano attraverso l'organo principale e la sua progressione è determinata da fattori ambientali e genetici, tra cui fattori genetici influenzate dall'ambiente 12-14 . La risposta della radice primaria ad uno stimolo gravità è stato studiato almeno dal Darwin, eppure c'è molto da imparare su come funziona, soprattutto negli eventi di segnalazione precoce e nei fattori che mediano la risposta plasticità 12,14,15. Acquisire una conoscenza dettagliata delle dinamiche di questa risposta è importante nella ricerca di modi per migliorare la capacità di piantine di diventare con successo stabilita in un dato ambiente 16. Inoltre, la forma della radice rende suscettibile di applicazioni di elaborazione immagini 8,12,17. Presi insieme, la risposta gravitropica radice è un sistema ideale per lo sviluppo della tecnologia di imaging ad alta velocità al fine di condurre studi genomica livello della funzione organismal.
In questo rapporto, un high-throughput, il metodo ad alta risoluzione per la cattura di immagini della risposta della radice gravitropica utilizzando poco costoso, disponibili in commercio scanner piani è presentato. La panoramica dellaprotocollo è mostrato in Figura 1. Piantine piantate su piastre di agar sono stati posizionati su scanner piani verticali orientati dotati di supporti in plexiglass personalizzati piastra. Le immagini sono state raccolte ogni pochi minuti a 4.800 dpi e salvati su un disco locale o server di dati. Metadati associati ad ogni immagine serie è memorizzato in un database e le immagini memorizzate vengono elaborati. L'approccio utilizza il software VueScan per la cattura delle immagini. VueScan può essere utilizzato per eseguire oltre 2.100 scanner differenti su Windows, Mac o sistemi operativi Linux (vedi Materiali Tavolo). Una risoluzione di scansione di 4.800 dpi è stato utilizzato in questa applicazione per corrispondere alla risoluzione ottenuta in studi precedenti utilizzando telecamere CCD fisse 1,8,12. La flessibilità del software VueScan insieme con l'interfaccia comune utilizza per qualsiasi scanner corre permette di adottare prontamente qualsiasi hardware scanner di risoluzione sufficiente al protocollo presentato in questo documento. Velocità attuale consente la raccolta di216 risposte individuali al giorno. La tecnologia è adattabile e scalabile per l'uso a istituzioni che vanno da scuole superiori per ricercare università. Inoltre, le immagini raccolte sono di qualità sufficiente per le applicazioni di analisi di immagine.
Protocollo
1. Acquisizione di immagini di protocollo
Considerazioni:
Questo protocollo è più efficacemente eseguita con due persone, anche se è possibile per uno a lavorare da solo. L'accordo di lavoro migliore in questo laboratorio è stato per una persona per preparare le lastre per la scansione, mentre un altro opere di installazione dello scanner, poi entrambi lavorano insieme per mettere piastre scanner e avviare il processo di scansione.
E 'anche importante notare che gli scanner in questo progetto sono orientati verticalmente con i coperchi scanner appoggiato sul retro dello scanner. Un supporto personalizzato è stato fatto per tenere i piatti in posizione verticale e questa è stata apposta alla superficie piana con strisce 3M comando (Figura 2). Il coperchio rimovibile documento che viene fornito con lo scanner utilizzato in questo protocollo (un Epson V700) è stato rivestito su un lato con feltro nero. Il coperchio documento è stato posizionato contro la lastra piana con una corda elastica atenere le piastre in posizione e per fornire contrasto dell'immagine (Figura 3).
Ogni scanner di risoluzione sufficiente potrebbe essere utilizzato per la cattura delle immagini. L'Epson Perfection V700 è stato scelto a causa del suo profilo quadrato (rendendo più facile il posizionamento in verticale), la sua alta risoluzione, e le opzioni aggiuntive per la scansione dal sia il letto e il coperchio e di utilizzare il canale infrarosso. Queste opzioni aggiuntive non sono stati utilizzati in questo protocollo.
Una volta che le piastre sono state rimosse dalla camera di crescita, è indispensabile che il protocollo proseguire fino alla fine.
Piatto Preparazione
Sono stati utilizzati piatti standard Petri contenenti 10 ml di mezzo trasparente e 9 semi piantati in tutto il centro di ogni piatto. Procedure per l'etichettatura piatto, la preparazione dei media e le piantine sono disponibili all'indirizzo: http://www.doane.edu/doane-phytomorph
- recuperare la prima piastra di agar e assorbo raccolta condensa sul coperchio e il bordo del coperchio della piastra di agar con un Kimwipe.
- Applicare Triton X-100 (detergente) per coperchio con un Kimwipe - essere generosi.
(Si noti che Triton X-100 aiuta a prevenire l'accumulo di condensa sul coperchio della piastra viene scansionato. Un'applicazione generosa (sufficiente a creare una pellicola sulla superficie del coperchio) consentirà di assicurarsi che il coperchio rimane trasparente durante l'intero periodo scanner .) - Avvolgere la piastra con nastro micropori per fissare il coperchio, e per consentire la ventilazione.
Scanner Setup and Image Collection
Questo protocollo si presuppone che venga utilizzato più di 1 scanner, e fornisce le istruzioni per avviare più scanner da un singolo computer.
- Creare cartelle per la memorizzazione di immagini da ogni scanner. Ogni scanner terrà due piatti, in modo da tenere a mente durante la creazione di cartelle. Unopotrebbe scegliere di utilizzare i metadati come componenti del nome del file come ID univoci per ogni piastra, età piantina, dimensione dei semi, e gli ID delle scorte piantati. Un esempio di un nome di cartella utilizzata nella raccolta di dati contenente questi metadati è "1652-2-sm-9-92-17-1653-2-lg-88-79-161".
- Impostare i timer di uscita per il tempo di raccolta designati (9 ore è stato utilizzato in questo laboratorio). Assicurarsi di impostare il tempo supplementare (un'ora o giù di lì) per la preparazione.
(Si noti che gli scanner devono essere collegati a timer di uscita, al fine di impostare il tempo di acquisizione. Mentre il software VueScan consente all'utente di raccogliere più volte le immagini, non permette all'utente di indicare il numero di immagini per raccogliere o per quanto tempo per raccogliere le immagini per .) - Accendere il primo scanner e attendere circa 10 secondi per la scansione di passare attraverso le sue iniziali warm-up.
- Aprire il programma VueScan una volta. VueScan versione 9.0.20 è stato utilizzato in questo protocollo (vedi Materiali Tavolo), anche se le versioni più recenti, possono essere utilizzati con poca modificzione. Assicurarsi che il pulsante 'Altro' è stato premuto sul pannello inferiore dell'interfaccia utente per visualizzare le opzioni di menu descritte di seguito.
- Impostare la ripetizione automatica: casella a discesa a nessuno nella scheda Input e sotto la scheda Ritaglia area di anteprima set: al massimo (Figura 4). Premere 'Anteprima'.
- Creare una casella di ritaglio che cattura la regione di interesse utilizzando il mouse per fare clic e trascinare tutta la regione di interesse in anteprima. Le impostazioni possono essere modificate per la regione di interesse nella scheda Ritaglia. Le impostazioni tipiche utilizzate per la casella di ritaglio sono stati: x-offset 0.675;-y offset di 1.924 in, anche se questo è stato adeguato per catturare l'area piantina per ogni scanner. La dimensione del riquadro di ritaglio utilizzato è stato 7,246 in larghezza per 1,1 di altezza (figura 5).
- Per spostare la casella di ritaglio, tenere premuto il tasto shift mentre si trascina con il mouse. Assicurarsi che la casella di ritaglio contiene tutte le piantine da sottoporre a scansione più eventuali metadati desideri che potrebbero essere contenute in una etichetta (Figura 5).
- Nella scheda Ritaglia, impostare l'area di anteprima: per box Crop e premere 'Anteprima'.
- Vai alla scheda Output e selezionare il file corretto per lo scanner (Figura 5).
- Ripetere i passaggi 1,7-1,12 su tutti gli scanner per un computer. Scegliere l'opzione 'sì' quando gli viene chiesto se aprire più di una istanza di VueScan.
- Passare attraverso ogni scheda e verificare le impostazioni siano corrette. (Si noti che tutte le specifiche possono essere modificate per soddisfare le esigenze di un singolo laboratorio, tra cui il colore dell'immagine, risoluzione, ecc. Tuttavia, le impostazioni utilizzate in questo protocollo può essere applicato direttamente alla particular scansione hardware di un dato di laboratorio grazie alla interfaccia comune del software VueScan. Consultare l'elenco specifiche allegato per visualizzare i parametri utilizzati in questo progetto, usando VueScan versione 9.0.20).
- Sotto la scheda Input scegliere continuo a ripetere Auto: campo, o scegliere un intervallo di tempo più lungo tra le immagini, se lo si desidera. L'intervallo di tempo è il tempo in cui la scanner ferma dopo aver salvato l'ultima immagine e iniziare la raccolta dell'immagine successiva. In modalità continua, 3-4 risoluzione min sono disponibili presso 4.800 dpi.
- Ripetere i passaggi 1,14-1,15 per il resto degli scanner collegati ad un singolo computer.
- Posizionare le piastre preparate in scanner corretti con piantine orientati orizzontalmente (non gravistimulate).
- Collocare temporaneamente una nera, sentito sfondo contro le piastre in modo che non cadono dal modello in plexiglas. Ripetere l'operazione per tutte le scanpartner.
(Nota: In questo progetto, pezzi neri di feltro sono state allegate al documento copre fornito con l'apparecchiatura per evitare l'abbagliamento e per fornire il contrasto contro il tessuto della radice Il colore di sfondo specifico utilizzato dipenderà dal colore del tessuto che viene ripreso.). - Avere una persona girare le piastre a 90 ° (piastre sono state trasformate in senso antiorario in questo protocollo) e subito sostituire lo sfondo feltro.
- L'altra persona deve essere in piedi al computer in modo da poter premere immediatamente il tasto 'Scan'.
- Fissare lo sfondo allo scanner con una corda elastica (Figura 3). Avere una persona tenere lo sfondo sul posto mentre altre posizioni la corda elastica.
(Nota: Subito dopo gravistimulation (rotazione delle lastre di 90 °) e il posizionamento dello sfondo feltro, 'Scan' deve essere premuto). - Ripetere i passaggi 1,17-1,21 per il resto degli scanner su un singolo computER.
- Ripetere i passaggi 1,6-1,22 per la prossima serie di scanner se applicabile.
- Non lasciare gli scanner fino a diverse immagini sono state raccolte per assicurarsi che stanno salvando correttamente.
- E 'ideale per mantenere gli scanner in una zona che sarà privo di disturbi per il tempo di scansione designato. E 'anche prudente considerare le condizioni ambientali della zona di scansione per garantire risposte fenotipiche ideali.
- Quando la raccolta dei dati è completa, premere il tasto di interruzione verde su ogni finestra VueScan che coincide con ogni scanner.
- Chiudere tutti i programmi sul computer.
- Riavviare il computer e spegnere tutti gli scanner prima di iniziare un altro giro di raccolta di immagini.
Risultati
Immagini rappresentative
Questo approccio consente una rapida produzione di serie temporali ad alta risoluzione di crescita delle piantine di Arabidopsis. Immagini prima e l'ultima di una corsa scanner sono mostrati nelle Figure 7A e 7B. Figure 7C e 7D mostrano risultati ottimali da metà di una immagine a scanner. Alcuni problemi che possono influenzare la qualità delle immagini sono mostrate nelle Figure 7A e 7B. Questi problemi comprendono la variazione in germinazione, variazione piantina traiettoria di crescita all'inizio della corsa, e l'accumulo di condensa durante la scansione. La condensazione può essere ampiamente risolto aumentando la quantità di Triton X-100 applicata all'interno del coperchio piastra. Altri fattori che potrebbero inibire raccolta di immagini accurate sono errata configurazione della casella di ritaglio rispetto alle piastre di posizionamento della piastra di posizionamento in modo che siano sghembo rispetto alla casella di ritaglio.
Image Analysis Applicazione: compressione delle immagini
Una volta ottenuta una sequenza temporale di immagini scanner, deve essere conservato in modo sicuro in modo che siano accessibili rete per facilitare l'analisi dell'immagine. I file di immagine associati a una corsa scanner individuo occupano una notevole quantità di spazio su disco. Un singolo file TIFF raccolti a 4.800 dpi è di circa 220 MB e una tipica corsa scanner genera 200 file di immagine. Pertanto, circa 44 GB di spazio su disco è necessario per corsa. Per ridurre i costi di stoccaggio e di trasmissione di rete associati analisi di immagine è desiderabile ridurre la quantità di spazio necessario alla memorizzazione di dati immagine, mentre allo stesso tempo riducendo al minimo la perdita di dati. Analisi Downstream coinvolgerà l'identificazione di ogni piantina in file di immagini successive associati a una corsa sperimentale. Pertanto, segmentando le singole piantine dall'immagine scanner può facilitare l'analisi a valle. Poiché segmentazione della piantina lontano dal resto del secoloe immagine può anche ridurre significativamente stoccaggio di background inutili pixel, questo approccio comporta anche significativa riduzione delle dimensioni dei dati. Inoltre, se l'analisi a valle è focalizzata sul tessuto radice può non essere necessario conservare informazioni colore dal pixel radice sono relativamente stretta nel loro spazio colore. È stato sviluppato un protocollo di elaborazione delle immagini del computer e il codice per ridurre la dimensione dei dati da entrambi segmentando le singole piantine e conversione di immagini in scala di grigi. L'approccio si traduce in una riduzione del 60% i requisiti di spazio di archiviazione.
Il flusso di lavoro utilizzato per raggiungere questo obiettivo la compressione dei dati è descritta nei seguenti passi:
- Inizia con una serie temporale di file immagine dello scanner in una singola cartella.
- Per ogni immagine, conversione da RGB a scala di grigi (Figura 8, in alto).
- Dividere l'immagine in lati sinistro e destro.
- Estrarre ogni piantina della immagine nel proprio file (Figura 8).Questo viene fatto applicando una soglia per convertire pixel bianco o nero e poi calcolando l'intensità dei pixel totale di ogni riga dell'immagine. La riga con la massima intensità viene identificato e ciascun pixel viene classificato come 'pianta' o 'nonplant' basato sull'intensità dei suoi vicini. Il centro di ogni 'pianta' all'interno di questa riga viene trovato e da quel punto una casella di ritaglio di una dimensione predeterminata viene disegnato (Figura 8, in basso).
- Creare una cartella separata per ogni lato dell'immagine (sinistra e destra) con sottocartelle separate per ogni piantina per la memorizzazione dei file di immagine serie temporali individuale.
- Archiviare le cartelle risultanti in un file ZIP compresso.
Un codice che compie questi passi è stato sviluppato utilizzando il linguaggio di programmazione Python 20. L'algoritmo consente una riduzione di circa il 60% della dimensione dei dati e ha successo in nell'identificare tutte le singole piantine nel 90% del imag scannerfile e analizzati finora. I codici sono liberamente disponibili per il download sotto licenza GNU General Public License 3 (vedi Materiali Tavolo).
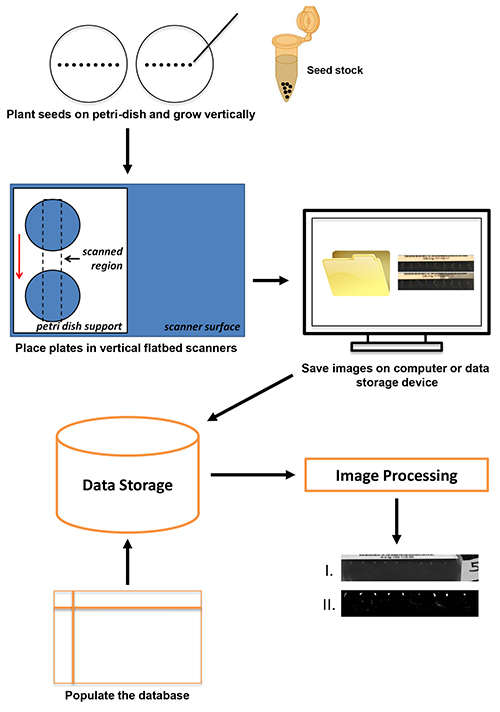
Figura 1. La procedura di scansione inizia con la semina (fino a nove semi di Arabidopsis per piastra) e termina con la memorizzazione dei dati e di elaborazione delle immagini. Clicca qui per vedere l'immagine ingrandita .
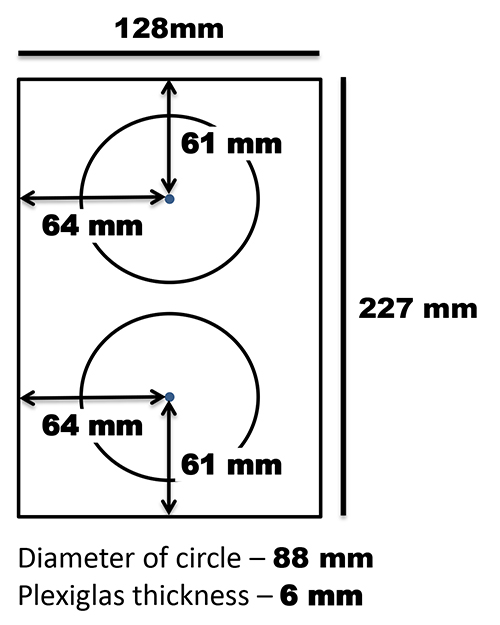
Figura 2. T emplate per la costruzione di un sostegno piastra di Petri. Ple xiglas è stato tagliato in modo tale che la larghezza adatta la lastra piana (in questa causa 227 mm) e la lunghezza era di 128 mm. Due cerchi con diametro 88 millimetri sono stati tagliati fuori dal pezzo rimanente tale che essi sono stati distribuiti uniformemente lungo la larghezza e la lunghezza del supporto. Il sostegno è stato apposto il piano con strisce 3M Command. Clicca qui per vedere l'immagine ingrandita .

Figura 3. Configurazione dello scanner dopo piantine sono state gravistimulated e il coperchio del documento posizionato. Questa è la configurazione dello scanner al punto 1.21 del programma di installazione dello scanner e immagine Collection."_blank"> Clicca qui per vedere l'immagine ingrandita.
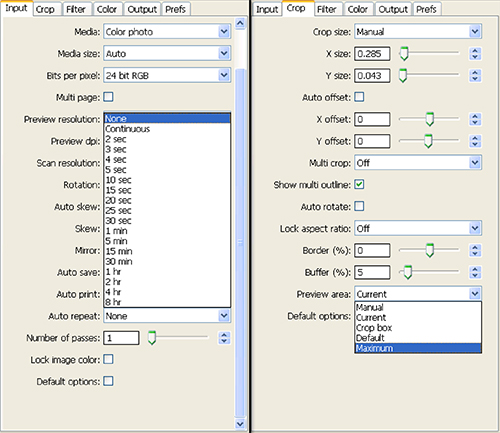
Figura 4. Schermata di impostazioni selezionate per la fase 1.8 del programma di installazione dello scanner e immagine Collection. Clicca qui per vedere l'immagine ingrandita .

Figura 5. Schermata di software VueScan durante le fasi 1.9 e 1.10 del programma di installazione dello scanner e immagine Collection. La scatola rossa evidenzia la dimensione delle colture, mentre la scatola blu evidenzia impostazioni specifiche fo r-x e-y compensare utilizzato per catturare piantine e informazioni di etichetta. La regione del piano da sottoporre a scansione viene visualizzata come una linea tratteggiata nell'area Anteprima. Clicca qui per vedere l'immagine ingrandita .
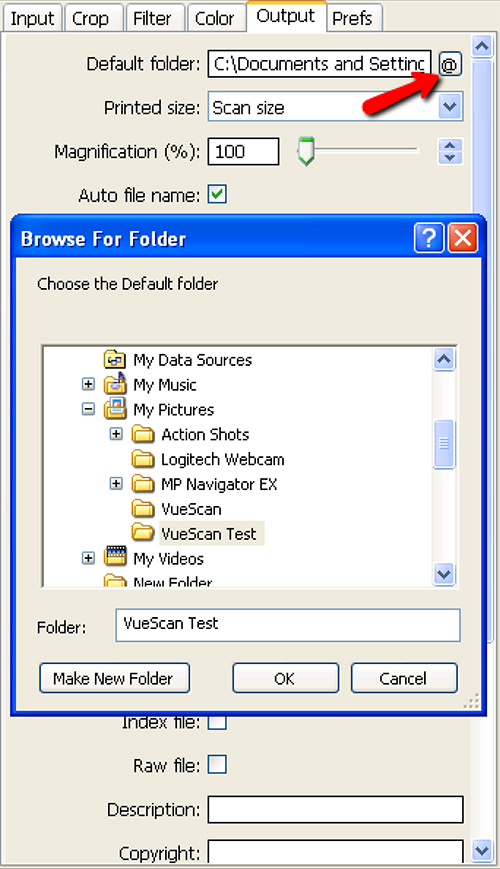
Figura 6. Selezione della cartella di destinazione per passo 1.12 Scanner Setup and Image Collection. Premendo il tasto @ accanto alla finestra di dialogo cartella predefinita (freccia rossa) permette all'utente di selezionare la cartella di destinazione appropriata. Clicca qui per vedere l'immagine ingrandita .
re 7 "fo: content-width =" 5in "fo: src =" / files/ftp_upload/50878/50878fig7highres.jpg "src =" / files/ftp_upload/50878/50878fig7.jpg "width =" 600px "/>
Figura 7 (AD). Le immagini qui sopra sono esempi di quelli raccolti con il metodo descritto in questo documento. Pannelli A, B e C, D sono le prime e finali immagini, rispettivamente, da un singolo periodo di scansione. A, B visualizza piena area di scansione, mentre C, D sono una regione ritagliata dell'area scansionata, mostrando un piatto unico. Una serie di incongruenze possono essere osservati. Pannello A mostra variazione di germinazione e in traiettoria di crescita. Panel B (le stesse piantine come immagine; 9 ore successive) mostra che le piastre possono accumularsi condensa. Pannelli C e D sono considerati buoni risultati a causa della crescita robusta of piantine e qualità d'immagine per tutta la corsa. Clicca qui per vedere l'immagine ingrandita .
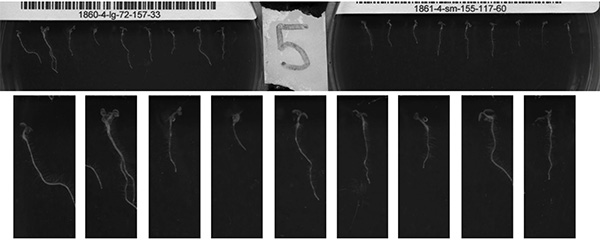
Figura 8. L'algoritmo di compressione immagine sviluppata converte un'immagine scanner in scala di grigi (in alto). L'immagine è divisa in due metà destra e sinistra e bordi dell'immagine vengono rimossi (non mostrato). Le posizioni di piantine individuali su ciascuna metà sono identificati trovando la riga con il maggior intensità totale dei pixel. Tali posizioni sono utilizzate per definire una nuova area di ritaglio, applicato a tutte le piantine sulla piastra (in basso). Clicca qui per vedere l'immagine ingrandita .
Discussione
Osservazione fenotipica accurata è fondamentale per comprendere le manifestazioni della funzione del gene all'interno di un organismo. Un modo per acquisire informazioni fenotipiche è attraverso l'acquisizione dei dati immagine ad alta risoluzione. La piattaforma basata scanner sviluppati ha permesso raccolta di molte immagini (200 immagini / periodo di scansione) ad alta risoluzione (4800 dpi) per un numero di ore. Inoltre, questa piattaforma è facilmente adattato ad una varietà di ambienti di laboratorio e di classe grazie alla flessibilità del software VueScan di eseguire migliaia di diversi scanner utilizzando un'interfaccia comune 18.
Il metodo qui presentato riempie un vuoto nella cattura di immagini ad alta velocità che si estende da grandi impianti di fenotipizzazione scala e sistemi automatizzati implementabili in un unico laboratorio. Le piattaforme high-throughput attualmente disponibili tendono a utilizzare l'hardware di imaging specializzato, comprese le telecamere montate su supporti robotici, per catturare immagini ad alta risoluzione di primarily sopra tessuti vegetali terra (es. Centro per piante Integrative tecnologia e il Scanalyzer HTS da LemnaTec) 20,21. Sistemi di imaging specializzato con l'uso di raggi X e le tecnologie MRI sono stati sviluppati anche per l'immagine qui sotto tessuti terra con notevole risoluzione man mano che crescono nell'ambiente suolo (ad es Centre for Integrative Flora Technology) 11,22,23. Questo sviluppo della tecnologia più specializzata è generalmente al costo della resa, facendo studi fenotipici dinamiche più difficile. È importante sottolineare che le esigenze di costo e di infrastruttura per queste piattaforme di fascia alta li rendono impraticabile soprattutto per l'implementazione nei laboratori più piccoli.
Le piattaforme sono state sviluppate anche che usano la tecnologia di acquisizione delle immagini più standard e ben si adattano alla misura delle risposte dinamici come la risposta principale ad uno stimolo gravità. Ad esempio, telecamere CCD sono stati utilizzati per catturare singole risposte piantine alla luce e gravità ad altoRisoluzione 1,8,12 spaziale e temporale. Altri sistemi sono stati sviluppati consentendo la misurazione dell'orientamento punta della radice di radici multiple da una singola immagine (ad esempio RootTipMulti dal iPlant Collaborative) 17,24. Nel primo caso, la velocità è relativamente bassa dato che solo una piantina viene esposta da ogni telecamera alla volta, mentre nel secondo caso erogato è più alto, ma generalmente a costo di risoluzione.
La procedura descritta in questo documento presenta una piattaforma per catturare immagini ad alta risoluzione in alta velocità con attrezzature e software che sono facilmente disponibili e relativamente abbordabili. Usando questa configurazione, 1.080 risposte radice individuali possono essere raccolti ogni settimana in un unico laboratorio attrezzato con una banca di sei scanner. In 15 mesi di raccolta una media di 864 risposte individuali a settimana, per un totale di 41.625 piantine sono state scannerizzate per uno studio di genomica. Circa il 15% delle singole collezioni riuscita a causa di errore di installazione, GFguasto rk o malfunzionamento. Altre risposte 22% non è riuscito a causa della mancanza di germinazione e crescita delle radici sufficienti per suscitare una risposta di crescita. Il set di dati finale consiste in 27.475 risposte individuali piantina ad uno stimolo gravitazionale da 163 linee consanguinee ricombinanti oltre 99 linee isogeniche vicino. I dati sono stati raccolti in un unico laboratorio, rendendo questo un approccio molto high-throughput. Anche dato che l'attrezzatura utilizzata per l'acquisizione è relativamente poco costoso, ha funzionato in modo affidabile per oltre due anni, anche con un utilizzo intenso.
Anche se questo protocollo è stata molto utile per gli scopi di ricerca di questo gruppo, esistono ancora alcune limitazioni. A causa della velocità di circa 50 GB di dati non compressi al giorno, era evidente che una grande quantità di spazio era necessario per casa immagini meno potrebbero sviluppare schemi di compressione efficace. Il problema di stoccaggio è stato temporaneamente risolto con l'acquisto di hard disk esterni per ogni computer. Inoltre, due 1Dispositivi di archiviazione di rete associati 0 TB sono stati acquistati. Successivamente, sono stati sviluppati algoritmi di compressione, come descritto sopra, che può contribuire a ridurre le dimensioni dei dati fino al 60% (Figura 8). È importante notare che la velocità alla quale i dati possono essere salvati su un dispositivo di memorizzazione associata rete dipende dalla velocità della connessione di rete. Schemi di compressione sono stati costretti a causa del desiderio di prevenire la perdita dei dati di immagine.
Sono inoltre allo studio altre limitazioni specifiche per un sistema di imaging basato su scanner. Ad esempio, in un approccio basato su scanner piantine vengono esposti alla luce ad alta intensità nelle gamme bianchi e potenzialmente infrarossi durante ogni scansione. Questo probabilmente influisce crescita delle piantine, anche se piantine possono ancora essere osservati a subire le risposte esaurienti ad uno stimolo gravità (Figura 7). Un futuro miglioramento potrebbe comportare la programmazione scanner tali che solo i LED infrarossi sono attivi. Un'area in SVILUPPO attivat è la creazione di algoritmi di analisi ben assortiti per la risoluzione e la velocità di questi dati immagine. La grande set di dati generati con questo metodo basato su scanner è ideale per lo sviluppo di strumenti affidabili per high-throughput fenotipizzazione delle immagini piantine. L'algoritmo di compressione impiegato su queste immagini mostrate in Figura 7 supporta l'affermazione che essi sono suscettibili di applicazioni di analisi di immagine. Inoltre, le immagini generate possono essere analizzati dall'algoritmo pubblicato in precedenza, RootTrace 17,24, se sono raccolti a risoluzione più bassa (inferiore a 1.200 dpi), e le singole piantine sono segmentati dall'immagine utilizzando l'algoritmo di compressione sopra descritta prima dell'analisi. Dati di crescita delle radici potrebbero essere estratti dalle immagini ridotte a 1.200 dpi, mentre i dati angolari punta potrebbero essere estratti dalle immagini ridotte a 900 dpi (osservazione inedito).
La procedura descritta in questo documento si inserisce la propria nicchia nel mondo della root imaging che è alta produttività e alta risoluzione, pur essendo relativamente conveniente. Un ulteriore vantaggio di questo approccio è che può essere facilmente adattato per soddisfare le esigenze di imaging di un particolare gruppo di ricerca.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari in competizione.
Riconoscimenti
Questo lavoro è stato finanziato da una sovvenzione da parte del National Science Foundation (numero aggiudicazione IOS-1.031.416) ed è stato condotto in collaborazione con Nathan Miller, Logan Johnson e Edgar Spalding della University of Wisconsin e Brian Bockelman, Carl Lundstedt e David Swanson del University of Holland Computing Center del Nebraska.
Materiali
| Name | Company | Catalog Number | Comments |
| Epson Perfection V700 Photo Scanners | Epson | B11B178011 | - |
| Plexiglas Scanner Template | - | - | Custom made. See Figure 2. |
| Smart Strap Bungee Cords | SmartStraps | Wal-Mart 1079478 | |
| Brinks Digital Outdoor Timers | Brinks | Wal-Mart 42-1014-2 | |
| VueScan Software | Hamrick Software | http://www.hamrick.com | |
| Segmentation Software | Chris Wentworth, Doane College | https://sites.google.com/a/doane.edu/compphy-doane/projects/root-gravitropism/image-segmentation | |
| 3M Micropore Tape | Fisher Scientific | 19-061-655 | - |
| Holding racks | - | - | Custom made by gluing two cookie racks together. |
Riferimenti
- Miller, N. D., Brooks, T. L. D., Assadi, A. H., Spalding, E. P. Detection of a gravitropism phenotype in glutamate receptor-like 3.3 mutants of Arabidopsis thaliana using machine vision and computation. Genetics. 186, 585-593 (2010).
- Clack, N. G. Automated Tracking of Whiskers in Videos of Head Fixed Rodents. PLoS Comp. Biol. 8, (2012).
- Lussier, Y. A., Liu, Y. Computational approaches to phenotyping: high-throughput phenomics. Proc. Am. Thoracic Soc. 4, 18-25 (2007).
- Houle, D. Colloquium Paper: Numbering the hairs on our heads: The shared challenge and promise of phenomics. Proc. Natl. Acad. Sci. U.S.A. 107, 1793-1799 (2009).
- Elwell, A. L., Gronwall, D. S., Miller, N. D., Spalding, E. P., L, T. D. B. Separating parental environment from seed size effects on next generation growth and development in Arabidopsis. Plant Cell Env. 34, 291-301 (2011).
- Silk, W. K. Quantitative Descriptions of Development. Ann. Rev. Plant Physiol. 35, 479-518 (1984).
- Cronin, C. J., Feng, Z., Schafer, W. R. Automated imaging of C. elegans behavior. Methods Mol. Biol. 351, 241-251 (2006).
- Miller, N. D., Parks, B. M., Spalding, E. P. Computer-vision analysis of seedling responses to light and gravity. Plant J. 52, 374-381 (2007).
- Iyer-Pascuzzi, A. S. Imaging and Analysis Platform for Automatic Phenotyping and Trait Ranking of Plant Root Systems. Plant Physiol. 152, 1148-1157 (2010).
- Houle, D., Mezey, J., Galpern, P., Carter, A. Automated measurement of Drosophila wings. BMC Evol. Biol. 3, 25 (2003).
- Jahnke, S. Combined MRI-PET dissects dynamic changes in plant structures and functions. Plant J. 59, 634-644 (2009).
- Durham Brooks, T. L., Miller, N. D., Spalding, E. P. Plasticity of Arabidopsis Root Gravitropism throughout a Multidimensional Condition Space Quantified by Automated Image Analysis. Plant Physiol. 152, 206-216 (2010).
- Perrin, R. M. Gravity signal transduction in primary roots. Ann. Botany. 96, 737-743 (2005).
- Strohm, A. K., Baldwin, K. L., Masson, P. H. Molecular mechanisms of root gravity sensing and signal transduction. Dev. Biol. 1, 276-285 (2012).
- Harrison, B. R., Masson, P. H. ARL2, ARG1 and PIN3 define a gravity signal transduction pathway in root statocytes. Plant J. 53, 380-392 (2007).
- Beeckman, T. Root Development. , Wiley-Blackwell. 157-174 Forthcoming.
- French, A., Ubeda-Tomás, S., Holman, T. J., Bennett, M. J., Pridmore, T. High-throughput quantification of root growth using a novel image-analysis tool. Plant Physiol. 150, 1784-1795 (2009).
- Granier, C. PHENOPSIS, an automated platform for reproducible phenotyping of plant responses to soil water deficit in Arabidopsis thaliana permitted the identification of an accession with low sensitivity to soil water deficit. New Phytol. , 169-623 (2006).
- Walter, A. Dynamics of seedling growth acclimation towards altered light conditions can be quantified via GROWSCREEN: a setup and procedure designed for rapid optical phenotyping of different plant species. New Phytol. 174, 447-455 (2007).
- Gregory, P. J. Non-invasive imaging of roots with high resolution X-ray micro-tomography. Plant Soil. , 255-351 (2003).
- Pierret, A., Kirby, M., Moran, C. Simultaneous X-ray imaging of plant root growth and water uptake in thin-slab systems. Plant Soil. 255, 361-373 (2003).
- Naeem, A., French, A. P., Wells, D. M., Pridmore, T. P. High-throughput feature counting and measurement of roots. Bioinformatics. 27, 1337-1338 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon