Method Article
Expression de protéines recombinantes pour la Biologie Structurale HEK 293F cellules en suspension: une approche nouvelle et accessible
Dans cet article
Résumé
The expression of recombinant proteins by mammalian systems is becoming an attractive method for producing protein complexes for structural biology. Here we present a simple yet highly efficient expression system using suspension grown mammalian cells to purify protein complexes for structural studies.
Résumé
The expression and purification of large amounts of recombinant protein complexes is an essential requirement for structural biology studies. For over two decades, prokaryotic expression systems such as E. coli have dominated the scientific literature over costly and less efficient eukaryotic cell lines. Despite the clear advantage in terms of yields and costs of expressing recombinant proteins in bacteria, the absence of specific co-factors, chaperones and post-translational modifications may cause loss of function, mis-folding and can disrupt protein-protein interactions of certain eukaryotic multi-subunit complexes, surface receptors and secreted proteins. The use of mammalian cell expression systems can address these drawbacks since they provide a eukaryotic expression environment. However, low protein yields and high costs of such methods have until recently limited their use for structural biology. Here we describe a simple and accessible method for expressing and purifying milligram quantities of protein by performing transient transfections of suspension grown HEK (Human Embryonic Kidney) 293F cells.
Introduction
Les progrès rapides de la biologie cellulaire et moléculaire et le besoin constant de médicaments améliorés en médecine a créé un besoin pour les biologistes structurels à regarder structures de protéines de plus en plus complexes. Ceux-ci peuvent souvent exiger notamment des modifications post-traductionnelles, chaperons moléculaires et des co-facteurs pour soutenir leur repliement complexe et l'activité enzymatique. Alors que la grande majorité des structures présentes dans la Protein Data Bank ont été obtenus en utilisant des systèmes d'expression bactériens, les procaryotes sont incapables de réaliser un grand nombre de ces modifications et n'ont pas beaucoup de co-facteurs essentiels eucaryotes. Cela peut être un problème pour l'étude de grands complexes multi-sous-unités qui sont activés par de petites molécules de signalisation, ainsi que pour le nucléaire, la surface cellulaire et les protéines sécrétées qui nécessitent mécanismes de pliage élaborés. Un certain nombre de E. souches de E. coli ont été conçues pour surmonter certaines de ces limitations 1. Ces dernières années, cependant, l'utilisation de msystèmes d'expression ammalian n'a cessé d'augmenter, car ils produisent de manière fiable des protéines eucaryotes qui sont par ailleurs problématique pour exprimer dans d'autres systèmes 2. Aujourd'hui, il est possible d'obtenir des lignées de cellules d'expression de mammifère stables et transitoires par une variété de techniques qui vont de la transduction virale de la transfection médiée par des produits chimiques, de transfert de gène physiques telles que l'électroporation et l'injection directe 3. Bien que toutes ces méthodes ont leur propre ensemble d'avantages et les inconvénients, seuls quelques-uns d'entre eux sont adaptés pour des études structurales étant soit trop cher et / ou de temps.
Nous décrivons ici une méthode très simple, rapide, peu coûteuse et très efficace pour l'expression de complexes protéiques pour la biologie structurale dans les cellules de mammifères de suspension grandi. L'approche utilise co-transfection transitoire d'une ligne de rein embryonnaire humain (HEK) de la cellule (par exemple, les cellules HEK Freestyle 293F). Ces cellules ont été tirés de la CE HEK 293ligne ll, sont adaptés à croître dans des cultures en suspension, pour atteindre des densités élevées dans un milieu sans sérum (comme FreeStyle 293 Expression moyen). Les cellules sont ensuite transfectées de manière transitoire en utilisant une version de la polyéthylèneimine ramifiée (PEI), un polymère réactif peu coûteux qui a été rapporté pour fonctionner sur une large gamme de cellules mammaliennes 4 en formant des complexes de PEI / ADN qui pénètrent dans la cellule hôte par endocytose 5. Cette méthode est adaptée à la fois à petite échelle (30 ml) et à grande échelle (jusqu'à 300 ml) expériences et peut produire des niveaux élevés de complexes protéiques purifiés. Il est particulièrement utile pour l'étude de protéines qui nécessitent mécanismes complexes de pliage, des co-facteurs particuliers ou des modifications post-traductionnelles qui ne peuvent pas être effectuées par des bactéries, des levures et des cellules d'insectes.
Dans ce protocole, nous présentons l'expression et la purification de l'échafaudage central de trois protéines du complexe de répression de la transcription de Sin3A. Il s'agit d'histoneDéacétylase 1 (HDAC1), suppresseur de défectueux de Silence 3 (SDD3) et Switch-3 indépendante (Sin3A). Le complexe purifié est utilisé pour les essais de cristallisation à haut débit.
Protocole
NOTE: Le protocole est adapté à toute échelle d'expression, donc les volumes et les quantités de réactifs doivent être réduites proportionnellement. Un vecteur d'expression de mammifère approprié doit être utilisé pour ce protocole. Ici, nous avons utilisé un vecteur modifié d'expression pcDNA 3.1 qui permet facilement l'inclusion ou l'exclusion d'un marqueur d'affinité selon le choix des enzymes de restriction utilisées dans le clonage (Figure 1). Le protocole suivant décrit une transfection à grande échelle.
1. culture à grande échelle / transfection en bouteilles de 1 L à rouleaux
Croître et maintenir les cellules en suspension adaptées HEK293F selon des protocoles standards. Typiquement, les cultures starter de 30 à 100 ml sont cultivés dans 250 ml de fioles coniques de culture cellulaire.
- des cellules de semences à 0,5 x 10 6 cellules / ml dans un volume final de 300 ml dans chaque flacon de 1 L rouleau.
REMARQUE: Les flacons roulants accueillir un minimum de 150 ml pour un maximum de300 ml de culture en suspension. Pour les plus grands transfections échelle utiliser plusieurs bouteilles. - Incuber pendant 24 heures dans un agitateur incubateur orbital à 37 ° C, 120 rpm, et 5% de CO 2 jusqu'à ce que les cellules atteignent une densité de 1,0 x 10 6 cellules / ml (cellules devraient diviser environ toutes les 24 heures).
- Introduire à la pipette un total de 300 pg d'ADN stérilisée par filtration (voir méthode complémentaire) dans 30 ml de PBS et vortex vigoureusement pendant 3 sec.
REMARQUE: Utilisez un total de 1 pg d'ADN par million de cellules transfectées. Si deux ou plusieurs plasmides sont co-transfectés de réduire la quantité de chacune de sorte que le rapport de l'ADN de cellules reste constant. - Ajouter 1,2 ml de 0,5 mg / ml, stérilisée par filtration PEI à la solution et vortex PBS / ADN vigoureusement pendant 3 sec.
- Incuber le mélange à température ambiante pendant 20 min.
- Ajouter l'ADN / PEI mélanger aux cellules - qui devrait être à une densité de 1 x 10 6 cellules / ml (étape 1.3).
- Après co-transfection, incuber les cellulesdans un incubateur à agitation pendant encore 48 heures à 37 ° C, 120 tours par minute, et 5% de CO 2.
- Protéines intracellulaires de récolte par centrifugation des cellules à 3000 g pendant 5 min et stocker le culot à -80 ° C.
REMARQUE: Vous pouvez également utiliser un standard (non-CO 2) en secouant incubateur, si l'atmosphère au-dessus de la culture est remplacé par 5% de CO 2 et le couvercle de la bouteille est scellée. L'ambiance devra être remplacé à chaque passage (normalement tous les 2 jours).
2.-protéine complexe purification de l'extrait de cellules entières
Ce protocole est optimisé pour la purification de complexes nucléaires utilisant des protéines de marquage Flag.
- Décongeler culot cellulaire dans ~ 40 ml de tampon de lyse pré-refroidi (100 mM d'acétate de potassium, 50 mM Tris pH 7,5, 5% de glycerol, 0,3% de Triton X-100, les inhibiteurs de protéase) par litre de culture.
- Re-suspendre le culot par aspiration et à plusieurs reprises (pour éviter la formation de mousse, ne pas vortex).
- Bien remettre en suspension les cellules en utilisant un homogénéiseur en verre. Soniquer pendant 3 cycles (15 sec sur 15, s Arrêt). Centrifuger à 30 000 g pendant 25 min à 4 ° C et conserver le surnageant.
- Equilibrer 1,25 ml d'anticorps anti-flag emballé résine d'agarose par litre de culture par lavage trois fois avec du tampon d'équilibrage de la résine (100 mM d'acétate de potassium, 50 mM Tris pH 7,5).
- Incuber l'ensemble de l'extrait cellulaire de l'étape 2.3 de la résine d'affinité dans un ou plusieurs tubes de 50 ml à centrifuger et faire tourner doucement l'échantillon pendant 30 à 120 min à 4 ° C.
- Centrifugeuse à 3000 g pendant 1 min à 4 ° C, le surnageant défausse.
- Laver la résine avec 45 ml de tampon de pré-réfrigérés 1 (100 mM d'acétate de potassium, 50 mM Tris pH 7,5, 5% de glycerol, 0,3% de Triton X-100). Centrifuger à 3000 g pendant 1 min et éliminer le surnageant.
- Répétez l'étape 2.7 en utilisant du tampon riche en sel (300 mM d'acétate de potassium, 50 mM Tris pH 7,5, 5% de glycerol), suivie d'un tampon pauvre en sel (50 mM d'acétate de potassium, 50 mM de Tris pH 70,5, 5% de glycerol) et le tampon de clivage TEV (50 mM d'acétate de potassium, 50 mM Tris pH 7,5, 0,5 mM de TCEP).
REMARQUE: S'assurer que chaque lavage est de courte durée est adéquat pour tout remettre en suspension la résine et plus. - Prélever un échantillon de 10 pi de résine et de diluer dans 1 volume de tampon 2x protéines de chargement pour l'analyse (contrôle de protéines). Ne pas utiliser des agents réducteurs afin d'éviter la libération de l'anticorps de la résine.
- Re-suspendre la résine dans 10.8 ml de tampon de pré-refroidie de clivage TEV et transférer dans un tube de centrifugation de 15 ml.
- Ajouter ~ 40 mg de protéase TEV (en stock à 1 mg / ml) par litre de culture d'origine et bien mélanger par pipetage de haut en bas plusieurs fois.
- Remplacer atmosphère tube avec 100% de N 2 gaz pour éviter l'oxydation des protéines.
- Tournez doucement O / N à 4 ° C.
- Centrifuger à 3000 g pendant 10 min. Transférer le surnageant dans un filtre ultra centrifuge avec un poids moléculaire de coupure approprié et de se concentrerjusqu'à 500 pi.
- Prélever un échantillon de 10 pi de la protéine concentrée et diluée dans 1 volume de tampon de charge 2x protéine pour l'analyse. (TEV éluat contrôle).
- Prélever un échantillon de 10 pi de la résine et diluer dans 1 volume de tampon de charge 2x protéine pour l'analyse. Ne pas utiliser des agents réducteurs afin d'éviter la libération anticorps grandes quantités de la résine. (Post-TEV contrôle de résine).
- Equilibrer la colonne de chromatographie d'exclusion de taille avec du tampon de filtration sur gel (50 mM d'acétate de potassium, 50 mM Tris pH 7,5, 0,5 mM de TCEP).
- Filtrer la protéine à travers un filtre de 0,22 um
- Chargez l'échantillon dans la colonne et recueillir les fractions.
- Échantillons exécuter des étapes 2.9, 2.15 et 2.16 et les fractions de filtration sur gel de l'étape 2.19 sur une SDS-PAGE et de Coomassie pour analyse.
NOTE: Il est recommandé d'effectuer une SDS-PAGE d'échantillons de mesures 2.9, 2.15 et 2.16 avant filtration sur gel pour confirmer l'expression de la protéine cible.
Résultats
Ici, nous montrons une 2 L (8 x 250 ml de cultures) la co-transfection transitoire et purification de la HDAC1, SDD3, Sin3A complexe ternaire. HDAC1 et SDD3 interagissent avec Sin3A à travers le domaine HDAC-interaction (HID) de Sin3A. A typiques rendements de purification jusqu'à 1 mg de complexe par litre de culture.
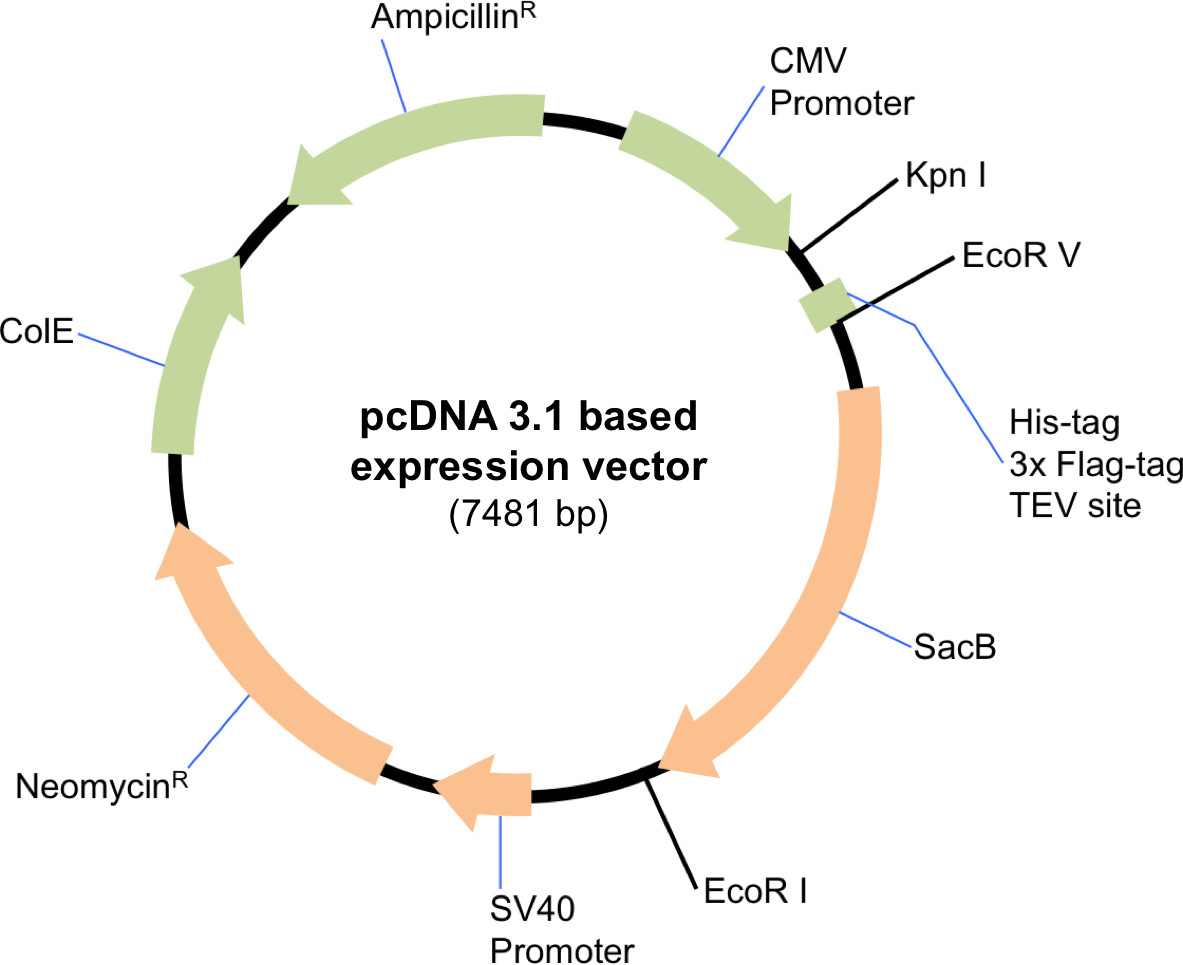
Figure 1: Représentation schématique du vecteur pcDNA 3.1 d'expression modifié. Le plasmide a été digéré par EcoRV et EcoRI pour y inclure la balise d'affinité et la zone de clivage TEV sur l'extrémité amino-terminale de Sin3A. Pour cloner des versions non marquées de HDAC1 et SDD3, le vecteur a été digéré avec Kpnl et EcoRI.
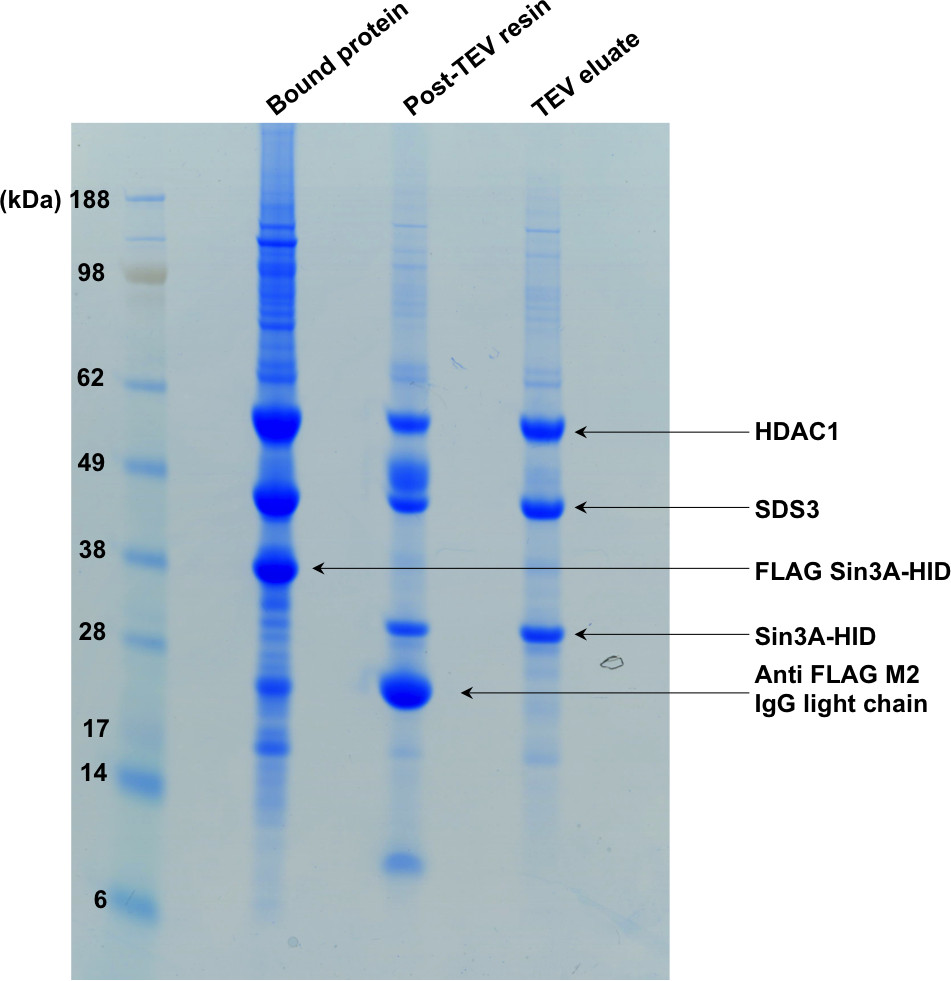
Figure 2: SDS-PAGE montrant la première étape de la purification. L'"protéine liée" voie montre le complexe lié à la résine d'affinité. Suite à la digestion TEV, l'étiquette présente sur Sin3A-HID est clivé et le complexe est élué de la résine, comme indiqué dans les deuxième et troisième voies de gel.
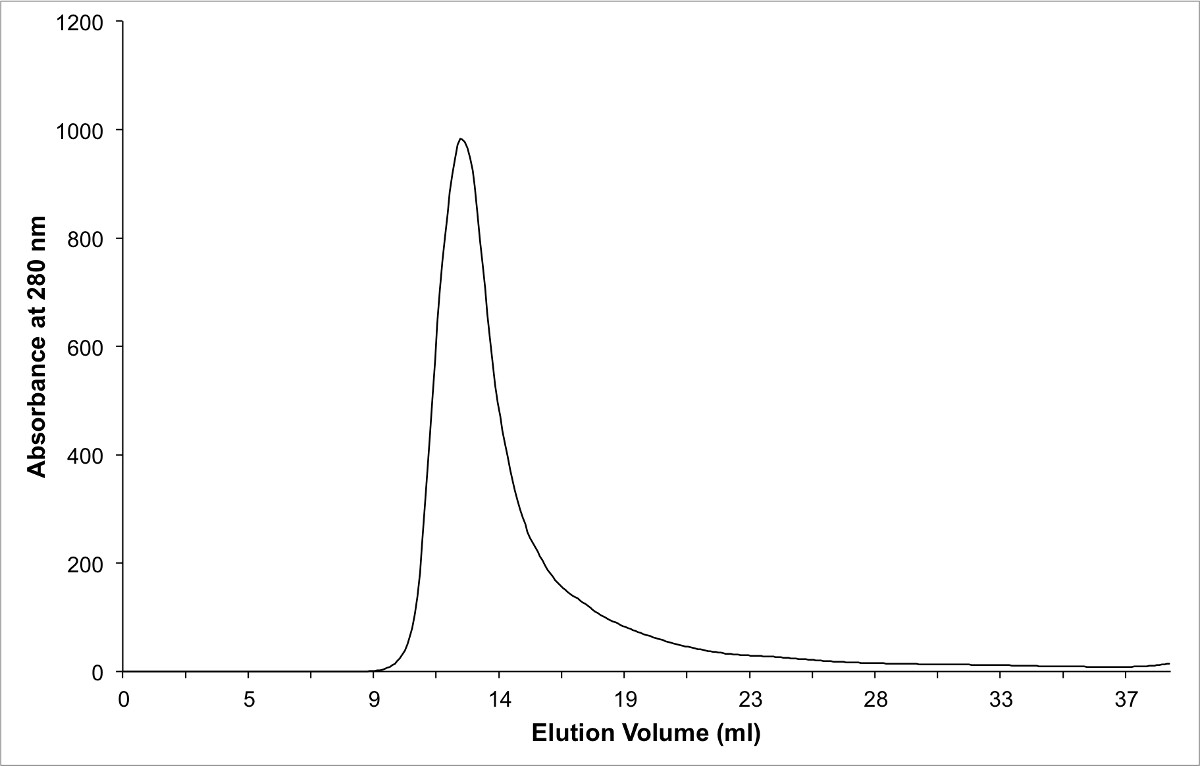
Figure 3 Chromatogramme de purifié en utilisant une Chromatographie d'exclusion de taille de la protéine du complexe. Notez que le complexe pur élue dans le volume vide, car il forme un dimère en solution.
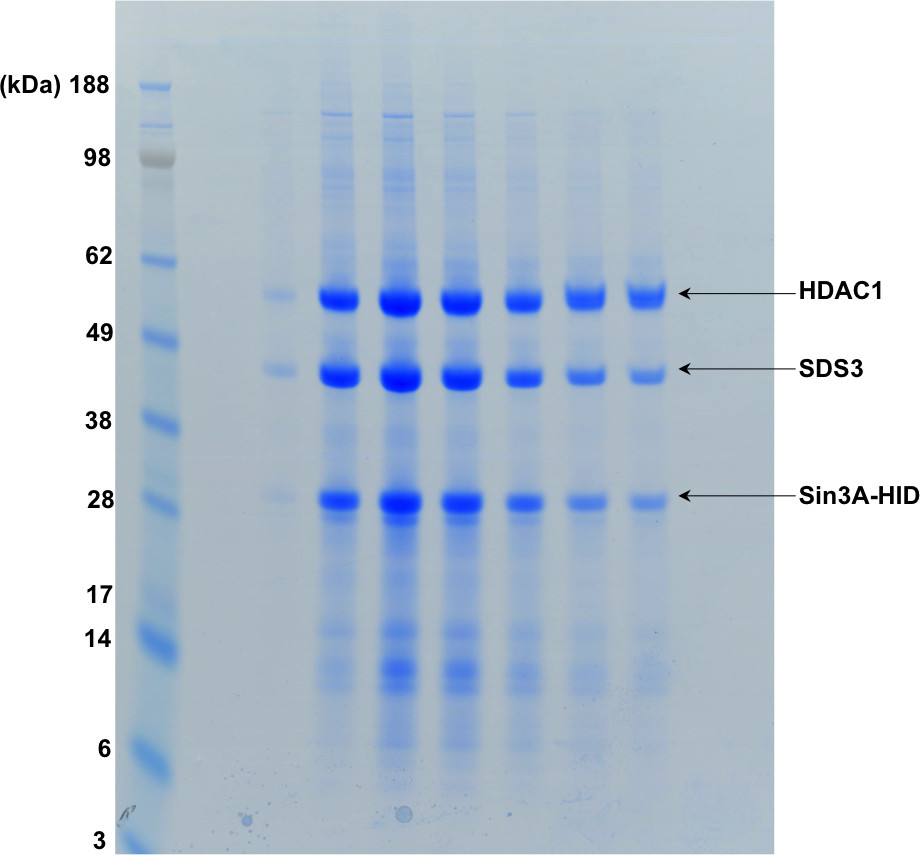
Figure 4: SDS-PAGE montrant les fractions de filtration sur gel montre la figure 3.
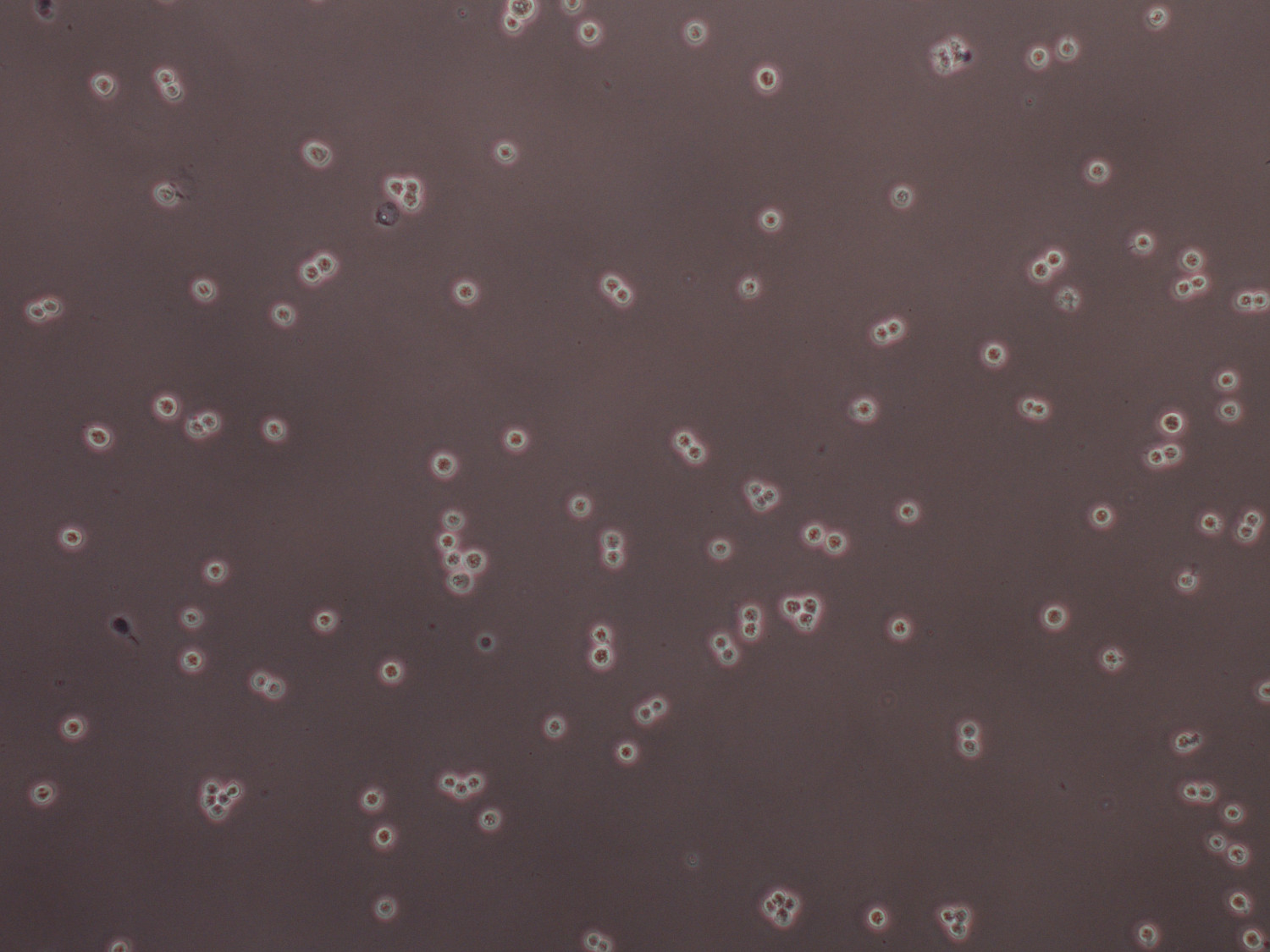
Figure 5 TRYPAN cellules HEK 293F colorées en bleu à 2.3x10 6 cellules / ml prêt à être transfectées. Cellules ne devraient être présents comme des cellules individuelles ou de division, alors que les grands groupes peuvent être brisés par vortex vigoureuse pendant environ 25 secondes.
| Problème | Les causes possibles | Action |
| Faible rendement en protéine. | Faible nombre de cellules transfectées. | Assurez-vous que la densité des cellules est d'environ 1,0 x 10 6 avant d'ajouter le mélange de réaction de transfection de la culture. |
| Les cellules peuvent avoir été repiquées trop de fois. | Utiliser des cellules de base fraîches après environ 90 passeâges. | |
| L'ADN peut être dégradé ou avoir une grande quantité d'impuretés. | Assurez-vous que l'ADN plasmidique utilisé a un rapport 260/280 entre 1,8 et 2,0. Exécution de l'ADN sur un gel d'agarose est recommandé d'évaluer sa qualité. | |
| Protéine (s) étant exprimées ne sont pas stable ou suffisamment soluble. | Testez différentes constructions à petite échelle avant de mettre à l'échelle les transfections. Assurez-vous que les balises ne pas interférer avec la structure de la protéine (s) d'intérêt. | |
| Cellules regarder nuageux et avoir une couleur et / ou une odeur inhabituelle. | Les cellules sont infectées par des bactéries ou des levures. | Une bonne technique stérile doit être utilisé en tout temps. La fumigation des hottes à flux laminaire et de désinfection UV-la chambre de culture de cellules en cas d'infection aide contenant le problème. |
| Les cellules ont une faible viabilité. | PH mal dans les médias. | Assurez-vous que les cultures sont cultivées à 5-8% de CO 2à tout moment. |
| Les cellules ont été cultivées jusqu'à une densité de plus de 3.0x10 6 cellules / ml. | Les cellules ne doivent pas être cultivées jusqu'à des densités au-dessus de 2,5 x 10 6 cellules / ml immédiatement avant une transfection et jamais au-dessus de 3,0 x 10 6 cellules / ml. | |
| La purification par affinité ne fonctionne pas | Protéine (s) n'est pas exprimé. | Voir ci-dessus. |
| Conditions de purification peut être erroné. | Régler les conditions de tampon (par exemple, forte teneur en sel, faible teneur en sel, pH). |
Tableau 1 Dépannage.
| Système | Avantages | Inconvénients |
| E. coli |
|
|
| P. pastoris |
|
|
| Expression baculovirus dans des cellules d'insecte |
|
|
| Bioréacteurs avec les mammifères |
|
|
| Cellules en suspension des cellules HEK 293F |
|
|
Tableau 2: Avantages et inconvénients des principaux systèmes d'expression.
Discussion
Nous avons développé une méthode efficace simple et économique (coûte beaucoup moins cher que disponibles dans le commerce des réactifs de transfection lipophiles PEI) pour exprimer et purifier de grandes quantités de protéines recombinantes et complexes multi-unités à partir de cellules de mammifères. Transfection optimale et l'efficacité de l'expression peut être atteint si l'ADN plasmidique très pur (260/280 entre 1,8 et 2,0) est utilisé en combinaison avec de la PEI, comme décrit dans la section de protocole. Les cellules doivent être cultivées dans des milieux sans sérum et sans antibiotique, par conséquent, une technique stérile est strictement nécessaire pour repiquage et la transfection de cellules afin d'éviter les infections coûteuses et chronophages. La viabilité cellulaire doit être de 90% ou plus et les cultures ne doit pas être augmenté à des densités supérieures à 2,5 x 10 6 cellules / ml immédiatement avant une transfection, car cela permettra de réduire le rendement en protéines. Pour une transfection réussie, les cultures doivent contenir que des cellules individuelles ou de division. Grappes peuvent être brisés par la vigueurous vortex 20 à 30 secondes (Figure 5). Le rapport de chacun des plasmides utilisés dans la co-transfection peut être modifiée par l'utilisateur en fonction de la stoechiométrie du complexe étant étudié. l'efficacité de l'expression peut être optimisé pour la protéine d'intérêt, de sorte qu'un temps d'expression approprié peut être établi. La purification doit être effectué en gardant l'échantillon de protéine froid à tout moment de réduire les risques de dégradation protéolytique indésirable. Le choix des mots-clés et des tampons de purification est indispensable, car ils peuvent interférer avec les éléments de structure ou des sites actifs de certaines protéines, ce qui entraîne souvent la solubilité et / ou la perte de l'activité enzymatique réduite. Les petites transfections à grande échelle sont particulièrement utiles pour tester différentes constructions pour la purification de grands complexes de protéines.
De nos jours, une grande variété d'autres méthodes sont disponibles pour l'expression de protéines eucaryotes recombinants (tableau 2). Par exemple, Baculovirus expression dans des cellules d'insectes est largement utilisé en raison de sa haute efficacité de transduction et son manque de cytotoxicité par rapport à d'autres espèces virales 6. Cependant, le procédé de fabrication du virus est fastidieux et son instabilité ne permet pas le virus d'être stocké pendant de longues périodes. D'un autre côté, les systèmes d'expression de levure offrent la possibilité de cellules de très hautes densités de plus en plus dans des cultures de fermentation, ce qui entraîne des rendements élevés de protéines 7. Mais ils n'ont pas encore la pleine variété de modifications post-traductionnelles requises pour les protéines eucaryotes à plier correctement et d'interagir avec leurs partenaires protéiques. HDAC3, par exemple, est exprimé, mais ne se replie pas dans E. coli. Cependant, lorsqu'il est exprimé dans les cellules 293F, nous avons été en mesure de purifier une enzyme active dans un complexe avec son co-répresseur (SMRT) et une molécule de l'inositol tétraphosphate (IP4) 8, qui n'est pas présente dans les cellules procaryotes. Cette méthode nous a également permis de purifier et de résoudre le cristal structure de HDAC1 interagir avec MTA1 dans le complexe de NuRD, qui est activé par de la même IP4 9. Idéalement, nous aimerions toujours pour exprimer des protéines eucaryotes dans leur environnement naturel, physiologique. Systèmes d'expression mammifères employant HEK 293 cellules-EBNA1 dans des bioréacteurs 10-12 ont été décrites et obtenir des niveaux très élevés de protéines, mais elles peuvent être complexes à utiliser.
Notre procédé est une alternative simple et accessible à l'expression dans les systèmes de bactéries, levures et bioréacteurs. Procédé d'expression est rapide et ne nécessite pas l'utilisation d'un matériel coûteux, surtout si la bouteille ou le flacon à rouleaux atmosphère est remplacé par 5% de CO 2 et les incubateurs serrant standard sont utilisés. Nous avons utilisé ces protocoles pour co-transfecter plusieurs plasmides et purifier des complexes avec jusqu'à cinq protéines avec des rendements de> 1 mg / L de culture. Fait intéressant, le système permet l'identification des complexes stables bien élevés. Par exemple, expression du complexe binaire de HDAC1 et Sin3A a donné des rendements limités de protéines, encore plus de SDD3 abouti à 5 fois plus grandes quantités et guide donc le biologiste structurel dans le choix de constructions appropriées et des complexes stables pour la cristallisation.
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
Nous tenons à remercier le Dr Yang Xiaowen (service de clonage PROTEX) pour la préparation des constructions d'expression utilisés pour ce travail et de l'Université de Leicester Core Services biotechnologie. Ce travail a été soutenu par une bourse BBSRC, le Programme Wellcome Trust et subventions de chercheurs chevronnés WT085408 & WT100237 et BBSRC accordent RM31G0224.
matériels
| Name | Company | Catalog Number | Comments |
| FreeStyle HEK 293F cells | LifeTechnologies | R790-07 | |
| FreeStyle 293 Expression Medium | LifeTechnologies | 12338-018 | |
| Anti-FLAG M2 Affinity Gel | SIGMA | A220 | |
| 250 ml Erlenmeyer Flask with Vented Cap | Corning | 431144 | |
| Roller bottles with vented caps | Corning | 01836-02 | |
| Polyethylenimine, 25 kDa, branched | Sigma-Aldrich | 408727 | Make 0.5 mg/ml stocks in H2O, adjust pH to 7.0 with dilute HCl and store at -20 - 4ºC |
| Mammalian expression vector | |||
| Dulbecco’s Phosphate Buffered Saline (DPBS) | Sigma-Aldrich | D8537 | |
| 0.22 µm Centrifugal Filter Units | Amicon | UFC30GV00 | |
| 15 ml Ultra centrifugal filters (10 kDa cut-off) | Amicon | UFC901008 | |
| Superdex 10/300 GL | GE Healthcare Life Sciences | 17-5175-01 |
Références
- Baneyx, F. Recombinant protein expression in Escherichia coli. Current opinion in biotechnology. 10 (5), 411-421 (1999).
- Aricescu, A. R., Owens, R. J. Expression of recombinant glycoproteins in mammalian cells: towards an integrative approach to structural biology. Current opinion in structural biology. 23 (3), 345-356 (2013).
- Kim, T. K., Eberwine, J. H. Mammalian cell transfection: the present and the future. Analytical and bioanalytical chemistry. 397 (8), 3173-3178 (2010).
- Boussif, O., Zanta, M. A., Behr, J. P. Optimized galenics improve in vitro gene transfer with cationic molecules up to 1000-fold. Gene therapy. 3 (12), 1074-1080 (1996).
- Godbey, W. T., Wu, K. K., Mikos, A. G. Poly (ethylenimine) and its role in gene delivery. Journal of Controlled Release. 60 ((2-3)), 149-160 (1999).
- Beljelarskaya, S. N. Baculovirus expression systems for production of recombinant proteins in insect and mammalian cells. Molecular Biology. 45 (1), 123-138 (2011).
- Cregg, J. M., Vedvick, T. S., Raschke, W. C. Recent advances in the expression of foreign genes in Pichia pastoris. Nature Biotechnology. 11 (8), 905-910 (1993).
- Watson, P. J., Fairall, L., Santos, G. M., Schwabe, J. W. R. Structure of HDAC3 bound to co-repressor and inositol tetraphosphate. Nature. 481 (7381), 335-340 (2013).
- Millard, C. J., Watson, P. J., et al. Class I HDACs Share a Common Mechanism of Regulation by Inositol Phosphates. Molecular Cell. 51 (1), 57-67 (2013).
- Tom, R., Bisson, L., Durocher, Y. Transfection of HEK293-EBNA1 Cells in Suspension with Linear PEI for Production of Recombinant Proteins. CSH protocols. , pdb.prot4977 (2008).
- Durocher, Y., Perret, S., Kamen, A. High-level and high-throughput recombinant protein production by transient transfection of suspension-growing human 293-EBNA1 cells. Nucleic Acids Research. 30 (2), (2002).
- Baldi, L., Muller, N., et al. Transient Gene Expression in Suspension HEK‐293 Cells: Application to Large‐Scale Protein Production. Biotechnology Progress. 21 (1), 148-153 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon