Method Article
소설 및 액세스 접근 : 구조 HEK 293F 서스펜션 세포의 생물학에 대한 재조합 단백질 발현
요약
The expression of recombinant proteins by mammalian systems is becoming an attractive method for producing protein complexes for structural biology. Here we present a simple yet highly efficient expression system using suspension grown mammalian cells to purify protein complexes for structural studies.
초록
The expression and purification of large amounts of recombinant protein complexes is an essential requirement for structural biology studies. For over two decades, prokaryotic expression systems such as E. coli have dominated the scientific literature over costly and less efficient eukaryotic cell lines. Despite the clear advantage in terms of yields and costs of expressing recombinant proteins in bacteria, the absence of specific co-factors, chaperones and post-translational modifications may cause loss of function, mis-folding and can disrupt protein-protein interactions of certain eukaryotic multi-subunit complexes, surface receptors and secreted proteins. The use of mammalian cell expression systems can address these drawbacks since they provide a eukaryotic expression environment. However, low protein yields and high costs of such methods have until recently limited their use for structural biology. Here we describe a simple and accessible method for expressing and purifying milligram quantities of protein by performing transient transfections of suspension grown HEK (Human Embryonic Kidney) 293F cells.
서문
분자 세포 생물학의 급속한 발전과 의학에서 개선 된 의약품에 대한 지속적인 필요가 구조 생물 학자들이 점점 더 복잡한 단백질 구조를 보면 할 필요를 만들었습니다. 이들은 종종 자신의 정교한 폴딩 및 효소 활동을 지원하기 위해 특정 번역 후 변형, 분자 보호자와 공동 요인을 요구할 수 있습니다. 박테리아 발현 시스템을 사용하여 수득 된 단백질 데이터 뱅크에 존재하는 구조의 대부분 동안, 원핵 이러한 변형의 다수를 수행 할 수없는 많은 진핵 필수적인 공동 요인이 부족하다. 이 작은 신호 전달 물질에 의해뿐만 아니라 핵, 세포 표면과 정교한 접는 기계를 필요로 분비 단백질 활성화 대형 멀티 - 서브 유닛 단지의 연구에 문제가 될 수 있습니다. E.의 숫자 대장균 균주는 이러한 한계 일의 일부를 극복하기 위해 설계되었다. m의 최근에는, 그러나, 사용그들이 안정적으로 다른 시스템 2에 표현 그렇지 않으면 문제가된다 진핵 세포 단백질을 생산하기 때문에 ammalian 발현 시스템이 증가하고있다. 오늘은 화학 매개 형질 전환에 바이러스 성 전달에 이르기까지 다양 다양한 기술을 통해 안정적이고 과도 포유 동물 발현 세포주를 얻을 수있다, 이러한 일렉트로 및 직접 분사 3과 같은 물리적 유전자 전달. 이들 방법 모두가 장점과 단점을 자신의 세트를 가지고 있지만, 그 중 일부는 어느 너무 비싸고 및 / 또는 시간 소모적 인 구조적 연구에 적합하다.
여기에서 우리는 서스펜션 성장 포유 동물 세포에서 구조 생물학에 대한 단백질 복합체를 표현하기위한 매우 간단하고, 빠르고, 저렴하면서도 효율적인 방법을 설명합니다. 접근 방법 (예를 들어, 자유형 HEK 293F 세포) 인간 배아 신장 (HEK) 세포주의 과도 공동 형질을 사용합니다. 이러한 세포는 HEK 293 CE로부터 유도 된LL 라인은, 혈청이없는 배지를 사용하여 고밀도 (예 : 자유형 293 식 매체로서)에 도달, 현탁 배양 물에서 성장하도록 적응된다. 세포는 일시적으로 폴리에틸렌 이민의 분지 버전 (PEI), 엔도 시토 시스 (5)에 의해 숙주 세포를 입력 DNA / PEI 복합체를 형성함으로써 포유 동물 세포 (4)의 넓은 범위에서 작동하는 것으로보고되었다 저렴 중합체 시약을 사용하여 형질 전환된다. 이 방법은 소규모 (30 ml) 및 (300 mL로) 큰 규모의 실험 모두에 적합하며 정제 단백질 복합체의 높은 수준을 생성 할 수있다. 그것은 복잡한 접는 기계, 공동 요인 또는 박테리아, 효모 및 곤충 세포에 의해 수행 할 수없는 특정 번역 후 변형을 필요로하는 단백질을 연구에 특히 유용합니다.
이 프로토콜에서 우리는 Sin3A 전사 억제 복합체의 세 가지 단백질 중앙 지지체의 발현 및 정제를 제시한다. 이 히스톤 구성아세틸 라제 일 (HDAC1), 결함이 음소거 세 (SDS3)의 보호 회로 및 스위치 독립적 인 세 (Sin3A). 정제 된 단지는 높은 처리량 결정화 실험에 사용됩니다.
프로토콜
주 : 프로토콜은 따라서 시약의 볼륨과 수량이 비례 적으로 조정해야한다 식의 규모에 적합하다. 적합한 포유 동물 발현 벡터는이 프로토콜에 사용되어야한다. 여기서는 편리 클로닝 (도 1)에서 사용되는 제한 효소의 선택에 따라 친 화성 태그를 포함 또는 배제를 허용하여 pcDNA 3.1 변경됨 발현 벡터를 사용 하였다. 다음의 프로토콜은 대규모 트랜 스펙을 설명한다.
1 L 롤러 병에 1 대규모 문화 / 형질
성장 및 표준 프로토콜에 따라 HEK293F 서스펜션 적응 세포를 유지한다. 일반적으로 30에서 100 ㎖로 선발 문화 250 ML 원뿔 세포 배양 플라스크에서 재배된다.
- 각각 1 L 롤러 병에 300 ml의 최종 부피로 0.5 × 106 세포 / ml의 세포 종자.
주 : 롤러 병에서 최대 150 ㎖가 최소 수용현탁 배양의 300 ML. 큰 규모의 형질에 대해 여러 병을 사용합니다. - 세포를 1.0 × 106 세포 / ml의 농도에 도달 할 때까지 37 ° C에서 진탕 인큐베이터에서 24 시간, 120 rpm으로, 5 % CO 2 동안 배양 (세포는 대략 매 24 시간을 분할한다).
- 필터 살균 DNA의 300 μg의 총을 피펫 3 초 동안 적극적으로 PBS 30 ㎖의 소용돌이에 (보충 방법 참조).
참고 : 만 형질 세포 당 DNA의 1 μg의 총을 사용합니다. 두 개 이상의 플라스미드 될 경우 세포에 DNA의 비율이 일정하게 유지되도록 각각의 양을 감소 공동 형질. - 1.2 ml의 0.5 ㎎의 추가 / 3 초 동안 적극적으로 PBS / DNA 용액 소용돌이에 PEI를 살균 필터링 ML.
- 20 분 동안 실온에서 믹스를 품어.
- DNA를 추가 / PEI는 세포에 혼합 - 1 × 106 세포 / ml (단계 1.3)의 밀도에 있어야한다.
- 공동 - 형질 감염 후, 세포를 부화또한 37 ° C에서 48 시간, 120 rpm으로, 5 % CO 2의 진탕 배양기에서.
- 5 분 동안 3,000 XG에서 세포를 원심 분리 및 -80 ° C에서 펠렛을 저장하여 수확 세포 내 단백질.
참고 : 또는 문화 위의 분위기가 5 % CO 2로 대체되고, 병 뚜껑을 밀봉하는 경우 (비-CO 2) 배양기를 흔들어 표준을 사용합니다. 분위기는 각 통로 (일반적으로 모든 이일)에서 교체해야합니다.
전 세포 추출물에서 2 단백질 복합 정제
이 프로토콜은 플래그 - 태그 된 단백질을 사용하여 핵 착물의 정제를 위해 최적화된다.
- 으로 세포 펠렛을 해동 ~ 미리 냉장 용해 완충액 40 ㎖ (100 mM 아세트산 칼륨, 50 mM 트리스 pH가 7.5, 5 % 글리세롤, 0.3 % 트리톤 X-100, 프로테아제 억제제) 문화의 L 당.
- 다시 일시 중지로 pipetting에 의해 여러 번 아래로 펠렛을 (거품 방지 소용돌이를하지 않는합니다).
- 철저히 유리 균질기를 이용하여 세포를 다시 일시. 3주기 (15 초, 15 초 Off)에 대한 초음파 처리. 4 ℃에서 25 분 동안 30,000 XG에 원심 분리기와 뜨는을 유지합니다.
- 평형 수지 평형 완충액 (100 mM 아세트산 칼륨, 50 mM 트리스 pH를 7.5)로 3 회 세척하여 배양 리터당 아가 로스 수지를 충전 방지 플래그 1.25 ML.
- 하나 이상의 50 ㎖의 원심 분리기 튜브의 친 화성 수지와 단계 2.3에서 전체 세포 추출액을 품어 부드럽게 4 ° C에서 30 ~ 120 분 동안 샘플을 회전 할 수 있습니다.
- 4 ° C, 폐기 상층 액에서 1 분 동안 3,000 XG에 원심 분리기.
- 미리 차게 한 완충액 45 ㎖로 씻어 수지 (100 mM 아세트산 칼륨, 50 mM 트리스 pH가 7.5, 5 % 글리세롤, 0.3 % 트리톤 X-100). 1 분 동안 3,000 XG에 원심 분리기 및 상층 액을 제거한다.
- 반복 단계 2.7 높은 염 완충액을 이용하여 낮은 염 완충액 (50 mM의 아세트산 칼륨, 50 mM 트리스 pH를 7로 (300 mM의 아세트산 칼륨, 50 mM 트리스 pH가 7.5, 5 % 글리세롤), 이어0.5, 5 % 글리세롤)과 TEV 쪼개짐 완충액 (50 mM의 아세트산 칼륨, 50 mM 트리스 pH를 7.5, 0.5 mM의 TCEP).
참고 : 각 세척을 확인 완전히 더 이상 수지를 다시 일시 중단하기에 충분한 간단한 즉,이다. - 수지의 10 ㎕의 샘플을 수집 및 분석을위한 배 단백질 로딩 버퍼 (바인딩 단백질 제어)의 1 부피로 희석한다. 수지에서 항체를 해제 피하기 위해 환원제를 사용하지 마십시오.
- 15 ㎖의 원심 분리 관에 미리 냉장 TEV 절단 버퍼와 전송의 8-10 ML에 수지를 다시 일시 중지합니다.
- 추가 ~ 40 원래 문화의 L 당 (1 ㎎ / ㎖에서 재고) TEV 단백질 분해 효소 ㎍의 아래로 여러 번을 피펫 팅에 의해 잘 섞는다.
- 단백질 산화를 방지하기 위해 100 % N 2 가스 튜브 분위기를 교체합니다.
- 조심스럽게 4 ℃에서 O / N 회전합니다.
- 10 분 동안 3,000 XG에 원심 분리기. 적절한 분자량 컷 - 오프와 초 원심 필터에 뜨는을 전송하고 집중500 μL에 이르기까지.
- 농축 된 단백질의 10 ㎕의 샘플을 수집 및 분석을위한 배 단백질 로딩 버퍼의 1 부피로 희석한다. (TEV 제어를 용출액).
- 수지의 10 ㎕의 샘플을 수집 및 분석을위한 배 단백질 로딩 버퍼의 1 부피로 희석한다. 수지에서 많은 양의 항체를 방출 방지하기 위해 환원제를 사용하지 마십시오. (후 TEV 수지 제어).
- 겔 여과 완충액 (50 mM의 아세트산 칼륨, 50 mM 트리스 pH를 7.5, 0.5 mM의 TCEP)와 크기 배제 크로마토 그래피 컬럼을 평형화.
- 0.22 μm의 필터를 통해 단백질을 필터링
- 열에 샘플을로드하고 분수를 수집합니다.
- 단계 2.9, 2.15 및 2.16와 분석을 위해 SDS-PAGE 및 쿠마시 염색 공정에 2.19에서 겔 여과의 분획에서 실행 샘플.
참고 : 목적 단백질의 발현을 확인하는 단계 2.9, 2.15 및 2.16 이전 겔 여과에서 샘플의 SDS-PAGE를 실행하는 것이 좋습니다.
결과
여기에서 우리는 HDAC1, SDS3, Sin3A 삼원 복합체의이 L (8 × 250 ㎖의 문화) 과도 공동 형질 전환 및 정제를 보여줍니다. HDAC1과 SDS3는 Sin3A의 HDAC 상호 작용 도메인 (HID)를 통해 Sin3A와 상호 작용합니다. 문화의 리터 당 단지의 1 mg의 최대 일반적인 정제 수율.
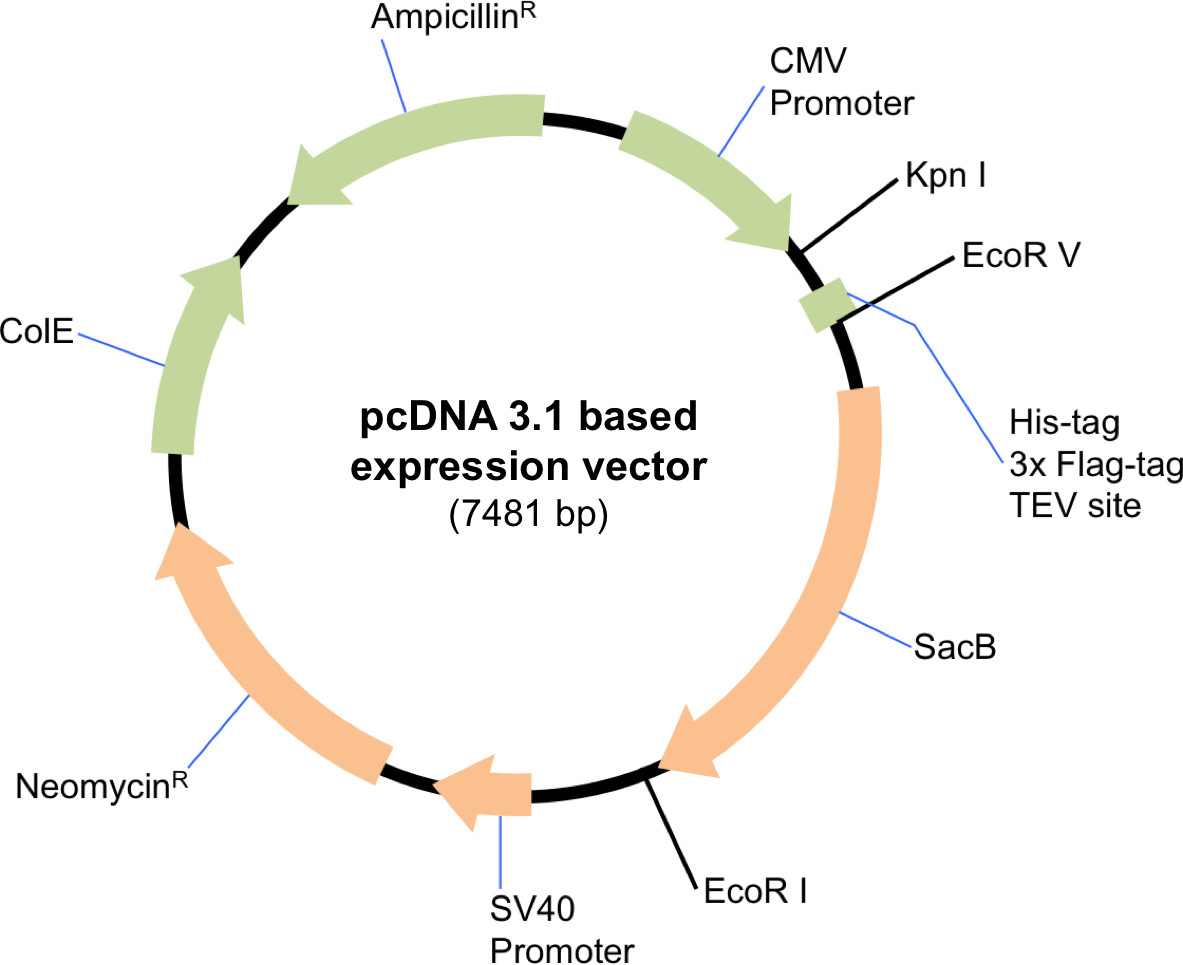
도 변경됨하여 pcDNA 3.1 발현 벡터의 개략도. 플라스미드 Sin3A의 아미노 말단에 친 화성 태그와 TEV 절단 부위를 포함하도록 ECORV 및 효소 EcoRI로 분해 하였다. HDAC1과 SDS3의 태그가 지정되지 않은 버전을 복제하려면 벡터를 KpnI과를 EcoRI로 소화했다.
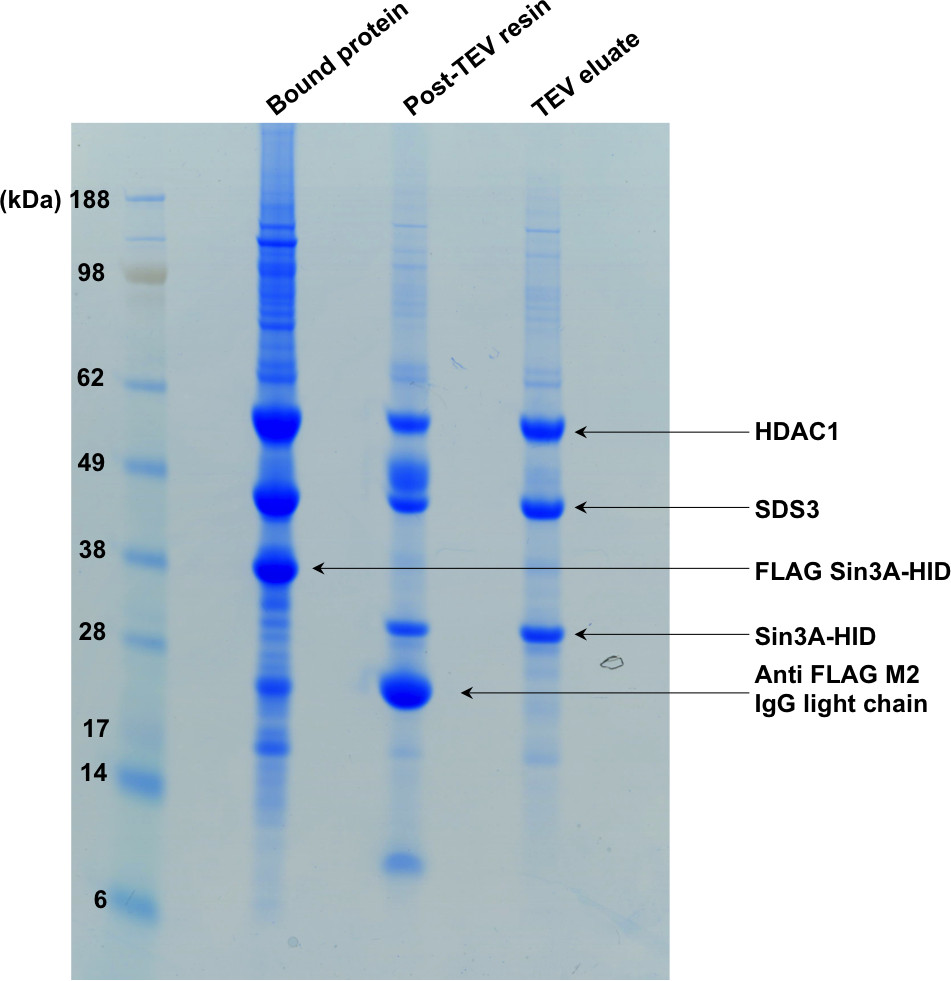
그림 2 SDS-PAGE 정화의 첫 번째 단계를 표시합니다. "결합 단백질"차선의 친 화성 수지에 결합 된 복합체를 보여줍니다. TEV 소화 후, Sin3A-HID에 태그 본 오프 절단하고 겔의 두 번째 및 세 번째 레인에 도시 한 바와 같이 복합체 수지로부터 용출된다.
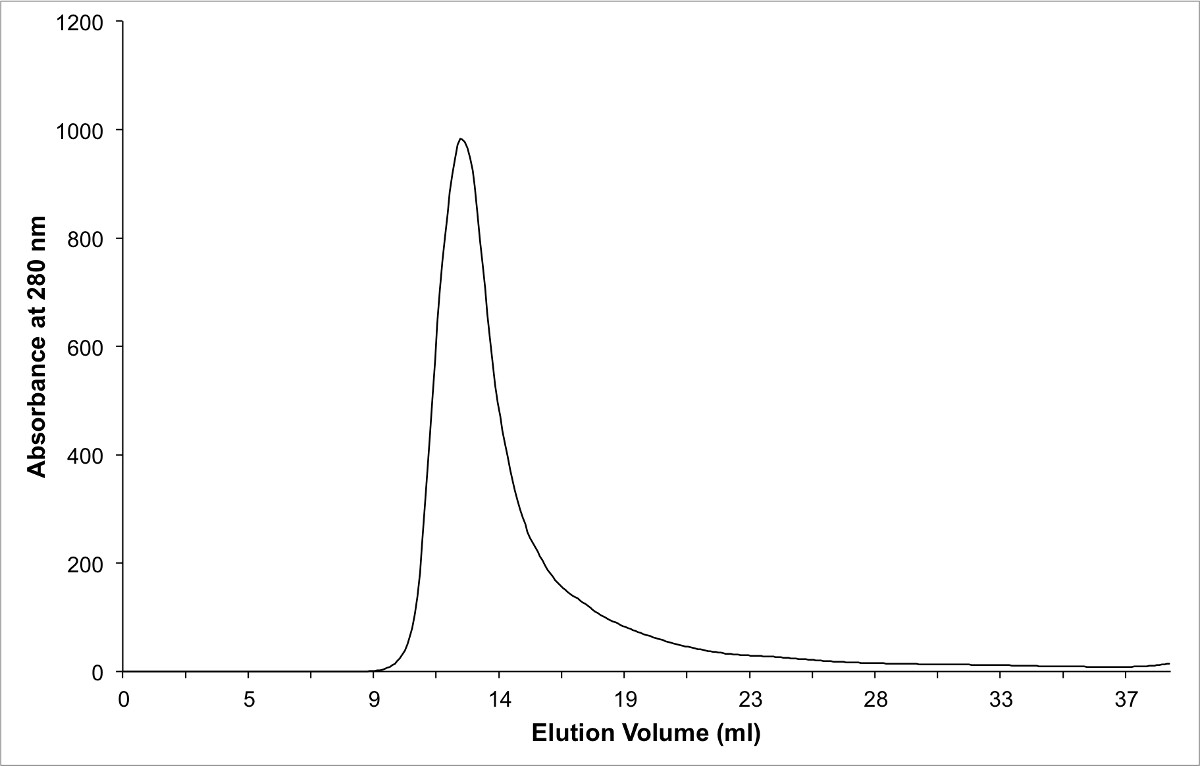
그림 단백질 - 복합 정제하여 크기 배제 크로마토 그래피의 3 크로마토 그램.이 용액에 이합체를 형성하기 때문에 순수한 복잡한 공극 부피에서 용출합니다.
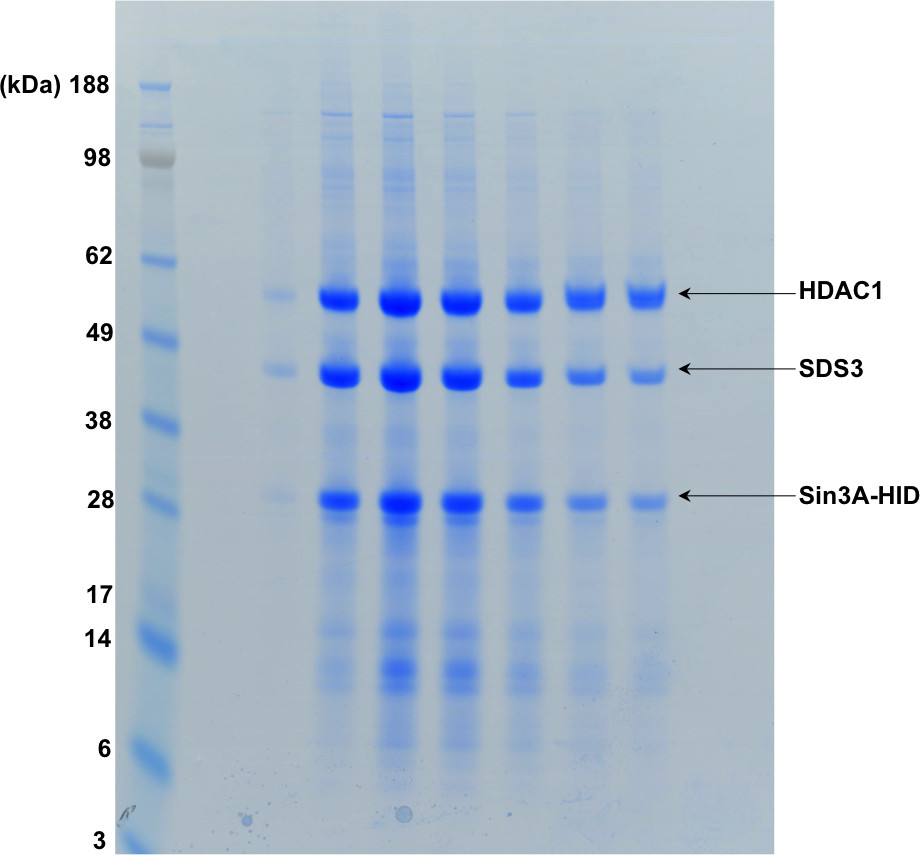
도 3에 도시 된 겔 여과의 분획을 보여주는도 4 SDS-PAGE.
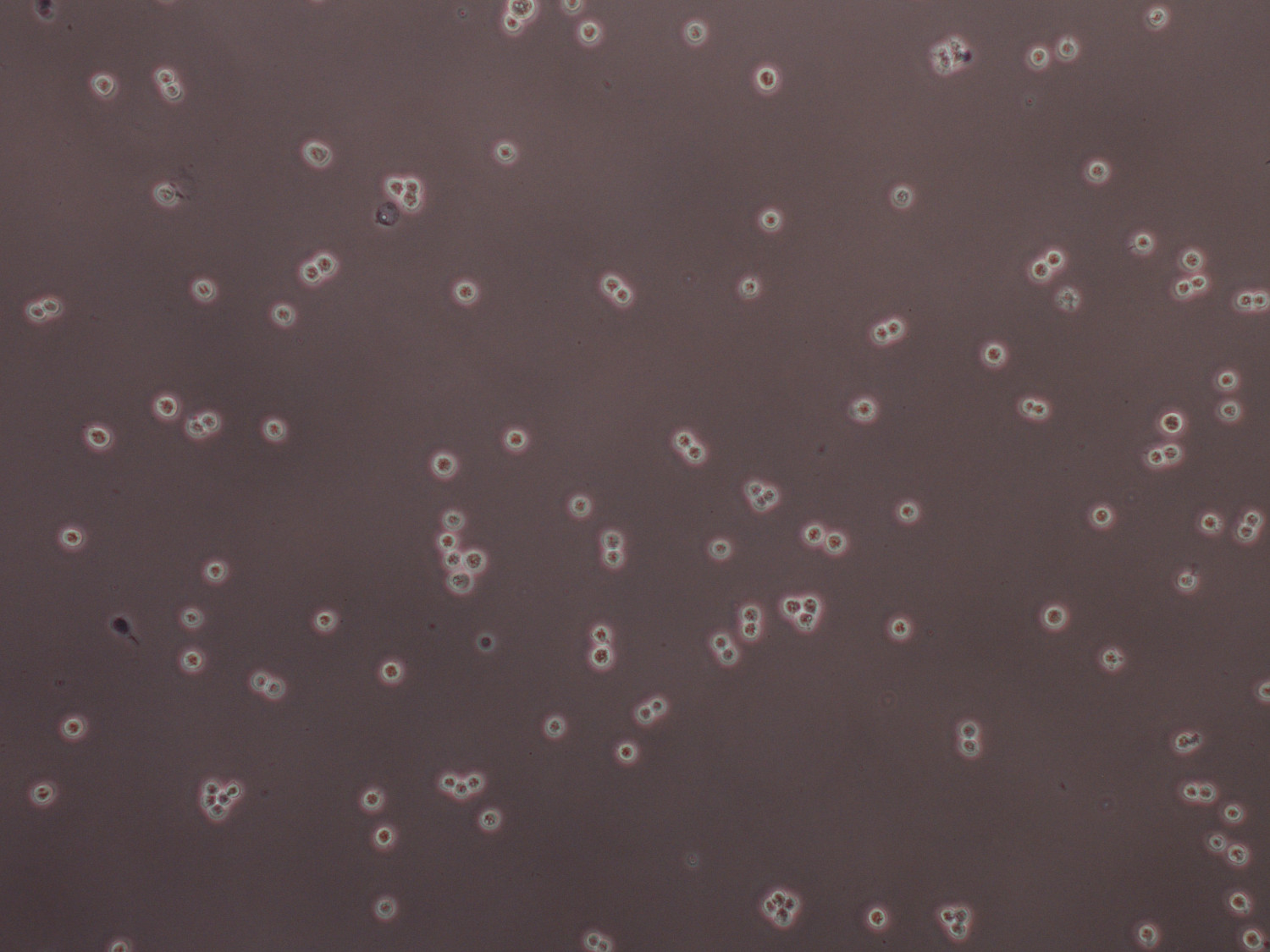
6 세포 / ㎖ 준비 2.3x10에서 그림 5 트리 판 블루 염색 HEK 293F 세포를 형질 전환합니다. 큰 클러스터가 약 25 초 동안 격렬한 소용돌이로 교반에 의해 나누어 질 수있는 반면 세포는, 단일 또는 분할 세포와 같은 존재해야한다.
| 문제 | 가능한 원인 | 액션 |
| 낮은 단백질 수율. | 세포의 낮은 수는 형질. | 확인 세포 밀도가 1.0 × 10 6의 문화에 형질 전환 반응 혼합물을 추가하기 전에 약합니다. |
| 세포는 여러 번 계대 배양되었을 수 있습니다. | 약 90 패스를 신선한 스톡 세포를 사용하여나이. | |
| DNA는 성능 저하 또는 불순물의 많은 양이 될 수있다. | 확인 플라스미드 DNA를 사용하고 있는지 확인하십시오 1.8과 2.0 사이의 280 분의 260 비율을 가지고있다. 아가로 오스 겔에서 DNA를 실행하면 그 품질을 평가하는 것이 좋습니다. | |
| 단백질 (들)로 표현되는 안정 또는 충분히 용해되지 않습니다. | 이전에 형질 스케일링 업에 작은 규모의 다른 구조를 테스트합니다. 반드시 태그 관심 단백질 (들)의 구조를 방해하지 않도록해야. | |
| 세포는 흐린 모양과 특이한 색상 및 / 또는 냄새가. | 세포는 세균이나 효모에 감염된다. | 좋은 멸균 기술은 항상 사용할 수 있어야합니다. 층류 후드를 소독하고 감염의 경우에는 세포 배양 공간은 UV-소독하는 문제를 포함 할 수 있습니다. |
| 세포는 낮은 가능성을 가지고있다. | 미디어의 잘못된 산도. | 확실히 문화 CO 2 5-8%에서 재배되어 있는지 확인항상. |
| 세포 3.0x10 6 세포 / ㎖ 이상 농도를 배양하고있다. | 세포는 2.5 × 10 6 세포 / ㎖ 즉시 형질 전환 이전과 결코 6 10 X 3.0 이상 세포 / ml 이상 밀도로 성장 할 수 없습니다. | |
| 선호도 정화 작동하지 않았다 | 단백질 (들) 표시되지 않습니다. | 위의 내용을 참조하십시오. |
| 정제 조건은 잘못 될 수 있습니다. | (예를 들어, 높은 소금, 낮은 소금, 산도를.) 버퍼 상태를 조정 |
표 1 문제 해결.
| 시스템 | 장점 | 단점 |
| E. 콜라이 |
|
|
| P. 파스 |
|
|
| 곤충 세포에서 배큘로 바이러스 발현 |
|
|
| 포유류 시스템과 생물 반응 장치 |
|
|
| HEK 293F 서스펜션 세포 |
|
|
표 2에 장점 및 주요 발현 시스템의 단점.
토론
우리는 표현 및 재조합 단백질 및 포유 동물 세포에서 다중 서브 유닛 단지 많은 양의 정제 (PEI는 시중에서 판매하는 친 유성 형질 전환 시약보다 훨씬 적은 비용) 간단하고 비용 효율적인 방법을 개발했습니다. 프로토콜 절에서 설명한 바와 같이 고순도의 플라스미드 DNA (280 분의 260 1.8 내지 2.0) PEI와 조합하여 사용하는 경우 최적의 형질 전환 및 발현 효율에 도달 할 수있다. 세포 serum-과 항생제가없는 배지에서 배양해야하므로, 멸균 기술은 엄격히 비용과 시간이 소요되는 감염을 방지하기 위해 계대 및 형질 세포 요구된다. 세포 생존율이 90 % 이상이어야하며 문화가 2.5 × 10 6 세포보다 더 큰 밀도로 성장하지 말아야 / 즉시 형질 전환하기 전에, 이렇게 같이 단백질 생산량을 줄일 ML. 성공적인 형질의 경우, 문화는 단일 또는 분할 세포를 포함해야합니다. 클러스터는 활기에 의해 나누어 질 수있다30 초 (그림 5) OU를 소용돌이로 교반 (20). 공동 - 형질 전환에 사용 된 각 플라스미드의 비율은 연구 복잡한 존재의 화학량 론에 따라 사용자에 의해 변경 될 수있다. 적합한 발현 시간이 설정 될 수 있도록 발현 효율, 관심 단백질에 대해 최적화 될 수있다. 정제는 불필요한 단백질 가수 분해의 위험을 감소시키기 위해 시점의 단백질 샘플 차가운 유지 수행되어야한다. 그들은 종종 감소 된 용해도 및 / 또는 효소 활성의 손실의 결과, 구조적 요소 또는 특정 단백질의 활성 부위를 방해 할 수 있기 때문에, 태그와 정화 버퍼의 선택은 중요하다. 소규모 형질 큰 단백질 복합체의 정제를위한 다른 구조를 테스트하기 위해 특히 유용하다.
오늘, 대체 방법의 큰 다양성 재조합 진핵 생물의 단백질 (표 2)의 표현을 사용할 수 있습니다. 예를 들어, Baculovi곤충 세포에서 발현 RUS 널리 높은 전달 효율과 기타 바이러스 종 6과 비교하여 세포 독성의 결여로 인해 사용된다. 그러나 바이러스의 제조 공정은 시간 소모적이며 불안정성 바이러스 오랜 기간 동안 저장 될 수 없습니다. 한편, 효모 발현 시스템은 높은 단백질 수율 7의 결과, 발효기 배양에서 세포에 매우 높은 밀도의 증가 가능성을 제공한다. 그러나 그들은 여전히 제대로 접과 단백질 파트너와 상호 작용하는 진핵 생물의 단백질에 필요한 번역 후 변형의 전체 다양성이 부족하다. HDAC3은, 예를 들면, 발현 되나 E.를 접을하지 대장균. 293F 세포에서 발현 때, 우리는 공동 억제 (SMRT)와 원핵 세포에서 발견되지 이노시톨 tetraphosphate (IP4) 8의 분자 복잡한에서 활성 효소를 정제 할 수 있었다. 이 방법은 성을 정화하고 결정을 해결하기 위해 우리를 허용했다HDAC1 유사 IP4 구에 의해 활성화되는 NuRD 단지에서 MTA1와 상호 작용 ructure. 이상적으로, 우리는 항상 자연, 생리적 환경에서 진핵 생물의 단백질을 표현하고 싶습니다. 생물 반응기에서 10-12 HEK-293 세포를 EBNA1 이용한 포유 동물 발현 시스템을 설명하고 단백질의 매우 높은 수준을 수득하지만, 이러한 사용이 복잡 할 수있다.
우리의 방법은 박테리아, 효모 및 생물 반응기 시스템의 표현에 대한 간단하고 접근 대안입니다. 발현 방법은 빠르고 롤러 병 또는 플라스크 분위기 5 % CO 2 인큐베이터 진탕 및 표준을 사용하는 대체되는 경우에 특히 고가의 장비의 사용을 요구하지 않는다. 우리는 여러 플라스미드 - 형질을 공동 문화> 1 ㎎ / ℓ의 수율 최대 5 단백질과 복합체를 정화하기 위해이 프로토콜을 사용하고 있습니다. 흥미롭게도, 시스템이 안정적으로 잘 작동 단지의 식별을하는 데 도움이됩니다. 예, 예를 들어HDAC1과 Sin3A의 이진 단지의 Pression의 단백질의 제한 수율을 준, 아직 SDS3의 추가는 더 높은 금액을 5 배, 따라서 적절한 구조와 결정화 안정적인 단지 선택에 구조 생물학을 안내 결과.
공개
The authors declare that they have no competing financial interests.
감사의 말
우리는이 작업과 레스터 핵심 생명 공학 서비스의 대학에 사용되는 식 구조를 준비 박사 Xiaowen 양 (PROTEX 복제 서비스) 감사의 말씀을 전합니다. 이 작품은 BBSRC 학생이기 의해 지원되었다, 웰컴 트러스트 (Wellcome Trust) 프로그램 및 수석 수사관 보조금 WT085408 & WT100237 및 BBSRC는 RM31G0224을 부여합니다.
자료
| Name | Company | Catalog Number | Comments |
| FreeStyle HEK 293F cells | LifeTechnologies | R790-07 | |
| FreeStyle 293 Expression Medium | LifeTechnologies | 12338-018 | |
| Anti-FLAG M2 Affinity Gel | SIGMA | A220 | |
| 250 ml Erlenmeyer Flask with Vented Cap | Corning | 431144 | |
| Roller bottles with vented caps | Corning | 01836-02 | |
| Polyethylenimine, 25 kDa, branched | Sigma-Aldrich | 408727 | Make 0.5 mg/ml stocks in H2O, adjust pH to 7.0 with dilute HCl and store at -20 - 4ºC |
| Mammalian expression vector | |||
| Dulbecco’s Phosphate Buffered Saline (DPBS) | Sigma-Aldrich | D8537 | |
| 0.22 µm Centrifugal Filter Units | Amicon | UFC30GV00 | |
| 15 ml Ultra centrifugal filters (10 kDa cut-off) | Amicon | UFC901008 | |
| Superdex 10/300 GL | GE Healthcare Life Sciences | 17-5175-01 |
참고문헌
- Baneyx, F. Recombinant protein expression in Escherichia coli. Current opinion in biotechnology. 10 (5), 411-421 (1999).
- Aricescu, A. R., Owens, R. J. Expression of recombinant glycoproteins in mammalian cells: towards an integrative approach to structural biology. Current opinion in structural biology. 23 (3), 345-356 (2013).
- Kim, T. K., Eberwine, J. H. Mammalian cell transfection: the present and the future. Analytical and bioanalytical chemistry. 397 (8), 3173-3178 (2010).
- Boussif, O., Zanta, M. A., Behr, J. P. Optimized galenics improve in vitro gene transfer with cationic molecules up to 1000-fold. Gene therapy. 3 (12), 1074-1080 (1996).
- Godbey, W. T., Wu, K. K., Mikos, A. G. Poly (ethylenimine) and its role in gene delivery. Journal of Controlled Release. 60 ((2-3)), 149-160 (1999).
- Beljelarskaya, S. N. Baculovirus expression systems for production of recombinant proteins in insect and mammalian cells. Molecular Biology. 45 (1), 123-138 (2011).
- Cregg, J. M., Vedvick, T. S., Raschke, W. C. Recent advances in the expression of foreign genes in Pichia pastoris. Nature Biotechnology. 11 (8), 905-910 (1993).
- Watson, P. J., Fairall, L., Santos, G. M., Schwabe, J. W. R. Structure of HDAC3 bound to co-repressor and inositol tetraphosphate. Nature. 481 (7381), 335-340 (2013).
- Millard, C. J., Watson, P. J., et al. Class I HDACs Share a Common Mechanism of Regulation by Inositol Phosphates. Molecular Cell. 51 (1), 57-67 (2013).
- Tom, R., Bisson, L., Durocher, Y. Transfection of HEK293-EBNA1 Cells in Suspension with Linear PEI for Production of Recombinant Proteins. CSH protocols. , pdb.prot4977 (2008).
- Durocher, Y., Perret, S., Kamen, A. High-level and high-throughput recombinant protein production by transient transfection of suspension-growing human 293-EBNA1 cells. Nucleic Acids Research. 30 (2), (2002).
- Baldi, L., Muller, N., et al. Transient Gene Expression in Suspension HEK‐293 Cells: Application to Large‐Scale Protein Production. Biotechnology Progress. 21 (1), 148-153 (2005).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유