Method Article
Bir Roman ve Erişilebilir Yaklaşım: Yapısal HEK 293F Askı Hücreleri Biyoloji Rekombinant Protein
Bu Makalede
Özet
The expression of recombinant proteins by mammalian systems is becoming an attractive method for producing protein complexes for structural biology. Here we present a simple yet highly efficient expression system using suspension grown mammalian cells to purify protein complexes for structural studies.
Özet
The expression and purification of large amounts of recombinant protein complexes is an essential requirement for structural biology studies. For over two decades, prokaryotic expression systems such as E. coli have dominated the scientific literature over costly and less efficient eukaryotic cell lines. Despite the clear advantage in terms of yields and costs of expressing recombinant proteins in bacteria, the absence of specific co-factors, chaperones and post-translational modifications may cause loss of function, mis-folding and can disrupt protein-protein interactions of certain eukaryotic multi-subunit complexes, surface receptors and secreted proteins. The use of mammalian cell expression systems can address these drawbacks since they provide a eukaryotic expression environment. However, low protein yields and high costs of such methods have until recently limited their use for structural biology. Here we describe a simple and accessible method for expressing and purifying milligram quantities of protein by performing transient transfections of suspension grown HEK (Human Embryonic Kidney) 293F cells.
Giriş
Moleküler hücre biyolojisi hızlı ilerleme ve tıp geliştirilmiş ilaçların sürekli bir ihtiyaç yapısal biyologlar giderek daha karmaşık protein yapılarının bakmak için bir ihtiyaç yarattı. Bu genellikle karmaşık bir katlama ve enzimatik aktivitesini desteklemek için özel bir post-translasyonel modifikasyonlar, moleküler şaperonlar ve ko-faktörlerini de gerektirebilir. Bakteriyel ekspresyon sistemleri kullanılarak elde edilmiştir Protein Data Bank mevcut yapıların büyük çoğunluğu iken, prokaryotes bu değişiklikler çok sayıda yapamazsanız ve birçok temel ökaryot ko-faktörler yoksundur. Bu küçük sinyal molekülleri tarafından yanı sıra nükleer, hücre yüzeyinde ve ayrıntılı katlama makineleri gerektiren salgılanan proteinler aktive edilmiş büyük çok-alt birim komplekslerinin çalışma için bir sorun olabilir. E. bir dizi coli suşları bu sınırlamaların 1 bazılarının üstesinden gelmek için tasarlanmış edilmiştir. M Son yıllarda, ancak, kullanımonlar güvenilir diğer sistemlerde 2 ifade aksi takdirde sorunlu ökaryotik proteinler üretmek çünkü ammalian ifade sistemleri artmaktadır. Bugün kimyasal aracılığında transfeksiyon, viral transdüksiyon arasında değişen çeşitli teknikler vasıtasıyla kararlı ve geçici memeli ifadesi hücre çizgileri elde etmek mümkündür, örneğin elektroporasyon, doğrudan enjeksiyon 3 fiziksel gen transferi. Bu yöntemlerin hepsi avantaj ve dezavantajları kendi seti var ise, bunlardan sadece birkaç ya da çok pahalı ve / veya zaman alıcı olmak yapısal çalışmalar için uygundur.
Burada askı büyümüş memeli hücrelerinde yapısal biyoloji, protein kompleksleri ifade etmek için, çok basit, hızlı, ucuz ama son derece etkili bir yöntem açıklanmaktadır. Yaklaşım (örneğin, 293F Serbest HEK hücreleri) bir insan embriyonik böbrek (HEK) hücre hattının geçici ko-transfeksiyon kullanır. Bu hücreler, HEK 293 mesaf elde edilmiştirII hattı, serumsuz ortam kullanılarak yüksek yoğunluğa (örneğin 293 Antarctica sentezlenmesi ortamı) ulaşan, süspansiyon kültürleri içinde büyümeye adapte edilir. Hücreler, bundan sonra, geçici polietilenimin dallı bir versiyonu (PEI), endositoz 5 konak hücre içine girer, DNA / PEI kompleksleri oluşturarak memeli hücrelerinin 4 arasında geniş bir aralıkta çalışması için rapor edilmiş bir ucuz polimerik bir reaktif kullanılarak transfekte edilir. Bu yöntem büyük ölçekte (30 mi) ve (300 ml kadar) büyük ölçekli deneyler için uygundur ve saflaştırılmıştır protein komplekslerinin yüksek seviyelerde üretebilir. Bu kompleks bir katlama makineleri, ko-faktörler ya da bakteri, maya ve böcek hücreleri tarafından yapılamaz, özellikle post-translasyonel modifikasyonlar gerektiren protein çalışmaları için yararlıdır.
Bu protokolde Sin3A transkripsiyonel represyon kompleksinden üç proteinin merkezi skafoldun ifadesi ve saflaştırılması sunuyoruz. Bu histon oluşmaktadırDeacetylase 1 (HDAC1), Arızalı suskunluğu 3 (SDS3) arasında Supresor ve Switch-bağımsız 3 (Sin3A). Arıtılmış karmaşık ve yüksek verimlilik kristallendirme çalışmalarında kullanılmaktadır.
Protokol
NOT: Protokol, bu nedenle reaktif hacimleri ve miktarları orantılı ölçekli gerektiğini ifade herhangi bir ölçek için uygundur. Uygun bir memeli ifade vektörü, bu protokol için kullanılmalıdır. Burada uygun bir klonlama (Şekil 1) ikinci sınırlama enzimleri seçimine bağlı olarak, bir afinite etiketi dahil veya hariç tutulması sağlayan değiştirilmiş pcDNA 3.1 sentezleme vektörünü kullandık. Aşağıdaki protokol, büyük ölçekli bir transfeksiyon açıklanmaktadır.
1 litrelik silindir şeklinde şişelerde geliştirilmiştir: 1. Büyük Ölçekli Kültür / transfeksiyonu
Büyüme ve standart protokollere göre, süspansiyona adapte olmuş HEK293F hücreleri korumak. Tipik olarak 30 ila 100 ml 'lik başlangıç kültürleri 250 ml konik bir hücre kültürü şişelerinde büyütülür.
- Her bir 1 litrelik silindir bir şişe içinde 300 ml lik bir son hacim için 0.5 x 10 6 hücre / ml tohum hücreleri.
Not: Silindir şişe en fazla 150 ml 'lik bir minimum uyumSüspansiyon kültürünün 300 mi. Büyük ölçekli nakiller için birden fazla şişe kullanmayın. - Hücreler 1.0 x 10 6 hücre / ml 'lik bir yoğunluğa ulaşana kadar 37 ° C'de bir orbital çalkalayıcı bir inkübatör içinde 24 saat 120 rpm'de ve% 5 CO2 inkübe edin (hücreler yaklaşık olarak her 24 saatte bölmeliyiz).
- Filtre ve sterilize edilen 300 ug DNA, toplam Pipet 3 saniye boyunca kuvvetli bir şekilde 30 ml PBS ve girdap içine (tamamlayıcı şekli).
Not: milyon başına transfekte edilmiş hücrelerin DNA 1 ug toplam kullanın. Iki ya da daha fazla plazmidin edilecek ise hücrelere DNA oranı sabit kalır, böylece her bir miktarını azaltmak birlikte-transfekte edilmiştir. - 1.2 ml 0.5 mg Ekle / 3 saniye boyunca kuvvetlice PBS / DNA çözümü ve vorteks PEI-süzülerek sterilize ml.
- 20 dakika boyunca oda sıcaklığında inkübe karışımı.
- DNA ekleme / PEI karışımı hücrelere - 1 x 10 6 hücre / ml (adım 1.3) de bir yoğunlukta olması gereken.
- Müşterek transfeksiyon sonrasında hücreler inkübeBir başka 37 ° C de 48 saat, 120 rpm'de ve% 5 CO2 boyunca orbital bir gece boyunca kuluçkaya yatırılmaktadırlar.
- 5 dakika boyunca 3000 x g'de santrifüj ile hücreler -80 ° C'de saklayın pelet Hasat hücre içi proteinlerdir.
Not: Alternatif olarak, kültür ortamı üzerinde% 5 CO2 ile değiştirilir ve şişe kapağı kapatılır değilse (CO2), kuluçka makinesi çalkalanarak bir standart kullanır. Atmosfer her bir geçit (normal olarak her 2 gün) ile değiştirilmesi gerekir.
Tüm Hücre ekstresi 2. Protein saflaştırma kompleks
Bu protokol, FLAG-etiketli proteinleri kullanılarak nükleer komplekslerinin saflaştırılması için optimize edilmiştir.
- Hücre topaklarını içine defrost ~ önceden soğutulmuş lizis tamponu, 40 ml (100 mM potasyum asetat, 50 mM Tris, pH 7.5,% 5 gliserol,% 0.3 Triton X-100, proteaz inhibitörleri) kültür bir L başına.
- Yeniden askıya pipetleme ve birkaç kez aşağı pelet (köpük önlemek vorteks yapmak değil).
- İyice bir cam homojenleştirici kullanılarak hücrelerin yeniden askıya. 3 siklus (15 sn, 15 sn kapalı) için sonikasyon. 4ºC'de 25 dakika boyunca 30.000 x g'de santrifüj ve süpernatant saklayın.
- Dengeye reçine dengeleme tamponu (100 mM potasyum asetat, 50 mM Tris pH 7.5) ile üç kez yıkanarak kültürün her bir litresi için agaroz reçinesi paketlenmiş bir anti-flag 1.25 ml.
- Bir ya da daha fazla 50 ml santrifüj tüplerine afinite reçinesiyle adım 2.3 bütün hücre ekstresi inkübe yavaşça 4 ° C'de 30-120 dakika için örnek döndürün.
- 4 ° C, ıskarta süpernatan 1 dakika boyunca 3000 x g'de santrifüjleyin.
- Önceden soğutulmuş tampon 1 45 ml reçine ile yıkayın (100 mM potasyum asetat, 50 mM Tris, pH 7.5,% 5 gliserol,% 0.3 Triton X-100). 1 dakika boyunca 3.000 x g'de santrifüj ve süpernatant atın.
- Adımı tekrar 2.7 tuz tamponu kullanılarak düşük tuzlu tampon (50 mM potasyum asetat, 50 mM Tris pH 7 ile (300 mM potasyum asetat, 50 mM Tris pH 7.5,% 5 gliserol), ardından0,5,% 5 gliserol) TEV yarılması tamponu (50 mM potasyum asetat, 50 mM Tris, pH 7.5, 0.5 mM TCEP).
NOT: Her yıkama emin olun tamamen artık reçine yeniden askıya ve yeterli kısa, yani olduğunu. - Reçine 10 ul numune toplamak ve analiz için 2x protein yükleme tamponu (bağlı protein kontrol) 1 hacim içine sulandırmak. Reçineden antikoru serbest önlemek için indirgeyici maddeler kullanmayın.
- Bir 15 ml santrifüj tüpüne önceden soğutulmuş TEV yarılma tamponu ve transfer 8-10 ml reçine yeniden askıya.
- Ekle ~ 40 orijinal kültür bir L başına (1 mg / ml stok) TEV proteaz ug ve birçok kez aşağı ve yukarı pipetlenerek ile iyice karıştırın.
- Protein oksidasyonunu önlemek için% 100 N 2 gazı ile tüp atmosferi değiştirin.
- Yavaşça 4ºC'de O / N döndürmek.
- 10 dakika boyunca 3000 x g'de santrifüj. Uygun bir molekül ağırlığı kesmesi ile bir ultra santrifüj filtre içine süpernatant aktarın ve konsantre500 ul kadar.
- Konsantre protein, 10 ul numune toplamak ve analiz için 2x protein yükleme tamponu 1 hacim içine sulandırmak. (TEV kontrol sıyırma sıvısı).
- Reçine, 10 ul numune toplayın ve analiz için 2x proteini yükleme tamponu içinde 1 hacim içine seyreltilir. Reçineden büyük miktarlarda antikor serbest önlemek amacıyla indirgeyici maddeler kullanmayın. (Post-TEV reçine kontrol).
- Jel filtrasyon tamponu (50 mM potasyum asetat, 50 mM Tris pH 7.5, 0.5 mM TCEP) ile boyut dışlama kromatografisi kolonu dengelenmesi.
- 0.22 um bir filtre ile filtre proteinini
- Kolona numunenin yükleyin ve fraksiyonlarım toplamak.
- Adım 2.9, 2.15 ve 2.16 ve analiz için bir SDS-PAGE ve Coomassie boyaması, adım 2.19 ikinci jel filtrasyon fraksiyonlardan çalıştırın örnekleri.
Not: Bu, hedef proteininin ekspresyonunu doğrulamak için adımlar 2.9, 2.15 ve 2.16 önce jel süzülerek örnekler SDS-PAGE çalıştırmak için tavsiye edilir.
Sonuçlar
Burada HDAC1, SDS3, Sin3A üçlü kompleksin bir 2 L (8 x 250 mi kültür) geçici ko-transfeksiyon ve saflaştırılmasını göstermektedir. HDAC1 üzerindeki etkisi ve SDS3 Sin3A bir HDAC-etkileşim alanı (HID) aracılığıyla Sin3A etkileşime girer. Kültürün litresi başına kompleksi 1 mg a kadar bir tipik saflaştırma ürünleri.
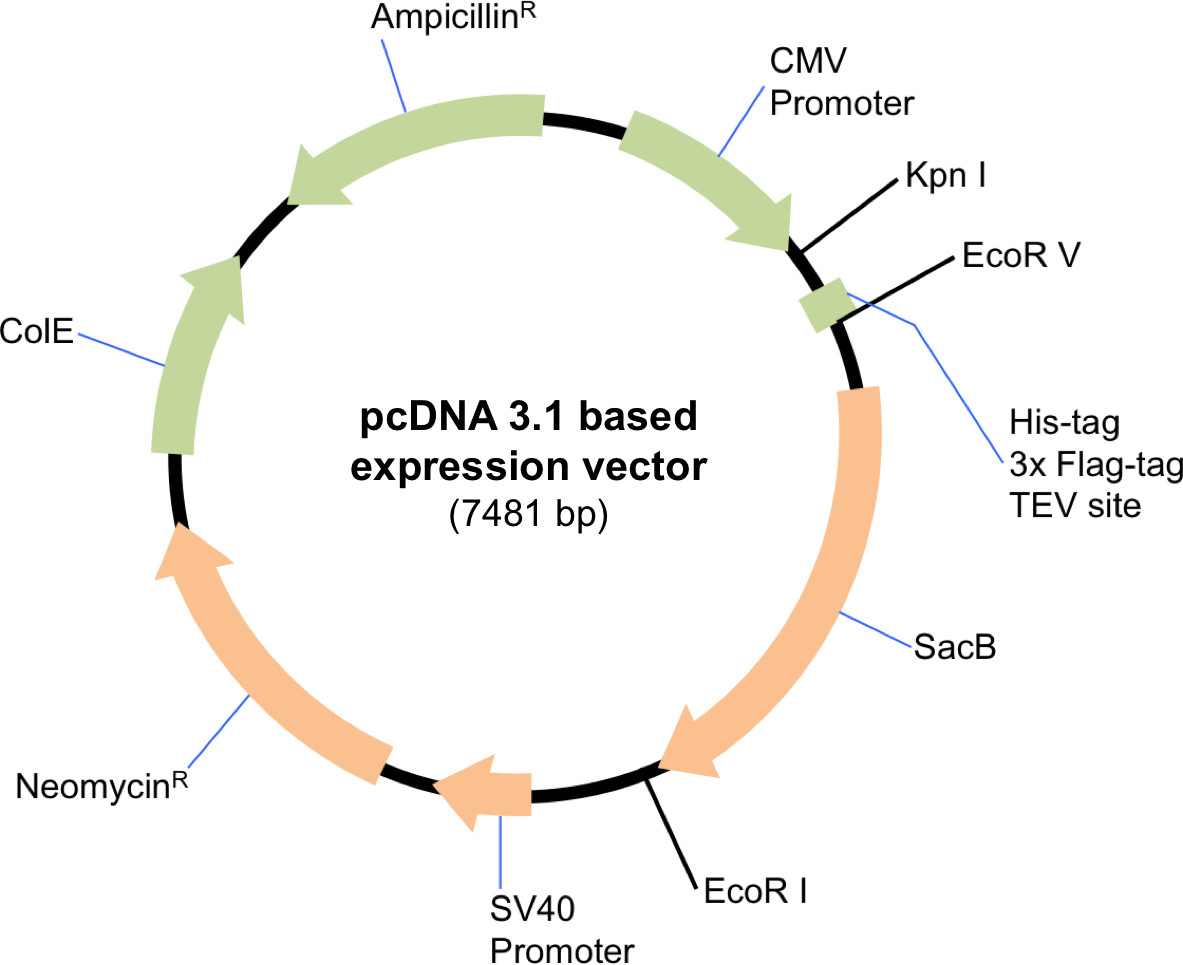
Şekil değiştirilmiş pcDNA 3.1 ekspresyon vektörünün şematik 1.. Plazmid Sin3A amino terminusunda afinite etiketi TEV yarılma sitesini içermeli EcoRV ve EcoRI ile sindirildi. HDAC1 ve SDS3 arasında etiketlenmemiş sürümlerini klonlanması amacıyla, vektör Kpnl ve EcoRI ile sindirildi.
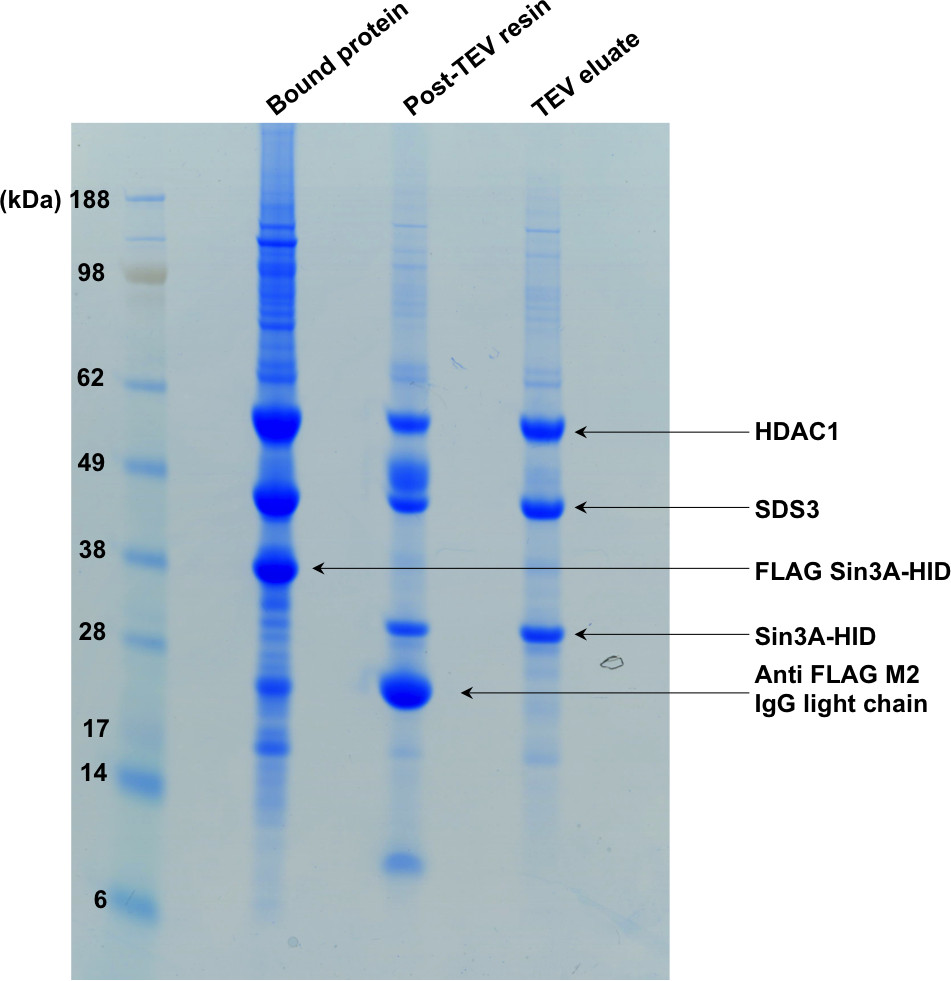
Şekil 2. SDS-PAGE saflaştırma birinci aşamasını gösteren. "Bağlı protein," şerit afiniteli bir reçine bağlı kompleksini göstermektedir. Sindirme işlemini takiben, TEV, Sin3A-HID üzerinde etiketi mevcut keislir ve jelin ikinci ve üçüncü şerit gösterildiği gibi karmaşık reçineden elüe edilir.
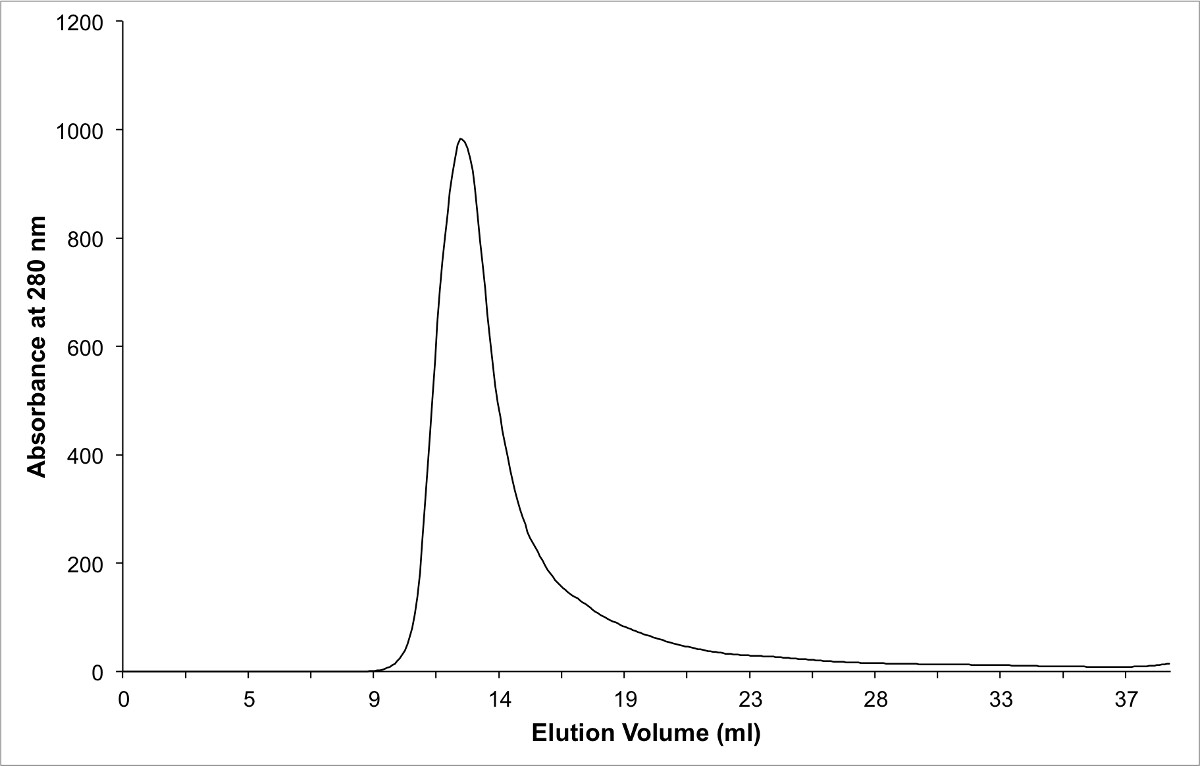
Şekil protein kompleksi kullanılarak saflaştınldı boyut dışlama kromatografisi 3. kromatogramı. Bu çözelti içinde bir dimer oluşturur, çünkü saf kompleks boşluk hacminde elüt unutmayın.
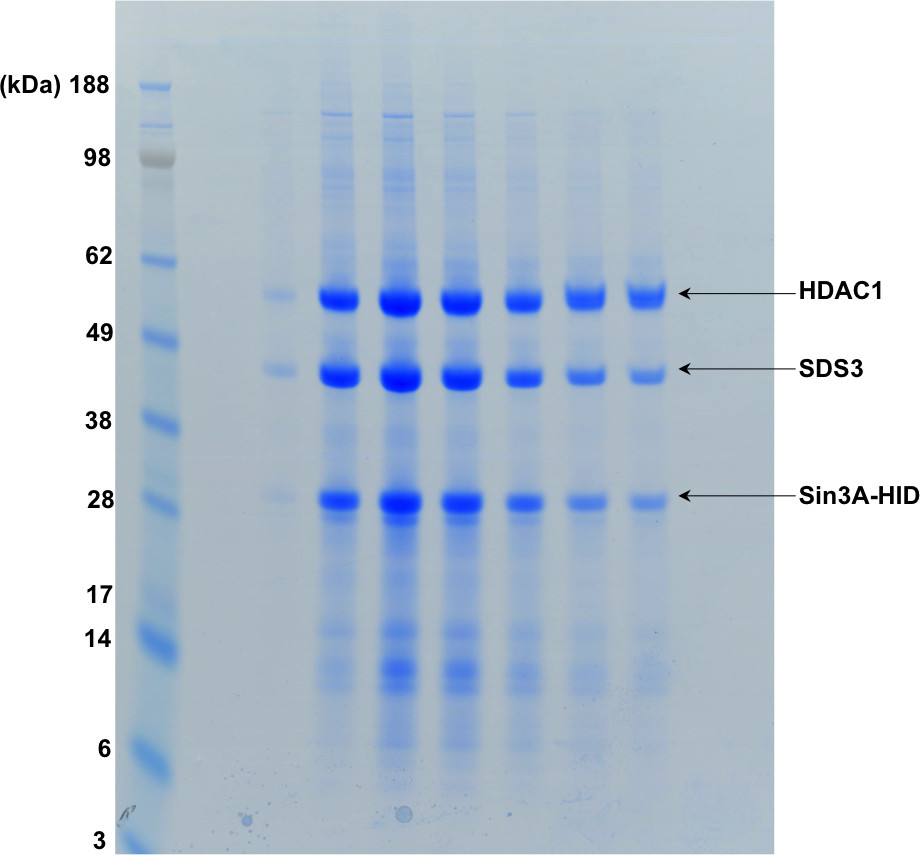
Şekil 3'te gösterilen jel filtrasyon fraksiyonların gösteren Şekil 4, SDS-PAGE.
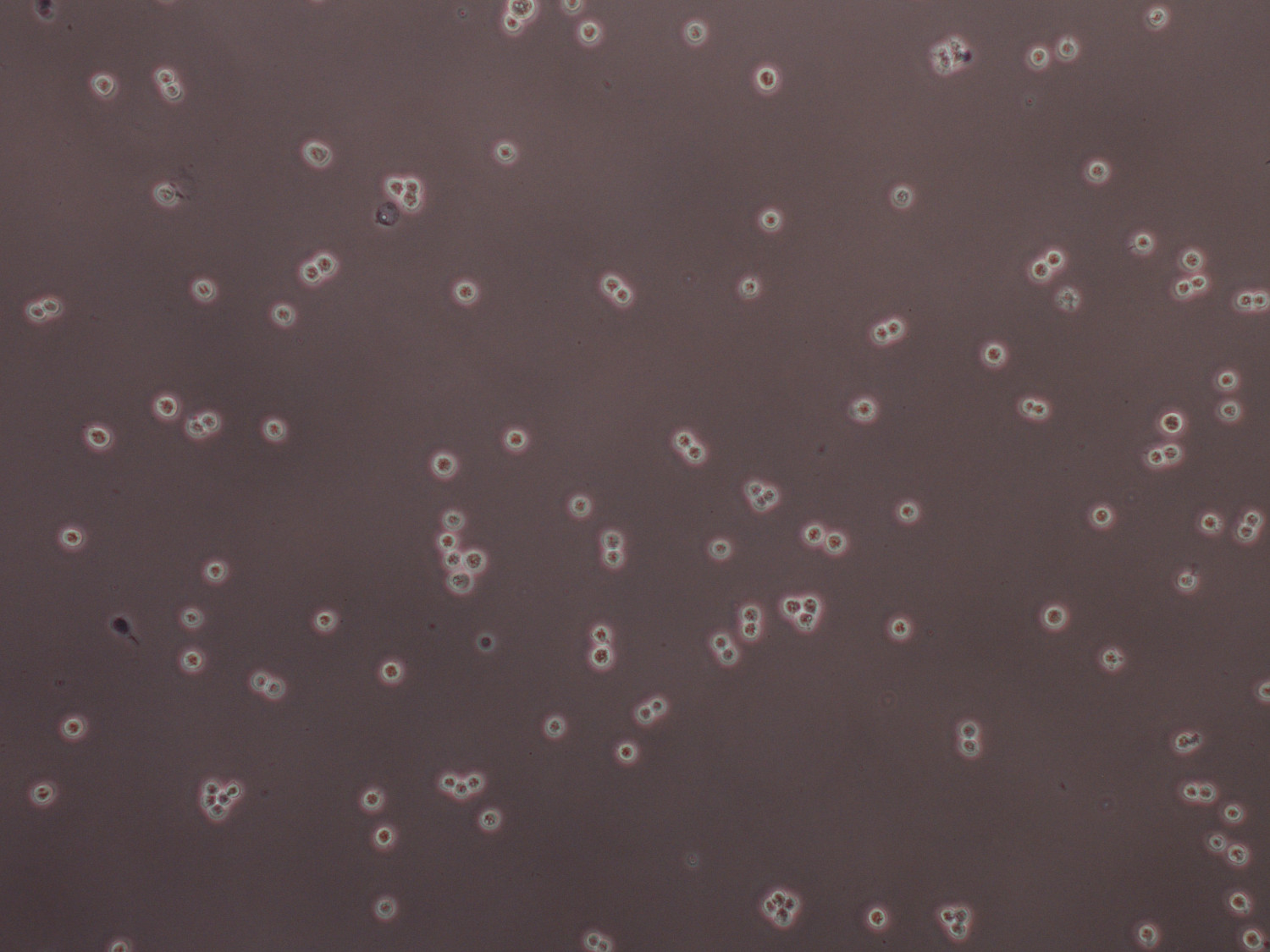
6 hücre / mL Ready 2.3x10 Şekil 5'de Tripan mavi boyalı HEK 293F transfekte edilebilecek hücreler. Büyük kümeler, yaklaşık 25 saniye boyunca kuvvetli bir girdap tarafından kırılmış olabilir iken, sadece hücreler, tek veya bölünen hücreler olarak mevcut olması gerekmektedir.
| Sorun | Olası nedenleri | Eylem |
| Düşük protein verimi. | Düşük sayıda hücrelerin transfekte edildi. | Emin hücre yoğunluğu 1.0 x 10 6 kültüre transfeksiyon reaksiyon karışımının eklemeden önce yaklaşık olduğundan emin olun. |
| Hücreler çok kez pasajlandı olabilir. | Yaklaşık 90 geçişten sonra Taze stok hücrelerini kullanınyaşları. | |
| DNA, düşmüş ya da yabancı maddeler, yüksek bir miktarda olabilir. | Emin plazmid DNA, kullanılmakta olan 1.8 ve 2.0 arasında bir 260/280 oranına sahiptir. Bir agaroz jeli üzerinde çalışan DNA kalitesini değerlendirmek için tavsiye edilir. | |
| Protein (ler) olarak ifade edilen sabit ya da yeterince çözünür değildir. | Önce transfections ölçekleme yukarı-küçük ölçekli Farklı yapıları test edin. Emin etiketler ilgilenilen protein (ler) in yapısı ile karışmaz olun. | |
| Hücreler bulutlu bakmak ve sıradışı renk ve / veya koku var. | Hücreler, bakteri ya da maya ile enfekte edilir. | İyi steril teknik her zaman için kullanılmalıdır. Laminer akış davlumbaz buharla dezenfekte eden ve enfeksiyon durumunda, hücre kültür odası UV dezenfekte sorunu içeren yardımcı olur. |
| Hücreler, düşük canlılığı sahiptir. | Medyada yanlış pH. | Emin kültürler CO 2% 5-8 yetiştirilen emin olunher zaman. |
| Hücreler 3.0x10 6 hücre / ml 'den fazla bir yoğunluğa kadar kültürlenmiştir. | Hücreler, 2.5 x 10 6 hücre / ml hemen önce transfeksiyon ve asla 6 10 x 3,0 Yukarıda sözü edilen hücreler / ml üzerinde yoğunluklara büyümüş olmamalıdır. | |
| Afinite saflaştırma işe yaramadı | Protein (ler) olarak ifade varlık değildir. | Yukarıdaki bakın. |
| Arıtma koşulları yanlış olabilir. | (Örneğin, yüksek tuz, düşük tuz, pH). Tampon koşullarını ayarlayın |
Tablo 1. Sorun Giderme.
| Sistem | Avantajları | Dezavantajları |
| E.coli |
|
|
| P. pastoris |
|
|
| Böcek hücrelerinde baculovirüs tanım |
|
|
| Memeli sistemleri Biyoreaktörler |
|
|
| HEK hücreleri süspansiyon 293F |
|
|
Tablo 2. Avantajları ve ana sentezleme sistemlerinin dezavantajları.
Tartışmalar
Bu ifade ile, rekombinant proteinleri ve memeli hücrelerinden çoklu bir alt birim kompleksinin saflaştırılması için büyük miktarda (PEI'ler ticari olarak temin edilebilen lipofilik transfeksiyon reaktifleri daha az maliyeti), bir basit ve uygun maliyetli bir yöntem geliştirdik. Protokol bölümünde tarif edildiği gibi, son derece saf DNA (260/280 1.8 ila 2.0) PEI ile bir arada kullanıldığında, optimum transfeksiyon ve ekspresyon etkinliği ulaşılabilir. Hücreler serum- ve antibiyotik içermeyen ortam içinde kültür olmalıdır, bu nedenle sıkı bir şekilde steril teknik pahalı ve zaman alıcı enfeksiyonları önlemek için pasaj ve transfekte hücreler için gereklidir. Hücre canlılığı,% 90 ya da daha yüksek olmalıdır ve kültürler 2.5 x 10 6 hücre daha yüksek yoğunlukları ile olmamalıdır / hemen transfeksiyondan önce, bu sayede protein verimini düşürür ml. Başarılı transfeksiyon için, kültürler, sadece tek ya da bölünen hücreleri içermelidir. Kümeler gayretle tarafından kırılmış olabilir30 sn (Şekil 5) için lı vorteksleme 20. Ko-transfeksiyon kullanılan her plazmid oranı incelenmiştir olan kompleks bir karma bilgisine göre kullanıcı tarafından değiştirilebilir. Bir kez uygun bir ekspresyon kurulabilir, böylece sentezlenmesi verimliliği, ilgilenilen protein için optimize edilebilir. Arıtma istenmeyen proteolitik bozulması riskini azaltmak için her zaman, protein numune soğuk tutmak yapılmalıdır. Genellikle daha düşük çözünürlük ve / veya enzimatik aktivite kaybı ile sonuçlanan, yapısal elemanlar veya belli proteinlerin aktif alanlarının müdahale edebilir yana etiketler ve saflaştırma tamponların seçimi kritiktir. Küçük ölçekli transfeksiyon, büyük protein komplekslerinin saflaştırılması için çeşitli konstruktlarının test edilmesi için özellikle yararlıdır.
Bugün, farklı yöntem büyük bir çeşitlilik rekombinant proteinlerin ökariyotik (Tablo 2) ekspresyonu için kullanılabilir. Örneğin, Baculoviböcek hücrelerinde sentezleme rus yaygın olarak yüksek transdüksiyon verimliliği ve diğer viral türler 6 ile karşılaştırıldığında sitotoksisite eksikliğine bağlı olarak kullanılır. Bununla birlikte, virüs verme süreci, zaman alıcıdır ve istikrarsızlık virüs uzun süre saklanmasına izin vermez. Öte yandan, maya ekspresyon sistemleri, yüksek protein verimi 7 sonuçlanan fermentasyon kültürlerde hücre çok yüksek yoğunluklar büyüme ihtimalini sunmaktadır. Ama yine de doğru katlanmayacak ve protein partnerleri ile etkileşim için gereken ökariyotik proteinlerin post-translasyonel modifikasyonlar tam çeşitli yoksundur. HDAC3, örneğin, eksprese edilir, fakat E'de bükülmemesini coli. 293F hücrelerinde ifade Ancak, onun ortak bastıncısı (SMRT) ve prokaryotik hücrelerde bulunmayan inositol tetrafosfat (IP4) 8, bir molekül ile kompleks aktif enzimin saflaştırılması mümkün. Bu yöntem ayrıca st arındırmak ve kristal çözmek için bize izin verdiHDAC1 üzerindeki etkisi benzer şekilde 9 IP4 aktive edilir nurd kompleksinde mta1 etkileşim kezlerinin. İdeal olarak, biz her zaman onların doğal, fizyolojik bir ortamda ökaryotik proteinleri ifade etmek istiyorum. Biyoreaktörler 10-12, HEK 293, EBNA1-hücreleri kullanan memeli ekspresyon sistemleri de tarif edilen ve proteininin çok yüksek seviyelerini elde edilmiştir, fakat bu kullanımı da karmaşıktır olabilir edilmiştir.
Önerilen yöntem, bakteri, maya ve biyoreaktör sistemlerinde tanımlanması için basit ve erişilebilir bir alternatiftir. Ekspresyon yöntem hızlıdır ve silindir şişe, kavanoz bir atmosfer,% 5 CO2 ve standart çalkalanarak kuluçka kullanılan ile değiştirilir, özellikle pahalı ekipman kullanımını gerektirmez. Birden fazla plazmidler ortak transfeksiyonu ve kültürü içinde> 1 mg / L'lik bir verimle en fazla beş proteinlerle de kompleksler saflaştırmak için aşağıdaki protokol kullanılmıştır. İlginç bir şekilde, sistem kararlı uslu komplekslerinin tanımlanmasını sağlar. Örneğin, exHDAC1 ve Sin3A ikili kompleksinin sıkıştırma protein sınırlı verimlerini verdi, ancak SDS3 ilavesi daha yüksek miktarlarda 5-kat ve bu nedenle uygun yapılar ve kristalize edilmesine yönelik olarak kararlı kompleksler seçimi yapısal biyologdan kılavuzları ile sonuçlanmıştır.
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
Biz bu iş ve Leicester Çekirdek Biyoteknoloji Hizmetleri Üniversitesi için kullanılan ifade yapıları hazırlamak için Dr Xiaowen Yang (PROTEX klonlama servisi) teşekkür etmek istiyorum. Bu çalışma BBSRC öğrencilikle tarafından desteklenen, Wellcome Trust Programı ve Kıdemli Araştırmacı hibe WT085408 & WT100237 ve BBSRC RM31G0224 hibe.
Malzemeler
| Name | Company | Catalog Number | Comments |
| FreeStyle HEK 293F cells | LifeTechnologies | R790-07 | |
| FreeStyle 293 Expression Medium | LifeTechnologies | 12338-018 | |
| Anti-FLAG M2 Affinity Gel | SIGMA | A220 | |
| 250 ml Erlenmeyer Flask with Vented Cap | Corning | 431144 | |
| Roller bottles with vented caps | Corning | 01836-02 | |
| Polyethylenimine, 25 kDa, branched | Sigma-Aldrich | 408727 | Make 0.5 mg/ml stocks in H2O, adjust pH to 7.0 with dilute HCl and store at -20 - 4ºC |
| Mammalian expression vector | |||
| Dulbecco’s Phosphate Buffered Saline (DPBS) | Sigma-Aldrich | D8537 | |
| 0.22 µm Centrifugal Filter Units | Amicon | UFC30GV00 | |
| 15 ml Ultra centrifugal filters (10 kDa cut-off) | Amicon | UFC901008 | |
| Superdex 10/300 GL | GE Healthcare Life Sciences | 17-5175-01 |
Referanslar
- Baneyx, F. Recombinant protein expression in Escherichia coli. Current opinion in biotechnology. 10 (5), 411-421 (1999).
- Aricescu, A. R., Owens, R. J. Expression of recombinant glycoproteins in mammalian cells: towards an integrative approach to structural biology. Current opinion in structural biology. 23 (3), 345-356 (2013).
- Kim, T. K., Eberwine, J. H. Mammalian cell transfection: the present and the future. Analytical and bioanalytical chemistry. 397 (8), 3173-3178 (2010).
- Boussif, O., Zanta, M. A., Behr, J. P. Optimized galenics improve in vitro gene transfer with cationic molecules up to 1000-fold. Gene therapy. 3 (12), 1074-1080 (1996).
- Godbey, W. T., Wu, K. K., Mikos, A. G. Poly (ethylenimine) and its role in gene delivery. Journal of Controlled Release. 60 ((2-3)), 149-160 (1999).
- Beljelarskaya, S. N. Baculovirus expression systems for production of recombinant proteins in insect and mammalian cells. Molecular Biology. 45 (1), 123-138 (2011).
- Cregg, J. M., Vedvick, T. S., Raschke, W. C. Recent advances in the expression of foreign genes in Pichia pastoris. Nature Biotechnology. 11 (8), 905-910 (1993).
- Watson, P. J., Fairall, L., Santos, G. M., Schwabe, J. W. R. Structure of HDAC3 bound to co-repressor and inositol tetraphosphate. Nature. 481 (7381), 335-340 (2013).
- Millard, C. J., Watson, P. J., et al. Class I HDACs Share a Common Mechanism of Regulation by Inositol Phosphates. Molecular Cell. 51 (1), 57-67 (2013).
- Tom, R., Bisson, L., Durocher, Y. Transfection of HEK293-EBNA1 Cells in Suspension with Linear PEI for Production of Recombinant Proteins. CSH protocols. , pdb.prot4977 (2008).
- Durocher, Y., Perret, S., Kamen, A. High-level and high-throughput recombinant protein production by transient transfection of suspension-growing human 293-EBNA1 cells. Nucleic Acids Research. 30 (2), (2002).
- Baldi, L., Muller, N., et al. Transient Gene Expression in Suspension HEK‐293 Cells: Application to Large‐Scale Protein Production. Biotechnology Progress. 21 (1), 148-153 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır