Method Article
Microbead Implantación en el embrión de pez cebra
En este artículo
Resumen
The zebrafish is an excellent model system for genetic and developmental studies. Bead implantation is a valuable tissue manipulation technique that can be used to interrogate developmental mechanisms by introducing alterations in local cellular environments. This protocol describes how to perform microbead implantation in the zebrafish embryo.
Resumen
El pez cebra se ha convertido en un valioso sistema de modelo genético para el estudio de la biología del desarrollo y la enfermedad. El pez cebra comparten un alto grado de conservación genómica, así como similitudes en los procesos celulares, moleculares y fisiológicas, con otros vertebrados, incluyendo los seres humanos. Durante la ontogenia temprana, embriones de pez cebra son ópticamente transparente, permitiendo a los investigadores visualizar la dinámica de la organogénesis utilizando un sencillo microscopio estereoscópico. Implantación Microbead es un método que permite la manipulación de tejido a través de la alteración de los factores en entornos locales. Esto permite a los investigadores a ensayo los efectos de cualquier número de moléculas de señalización de interés, tales como péptidos secretados, en los puntos espaciales y temporales específicos dentro del embrión en desarrollo. Aquí, detallamos un protocolo de cómo manipular y cuentas de implantes durante el desarrollo del pez cebra temprano.
Introducción
Investigadores de la biología del desarrollo utilizan una amplia gama de métodos celulares, moleculares y genéticos para descubrir los mecanismos que controlan cómo se forma un organismo. Entre estos enfoques, manipulación de los tejidos es una herramienta clave en el desciframiento de preguntas complejas sobre el destino celular, movimiento celular, y la organización de los tejidos. Una manera de alterar entornos tisulares locales es a través de la aplicación quirúrgica de microperlas que se utilizan para entregar una fuente focal de proteínas u otras moléculas de señalización 1. Este tipo de manipulación experimental ha sido ampliamente aplicado en modelos embriología vertebrados clásicos, como la rana y el polluelo 2.
El pez cebra se ha convertido en un importante organismo modelo para el estudio de los vertebrados de organogénesis y también proporciona muchas ventajas únicas para el modelado de la enfermedad 3-5, ya que comparten alta conservación genética con los humanos 6. En particular, la transparencia óptica y exel desarrollo interno del embrión de pez cebra ofrece un punto de vista sin igual para la observación de la ontogenia tejido 3-5. La implementación de las pantallas adelante genéticos a gran escala ha generado un poderoso depósito de cepas mutantes de pez cebra para el estudio adicional 7,8, y la identificación de las técnicas de detección alternativos que pueden llevarse a cabo de manera eficiente a escala reducida en los laboratorios individuales 9,10. Más trabajo experimental con el pez cebra se ha facilitado gracias a los avances en las metodologías transgénicas y revertir enfoques genéticos 11,12, así como la genética química 13-15.
Técnicas de manipulación de los tejidos, tales como la aplicación de microperlas, no han sido tan ampliamente empleado en el pez cebra, pero, no obstante, proporcionar una herramienta útil para comprender mejor la señalización celular durante el desarrollo. Implantación Microbead se ha utilizado para interrogar a los procesos de formación de órganos en la retina de pez cebra16,17, 18 de corazón, cerebro 19-22, cresta neural 23, y la aleta 24,25. En estos y otros estudios, los granos se han aplicado durante el desarrollo para entender la difusión de moléculas de señalización 26, cómo gradientes afectan la migración celular 27 y el patrón axial 28. Más recientemente, microperlas se han utilizado para evaluar los mecanismos de regeneración en adultos de pez cebra 29. En estudios de desarrollo, por ejemplo, el trabajo microperla pez cebra ha proporcionado una visión de los mecanismos de formación de las extremidades a través de estudios de la aleta pectoral 25. El brote aleta pectoral pez cebra es homóloga a la yema de la extremidad anterior en el ratón 30 y 31 del polluelo. El esbozo de la extremidad de los vertebrados tiene dos nodos esenciales de señalización: la zona de actividad polarizante (ZPA) que establece el eje antero-posterior a través de la expresión de Sonic hedgehog (Shh) y objetivos de genes Hox aguas abajo,y la cresta ectodérmica apical (AER) presente en la punta de la yema de la extremidad, que actúa para establecer proximal a la identidad de la extremidad distal a través de la expresión de factores de crecimiento de fibroblastos (FGF). Mediante la implantación de microesferas de FGF empapadas en pez cebra mutantes genéticos Shh, investigadores FGF identificado como esencial para la progresión del ciclo celular y el crecimiento de la extremidad de vertebrados 25. Además de Fgf cascadas de señalización de Shh y que establecen la identidad posicional, estudios pioneros utilizando el primordio de la extremidad del polluelo identificado el ácido retinoico (RA) como una molécula que podría imitar la acción de la región de polarización para establecer la identidad anterior a posterior 32. Estos experimentos implicados colocando pequeñas tiras de papel Whatman empapado-RA en la extremidad de pollo para evaluar los patrones dígitos 32. Además, los investigadores han realizado otros estudios elegantes que emplean el uso de microperlas, el trasplante de células, y exógenoTratamientos con AR en el pez cebra para determinar que la AR actúa para proporcionar largo alcance señales posicionales en el cerebro posterior pez cebra y mesodermo 28. Sin embargo, en la actualidad quedan muchas preguntas acerca de los roles de factores como FGF y RA de señalización durante numerosos aspectos del desarrollo de los vertebrados. Los efectos de señalización de la AR, actuando como un morfógeno, afectan muchos órganos 33, como el corazón en desarrollo 34 y los progenitores renales, donde RA especifica células renales proximales tipo destinos 35-39. Una mayor comprensión de este tipo de temas podría beneficiarse significativamente de los estudios experimentales utilizando técnicas de manipulación de tejidos y de implantación microperla.
Mientras que un menor número de estudios se han realizado con la implantación microperla en el pez cebra, en comparación con modelos como el pollo, las que se han llevado a cabo han sido muy informativo. Una razón de la escasez de la implantación microperla-investigación basada en el embrión de pez cebra es likely la noción de que hay desafíos técnicos difíciles, basado en el tamaño del embrión, que constituyen un impedimento para realizar con éxito tales manipulaciones. Sin embargo, la implantación de microperlas en embriones de pez cebra se puede aprender con la práctica y asistido través de la observación visual de la técnica, y por lo tanto puede llevarse a cabo como un medio para interrogar a los mecanismos de desarrollo. Aquí, demostramos la aplicación precisa de una microperla en el embrión de pez cebra, que puede ser utilizado para la realización de una amplia variedad de ensayos sobre la formación de tejido y la morfogénesis celular.
Protocolo
Los procedimientos para trabajar con embriones de pez cebra que se describen en este protocolo fue aprobado por el Comité de Cuidado y Uso de Animales Institucional de la Universidad de Notre Dame.
1. Preparación de Ringer Solución
- Prepare una solución de NaCl 116 mM, 2,9 mM KCl, 3,6 mM CaCl 2 y 5 mM Hepes con ultrapura H2O través agitación continua para evitar la precipitación de sales.
- Después de la adición de sales y mientras la solución todavía se agita, añadir 100 unidades / ml de penicilina y por 100 g de estreptomicina por ml.
- Después de añadir todos los antibióticos y sales, realice la esterilización del filtro de la solución y almacenar en el recipiente estéril.
Nota: N-feniltiourea (1-fenil-2-tiourea) o PTU se pueden añadir a la solución de Ringer para bloquear la formación de pigmento en grano embriones implantados sin consecuencias negativas para la salud del embrión. Para preparar la solución de bloqueo / pigmentación de Ringer, use un concentración de 0,003% PTU. Debido a la baja concentración de la PTU que se añade, se aconseja que un mayor volumen de solución de Ringer hacerse, por lo menos 1 L, para evitar la adición de cantidades minúsculas de polvo PTU. Añadir PTU durante el paso 1.2, mientras que la solución se agitaba.
2. Preparación de la solución tricaína
- Añadir 2 g de acetato de 3-aminobenzoato de sal metanosulfonato (tricaína) por L de solución 0,1 M Tris además, de un stock de 1 M equilibrada a un pH de 9,5 y hecho con ultrapura H 2 O.
Nota: tricaína será utilizado para la eutanasia de los embriones de pez cebra en el punto de tiempo deseado para ensayar fenotipos implantación de bolas.
3. Preparación de la solución E3
- Hacer una solución de NaCl 0,25 M, KCl 10 mM, 12,5 mM CaCl 2, y 16,6 mM MgSO 4 a 1 L de agua ultrapura para crear 1 L de E3.
- Añadir 200 l de azul de metileno a la solución E3 para inhibir el crecimiento de hongos.
4. Agujas Pulling para Microbead Transferencia
- Use fuego pulido de vidrio de borosilicato con filamento a una OD: 1,0 mm, ID: 0,5 mm, en una longitud de 10 cm.
- Coloque el vidrio borosilicatado en un extractor de micropipeta para preparar finas agujas.
Nota: Los siguientes cuatro dimensiones se pueden utilizar como punto de partida para tirar de las agujas: Calor = 540, Pull = 245, Velocidad = 200, y el Tiempo = 125. - Después de tirar un número adecuado de agujas, almacenar en plástico cubierto placas petri, colocados en tiras de plastilina o cinta adhesiva para evitar romper la punta de la aguja, hasta su uso.
- Para recortar la punta de la aguja al tamaño orificio deseada, utilice un par de pinzas finas para anotar el extremo de la aguja.
Nota: Tamaño de la aguja orificio variará dependiendo del tamaño de microperlas siendo utilizado así como las preferencias de manipulación de usuario. Un buen punto de partida es diámetros embarcación en un rango entre 100 y 200 micras si se utilizarán microperlas que van desde 50 hasta 100 micras. - Príor de usar, inserte la aguja recortado en el soporte de tubo capilar a la moda del instrumento de transferencia microperla completado.
5. Bigote / Lash Preparación Herramienta
- Obtener un pelo, latigazo, u otra pieza pequeña pero firme de filamento de cabello natural o sintético. Cortar cerca de la base del filamento en un ángulo de 45 °. Adherirse la barba a una punta de micropipeta P-1000 con pegamento adhesivo transparente permanente.
6. Microbead Implantación Preparación bandeja
- Mezclar 2 g de agarosa con 100 ml de solución de E3 para hacer una E3 gel de agarosa al 2%.
- Calentar la solución de agarosa al 2% durante 1 min y 30 seg en un matraz Erlenmeyer de 250 ml, agitando el matraz cada 30 seg para evitar el gel de burbujeo terminado.
- Tome la tapa de un 60 mm x 15 mm placa de Petri y colocarlo en un mayor de 150 mm x 15 mm plato con el interior hacia arriba.
- Verter el gel de agarosa caliente en el 150 mm x 15 mm placa de Petri, asegurándose de anclar abajola tapa del plato más pequeño con el dedo índice.
Nota: Permitir una capa delgada de agarosa por debajo de la tapa del plato más pequeño para eliminar la condensación que se forma cuando se vierte el gel; esto hará que las perlas más fácil de ver bajo un microscopio de disección. - A medida que la agarosa se enfría, pero antes de que se solidifica, colocar un molde bien en el gel. Esto permitirá la colocación más fácil de los embriones.
- Nota: Con el fin de evitar burbujas en los pozos, colocar el molde lentamente en un ángulo hasta que está flotando en la parte superior del gel.
- El uso de un microespátula, retire con cuidado el molde bien una vez que el gel se ha solidificado. Añadir solución E3 y almacenar a 4 ° C.
7. Embryo Collection
- Preparar cámaras de apareamiento, separados por divisores, llenándolos con agua del sistema, y luego colocar adulto hembra (s) pares masculinos pez cebra (s) y en las cámaras de O / N.
- Recoge los huevos fertilizados utilizando un colador de malla de alambre fino (etapas embrionarias pueden variar ligeramente).
- Depositar los huevos fertilizados en un, 10 cm de diámetro placa de Petri limpia girando el colador boca abajo y enjuagar con un chorro fino de E3 hasta que no hay huevos que quedan en el tamiz, y hay aproximadamente 25 ml de solución de E3 en el plato.
- Después de la recogida, divida los huevos en varios platos (aproximadamente 50 a 60 huevos por plato) para evitar el hacinamiento, lo que podría conducir a la asincronía del desarrollo dentro del embrague y realizar la recogida de puntos deseados veces difícil.
- Incubar los embriones en solución E3 a 28,5 ° C para permitir la evaluación del desarrollo de acuerdo con la norma serie estadificación pez cebra 40.
Nota: Los embriones deben ser transferidos a E3 / PTU a 24 h después de la fecundación (HPF) para prevenir el desarrollo de pigmento si manipulaciones en las etapas de mayor edad necesitan claridad óptica.
8. Implantación del grano
- Incubar las microperlas en la concentración de molécula de ensayo deseada o el correspondiente s vehículoolución durante el tiempo necesario en un volumen apropiado.
Nota: El investigador puede usar placas de Petri estériles que van 3-6 cm de diámetro, o placas de múltiples pocillos, ambos de los cuales permiten la visualización de las microperlas dentro de la solución. El tiempo puede variar en función del tipo y la cantidad de molécula de interés, y el investigador debe hacer referencia a fabricante o recomendaciones publicadas por la duración de la incubación y otros aspectos como la sensibilidad a la luz y la temperatura. - Una vez que los embriones han alcanzado el punto de tiempo de desarrollo deseado, retire los embriones de sus chorions utilizando unas pinzas finas.
- Incubar los embriones en la solución de Ringer filtrada con antibióticos durante 10 min para aclimatarse a la solución.
- Mientras que los embriones son aclimatando, transferir las microperlas en la placa microperla enclavado dentro de la bandeja de implantación y enjuagarlos en solución Ringer durante 10 min.
Nota: Implante las cuentas dentro de 50 minutos después de llegar a este punto. Esta wenfermo disminuir la probabilidad de que uno implantar un cordón con una concentración más pequeña de la molécula de interés. - Matriz de los embriones en los pocillos de la bandeja de la implantación microperla, teniendo cuidado de orientarlas de manera que el área de interés, donde la microperla será implantado es accesible.
- Hacer una pequeña incisión en el embrión utilizando la aguja de tungsteno.
- Transferir una microperla en el embrión utilizando la pipeta de transferencia microcapilar: presionando el bulbo de la pipeta, tire suavemente de la microperla en la columna capilar, y luego liberar la presión para transferir la microperla en el destino deseado.
- Utilice la herramienta de la barba / pestañas para posicionar la microperla dentro del embrión. Nota: Asegúrese de colocar la microperla en el tejido fuera del sitio de la incisión por lo que el microperla no será expulsado del embrión a medida que sana.
Resultados
Varios tipos de herramientas de manipulación son útiles para el manejo de microperlas durante aplicaciones de investigación (Figura 1). Además, un molde de agarosa simple con pozos pequeños se puede utilizar para mantener el embrión de pez cebra, que es vital para llevar a cabo estos experimentos de manera oportuna y eficiente (Figura 1). La implantación de una microperla se puede realizar en la posición espacial y la etapa temporal de interés, lo que permite a los investigadores estrechen una ventana de acción específico para la molécula de interés.
Aquí, microperlas individuales se implantaron en embriones de pez cebra en la etapa de cola brote o en posteriores puntos de tiempo durante las etapas somitogenesis (Figura 3). Dos microperlas de diferentes tamaños, se enjuaga con solución de Ringer solo, se utilizaron en este protocolo de demostración (Figura 3A, 3B y 3C). Esta implantación microbead en ausencia de cualquier conjugadopequeñas moléculas demuestra que la implantación de bolas puede lograrse sin efectos morfológicos brutos durante el desarrollo adecuado del embrión de pez cebra (Figura 4).
El experimentador puede encontrar dificultades con la maniobra de la microperla en el orificio de punción realizada por una aguja de tungsteno encima del embrión. Para lograr un mejor manejo de la microperla una vez colocado en el embrión por el micro-aguja, a / herramienta de pestañas whisker se puede utilizar. Esto puede ser elaborado con arrojar naturalmente felino o canino bigotes, aunque otros filamentos pestañas naturales o sintéticos pueden ser utilizados (Figura 1). Un suave empujón del microperla, ya sea con la aguja de tungsteno o la herramienta de la barba debe ver la microperla hundirse en la solución de Ringer del molde. Una vez que el microbead se ha hundido en el molde que se debe mover grandes distancias si es necesario utilizando la aguja de tungsteno y una vez encima de la del embrión, la herramienta de la aguja o de la barba se puede utilizar para position la microperla en el embrión. El éxito de la implantación de microperlas se puede medir inmediatamente a través de la visualización en un microscopio estereoscópico, ya que el grano se mantendrá de forma estable posicionado en el tejido. Para evaluar la posición de talón con el tiempo, cada muestra embrión se pueden obtener imágenes a través de Live tiempo-curso de fotografía o comprueba a intervalos periódicos (tal como se representa en la Figura 4) para asegurar que la ubicación de talón no se ha desplazado durante la duración del experimento debido al tejido endógeno morfogénesis. La comprensión de la posición de la perla en el tiempo es crítico para la interpretación más informada de los resultados, tales como la evaluación del efecto de una molécula pequeña en un tejido diana o proceso de desarrollo.
El uso de estos pasos anteriores proporcionará un entorno ideal para incrustar microperlas en el embrión de pez cebra a la vez y posición deseada. En nuestra experiencia, los usuarios novatos de este protocolo de implantación microperla normalmente ganaron el ne habilidadnece- para llevar a cabo la implantación quirúrgica consistente de microperlas en el embrión de pez cebra después de aproximadamente una semana de la práctica.
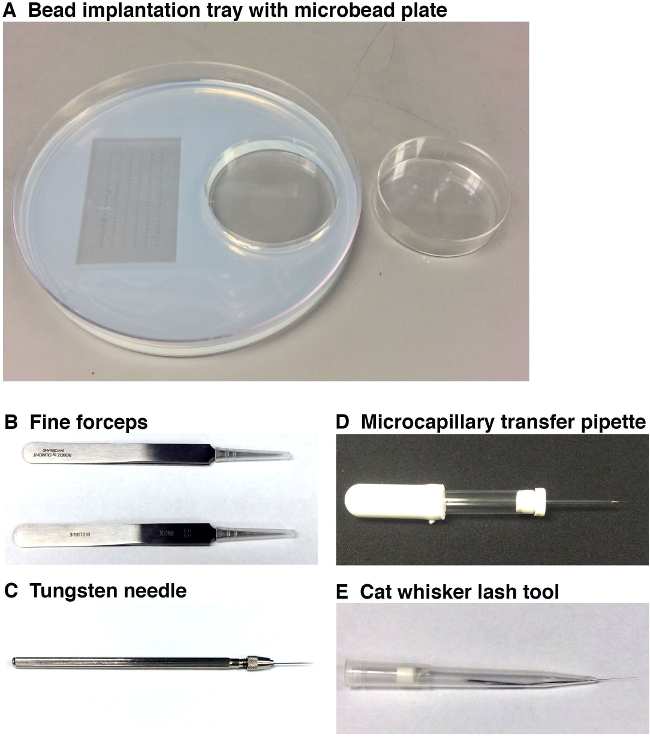
Figura 1. Herramientas utilizadas para llevar a cabo la implantación microperla. (A) La bandeja de la implantación de bolas (izquierda, 15 cm de diámetro) con moldes de embriones (a la izquierda) y una bandeja de incubación microperla (a la derecha, 6 cm de diámetro). Esta bandeja de trabajo permite al investigador para colocar los embriones en la orientación deseada para la implantación de microperlas, y para tener las microperlas preparados para la implantación en estrecha proximidad a la estación de microscopio. Microperlas deben incubarse en pequeña molécula (s) y / o vehículo y luego se enjuagaron en una placa separada de microperlas (derecha) antes de colocarlos en la bandeja de la implantación de bolas que se coloca debajo de la estación microscopio. (B) Dos pares de pinzas finas se utilizan para eliminar el Chorien torno a cada embrión de pez cebra y también para romper el extremo de la aguja microcapilar. Se empleará (C) Una aguja de tungsteno para hacer una punción muy fino en el embrión de pez cebra en el que para posicionar la microperla. (D) La pipeta de transferencia microcapilar será utilizado para recoger y colocar una microperla en la parte superior del embrión de pez cebra cerca del sitio de la punción. (E) La herramienta bigote / pestañas permitirá el posicionamiento suave de la microperla en el sitio de la incisión en el embrión que se hizo previamente por la aguja de tungsteno. Haga clic aquí para ver una versión más grande de esta figura.
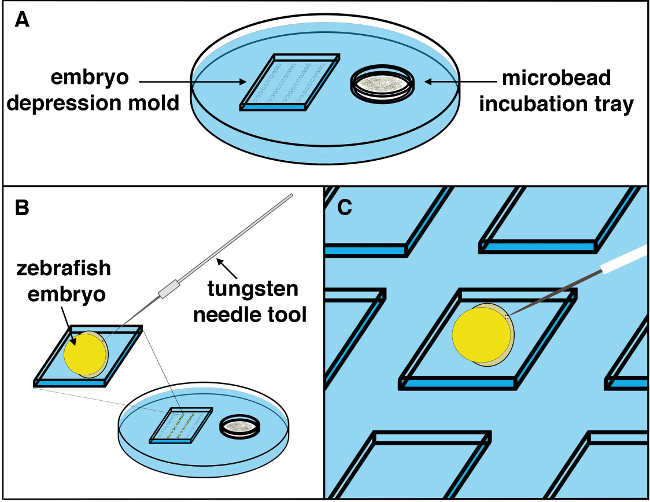
Figura 2. Representación esquemática del procedimiento de implantación de microperlas. (A) Una bandeja de implantación de microperlas con microperlas soaking en la solución de lavado deseado está configurado bajo un microscopio estereoscópico estación, y los embriones posicionada con el tejido hacia arriba. (B) Usando una aguja de tungsteno, de una pequeña incisión en el embrión se puede hacer con un ligero movimiento todavía contundente. (C) Con una pipeta de transferencia microcapilar, la microperla deseado puede ser recogido de la cámara de incubación microperla en la bandeja, situado a la derecha, y trajo al compartimento izquierdo donde el área de trabajo embrión se encuentra. El microbead debe ser depositado cerca del sitio de la incisión, a continuación, coloca suavemente en el sitio de la incisión hecha por la aguja de tungsteno utilizando el / herramienta de pestañas whisker. Una vez que una microperla es maniobrado en el sitio de la incisión, debe ser metido en el tejido (lejos de la incisión) en la posición de forma estable la microperla y evitar el movimiento subsiguiente de la embrión como el desarrollo continúa. Parrendar clic aquí para ver una versión más grande de esta figura.
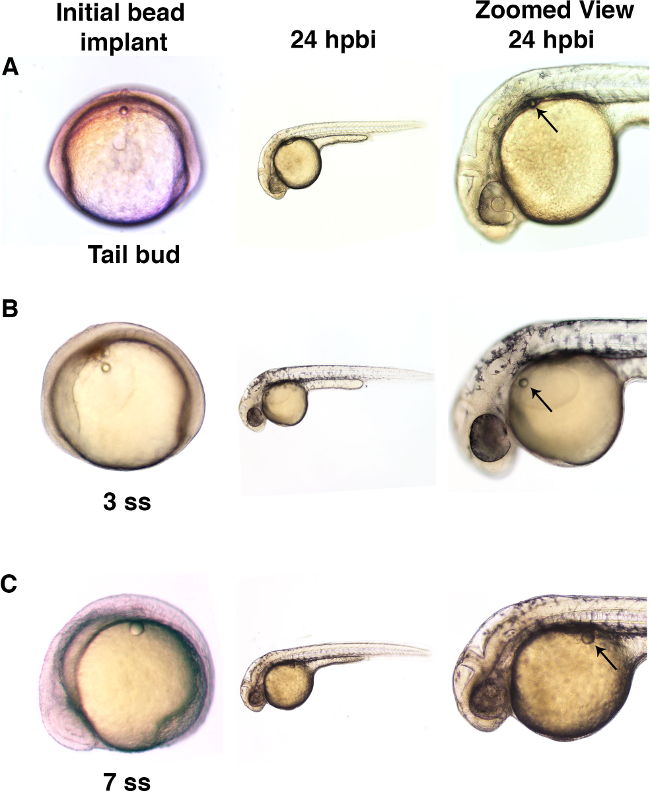
Figura 3. microperlas pueden ser implantados en embriones en diferentes etapas de desarrollo. (A) embriones de pez cebra fueron implantados con una microperla (diámetro de aproximadamente 50 micras) en el tronco en la fase de brote de la cola. Cuando se examina en el implante poste de talón 24 hr (hpbi), los embriones habían desarrollado normalmente y la microperla mostró un mínimo movimiento durante el paso del tiempo de desarrollo. (B) los embriones de pez cebra implantados con microperlas (con un diámetro de aproximadamente 50 micras) en el saco de yema en la etapa 3 somite (ss) muestran un desarrollo normal con el movimiento del grano relativamente menor con el tiempo. (C) microperlas más grandes (diámetro de aproximadamente 70 micras) se implantaron en el embrión 7 ss de manera similar mostró posterior desarrollo normal, así como minimal si cualquier movimiento desde el lugar de implantación. Por favor, haga clic aquí para ver una versión más grande de esta figura.
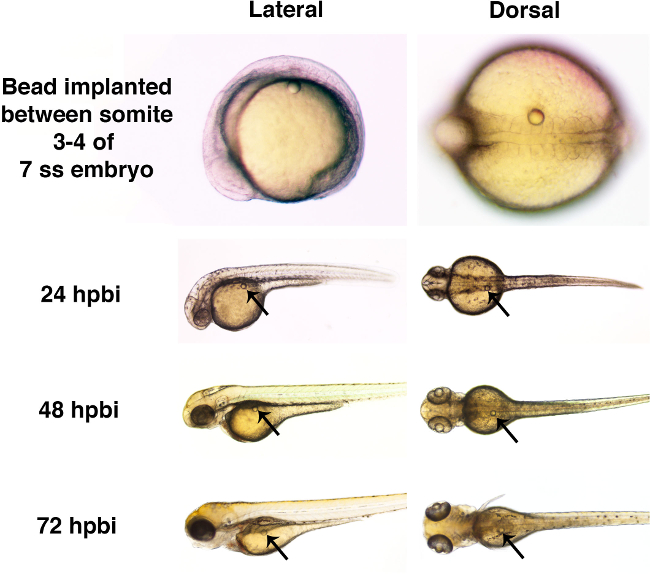
Figura 4. desarrollo bruto del embrión de pez cebra es perturbada por la presencia de una microperla a través de 72 hpbi. Embriones de pez cebra fueron implantados con microperlas empapados en solución de Ringer (con un diámetro de aproximadamente 50 micras) en la etapa 7 somite (ss). Cada microperla se inserta quirúrgicamente en el tronco, entre los somitas 3 y 4. La presencia de la cuenta no se asoció con defectos evidentes de desarrollo a 24 horas después del implante del grano (hpbi), 48 hpbi o 72 hpbi. Por favor, haga clic aquí para ver una versión más grande de esta cifra.
Discusión
Durante el siglo pasado, la comprensión de los patrones plan corporal y la organogénesis ha experimentado avances monumentales. Técnicas de manipulación de tejidos fueron críticos en el descubrimiento de la información clave acerca de estos procesos vitales. La modificación genética es uno de los métodos más utilizados para determinar la función de genes, y los métodos de análisis de mosaico, como el trasplante de células, proporcionan enfoques útiles para entender la autonomía de la función génica. Implantación Microbead ofrece otro lugar para interrogar cómo las moléculas particular, altera la dinámica del desarrollo, ya que este método permite al investigador para alterar un entorno local de los tejidos mediante la introducción de moléculas o inhibidores de la señalización. Una gama de diferentes microperlas están disponibles comercialmente, que han existir diferentes tamaños y otras propiedades físicas (por ejemplo, carga) de modo que se pueden emplear para para las condiciones experimentales de interés. De este modo, mediante la implantación de microperlas que se remojan en una proteína o químicocal de interés dentro de un organismo, los investigadores pueden investigar los efectos localizados durante el desarrollo y encontrar asociaciones entre el gen o molécula de interés y en particular fenotipo biológico (s).
Estudios como el realizado por la AMA y colegas utilizado implantación microperla con el fin de evaluar el efecto del aumento de la señalización de Hedgehog en el patrón esquelético en el neurocranium anterior (ANC) en el pez cebra 23. Estudios anteriores han demostrado que Shh es necesario para la formación de ANC 14. Uso de microperlas recubiertas con Shh investigadores identificaron que esta señal promueve la formación de cartílago en el ANC. Se utilizó el proceso de implantación microperla para demostrar un vínculo claro entre erizo de señalización y la formación de cartílago en el ANC. Otro ejemplo clave de esta técnica de manipulación de tejidos en el pez cebra se observa en los estudios donde los científicos investigaron el control transcripcional del eritroblastoma Veintiséis (ETS) de dominio fmolécula relacionada con ETS actores (ERM) y Polioma potenciador activador 3 (PEA3) por la señalización FGF durante principios de desarrollo del cerebro de pez cebra 19. A través de experimentos de implantación microesferas, que fueron capaces de demostrar que Fgf8 y Fgf3 pueden activar ectópica expresión de erm y PEA3. Estos ejemplos ilustran la utilidad de microperlas para proporcionar conocimientos sobre los mecanismos de desarrollo que colaboran durante la formación de tejido, que puede ser bien caracterizado por el uso de métodos para evaluar la expresión del gen 41. Por lo tanto, el trasplante de microperlas puede ser un método viable para explorar otros tejidos, tales como el mesodermo intermedio (IM) que da lugar al riñón. En concreto, se ayudaría a los estudios de desarrollo renal, para investigar cómo las diferentes moléculas afecta nefrona segmentación 42 y tubulogenesis 43,44, los procesos que se entienden sólo superficialmente en la actualidad. Además, la implantación de microperlas ha comenzado a ser utilizado al perno prisioneroprocesos de regeneración y en el pez cebra 29] y podrían ser adaptados para su uso con cualquier número de modelos de la regeneración de órganos, tales como después de la ablación con láser de tejidos embrionarios como la nefrona 45 o en conjunción con métodos que se han formulado para llevar a cabo la investigación con las estructuras adultas correspondientes 46-49. Finalmente, la implantación de microperlas tiene el potencial de ser utilizado en los modelos de enfermedades humanas, tales como el cáncer o tejido 50,51 52,53 degeneración.
En el presente protocolo, se demuestra el método de implantación microperla en embriones de pez cebra, que también ha sido descrito de manera similar por otros investigadores, pero no se muestra a través de protocolos de video 1. Con la práctica mínima pudimos implantar microperlas a un ritmo aproximado de 8 a 10 embriones / h, que relaciona la viabilidad de este procedimiento una vez que el investigador tiene un poco de experiencia. Los resultados que se muestran en este documento demuestran que las perlas de diversos dimensiones se pueden implantar en las primeras etapas, y que con cuidado, esta técnica manipulación de los tejidos se pueden implementar con una interrupción física mínima para el embrión. Una mejora que se debe destacar es el uso de una herramienta whisker / pestañas para posicionar la microperla en el embrión. Esta pieza relativamente barato y simple de equipo es de aproximadamente el mismo diámetro que la microperla, es fácil de obtener y ayuda a acelerar el proceso de implantación. La barba / pestañas se puede cortar a una longitud deseada para producir una firma pero delicada herramienta de manipulación bead-, dependiendo de la destreza investigador y preferencia. Por último, mientras que describimos aquí cómo manipular físicamente microperlas y embriones de pez cebra para llevar a cabo la implantación, este protocolo no describe los procedimientos de manipulación específicas para diferentes fármacos o péptidos. En general, microperlas tratadas químicamente deben ser implantadas en el animal con la conveniencia, para evitar efectos no deseados en otras zonas del organismo, y los investigadores deben estar bien enformada por los posibles problemas de seguridad asociados con tales productos químicos antes de iniciar sus estudios.
En resumen, hemos demostrado un método de implantación de microperlas relativamente simple y eficiente con una amplia gama de aplicaciones que utilizan materiales que están fácilmente disponibles en el laboratorio. En última instancia, esperamos que este manual ayudará a los investigadores a la naturaleza delicada de manipulación de los tejidos del pez cebra.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Este trabajo fue apoyado por el NIH subvención DP2OD008470.
Materiales
| Name | Company | Catalog Number | Comments |
| Sodium Chloride | American Bioanalytical | AB01915 | |
| Potassium Chloride | American Bioanalytical | AB01652 | |
| Calcium Chloride | American Bioanalytical | AB00366 | |
| HEPES | Sigma Life Science | H4034 | |
| Penicillin-Streptomycin solution | Sigma-Aldrich | P4333-20ML | |
| N-Phenylthiourea (PTU) | Aldrich Chemistry | P7629 | |
| Ethyl 3-aminobenzoate (Tricane) | Fluka Analytical | A5040 | |
| Borosilicate glass | Sutter Instruments Co. | BF100-50-10 | |
| Flaming/Brown Micropipette puller | Sutter Instruments Co. | Mo. P097 | |
| UltraPure Agarose | Invitrogen | 15510-027 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Methylene Blue | Sigma-Aldrich | M9140 | |
| 250mL Erlenmeyer Flask | Fischer Scientific | FB-500-250 | |
| Falcon Diposable Petri Dishes, Sterile | Corning | 430167 | |
| 60mm x 15mm | VWR | 25373-085 | |
| 100mm x 15mm | VWR | 25373-100 | |
| 150mm x 15mm | VWR | 25373-187 | |
| Saint-Gobain Chemware Microspatula | Fischer Scientific | 21-401-50B | |
| P-1000 Micropipette tips | Fischer Scientific | 2707402 | |
| Low Temperature Incubator | Fischer Scientific | 11 690 516DQ | |
| Dimethly Sulfoxide | American Bioanalytical | AB00435 | |
| Microbeads (45-106 µm) | Biorad | 140-1454 AG1-X8 | |
| Microbeads (45 µm) | Polysciences | 7314 | |
| Micro Dissecting Tweezer | Roboz Surgical Instruments Co. | RS-5010 | |
| Tungsten Needle | Roboz Surgical Instruments Co. | RS-6065 | |
| Capillary tube holder | Globe Scientific Inc. | 51674 |
Referencias
- Picker, A., et al., Lieschke, G. J., et al. Tissue micromanipulation in zebrafish embryos. Zebrafish, Methods in Molecular Biology. 546, (2009).
- Wilson, J., Tucker, A. S. Fgf and Bmp signals repress the expression of Bapx1 in the mandibular mesenchyme and control the position of the developing jaw joint. Dev Biol. 266, 138-150 (2004).
- Lieschke, G. J., Currie, P. D. Animal models of human disease: zebrafish swim into view. Nat Rev Genet. 8, 353-367 (2007).
- Santoriello, C., Zon, L. I. Hooked! Modeling human disease in zebrafish. J Clin Invest. 122, 2337-2343 (2012).
- Goldsmith, J. R., Jobin, C. Think small: zebrafish as a model system of human pathology. J Biomed Biotechnol. 2012, 817341 (2012).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496, 498-503 (2013).
- Haffter, P., Nüsslein-Volhard, C. Large scale genetics in a small vertebrate, the zebrafish. Int J Dev Biol. 40, 221-227 (1996).
- Amsterdam, A., Hopkins, N. Mutagenesis strategies in zebrafish for identifying genes involved in development and disease. Trends Genet. 22, 473-478 (2006).
- Pickart, M. A., Klee, E. W. Zebrafish approaches enhance the translational research tackle box. Transl Res. 163, 65-78 (2014).
- Kroeger, P. T., Poureetezadi, S. J., McKee, R., Jou, J., Miceli, R., Wingert, R. A. Production of haploid zebrafish embryos by in vitro fertilization. J Vis Exp. 89, e51708 (2014).
- Lawson, N. D., Wolfe, S. A. Forward and reverse genetic approaches for the analysis of vertebrate development in the zebrafish. Dev Cell. 21, 48-64 (2011).
- Auer, T. O., Del Bene, F. CRISPR/Cas9 and TALEN-mediated knock-in approaches in zebrafish. Methods. 69, 142-150 (2014).
- Peterson, R. T., Link, B. A., Dowling, J. E., Schreiber, S. L. Small molecule developmental screens reveal the logic and timing of vertebrate development. Proc Natl Acad Sci USA. 97, 12965-12969 (2000).
- Lessman, C. A. The developing zebrafish (Danio rerio): A vertebrate model for high-throughput screening of chemical libraries. Birth Defects Res C Embryo Today. 93, e52063 (2011).
- Donahue, E. K., Wingert, R. A. A manual small molecule screen approaching high–throughput using zebrafish embryos. J Vis Exp. , 52063 (2014).
- Hyatt, G. A., Schmitt, E. A., Marsh-Armstrong, N., McCaffery, P., Dräger, U. C., Dowling, J. E. Retinoic acid establishes ventral retinal characteristics. Development. 122, 195-204 (1996).
- Picker, A., Brand, M. Fgf signals from a novel signaling center determine axial patterning of the prospective neural retina. Development. 132, 4951-4962 (2005).
- Reifers, F., Walsh, E. C., Leger, S., Stainier, D. Y. R., Brand, M. Induction and differentiation of the zebrafish heart requires fibroblast growth factor 8 (fgf8/acerebellar.). Development. 127, 225-235 (2000).
- Raible, F., Brand, M. Tight transcriptional control of the ETS domain factors Erm and Pea3 by Fgf signaling during early zebrafish development. Mech Dev. 107, 105-117 (2001).
- Reim, G., Brand, M. spiel-ohne-grenzen/pou2. mediates regional competence to respond to Fgf8 during zebrafish early neural development. Development. 129, 917-933 (2002).
- Jaszai, J., Reifers, F., Picker, A., Langenberg, T., Brand, M. Isthmus-to-midbrain transformation in the absence of midbrain-hindbrain organizer activity. Development. 130, 6611-6623 (2003).
- Hirati, Y., Okamoto, H. Canopy1, a novel regulator of FGF signaling around the midbrain-hindbrain boundary in zebrafish. Curr Biol. 16, 421-427 (2006).
- Wada, N., Javidan, Y., Nelson, S., Carney, T. J., Kelsh, R. N., Schilling, T. F. Hedgehog signaling is required for cranial neural crest morphogenesis and chondrogenesis at the midline in the zebrafish skull. Development. 132, 3977-3988 (2005).
- Abe, G., Ide, H., Tamura, K. Function of FGF signaling in the developmental process of the median fin fold in zebrafish. Dev Biol. 304, 355-366 (2007).
- Prykhozhij, S. V., Neumann, C. J. Distinct roles of Shh and Fgf signaling in regulating cell proliferation during zebrafish pectoral fin development. BMC Dev Biol. 8, 91 (2008).
- Scholpp, S., Brand, M. Endocytosis controls spreading and effective signaling range of Fgf8 protein. Curr Biol. 14, 1834-1841 (2014).
- Hardt, S., et al. The Bmp gradient of the zebrafish gastrula guides migrating lateral cells by regulating cell-cell adhesion. Curr Biol. 17, 475-487 (2007).
- White, R. J., Nie, Q., Lander, A. D., Schilling, T. F. Complex regulation of cyp26a1 .creates a robust retinoic acid gradient in the zebrafish embryo. PLoS Biol. 5, e2522-e2523 (2007).
- Brittijn, S. A., et al. Zebrafish development and regeneration: new tools for biomedical research. Int J Dev Biol. 53, 835-850 (2009).
- Niswander, L., Jeffrey, S., Martin, G. R., Tickle, C. A positive feedback loop coordinates growth and patterning in the vertebrate limb. Nature. 371, 609-612 (1994).
- Laufer, E., Nelson, C. E., Johnson, R. L., Morgan, B. A., Tabin, C. Sonic hedgehog and Fgf-4 act through a signaling cascade and feedback loop to integrate growth and patterning of the developing limb bud. Cell. 79, 993-1003 (1994).
- Tickle, C., Alberts, B., Wolpert, L., Lee, J. Local application of retinoic acid to the limb bud mimics the action of the polarizing region. Nature. 296, 564-566 (1982).
- Samarut, E., Fraher, D., Laudet, V., Gibert, Y. ZebRA: an overview of retinoic acid signaling during zebrafish development. Biochimica et Biophysica Acta. 1849, 73-83 (2015).
- Lengerke, C., et al. Interactions between Cdx genes and retinoic acid modulate early cardiogenesis. Dev Biol. 354, 134-142 (2011).
- Wingert, R. A., et al. The cdx and retinoic acid control the positioning and segmentation of the zebrafish pronephros. PLoS Genet. 3, 1922-1938 (2007).
- Wingert, R. A., Davidson, A. J. Zebrafish nephrogenesis involves dynamic spatiotemporal expression changes in renal progenitors and essential signals from retinoic acid and irx3b. Dev Dyn. 240, 2011-2027 (2011).
- Gerlach, G. F., Wingert, R. A. Kidney organogenesis in the zebrafish: insights into vertebrate nephrogenesis and regeneration. Wiley Interdiscip Rev Dev Biol. 2, 559-585 (2013).
- Li, Y., Cheng, C. N., Verdun, V. A., Wingert, R. A. Zebrafish nephrogenesis is regulated by interactions between retinoic acid, mecom., and Notch signaling. Dev Biol. 386, 111-122 (2014).
- Cheng, C. N., Wingert, R. A. Nephron proximal tubule patterning and corpuscles of Stannius formation are regulated by the sim1a. transcription factor and retinoic acid in the zebrafish. Dev Biol. 399, 100-116 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203, 253-310 (1995).
- Cheng, C. N., Li, Y., Marra, A. N., Verdun, V., Wingert, R. A. Flat mount preparation for observation and analysis of zebrafish embryo specimens stained by whole mount in situ hybridization. J Vis Exp. , e51604 (2014).
- Cheng, C. N., Wingert, R. A., Carver, E., Lessman, C. Chapter 9: Renal system development in the zebrafish: a basic nephrogenesis model. Zebrafish: Topics in Reproduction & Development. , (2014).
- Gerlach, G. F., Wingert, R. A. Zebrafish pronephros tubulogenesis and epithelial identity maintenance are reliant on the polarity proteins Prkc iota .and zeta. Dev Biol. 396, 183-200 (1016).
- McKee, R., Gerlach, G. F., Jou, J., Cheng, C. N., Wingert, R. A. Temporal and spatial expression of tight junction genes during zebrafish pronephros development. Gene Expr Patterns. 16, 104-113 (2014).
- Johnson, C. S., Holzemer, N. F., Wingert, R. A. Laser ablation of the zebrafish pronephros to study renal epithelial regeneration. J Vis Exp. , e2845 (2011).
- McCampbell, K. K., Wingert, R. A. New tides: using zebrafish to study renal regeneration. Transl Res. 163, 109-122 (2014).
- Gerlach, G. F., Schrader, L. N., Wingert, R. A. Dissection of the adult zebrafish kidney. J Vis Exp. 54, e2839 (2011).
- McCampbell, K. K., Springer, K. N., Wingert, R. A. Analysis of nephron composition and function in the adult zebrafish kidney. J Vis Exp. , e51644 (2014).
- McCampbell, K. K., Springer, K., Wingert, R. A. Atlas of cellular dynamics during zebrafish adult kidney regeneration. Stem Cells Int. In press, (2015).
- Lee, S. L., et al. Hypoxia-induced pathological angiogenesis mediates tumor cell dissemination, invasion, and metastasis in a zebrafish tumor model. Proc Natl Acad Sci USA. 106, 19485-19490 (2009).
- Rouhi, P., et al. Hypoxia-induced metastasis model in embryonic zebrafish. Nat Prot. 5, 1911-1918 (2010).
- Cao, R., Jensen, L. D. E., Söll, I., Hauptmann, G., Cao, Y. Hypoxia-induced retinal angiogenesis in zebrafish as a model to study retinopathy. PLoS One. 3, e2748 (1371).
- Cao, Z., et al. Hypoxia-induced retinopathy model in adult zebrafish. Nat Prot. 5, 1903-1910 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados