Method Article
Bir Gel Yüzeyinde Büyüyen Bitki kökleri Işık Sac Flüoresan Mikroskopi
Bu Makalede
Özet
This protocol shows a plant sample preparation method for light-sheet microscopy. The setup is characterized by mounting the plant vertically on the surface of a gel and letting it grow in controlled bright conditions. This allows long-term observation of plant organ development in standardized conditions.
Özet
One of the key questions in understanding plant development is how single cells behave in a larger context of the tissue. Therefore, it requires the observation of the whole organ with a high spatial- as well as temporal resolution over prolonged periods of time, which may cause photo-toxic effects. This protocol shows a plant sample preparation method for light-sheet microscopy, which is characterized by mounting the plant vertically on the surface of a gel. The plant is mounted in such a way that the roots are submerged in a liquid medium while the leaves remain in the air. In order to ensure photosynthetic activity of the plant, a custom-made lighting system illuminates the leaves. To keep the roots in darkness the water surface is covered with sheets of black plastic foil. This method allows long-term imaging of plant organ development in standardized conditions.
Giriş
tek hücre organ farklılaşması ve büyüme sırasında nasıl davrandığını anlamak bitki gelişiminde önemli sorulardan biridir. İdeal olarak, gen ekspresyonu ve hücre içi protein lokalizasyonu gibi hücresel olaylar, doku daha geniş bir bağlamda ışığında görülebilir. Bu amaç, teknik zorluklar teşkil ve yüksek uzaysal ile tüm organ gözlem yanı sıra fotoğraf-toksisite etkilere neden olabilir zaman uzun süreli, aşırı zamansal çözünürlüğü gerektirir. bitkiler hızla çevresel değişimlere uyum beri, yetişme koşulları sıkı kontrol edilmelidir. bitkinin fizyolojik durumu ile müdahale etmeden uzun vadeli görüntüleme yapmak için, üç şey numune odasında, 1) büyüme koşulları sağlanmalıdır var, 2) istikrarlı uzun süre boyunca montaj örnek, ve 3) görüntüleme düşük ışık şiddetleri ile foto-hasar ve non-fizyolojik koşulları önlemek için.
Fizyolojik büyüyen Conditimikroskop numune odasında ons uzun vadeli deneyler için çok önemlidir. 3 - konfokal mikroskoplar 1 görüntüleme büyüme odaları açıklayan mevcut protokoller vardır. Ancak, konfokal mikroskopi stres yanıtları neden olabilir bitki, yüksek ışık yoğunluğu tanıtır ve genellikle 4 büyümesini engeller. Buna ek olarak, en geleneksel mikroskoplar kendilerini yeniden yönlendirmek ve ağırlık vektörü doğru büyümeye deneyin beri bitkiler için optimal değildir numune, sadece yatay konumlandırma izin verir. 9 - Son on yılda, ışık sayfalık mikroskobu birkaç gün 5 varan süreler için hücresel çözünürlükte büyük örneklerin gelişimini yakalamak için güçlü bir araç olarak ortaya çıkmıştır. Işık sayfalık mikroskobu dikey numune konumlandırma izin verir ve giderek kök gelişimi 10 okuyan bitki araştırmalarında kullanılan - Son zamanlarda Berthe tarafından gözden 21,t Maizel 22. Söz konusu çalışmaların 10,13 birçoğu - 18,21 optimize edilmiş ve örnek özel bir şekilde kullanan Ernst HK Stelzer laboratuarında gerçekleştirilmiştir bir jel 17 yüzeyindeki kök büyüyen karakterize montaj. Bu çalışmalarda, ısmarlama bir mikroskop burada bitki alt tutulur kullanılmıştır. Buna karşılık, genel olarak mevcut ışık sayfalık mikroskopları çoğunluğu üst örnek tutun. Bu nedenle, bu örnekte görülen yöntem hali hazırda uygulanamaz. Burada sunulan yöntem OpenSPIM 23, uygulanması ve Seçici Düzlem Aydınlatma Mikroskobu (SPIM) artırılması için açık erişim platformu için geçerli köklü üzerinde yüzeye montaj yöntemi için bir protokol sağlar.
Bu protokolün genel amacı OpenSPIM ışık sayfalık mikroskop Arabidopsis kökleri uzun vadeli görüntüleme sağlamaktır. Bu s dik bir bitkinin yetiştirilmesi gerçekleştirilirbir sıvı ortam içinde kökleri ile bir jel, sert bir yaprak havada kalmaya devam ederler. Bitkinin fotosentezik aktivitesi sağlamak için, ısmarlama bir aydınlatma sistemi yaprakları, kökleri etkilememektedir (Şekil 1) yanar.
Protokol
Görüntüleme 1. Arabidopsis Kültürleme önce
- 2.15 g, MS-ortamı, 10 g sakroz, 0.97 g MES (2- (N-morfolino) etansülfonik asit) ve 1 L GKD 2 O (iki kez damıtılmış su eklenmesi ile yarım MS ortamı (yarı-kuvvetli Murashige ve Skoog ortamı) hazırlanması ) 1 L'lik bir şişeye. KOH kullanılarak 5.8'e pH ayarlayın.
- ½ MS ortamına 15 g / l jellan zamkı ekleyin ve 121 ° C'de 20 dakika süreyle otoklav.
- yaklaşık 2 mm bir kalınlığı olan bir jel tabakası oluşturmak için köşeli Petri kapları (245 x 245 x 25 mm) içine sıcak ortam, 30 ml dökün. Yemekler orta katılaşmaya izin oda sıcaklığına kadar soğumasını bekleyin.
- 1 ml steril H2O cam pipet ya da 1000 uL bir pipet ucu kullanılarak tohumları kaldırmak ve jelin yüzey üzerine ekmek ihtiva eden 1.5 ml reaksiyon tüpüne sterilize Arabidopsis tohumlar konulur. tohumları ayrı ayrı yaklaşık 10 mm yerleştirin. bant ile plaka mühür.
- 4 ° C'de 24 saat boyunca inkübe levhasını° C (tabakalaşma).
- 6 gün boyunca ışık 120-140 umol / m / s miktarı ile 16/8 h gündüz / gece döngüsünde 22 ° C'de, örneğin büyüme inkübatör plaka, geliştirin. 10 güne kadar eski bitkiler kullanılabilir.
2. Bitki Numune Hazırlama Yöntemi
Not: numune tutucu 3D basılı veya elden Şekil 2C tasvir boyutları kullanarak bir makine atölyesinde yapılabilir ya. 3D model dosyası ek malzemenin (Supplemental_File _-_ 3D_Sample_Holder.stl) sağlanır. Malzeme listesinde 3D baskı siparişi için bağlantıya göz atın.
- 5 g 50 ml yarım MS ortamı içeren 50 ml şişe içine agaroz düşük eriyen ve 121 ° C'de 20 dakika süreyle otoklav ekleyin.
- 1.5 ml'lik tepkime tüpleri içinde% 1 düşük erimeli agaroz bir çözüm kısım. 4 ° C'de saklayın (en az iki ay için kullanılabilir).
- 80 ° C'de 1 %% düşük erime agaroz bir kısım eritin ve için soğumasını bekleyin33 ° C.
- bir ultrason ünitesi örnek tutucu temizleyin. % 70 etanol ile numune tutucu sterilize ve steril su ile yıkayın.
- Bir neşter kullanılarak bitki etrafında jel kesti.
- Düz spatula ile blok kaldırın ve ikinci spatula ile numune tutucu üzerinde dikkatle kaydırın.
- Bir 100 uL pipet kullanılarak (33 ° C'de),% 1 agaroz ile örneği üzerindeki jel Tutkal.
- 10 mcL pipet kullanarak% 1 agaroz jel üzerinde bir bitki Tutkal. Yaprakları jel ile kaplı olmadığını doğrulamak için bir stereo mikroskop kullanın. ilgi bölgeye doğrudan jeli yerleştirmeyin.
- kurumasını bitki önlemek için, kesintisiz çalışır. Mümkün 1.000 mcL pipetlemeyin ucu içine numune tutucu yerleştirin. bir kap olarak pipet ucu kullanın ve bitki bulunduğu numune tutucu bir ucuna dikkatlice kaydırın.
- Bir pipet kutusunda numune tutucu koymak ve gerekirse daha fazla bitki hazırlamak. Bitkiler doğrultularda olabilirtly görüntülü veya büyüme inkübatör geri koymak.
3. Mikroskop kurma
NOT: LED aydınlatma sistemi özel olarak oluşturulmuş lamba olduğunu. LED-ring oluşturmak için gerekli teknik detaylar Şekil 3 ve malzeme listesinde bulunabilir. Yönetim Kurulu tasarımı için ek malzeme dosyası (Supplemental_File _-_ LED_Ring_Board.brd) bakın.
- Vida veya tutkal (örneğin çift taraflı bant) OpenSPIM x / y / z / θ aşamalı kolunun alt tarafında LED halka.
- ayarlanabilir bir güç kaynağı (0-30 V, maksimum 2 A) LED halka bağlayın.
- İstenilen ışık yoğunluğu gerilim ayarlayın (Arabidopsis, 120-140 mmol / m 2 / s Şekil 3D için).
- % 70 etanol ile Örnek odacığının sterilize ve steril su ile yıkayın.
- benzin ve lens temizleme dokusu ile objektif lens temizleyin. % 70 etanol ile objektif lens sterilize edin.
- perfusi bağlayıntek yönlü bir düzenlemesi örnek odasına borular üzerinde. Bir sonraki peristaltik perfüzyon pompa taze ½ MS orta ve başka boş şişeyi içeren 1 L şişe koyun. bir perfüzyon tüpü kullanılarak örnek odasının alt girişi ile orta şişeyi bağlayın. Başka bir perfüzyon tüp kullanılarak kullanılan orta çöp boş şişe numune odasının üst çıkışını bağlayın.
- 1 ml / dk akış hızını ayarlamak.
Not: Örnek odası Overspill olup için, akışından daha yüksek bir çıkış olması önemlidir. Her iki pompalama hızını arttırmak ya da çıkış için daha geniş bir iç çapa sahip bir tüp kullanın. - % 70 etanol ile yıkayın ve su yüzeyinden örnek bölmesine yerleştirmeden önce kurumaya bırakın, 3 mm'lik küçük kareler halinde siyah plastik folyoyu kesin.
- numune tutucu gelen pipet ucu çıkarın ve örnek odasındaki numune tutucu takın. yeni üretilen numune tutucu sahne koluna uymuyorsa, bir ince kum kullanmakKağıt daha ince yapmak veya çok ince olması durumunda bir O-ring (∅ 6 mm) kullanın.
- kapakları oluşturmak için, iki adet 50 x 25 mm parçalar halinde siyah alüminyum folyo kesti. her bir parçanın bir tarafta orta kesim 5 mm yapın. Bir üçgen girinti (Şekil 1D) oluşturmak için katlayın. Numune tutucu bakan üçgen çentikler ile örnek odasının üstünde kapakları koyarak iki kapaklı numune odasına kapatın. Bitki yaprakları kapak gölgede olmadığından emin olun ve ışıklandırma sistemi ışık alır.
- görüş alanında yükselen bir yanal kök yerleştirmek için X / Y / Z ve rotasyon sahne kullanarak ilgi bölgeyi bulun.
- Kayıttan önce, sistem en az 15 dakika boyunca dengeye gelmesi sağlar.
- Kur görüntü elde etme.
- 3 um z aralığı (650 um) ile birlikte 217 bir görüntü yığını ayarlamak ve 17 saatlik bir toplam süre 15 dakika için görüntüleme aralıklarla geçen süreyi ayarlayın.
NOT: A ayrıntılı belgelerOpenSPIM yazılım bulunabilir nasıl işletmek (http://openspim.org/Acquisition#Acquiring_a_Stack).
- 3 um z aralığı (650 um) ile birlikte 217 bir görüntü yığını ayarlamak ve 17 saatlik bir toplam süre 15 dakika için görüntüleme aralıklarla geçen süreyi ayarlayın.
- Kayda başla.
Sonuçlar
Işık sayfalık mikroskobu (Şekil 1) ile kök sistemi izlerken Bu numune hazırlama yöntemi mikroskop numune haznesi içerisindeki bitki ekimi sağlar. Bitki, özel tasarlanmış örnek tutucu (Şekil 2) üzerine monte edilen jel (½% 1.5 jellan zamkı içeren MS ortamı) bir tabaka yüzeyi üzerinde büyür. numune tutucu 3D malzemesi olarak şeffaf bir reçine kullanılarak basılır olduğunu. Boyutları vurgulayan bir imal versiyonu Şekil 2C'de gösterilmektedir. kökler sürekli perfüzyon sistemi ile yenilenir sıvı (½ MS ortamı) daldırılır. Yaprakları havada kalır ve sürekli / bitki (Şekil 1A, B ve Şekil 3A-C) üzerinde bir halka halinde düzenlenmiş mavi ve kırmızı LED'ler gelen s 130 mol / m² ışık yoğunluğu ile aydınlatılmaktadır. LED halka bizim makine atölyemizde imal edilmektedir veBiz Şekil 3 ve malzeme listesinde LED-ring nasıl oluşturulacağı konusunda teknik ayrıntıları. Işık yoğunluğu sürekli 30-250 umol / m2 / s (Şekil 3B) arasında değişen ayarlanabilir. Kök sistemi, su yüzeyini kaplayan siyah plastik folyo küçük yaprak (Şekil 1) gölgeli. Algılama lens tarafından toplanır aydınlatma herhangi bir kaçak ışık GFP filtresi (Şekil 3E) tarafından filtre edilir.
Bu ayar ile, büyüyen bir Arabidopsis yanal kökü bir zaman atlamalı bir 20X / 0.5 lensi (Şekil 4) kullanılarak 17 saat süreyle kaydedildi. yan kök birincil kökü derinlerde bulunduğu perisiklden hücre tabakası, aslına vardır. uzun süreli dönemler için, bir doku içinde daha derin bir görüntüleme yeteneklerini göstermek için, daha yüksek bir büyütme (40X / 0.75) bir yanal ro oluşumunu çekmek için kullanılanot Birinci aşama primordiumunun gelen kadar 38 saat (Şekil 5) bir süre içinde birincil kök dışarı çıkması. Veri kümesinin bir örnek teşkil eden bir 2D dilim Şekil l'de gösterilmiştir. 5B. Bu kayıt hücresel çözünürlüğe sahip 3D (Şekil 5A) lateral kök oluşumu dinamiklerini takip etmemizi sağlar.
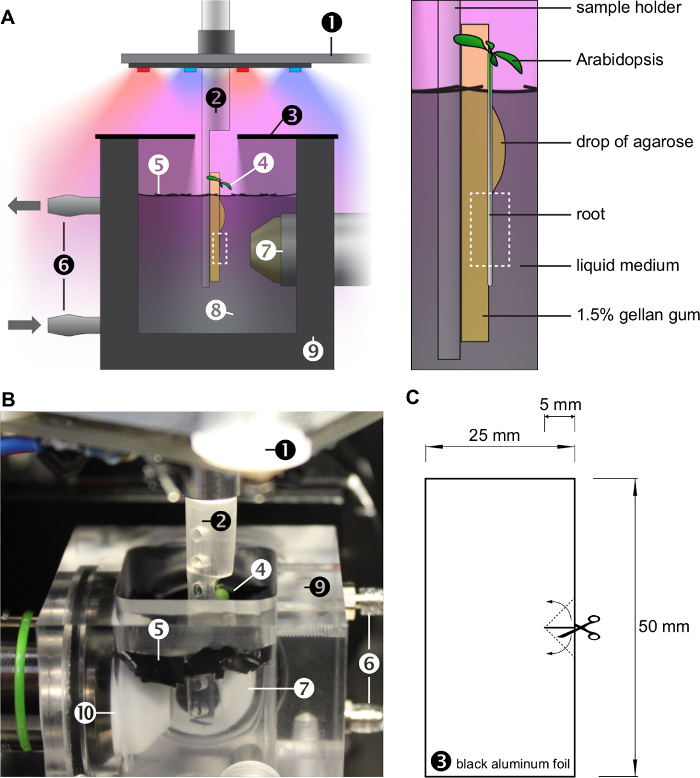
Şekil 1: OpenSPIM örnek odasının içine koşulları Büyüyen. A) görüntüleme odasının Sketch. Bitki jel yüzeyi üzerindeki dik büyümektedir, (bakınız Şekil 2), özel bir dahili numune tutucu üzerine yerleştirildi. kökler sürekli perfüzyon sistemi ile değiştirilen bir sıvı ortam içinde büyümektedir. Bitki havada büyür ve kırmızı ve mavi LED (ayrıca bakınız Şekil 3) tarafından aydınlatılır bırakır. Kök sistemi zekâ gölgeli Su yüzeyi kaplayan siyah plastik folyo h küçük levhalar. siyah alüminyum folyo iki parçadan oluşan bir kapak ayrıca su yüzeyinin altında ışık miktarını azaltır ve numune odasına nem tutar. Sağdaki büyütülmüş paneli likit ortamına daldırılmış jel bloğun yüzeyi üzerinde büyüyen bitki vurgular. agaroz bir damla jel üzerine kök bağlar. kesik kutu mikroskop tarafından gözlemlenen faiz bölgeyi gösterir. Kapaksız görüntüleme odasının (B) Fotoğraf). Sayılar (1) - (10) A ve B temsil etmektedir: (1): LED halka x / y / z / θ kademeli, (2): örnek tutucu (3): kapak (4): Arabidopsis thaliana (5): perfüzyon sistemi, (7): algılama objektif lens, (8): sıvı ortam, (9): örnek odası, (10): aydınlatma objektif lens siyah plastik folyo, (6) yaprak. C) kapak siyah alüminyum folyo iki parçadan oluşmaktadır. target = "_ blank"> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.

Şekil 2: numune tutucu. A) 3 boyutlu modeli. 3D veri dosyası ek malzemenin sağlanır. Saydam akrilik plastikler (4) ve (5): Reçine (6): şeffaf bir reçine (3) - (1) farklı malzemeler kullanılarak 3D baskı B) fotoğrafı. C) numune tutucu Teknik çizim, rakamlar milimetre temsil etmektedir. Bir bitki ile üretilen numune tutucu D) Fotoğraf monte edilebilir. kesik alan mikroskopla görülebilir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
/ 55044 / 55044fig3.jpg "upload />
Şekil 3: Bitki aydınlatma ayarı. Lambanın A) şematik diyagramı. LED'lerin çiftleri yönlü yıldırım için ayrı ayrı açma / kapama açılabilir. LED: ışık yayan diyot, R: direnç, T: transistör, JP: pinhead. Baskılı devre kartı): B) aydınlatma lambası nihai tasarım bir PCB yazılımı (PCB kullanılarak çekildi. Biz ek malzemenin devre tasarımı dosyası sağlar. Yönetim Kurulu daha sonra üretilen ve bizim enstitünün MIBA makine dükkanında toplandı. LED halkasının C) Fotoğraf açık. Kırmızı ve mavi LED dört çift bir halka olarak düzenlenmiştir. D) voltaj aralığı 3,5 V ve 14,0 V Direnişleri arasında ayarlanabilir 30-250 umol / m arasında değişen ışık miktarını ulaşmak için kullanılan 2 / s (R1-8: 220 Ohm, R9-12: 1220 Ohm ). E) lamba, GFP ve YFP emisyon spektrumu. tp: //ecsource.jove.com/files/ftp_upload/55044/55044fig3large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
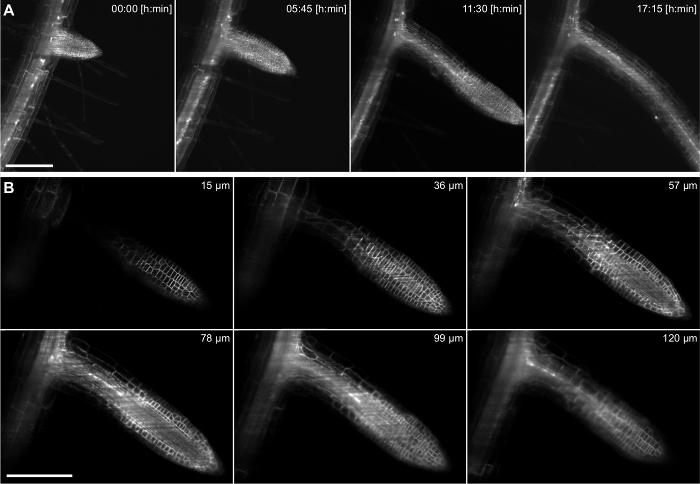
Şekil 4: Arabidopsis Zaman atlamalı kayıt thaliana yan kök. 5 gün eski fide bir membran işaretleyici (pUBQ10 :: YFP Pip1 4) ifade ve nükleer muhabir (pGATA23 :: nls-GUS-GFP) özel bir yanal kök içine geliştirmek hücrelerin perisiklden işaretleme. 217 görüntü (3 mikron z-boşluk) bir yığın 20X / 0.5 lens kullanarak 17 saat kayıt için her 15 dakikada yakalandı. A) 69 üzerinden dört kez noktaları maksimum yoğunluk projeksiyonu gösterilmiştir. B) bir zaman noktasında z-yığınının Altı 217 üzerinden tek dilim gösterilir. A ve B Ölçek çubukları 100 um temsil etmektedir.yük / 55044 / 55044fig4large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
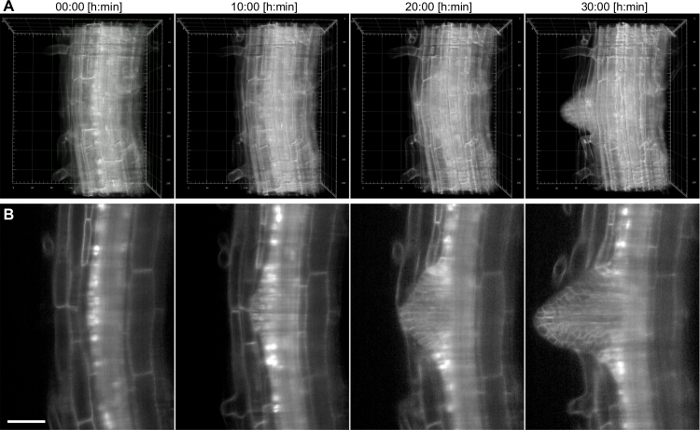
Şekil 5: Arabidopsis Zaman atlamalı kayıt thaliana yan kök. 6 gün eski fide bir membran işaretleyici (pUBQ10 :: YFP Pip1 4) ifade ve nükleer muhabir (pGATA23 :: nls-GUS-GFP) özel bir yanal kök içine geliştirmek hücrelerin perisiklden işaretleme. 200 görüntü (1.5 mikron z-boşluk) bir yığın 40X / 0.75 lens kullanarak 38 saat kayıt için her 15 dakikada yakalandı. A) Dört zaman noktalarının 3D render, ızgara numaraları, ana kök merkez düzlemi boyunca um, B) Tek dilim temsil etmektedir. Ölçek çubuğu 50 uM temsil eder. LütfenBu rakamın büyük halini görmek için buraya tıklayın.
Supplemental_File _-_ 3D_Sample_Holder.stl. 3D model dosyası sağlanır. Bu dosyayı indirmek için tıklayınız.
Company Dosya Halka Board.brd LED. devre tasarımı dosyası sağlanır. Bu dosyayı indirmek için tıklayınız.
Tartışmalar
Işık Sac Flüoresan Mikroskobu düşük fototoksisite ve fizyolojik durumda örnek tutarken yüksek uzamsal-zamansal çözünürlüğe sahip büyük bir hacmi yakalamak için kullanılabilecek ultra hızlı alım hızı, birleştirmek için büyük bir avantaja sahiptir. Işık levha mikroskobu çözünürlüğü konfokal mikroskop 9 ile karşılaştırıldığında edilebilir. Ancak, ışık saçılması ve emme bireysel uyarma ve emisyon yol boyunca meydana gelir ve genel görüntü kalitesi yüzeyine göre opak dokuların içinde önemli ölçüde daha düşük olabilir. Bu komplikasyonu aşmak için bir dikey eksen boyunca örnek döndürmek ve farklı yönlere aynı hacmi gözleyin imkanı kullanabilirsiniz. Ama bu, örneğin yan kökler daha fazla bilgi almadan düşük görüntü kalitesiyle sonuçlanacaktır arkasından kök ve görüntüleme bir tarafta ortaya, her zaman avantajlı değildir. Bununla birlikte, dönme esas SAMP konumlandırmak için kullanılabilmektediren iyi şekilde le. objektifler klasik yatay düzenlemesi örnek montaj yeni yollar sağlar. Bitkiler, bir dikey konumdan yarar. Montaj yöntemi "ifadesi, jel yüzeyi üzerindeki", burada sunulan bir jel 24,25 iç kök gömme kütlesi olarak diğer montaj yöntemlerine göre birçok avantajı vardır. 1) kök sistemi sıvı ortam ile doğrudan temas halindedir. örnek odası sürekli taze ortam sağlayan bir perfüzyon sistemine bağlanır. Aynı zamanda, hızlı bir şekilde, farklı ortam veya ilaç uygulamak için örnek odasının tüm hacmi değiştirmek için kullanılabilir. Onlar laboratuvarlarda büyümek için kullanılan olarak 2) Önceki hazırlık bitkilerin büyüdüğü örnek. Bitkiler flöresanlı bir mikroskop altında seçilebilir ve sadece arzu edilen bitkiler elde edilmesi gerekir. 3) bitki basılmadan numune tutucu Petri kabı aktarılır. Böylece bitki ayrıca, büyüme incubato üzerinde büyüyen aynı jel üzerinde gelişebilirR ve mekanik gerilim minimuma indirilir. 4) numune görünümü engelsiz ve numune ve algılama hedefi arasındaki boşluk sadece orta ve kırılma indeksleri farklı olan başka malzemeler ile doldurulur çünkü optik sapmaları en aza indirilir.
Uzun süreli görüntüleme gerçekleştirmek için, bitki aydınlatma sistemi bitkinin fotosentezik aktivitesi sağlamak için gereklidir. Laboratuarların çoğunda bitkileri, şeffaf bir jeli üzerinde büyümeye kökleri ışığa maruz yani. Bu çevrelerine farklı tepkiler neden olur ve bunların biyokimya ve geliştirme 26,27 değişikliğe sebep olabilir. Kök sistemi üzerindeki ışık miktarını azaltmak amacıyla, siyah plastik folyo, su yüzeyini yanı sıra siyah alüminyum folyodan yapılmış kapak örneği odasını kapalı kapak kullanıldı. bitki ulaşabilir ışık kapağının ortasındaki delikten bırakır. Bu kurulumda, arka plan ışığı bir artış, suggestin gözlenmiştirKırmızı ve mavi LED'ler gelen kaçak ışık miktarı önemli ölçüde GFP filtresi ve gölgeleme yaklaşımları azalmıştır g. Bu kamera arka plan gürültüsünü artırmadan görüntü alımı sırasında açık ışığı tutarak izin verdi.
numune tutucu 3D baskı için tasarlanmıştır. Ancak, seçim malzemesi isimli önemli gibi çeşitli plastik yönündeydi test edildi% 100 stabil, Oluşan bir sürüklenme içinde örnek. Bu nedenle, bunun yerine reçine kullanılabilir veya bir polietilen (PEP) çubuk öğütülmesiyle numune tutucu oluşturmak için tavsiye edilir. çift taraflı aydınlatma sistemi ile hafif levha mikroskobu kurulumu kullanırken numune tutucusu dönme açısına bağlı ışık yaprak biriyle etkileyebilir. plakadan bitki sıvı çekme sırasında mekanik stresi azaltmak için, spatula düz açı kullanılır. bitki hızla kurumasına ve ilk defa tecrübe hava akımı olabilir. wo, herhangi bir hava taslağı (hızlı hareketler, air-condition akışı) önlemek için deneyinMümkün rk kesintisiz ve 1000 mcL pipetlemeyin ucu içine örnek yuvasını kaydırın. mikroskop İçinde, sıvı bütün bitki daldırma ve kuru yaprakları tutmak için çok önemlidir.
teknik yanal kök oluşumunun erken aşamalarında görüntüleme için idealdir. olgun kök uçları uzun vadeli görüntüleme yaparken bir Arabidopsis kökleri görüş alanının dışında hızla 100-300 mm / h ile büyümek olduğunu akılda tutmak gerekir. Çok kullanışlı bir gelecekte uygulama süresi uzun süreler boyunca aşağıdaki kök ucu büyümesini sağlayacak bir otomatik izleme algoritması, olabilir. satın alma işlemi sırasında bu tür ışık ve ortamın besin kompozisyonu olarak çevresel koşulları kontrol etme yeteneği bitkiler değişimlere uyum nasıl araştırıyor sağlar. Kök 28 uyarılabilir deksametazon veya β-Estr kullanılarak, örneğin, kimyasal olarak gen ekspresyonu aktive etmek için ilaç uygulamak için kullanılabilecek sıvı bir ortam ile doğrudan temas halinde olanuyanlabilir sistem 29 adiol. Bununla birlikte, bir ilaç yıkamak için numune odasının tüm hacmi değiştirmek için zaman alır. Kurulum ortam değişikliği hızlandırmak için numune odasının hacminin en aza düşürülmesiyle iyileştirilebilir. Bununla birlikte, bu teknik büyük bir potansiyele sahiptir. montaj prosedürü, standart yetiştirme koşulları ve ışık sayfalık mikroskobu kullanılarak yumuşak görüntü elde kombinasyonu fizyolojik düzeyde yüksek çözünürlüklü bitki gelişiminin uzun vadeli çalışmalar sağlar. Bu bitki gelişiminin temel mekanizmaları keşfetmek için araştırmacıların yardımcı olacaktır.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
Biz ses donanımları için eleştirel okuma / görüntüleme Matyáš Fendrych ve Stephan STADLBAUER teşekkür ederiz. OpenSPIM katkılarından dolayı IST Avusturya'da Miba Makine Shop teşekkürler. Bu sonuçlara önde gelen araştırma REA hibe anlaşması n ° [291734] ve Avrupa Araştırma Konseyi (ERC projesi-2011 kapsamında Avrupa Birliği'nin Yedinci Çerçeve Programı (FP7 / 2007-2013) İnsanlar Programı (Marie Curie Eylemleri) fon aldı -StG-20101109-PSDP).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Agarose, low melting | VWR | AFFY3282125GM | |
| Black aluminum foil | Thorlabs | BKF12 | |
| Black plastic foil | Carl Roth | HT83.2 | |
| LED blue (453 nm) | OSRAM | LD CN5M-1R1S-35-1 | |
| LED red (625 nm) | OSRAM | LR T66F-ABBB-1-1 | |
| LED board - PCB design software | Cadsoft Eagle | ||
| MES monohydrate | Duchefa | M1503.0100 | |
| Micropore Surgical Tape | 3M | 1530-1 | |
| Murashige & Skoog Medium (MS-Medium) | Duchefa | M0221 | |
| Phytagel | Sigma-Aldrich | P8169 | |
| Sample holder 3D print | i.materialise | https://i.materialise.de/shop/item/sampleholder-openspim-zeisslightsheetz1 | |
| Square Petri dishes (245 x 245 x 25 mm) | VWR | 734-2179 | |
| Sucrose | Sigma-Aldrich | 84097-1KG |
Referanslar
- Grossmann, G., Guo, W. -. J., et al. The RootChip: an integrated microfluidic chip for plant science. Plant Cell. 23 (12), 4234-4240 (2011).
- Busch, W., Moore, B. T., et al. A microfluidic device and computational platform for high-throughput live imaging of gene expression. Nat Methods. 9 (11), 1101-1106 (2012).
- Calder, G., Hindle, C., Chan, J., Shaw, P. An optical imaging chamber for viewing living plant cells and tissues at high resolution for extended periods. Plant Methods. 11 (1), 22 (2015).
- Dixit, R., Cyr, R. Cell damage and reactive oxygen species production induced by fluorescence microscopy: effect on mitosis and guidelines for non-invasive fluorescence microscopy. Plant J. 36 (2), 280-290 (2003).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical Sectioning Deep Inside Live Embryos by Selective Plane Illumination Microscopy. Science. 305 (5686), 1007-1009 (2004).
- Keller, P. J., Schmidt, A. D., Wittbrodt, J., Stelzer, E. H. K. Reconstruction of Zebrafish Early Embryonic Development by Scanned Light Sheet Microscopy. Science. 322 (5904), 1065-1069 (2008).
- Keller, P. J., Schmidt, A. D., et al. high-contrast imaging of animal development with scanned light sheet-based structured-illumination microscopy. Nat Methods. 7 (8), 637-642 (2010).
- Höckendorf, B., Thumberger, T., Wittbrodt, J. Quantitative Analysis of Embryogenesis: A Perspective for Light Sheet Microscopy. Dev Cell. 23 (6), 1111-1120 (2012).
- Stelzer, E. H. K. Light-sheet fluorescence microscopy for quantitative biology. Nat Methods. 12 (1), 23-26 (2015).
- Maizel, A., Von Wangenheim, D., Federici, F., Haseloff, J., Stelzer, E. H. K. High-resolution live imaging of plant growth in near physiological bright conditions using light sheet fluorescence microscopy. Plant J. 68 (2), 377-385 (2011).
- Sena, G., Frentz, Z., Birnbaum, K. D., Leibler, S. Quantitation of Cellular Dynamics in Growing Arabidopsis Roots with Light Sheet Microscopy. PLoS ONE. 6 (6), e21303 (2011).
- Costa, A., Candeo, A., Fieramonti, L., Valentini, G., Bassi, A. Calcium Dynamics in Root Cells of Arabidopsis thaliana Visualized with Selective Plane Illumination Microscopy. PLoS ONE. 8 (10), (2013).
- Šamajová, O., Takáč, T., von Wangenheim, D., Stelzer, E. H. K. Update on methods and techniques to study endocytosis in plants. Endocytosis in Plants. , 1-36 (2012).
- Rosquete, M. R., Von Wangenheim, D., et al. An auxin transport mechanism restricts positive orthogravitropism in lateral roots. Curr Biol. 23 (9), 817-822 (2013).
- Lucas, M., Kenobi, K., et al. Lateral root morphogenesis is dependent on the mechanical properties of the overlaying tissues. Proc Natl Acad Sci USA. 110 (13), 5229-5234 (2013).
- Vermeer, J., von Wangenheim, D., et al. A Spatial Accommodation by Neighboring Cells Is Required for Organ Initiation in Arabidopsis. Science. 343 (6167), 178-183 (2014).
- Von Wangenheim, D., Daum, G., Lohmann, J. U., Stelzer, E. H. K., Maizel, A. Live Imaging of Arabidopsis Development. Arabidopsis Protocols. 1062, 539-550 (2014).
- Berson, T., von Wangenheim, D., et al. Trans-Golgi network localized small GTPase RabA1d is involved in cell plate formation and oscillatory root hair growth. BMC Plant Biol. 14 (1), 252 (2014).
- Langhans, M., Meckel, T. Single-molecule detection and tracking in plants. Protoplasma. 251 (2), 277-291 (2014).
- Novak, D., Kucharova, A., Ovecka, M., Komis, G., Samaj, J. Developmental nuclear localization and quantification of GFP-tagged EB1c in Arabidopsis root using light-sheet microscopy. Front Plant Sci. 6, (2015).
- Von Wangenheim, D., Fangerau, J., et al. Rules and Self-Organizing Properties of Post-embryonic Plant Organ Cell Division Patterns. Curr Biol. 26 (4), 439-449 (2016).
- Berthet, B., Maizel, A. Light sheet microscopy and live imaging of plants. J Microsc. , (2016).
- Pitrone, P. G., Schindelin, J., et al. OpenSPIM: an open-access light-sheet microscopy platform. Nat Methods. 10 (7), 598-599 (2013).
- de Luis Balaguer, M. A., et al. Multi-sample Arabidopsis Growth and Imaging Chamber (MAGIC) for long term imaging in the ZEISS Lightsheet Z.1. Dev Biol. 419 (1), (2016).
- Ovečka, M., Vaškebová, L., Komis, G., Luptovčiak, I., Smertenko, A., Šamaj, J. Preparation of plants for developmental and cellular imaging by light-sheet microscopy. Nat Protoc. 10 (8), 1234-1247 (2015).
- Yokawa, K., Kagenishi, T., Kawano, T., Mancuso, S., Baluška, F. Illumination of Arabidopsis roots induces immediate burst of ROS production. Plant Signal Behav. 6 (10), 1460-1464 (2011).
- Silva-Navas, J., et al. D-Root: a system for cultivating plants with the roots in darkness or under different light conditions. Plant J. 84 (1), 244-255 (2015).
- Aoyama, T., Chua, N. -. H. A glucocorticoid-mediated transcriptional induction system in transgenic plants. Plant J. 11 (3), 605-612 (1997).
- Brand, L., et al. A versatile and reliable two-component system for tissue-specific gene induction in Arabidopsis. Plant Physiol. 141 (4), 1194-1204 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır