Method Article
生後マウスにおける聴覚ブラの解剖:中耳の骨の単離および組織学的解析
要約
We present a protocol to isolate the auditory bulla, capsule, and ossicles from postnatal mice for whole mount and histological analysis.
要約
ほとんどの哺乳動物では、槌骨、きぬた骨とアブミ骨などの中耳内耳小骨は、最小の骨があります。マウスでは、骨構造は、聴覚カプセルは内耳、すなわち蝸牛および半規管を囲むのに対し、聴覚水疱は、小骨を収容呼ばれます。マウス耳小骨は、耳鼻咽喉科の分野の研究者に聞くので、大きな関心のために不可欠であるが、その代謝、開発、および進化が他の分野に非常に関連しています。変更された骨代謝は、成体マウスで聴覚機能に影響を与えることができ、様々な遺伝子欠損マウスは子宮内耳小骨の形態形成の変化を示しています。マウスの耳小骨は、小型であるが、一つはその解剖学的向きおよび3D構造を理解している場合、それらの操作が可能です。ここでは、出生後のマウスの聴覚水疱やカプセルを分析した後、水疱の一部を除去して、個々の小骨を分離する方法について説明します。また、議論する方法を全角に槌骨の、縦、横、または前頭セクションの調製に適したパラフィンまたは凍結切片を生成するために、異なる向きのベッド水疱やカプセル。最後に、我々はマウスとヒトの耳小骨の間の解剖学的な違いを列挙します。これらの方法は、耳小骨とマウスにおける中耳の、病理学的な発達と進化の側面を分析する上で有用であろう。
概要
中耳、すなわち槌骨、きぬた骨、およびアブミ骨の3耳小骨は、内耳、または蝸牛1,2に鼓膜からの音を伝達する哺乳類特有の聴覚チェーンを形成します。聴覚機能は、聴覚脳幹反応(ABR)3-6と、レーザドップラ振動計(LDV)7を用いてモニターすることができる鼓膜の背後槌骨の振動が閾値を測定することにより、マウスにおいて評価することができます。 ABR、LDV、及び歪み製品耳音響放射(DPOAE)の測定値を組み合わせることによって、導電性難聴は、感覚障害8から判別することができます。
耳の条件の動物モデルは、すべての年齢層の患者の幸福に聞くと耳の健康の重要性を与え、必要とされています。例えば、中耳炎は、人間の幼児や子供に見られる非常に一般的な耳の感染症であり、コンディ場合重度の、急性中耳炎とその合併症が発生する可能性がありますションは、適切な抗菌剤9で処理されていません。中耳炎のマウスモデルは、病因を理解するとトリートメント10,11の開発に有用であることを証明できました。
軟骨内骨化12,13によって形成されている(槌骨のgoniale一部を除く)は、マウス耳小骨は、骨代謝および形態形成の研究に非常に関連しています。まず、それらの小さなサイズは、X線または蛍光顕微鏡14を用いて、無傷の骨膜と骨の高分解能の分析を可能にします。第二に、このような骨細胞15の間で過不足骨吸収、または減損相互作用などの異常な骨代謝は、損失3,4,7を聞いへの潜在的な貢献者として分析することができます。第三に、異常な小骨の形態形成は、Hoxa2 16-19、MSX1 20-22、Prrx1 23、 グースコイドを欠く動物などのいくつかの遺伝子欠損マウスで報告されています(GSC)24,25、Bapx1 13、Tshz1 26、DUSP6(Mkp3)27、 ノギン ( ノーグ )28、FGFR1 29、甲状腺ホルモン受容体(THRA、THRB)5、Bcl2の 30と他1,31、または過剰発現マウスでHoxa2 32。最後に、その小さなサイズにもかかわらず、このような筋肉33や関節34,35など耳小骨に関連付けられている構造がアクセス可能です。
マウスの小骨は、人間の耳小骨よりも小さいですが、マウス中耳は、そのヒト対応のミニチュア版ではないことは注目に値します。ヒトでは、胚のあぶみ骨動脈が妊娠中に消えたのに対し、例えば、マウスでは、アブミ骨のリングを通過あぶみ骨動脈は、人生36を通じて持続します。また、マウスの槌骨の形態は、目と異なります電子人骨( 図6を参照)。ヒトでは、側頭骨に骨梁で構成乳様突起空気電池は小骨ではなく、水疱37を収容するのに対し、マウスでは、聴覚(鼓膜)水疱は、空気で満たされた中耳腔を囲みます。両種では、聴覚カプセル(耳のカプセル、骨迷路)は、蝸牛および内耳の三半規管を囲みます。中耳の比較と進化生物学は広範囲に38-40を検討されています。
最初の下に設けられたプロトコルはそれぞれ、中耳と内耳の主に構成され、聴覚水疱やカプセルを分析する方法について説明します。このプロトコルはまた、聴覚ブラから槌骨、きぬた骨とアブミ骨を分離する方法を示しています。最後に、耳小骨の組織切片の準備のために埋め込むための聴覚水疱やカプセルを配向する方法を示しています。
プロトコル
本研究で実行されるすべての動物の手順は、慶應義塾大学施設内動物管理使用委員会(IACUC - 承認番号:09221)によって承認され、研究における動物の使用のために慶應義塾大学で動物実験上の機関のガイドラインに従ってください。人間の標本は解剖学、慶應義塾大学医学部の学部に寄付死体から単離された、および機関の規制に従って使用しました。
聴覚ブラとカプセルの1の単離
- 呼吸換気が分以上の間停止するまでイソフルランまたはセボフルランに浸したペーパータオル上記のプラットフォームを含むjarにマウスを安楽死させる、その後、頚椎脱臼を行います。浸したペーパータオルでマウスの直接の接触を避けるように注意してください。
- 首の背側に小さい横切開を行い、基礎となる首のミューを露出するために両手を使用して、頭と尾に向かって離れて皮膚を引っ張りますSCLE組織。
- 14センチメートルに鋭い手術用はさみを使用して、子宮頸部領域にマウスを刎ねます。
- 完全に鼻に向かってピールスキン。鼻と切歯と一緒にすべての皮膚を切り取ります。
- 口の中にはさみを入れ、両側の咬筋をカット。
- 慎重に顎を開き、一緒に舌と下顎を削除します。
- 正中矢状面( 図1A、B)に沿って2つの半分に鋭いはさみ、スプリット頭蓋骨と頭蓋底を使用します。
- 鉗子を使用して、大脳と小脳半球および脳幹を削除します。聴覚水疱およびカプセルは小脳や脳幹に横方向に配置されています。聴覚水疱が聴覚カプセル( 図1C、D)をさらに横方向であることに注意してください。
- 周囲の頭蓋骨( 図1E)と水疱やカプセルを解剖。
- RTでリン酸緩衝生理食塩水(PBS)pHが7.4を含む皿に試料を転送します。
- U双眼解剖顕微鏡ファインダー、水疱やカプセル( 図1F)の周りに緩め境界をカットするために、周囲の骨やハサミを引き離すために鉗子を使用しています。削除周囲の骨がbasioccipital(腹側の境界線)、exoccipital(腹-後部ボーダー)、後頭上の(後部ボーダー)、壁間の、頭頂(背側の境界線)、側頭鱗(背前縁)、蝶形骨大翼の(前縁)、および蝶形骨底のです(前 - 腹ボーダー)の骨。耳管41の鼓膜開口部をサポートstyliformプロセス(SP)は、側頭骨の茎状突起は異なることに注意してください。
耳小骨の2単離:槌骨、きぬた骨とアブミ骨
- 槌骨
- 小さなはさみや鉗子の両方を使用して、鼓膜が表示されるように溝のtympanicusに外耳道の横の部分を削除する( 図2A、B)。
- 腹側(点線)と後部(#)の壁( 図2C)でmalleal突起ブレビス(輪骨端、ディスカッションを参照)、両方の近く鼓膜及び鼓膜骨の一部を削除してください。槌骨とテンソル鼓膜筋は今( 図2D、E)が露出されるべきです。
- 槌骨( 図2F)を持ち上げ、27 G針( 図2G)の斜めの縁と鼓膜張筋をカット。他の哺乳類に見られるようmalleal胸骨柄がしっかりと、鼓膜に付着していることに注意してください。
- 壊れやすい胸骨柄、より慎重に鼓膜を外します。 3耳小骨を明らかにするために鼓膜骨を削除します。
- 耳小骨の関節( 図2H)できぬたから槌骨を脱臼。
- gonialeで前方のプロセスを破壊することにより、槌骨を分離します。
- キヌタ骨とアブミ骨
- トンを隔離彼の短い下腿( 図3A)できぬたの後部靭帯を切断することによりきぬた。
- 27 G針( 図3B、C)の斜めの縁とアブミ骨の近くあぶみ骨動脈を切断してアブミ骨を分離します。必要に応じて、針とアブミ骨の筋肉の過程であぶみ骨筋の腱を切りました。
- アブミ骨の閉鎖孔に縫い針(またはマーキングピン)を挿入し、アブミ骨を持ち上げます。アブミ骨を除去した後、楕円形の窓の開口部がはっきりと見える( 図3D)でなければなりません。
聴覚ブラとカプセルの3埋め込み
- パラフィンブロックに埋め込むための準備
- 第1節で説明したように水疱やカプセルを分離します。
- 4℃でPBS中の4%パラホルムアルデヒド(PFA)で水疱やカプセルを浸し、ハサミでオフに水疱(styliformプロセス)の前端をカットCは、および固定液は胞に入ることを許可します。空気が水疱の中に閉じ込めてしまう場合は、針と注射器でそれを削除します。チューブローテーター上で4°CO / Nで固定液中に水疱やカプセルを残します。
注意:PFAは毒性があり、慎重に取り扱ってください。 - PBSで一度洗浄します。
- 10%エチレンジアミン四酢酸二ナトリウム塩二水和物(EDTA-2Naを)で4℃で一週間脱灰の水疱やカプセル、2 mL試験管中の100mMトリス塩基、pHは7.0、。一日おきにバッファを変更します。
- PBSで一度洗浄します。標本を4℃の水中に70%エタノール中で保存することができます。必要に応じて、段階的なアルコール系(30%、50%、70%水溶液)を介して70%エタノールに移します。
- 組織プロセッサでは、エタノール溶液(70%、2回95%、3倍の100パーセント、各1時間)、(40℃で4倍、各1時間)キシレンに明確な、一連の等級に標本を脱水し、して標本に潜入溶融したパラフィンワックス42。必要に応じて、商業組織clearinで代用キシレングラム溶液( 例えば 、ヒスト・クリア)。
- プロセッサからの標本をアンロードし、そのカセットから削除します。
- コンソールシステムを埋め込む組織で、場所は、溶融パラフィンワックスで満たされた金型に標本。 (第4章)を埋め込むに進んでください。
- 冷凍ブロックに埋め込むための準備(川本のフィルム法)43
- 第1節で説明したように水疱やカプセルを分離します。
- ハサミでオフ水疱(styliformプロセス)の前端をカットし、4℃で(抗原性を維持するために、2%または1%PFAではなく、PBS中4%)固定液中に水疱やカプセルを浸します。空気が水疱の中に閉じ込めている場合は、針と注射器を使用して、それを削除してください。チューブローテーター上で4°CO / Nで固定液中に水疱やカプセルを残します。
- PBSで迅速水疱やカプセルを洗浄し、直ちに4℃で液体凍結包埋化合物に浸します。
- 重要:もしあれば途中で気泡を削除しますそして、針であり、ピンセットで包埋化合物を添加することによって吸引を介して外耳。 (第4章)を埋め込むに進んでください。
4.サンプルオリエンテーションと埋め込み
注:全体の水疱やカプセルは、所望のセクションをカットするために埋め込む時に特定の方向に配置されなければなりません。以下に概説する手順はセクション様々な向きで槌骨に使用されています。
- 槌骨の縦方向(矢)セク
- 温かいパラフィン(または冷凍包埋化合物)でブラの側面または外耳道を置きます。槌骨の首と横方向ラミナは埋め込み皿( - C図4A)の水平方向の底に平行になるように向きを調整します。鼓膜がマウスヘッド( 図4Aに垂直に約30°の角度で傾斜していることに注意してください。図59をカンペンに 44)。
- 槌骨の水平切片
- 温かいパラフィン(または冷凍包埋化合物)に水平に背稜を置きます。槌骨の首と横方向ラミナは埋め込み皿( - F図4D)の底部に垂直になるように水疱やカプセルの向きを調整します。
- 胸骨柄と鼓膜5の正面切片(断面)
- それは埋め込み皿の底に垂直になるように温かいパラフィン(または冷凍包埋化合物)にmalleal胸骨柄を配置します。
- (その代わり、ドライアイス/ヘキサン浴中で凍結包埋化合物を使用する)コンソールシステムを埋め込む組織にパラフィンワックスを硬化させるのに適切な温度にブロックをクールダウン。
- プロセス・組織ブロックとの日常的な手順を用いて切断面。ヘマトキシリンおよびエオシン(H&#とたとえば、染色パラフィン切片38; E)、サフラニンO(軟骨用)、または破骨細胞のための酒石酸耐性酸性ホスファターゼ(TRAP)活性()3、または免疫組織化学による。非脱灰凍結切片は、骨の蛍光色素14を使用してラベル付け、カルシウムのためのアリザリンレッド染色、および免疫蛍光42に適しています。
結果
このプロトコルは、マウスの聴覚の水疱から小骨を単離するための方法を提示します。まず、水疱およびカプセルは、頭蓋骨( 図1)から単一部品として摘出されています。解剖水疱はその後槌骨( 図2)とキヌタ骨とアブミ骨( 図3)を調製するために使用されます。聴覚水疱やカプセルのランドマークは、ブラの前端に背稜、前半規管、およびsubarcuate窩( 図1F)styliformプロセスです。 Microcomputed断層撮影(CT)イメージングは、聴覚ブラで小骨ならびにそれらの小骨の縦と横切片( 図4)のための最適な方向を明らかにしています。
槌骨の長手方向のパラフィン切片について、水疱およびカプセルは、PA内に埋め込まれ、1週間4℃でEDTAで脱灰しました図4(A)に示す向きでラフィンブロック- C、4ミクロンの切片、その後、H&Eを用いて染色しました。聴覚胞に鼓膜に取り付けられた槌は、P14( 図5A)で継続的な軟骨内骨化を明らかにしました。新しい骨の形成を視覚化するために、カルセイン(30μgの/グラム体重)を腹腔P20マウスに注入し、そして水疱およびカプセルはP21で24時間後に単離しました。脱灰せずに試料を凍結包埋し、次いでカワモト43の方法に基づいて、接着フィルムを使用して6μmの凍結切片にしました。 DAPIで核染色(4 '、6-ジアミジノ-2-フェニルインドール)の後、切片を蛍光顕微鏡下で観察しました。カルセイン信号(緑)槌骨(M)、水疱カプセル( 図5B)に新たな骨形成を明らかにしました。槌骨の水平切片について、5週齢のマウスから単離した聴覚水疱がために(脱灰せずに冷凍埋め込まれました配向は、 図4Dを参照してください-川本法を用いて6μmの凍結切片でF)を、そしてH&Eを用いて染色しました。 malleal突起・ブレビス(MPB)の水平方向の切片はまた、蝸牛( 図5C)を示しています。
P31マウスから単離された右耳小骨の内側ビューは、マウスの槌骨の典型的な特徴を示し、すなわち、「滑空-カモメ翼様」(またはペルシャの剣のような45)胸骨柄、著名な突起・ブレビス(輪骨端、ディスカッション)を参照してください、と横方向の薄層( 図6)。前方プロセス(突起前方)はgoniale周りの解剖手順で破断したと(ectotympanic)鼓膜リングから分離したことに注意してください。 incudostapedial関節が脱臼されるのに対し、この代表的なサンプルでは、槌骨とキヌタ骨の間そのままincudomalleolarジョイントを示します。 mallealへの腱の挿入とあぶみ骨筋のプロセスは、( 図6A、アスタリスク)検出可能です。
図6Bは、同じ倍率で、マウスおよびヒトの耳小骨を比較します。サイズ以外の種の違いは、以下のものが挙げられます。 malleal胸骨柄は、翼状のマウスではなく、ヒトでのクラブのようです。解剖学的軸(または回転軸、槌骨ときぬたの短いプロセスの前工程を通る線)と胸骨柄との間の角度は、マウスにおいてはるかに小さく、ほぼ垂直とは対照的に2は、ほぼ平行ですヒトで6,46-48。人間の耳小骨では、vibrometric研究はincudo-くるぶし関節が機能的に49を固定するのではなく、モバイルであることを明らかにしました。マウスの槌骨は、ヒト47で見かけない、広い薄く、かつ平坦な横方向のラミナを示します。マウスでは、突起の前方には、gonialeとティンパニすなわち、膜性骨に融合しますCリング、ヒトでの突起の前方には、骨41の小さな骨片に縮小されています。マウスとヒトのアブミ骨も異なります。マウスでは、前の下腿は湾曲しており、後部下腿がよりストレートに対し、ヒトである、前方下腿がまっすぐ後方下腿以上です。体の大きさに槌骨頭の相対は、大規模な「最小」の骨48の相対成長関係に重大な変動性を実証し、そのような黄金のモルなどの種に拡大されたことは注目に値します。
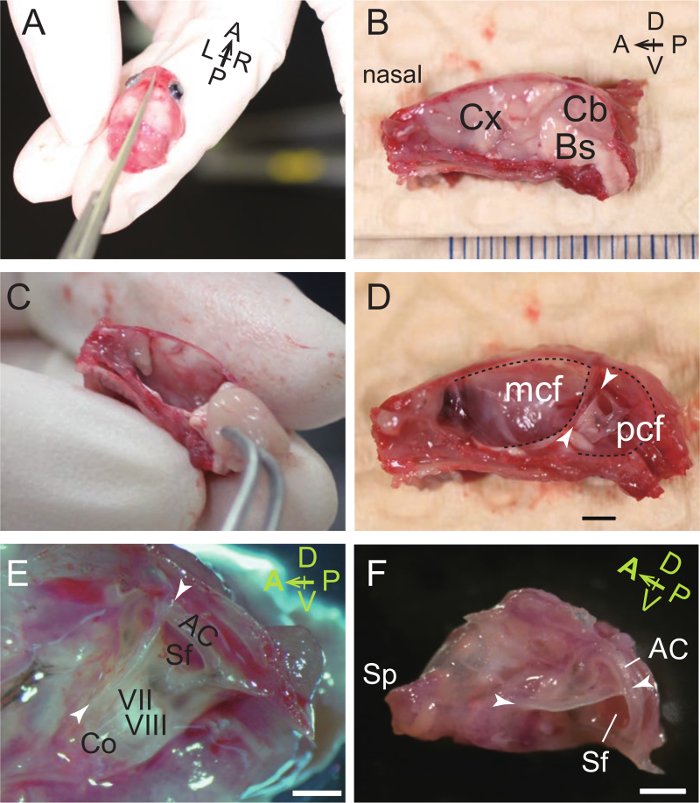
聴覚ブラとカプセルの図1.解剖。 (A)P31マウスの頭蓋骨は、右半分と左半分に分割されます。 、前方; P、後部; L、左; R、右。 (B)に二分、肌の頭の右半分の内側面。 CX、大脳皮質。 Cbと、小脳。旅館、brainstem。 D、背側; V、腹側。 (C)鉗子で脳の除去。 (D)右頭蓋骨における聴覚カプセルの内側側ビュー。背クレスト(矢頭)は中頭蓋窩(MCF)との間に位置し、後部頭蓋窩(PCF)と聴覚カプセルの背前部および腹-後面を分離します。スケールバー、2ミリメートル。 (E)聴覚水疱やカプセル(内側ビュー)の高倍率。株式会社、蝸牛。 VII、顔面神経; VIII、神経内耳; AC、前方(スーペリア)三半規管。小脳paraflocculusを収容SF、弓下窩、。スケールバー、1ミリメートル。孤立した聴覚水疱やカプセル(内側ビュー)の(F)顕微鏡写真。 SP、styliformプロセス。スケールバー、1ミリメートル。 (A - E)、P31マウス。 (F)、P33マウス。 この図の拡大版をご覧になるにはこちらをクリックしてください。
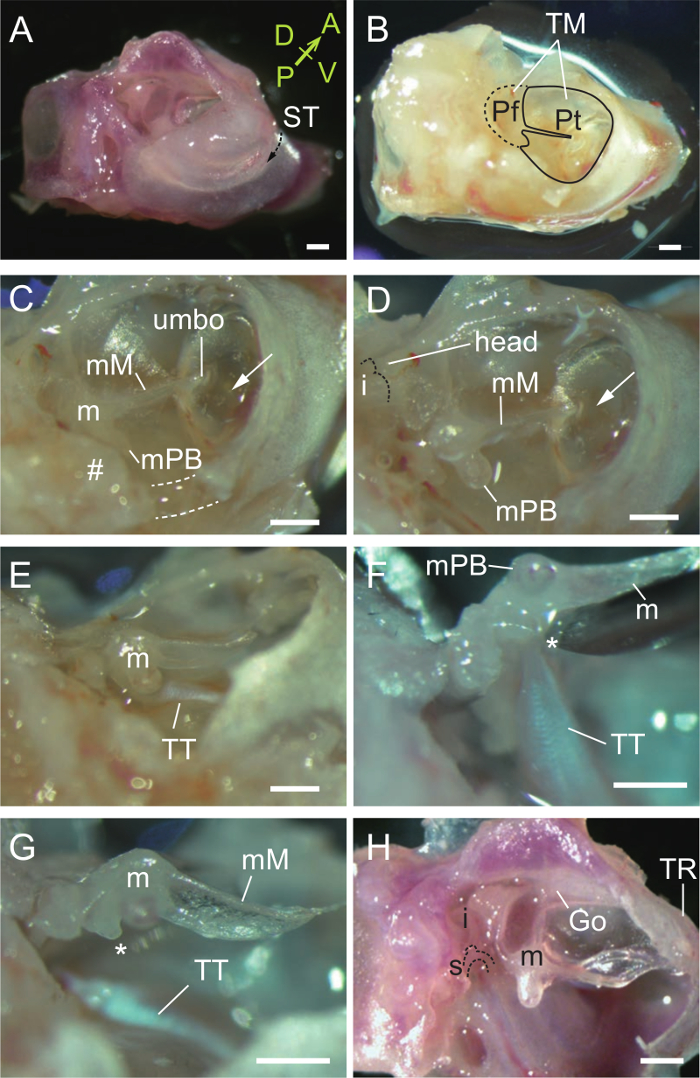
槌骨の2解剖図。 (A)右聴覚ブラとカプセルの腹外側ビュー。溝のtympanicus(ST、破線の矢印)は鼓膜の付着部位です。 STへの横方向の骨は、外耳の一部であり、STに骨の内側には、中耳腔の床を形成しています。 、前方; P、後部; D、背側; V、腹側。外耳道の除去後(B)閲覧PARS flaccida(PF)とtensaを扁平部白金(Pt)を含む鼓膜(TM)を明らかにしました。 (C)malleal突起・ブレビス(MPB)付近鼓膜骨(点線および#)の部分の除去。メートル、槌骨。 mMの、malleal胸骨柄。アロー、鼓膜を通して見た中耳腔における気泡。 (D)露出槌骨。槌骨頭が示されています。点在ラインはキヌタ骨の関節面を示しています。槌骨に取り付けられた鼓膜張筋(TT)の(E)腱。槌骨が解除されたとき(F)テンソル鼓膜が引っ張られます。 *、筋肉のプロセス。 (G)テンソル鼓室は、針を用いて切断されています。三耳小骨鼓膜を除去した後(H)。 incudo-くるぶし関節が脱臼されます。メートル、槌骨。私、きぬた。秒、アブミ骨。 、goniale(槌骨と鼓膜リング、TRに融合した)移動します。すべてのスケールバー、0.5ミリメートル。 (A、H)、P33マウス。 (B - G)、P31マウス。 この図の拡大版をご覧になるにはこちらをクリックしてください。
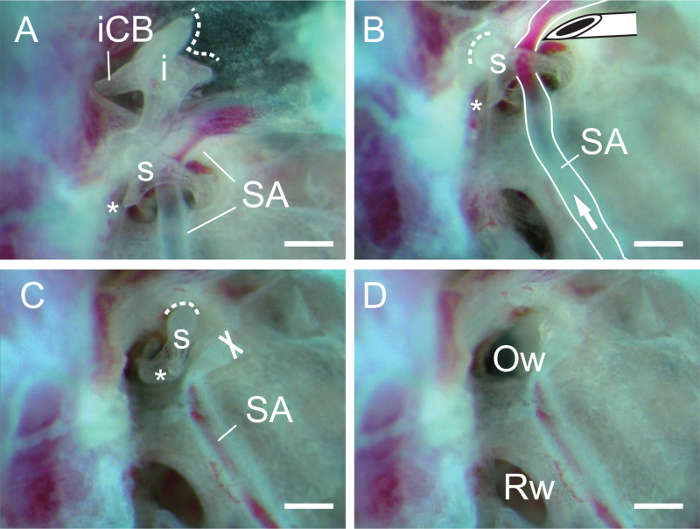
きぬた骨とアブミ骨の図3.解剖。 (A)きぬた骨と槌骨を除去した後アブミ骨。あぶみ骨動脈(SA)は、アブミ骨(複数可)を通過します。点線はきぬたの関節面を示しています。きぬた(i)の短い下腿(ICB、下腿ブレーベ)が後方靭帯(図示せず)により固定されていることに注意してください。アスタリスク、アブミ骨の筋肉のプロセス。 (B)は、キヌタ骨を除去した後アブミ骨。針先端はあぶみ骨動脈(SA)を切断するために使用されます。矢印、血流の方向。点線はアブミ骨の関節面を示しています。 (C)あぶみ骨動脈アブミ骨から除去されます。 Xは、あぶみ骨動脈(SA)の切断端を示しています。 (D)楕円形の窓(オウ、 卵円窓ovalisまたは前庭窓)は、アブミ骨を除去した後に表示されます。 RW、丸い窓( 正円窓または卵円窓蝸牛 )。スケールバー、0.5ミリメートル。 このの拡大版をご覧になるにはこちらをクリックしてください。図。
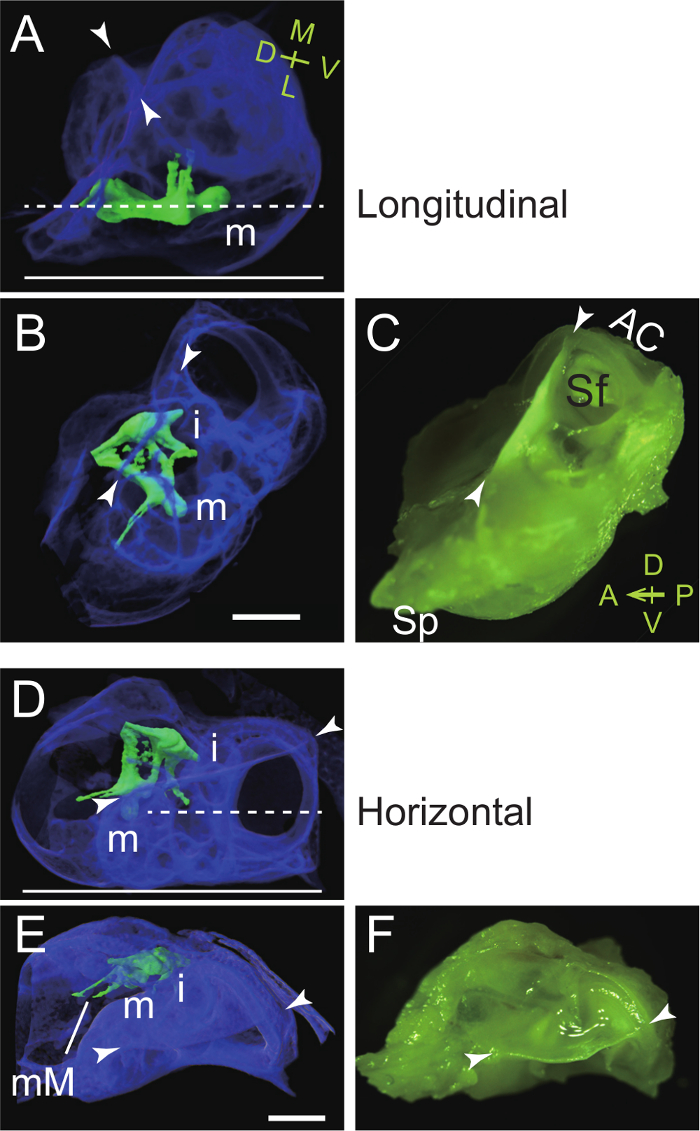
槌の セク -と水平(E D) -縦(C矢、A)の埋め込み時に聴覚ブラとカプセルを方向付ける 4.図 。 (A - C)槌骨の首と横方向ラミナ皿を埋め込むの底に平行に配置されています。 (A)は側面図:マイクロCT画像水疱(青疑似カラー)の右槌骨の埋め込みを表示します。槌骨とキヌタ骨は緑の疑似カラーされています。破線、所望の切断面。実線、皿を埋め込むの底。メートル、槌骨。矢じり、背稜。 M、内側。 L、横; D、背側; V、腹側。 (B)トップビュー:マイクロCT画像。水疱(styliformプロセス)の前端が削除されたことに注意してください。私、きぬた。 (C)トップビュー:顕微鏡写真(で撮影カラーフィルター)。 AC、前方(スーペリア)三半規管。 SF、弓下窩。 SP、styliformプロセス。 、前方; P、後部; D、背側; V、腹側。 (D - F)槌骨の突起ブレビス皿を埋め込むの底に垂直に配置されています。 (D)サイドビュー:マイクロCT画像右槌骨の埋め込みを表示します。破線、所望の切断面。実線、皿を埋め込むの底。 (E)トップビュー:マイクロCT画像。 mMの、malleal胸骨柄。 (F)トップビュー:顕微鏡写真(カラーフィルターで撮影)。スケールバー、1ミリメートル。以前7に記載されているように 、マイクロCT画像は、5ミクロンのボクセル解像度で得られました。 この図の拡大版をご覧になるにはこちらをクリックしてください。
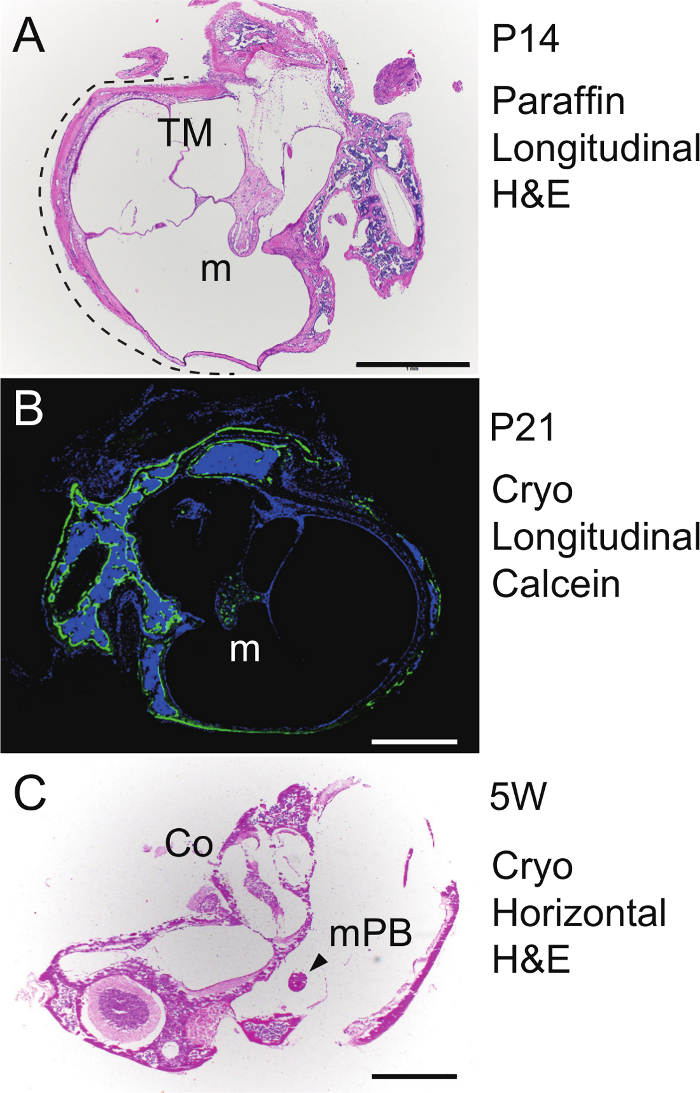
Figure 5.組織学。 (A)H&E染色。 P14で聴覚水疱(点線)でパラフィン包埋右槌(メートル)の長手方向(矢状)のセクション。 TM、鼓膜。 (B)カルセイン骨ラベリング。 P21での聴覚胞で凍結し、非脱灰左槌骨(メートル)の縦断面図。対比染色、DAPI。 (C)H&E染色。聴覚水疱やカプセル(5週齢のマウス)で凍結し、左の非脱灰malleal突起・ブレビス(MPB)の水平断面。株式会社、蝸牛。スケールバー、1ミリメートル。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図6. 耳小骨の内側側ビュー。 (A)Pの右耳小骨31マウス。 、前方; P、後部; D、背側; V、腹側。スケールバー、1ミリメートル。槌骨頭(槌骨頭、小頭malleusの複数形)。首(コルムmalleusの複数形)。ラミナ(横方向ラミナ)。 mMの(槌骨柄)。黒アスタリスク(槌骨の筋肉の工程)。 MPA(突起前方、突起薄筋)。 MPB(突起・ブレビス)。きぬた本体(コーパスのincudis)。 ICB(クリュのブレーベ、短い下腿、短い工程)。 ICL(クリュリウム・ロンガム、長い下腿、長いプロセス)。 IPL(突起のlenticularis、レンチキュラープロセス、シルヴィアンの骨端)。アブミ骨頭(頭がstapedis)。白アスタリスク(アブミ骨の筋肉の工程)。 SCA(クリュのanterius、前方下腿)。 SCP(クリュのposterius、後部下腿)。ベース(基底stapedis、踏み板)。 SOF(閉鎖孔、脚間の孔)。 (B)76歳のヒト女性(解剖学の学科の礼儀、慶應義塾大学医学部)の右耳小骨。 P31マウス(右下)の小骨ヒト小骨のために用いたものと同じ倍率で撮像されます。 CURVEDの矢印は、解剖学的軸と胸骨柄(点線)との間の角度を示しています。スケールバー、2ミリメートル。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
ここでは、出生後のマウスにおける聴覚水疱やカプセルを分離するのに有用な方法を提示します。 P12の前に、組織が脆弱であり、単離の間に損傷を受けることができます。 P12の後、聴覚水疱およびカプセルは簡単に周囲の組織から単離することができます。切片の前に頭から水疱を解剖することは、いくつかの利点があります。まず、出生後のキャビテーションと聴覚胞の成長が最も活発以降P6から発生し、P14 50によって完了しています。鼓膜と蝸牛の壁との間の間葉組織は、キャビテーション過程を通じて空気によって置き換えられます。中耳腔で得られた空気は、固定、脱灰と埋め込み時の組織と液体の間の接触を妨げることができます。むしろ非絶縁ブラでそうしようとするよりも、前端(styliformプロセス)を切断することにより、単離された聴覚水疱から空気を除去することが容易です。第二に、槌骨(および鼓膜)の向きは垂直ではありません頭インチこれは、与えられた向きに孤立した聴覚水疱やカプセルを埋め込むことにより望ま面での槌骨部分に容易です。
分離された後は、聴覚水疱およびカプセル剤は、多数の分析のために有用です。例えば、高分解能X線マイクロCTは、槌骨14内の骨形成の毛細血管などの骨微細構造の形態を明らかにすることができます。 stereofluorescence解剖顕微鏡は、中・内耳33中の蛍光タンパク質を発現するレポーターマウスを評価する際に構造を可視化するための強力なツールです。加えて、in vivoまたはex vivo蛍光標識法と全載免疫蛍光検出における種々に実施することができます。光シート蛍光顕微鏡は、3次元解析51のために有用です。ここで説明されていないが、多様な解剖学的構造は、末梢神経、血管などの聴覚水疱やカプセルに関連付けられている、と中耳内の鼓膜は、このプロトコルを使用して評価することができます。
パラフィン切片を埋め込むため、鉱化作用の解析を許可していない前に、骨組織の脱灰を必要とすることに注意してください。対照的に、凍結切片を調製するために使用されるカワモト膜方法43は、脱灰せずに行われ、アリザリン染色としてインビボ骨標識法や特殊染色に用いた石灰化の研究に適していることができます。クライオセクショニング条件は、マウスの年齢に基づい応じて最適化する必要があります。例えば、クライオスタットチャンバ内の少ない涼しい温度はセクションへのダメージを最小限に抑えるために古いマウスの試験片をお勧めします。
マウスでは、槌骨の顕著な半球状の突起の正しい用語は「輪骨端」です。それにもかかわらず、用語「突起ブレビス」は広く、より番目のための輪骨端を示すために使用されています特にマウスの発達生物学者の間で二十年、16,20,22-25。 「突起ブレビス」もともと輪骨端とは異なる横プロセス(突起が外側の)、と呼ばれます。ヒトでは、わずかに円錐状突起に似た横方向のプロセスは、( 図6B、内側のビューでは見られない)胸骨柄から延びる、鼓膜への取り付けの一般的なラインを形成しています。マウスでは、横方向のプロセスは、突起物48の反対側の端部で胸骨柄の投影です。鼓膜の扁平部flaccidaは槌骨の横方向のプロセスを上回っています。輪骨端は、人間の槌骨に明らかではありません。
開示事項
The authors have nothing to disclose.
謝辞
The authors thank Masaki Yoda and Elise Lamar for critical reading of the manuscript, Kazumasa Takenouchi for help with histology, Mari Fujiwara for help with microscopy and Makoto Morikawa for help in photographing human and mouse auditory ossicles.
資料
| Name | Company | Catalog Number | Comments |
| Tools/Equipment | |||
| Paper towel | Daio Paper Corporation | 703347 | can be purchased from other vendors |
| Glass Jar | Various | can be purchased from other vendors | |
| 14 cm surgical scissors | Fine Science Tools (F.S.T.) | 91400-14 | can be purchased from other vendors |
| Extra fine scissors-straight | Fine Science Tools (F.S.T.) | 14084-08 | can be purchased from other vendors |
| Fine Forceps Angled 45° | Fine Science Tools (F.S.T.) | 11063-07 | can be purchased from other vendors |
| Dissecting microscope | Nikon | SMZ800N | for routine dissection |
| Dissecting microscope | Nikon | SMZ18 | for movies |
| Injection needle 27 G | TERUMO | NN-2719S | |
| Syringe (1 mL) | TERUMO | SS-01T | |
| Marking Pin | Various | ||
| Tube rotator RT-50 | TAITEC | 0000165-000 | can be purchased from other vendors |
| Cryostat | Leica | CM3050S | http://www.leicabiosystems.com/histology-equipment/cryostats/details/product/leica-cm3050-s/ |
| TC-65 Tungsten blade | Leica | 14021626379 | for Kawamoto's firm method |
| Stainless containers | Leica | for Kawamoto's firm method | |
| Cryofilm type IIC | Leica | for Kawamoto's firm method | |
| Silane coated slide (New Silane II) | Muto Pure Chemicals | 511617 | can be purchased from other vendors |
| Cover glass | Matsunami | can be purchased from other vendors | |
| Tissue processor | Sakura Finetek | VIP-5 | can be purchased from other vendors |
| Tissue Embedding Console System | Sakura Finetek | Tissue-Tek TEC 5 | can be purchased from other vendors |
| Sliding microtome for paraffin | Yamato Kohki Industrial | REM-710 | can be purchased from other vendors |
| Path Blade+pro for hard tissue | Matsunami | PB3503C | for paraffin section |
| Micro-CT | RIGAKU | R_mCT2 | http://www.rigaku.com/en |
| Fluorescence microscope | KEYENCE | BZ-9000 | |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Isoflurane | Maruishi pharmaceutical Co. Ltd | ||
| NaCl | wako | 191-01665 | for PBS |
| KCl | wako | 285-14 | for PBS |
| Na2HPO4 12H2O | wako | 196-02835 | for PBS |
| KH2PO4 | wako | 287-21 | for PBS |
| Paraformaldehyde (PFA, EM Grade) | TAAB | P001 | |
| EDTA-2Na | wako | 15111-45 | |
| Trizma base | Sigma | T1503-1KG | |
| Super Cryoembedding Medium | Leica | for Kawamoto's firm method | |
| Dry Ice | Various | for Kawamoto's firm method | |
| Hexane | wako | 080-03423 | for Kawamoto's firm method |
| Super Cryomouting Medium type R2 | Leica | for Kawamoto's firm method | |
| Paraffin | Sakura Finetek | 781001A0107 | |
| Histo-Clear | NDS | HS-200 | |
| Calcein | DOJINDO | 340-00433 | |
| Hematoxylin | wako | 131-09665 | |
| Eosin | wako | 051-06515 |
参考文献
- Mallo, M. Formation of the middle ear: recent progress on the developmental and molecular mechanisms. Dev Biol. 231, 410-419 (2001).
- Manley, G. A. An evolutionary perspective on middle ears. Hear Res. 263, 3-8 (2010).
- Kanzaki, S., Ito, M., Takada, Y., Ogawa, K., Matsuo, K. Resorption of auditory ossicles and hearing loss in mice lacking osteoprotegerin. Bone. 39, 414-419 (2006).
- Kanzaki, S., Takada, Y., Ogawa, K., Matsuo, K. Bisphosphonate therapy ameliorates hearing loss in mice lacking osteoprotegerin. J Bone Miner Res. 24, 43-49 (2009).
- Cordas, E. A., et al. Thyroid hormone receptors control developmental maturation of the middle ear and the size of the ossicular bones. Endocrinology. 153, 1548-1560 (2012).
- Dong, W., Varavva, P., Olson, E. S. Sound transmission along the ossicular chain in common wild-type laboratory mice. Hear Res. 301, 27-34 (2013).
- Kanzaki, S., et al. Impaired vibration of auditory ossicles in osteopetrotic mice. Am J Pathol. 178, 1270-1278 (2011).
- Qin, Z., Wood, M., Rosowski, J. J. Measurement of conductive hearing loss in mice. Hear Res. , (2009).
- Klein, J. O. Is acute otitis media a treatable disease?. N Engl J Med. 364, 168-169 (2011).
- Rosch, J. W., et al. A live-attenuated pneumococcal vaccine elicits CD4+ T-cell dependent class switching and provides serotype independent protection against acute otitis media. EMBO Mol Med. 6, 141-154 (2014).
- Li, X., et al. Otitis media in sperm-associated antigen 6 (Spag6)-deficient mice. PLoS One. 9, e112879 (2014).
- Rodríguez Vázquez, J. F., Mérida Velasco, J. R., Jiménez Collado, J. A study of the os goniale in man. Acta Anat (Basel). 142, 188-192 (1991).
- Tucker, A. S., Watson, R. P., Lettice, L. A., Yamada, G., Hill, R. E. Bapx1 regulates patterning in the middle ear: altered regulatory role in the transition from the proximal jaw during vertebrate evolution. Development. 131, 1235-1245 (2004).
- Matsuo, K., et al. Osteogenic capillaries orchestrate growth plate-independent ossification of the malleus. Development. 142, 3912-3920 (2015).
- Matsuo, K. Cross-talk among bone cells. Curr Opin Nephrol Hypertens. 18, 292-297 (2009).
- Rijli, F. M., et al. A homeotic transformation is generated in the rostral branchial region of the head by disruption of Hoxa-2, which acts as a selector gene. Cell. 75, 1333-1349 (1993).
- Mallo, M., Gridley, T. Development of the mammalian ear: coordinate regulation of formation of the tympanic ring and the external acoustic meatus. Development. 122, 173-179 (1996).
- O'Gorman, S. Second branchial arch lineages of the middle ear of wild-type and Hoxa2 mutant mice. Dev Dyn. 234, 124-131 (2005).
- Santagati, F., Minoux, M., Ren, S. Y., Rijli, F. M. Temporal requirement of Hoxa2 in cranial neural crest skeletal morphogenesis. Development. 132, 4927-4936 (2005).
- Satokata, I., Maas, R. Msx1 deficient mice exhibit cleft palate and abnormalities of craniofacial and tooth development. Nat Genet. 6, 348-356 (1994).
- Zhang, Z., et al. Malleal processus brevis is dispensable for normal hearing in mice. Dev Dyn. 227, 69-77 (2003).
- Houzelstein, D., Cohen, A., Buckingham, M. E., Robert, B. Insertional mutation of the mouse Msx1 homeobox gene by an nlacZ reporter gene. Mech Dev. 65, 123-133 (1997).
- Martin, J. F., Bradley, A., Olson, E. N. The paired-like homeo box gene MHox is required for early events of skeletogenesis in multiple lineages. Genes Dev. 9, 1237-1249 (1995).
- Yamada, G., et al. Targeted mutation of the murine goosecoid gene results in craniofacial defects and neonatal death. Development. 121, 3005-3012 (1995).
- Rivera-Pérez, J. A., Mallo, M., Gendron-Maguire, M., Gridley, T., Behringer, R. R. Goosecoid is not an essential component of the mouse gastrula organizer but is required for craniofacial and rib development. Development. 121, 3005-3012 (1995).
- Coré, N., et al. Tshz1 is required for axial skeleton, soft palate and middle ear development in mice. Dev Biol. 308, 407-420 (2007).
- Li, C., Scott, D. A., Hatch, E., Tian, X., Mansour, S. L. Dusp6 (Mkp3) is a negative feedback regulator of FGF-stimulated ERK signaling during mouse development. Development. 134, 167-176 (2007).
- Hwang, C. H., Wu, D. K. Noggin heterozygous mice: an animal model for congenital conductive hearing loss in humans. Hum Mol Genet. 17, 844-853 (2008).
- Calvert, J. A., et al. A missense mutation in Fgfr1 causes ear and skull defects in hush puppy mice. Mamm Genome. 22, 290-305 (2011).
- Carpinelli, M. R., et al. Anti-apoptotic gene Bcl2 is required for stapes development and hearing. Cell death dis. 3, e362 (2012).
- Chapman, S. C. Can you hear me now? Understanding vertebrate middle ear development. Front Biosci (Landmark Ed). 16, 1675-1692 (2011).
- Kitazawa, T., et al. Distinct effects of Hoxa2 overexpression in cranial neural crest populations reveal that the mammalian hyomandibular-ceratohyal boundary maps within the styloid process. Dev Biol. 402, 162-174 (2015).
- Wang, L., et al. Scleraxis is required for differentiation of the stapedius and tensor tympani tendons of the middle ear. J Assoc Res Otolaryngol. 12, 407-421 (2011).
- Amin, S., Tucker, A. S. Joint formation in the middle ear: lessons from the mouse and guinea pig. Dev Dyn. 235, 1326-1333 (2006).
- Amin, S., Matalova, E., Simpson, C., Yoshida, H., Tucker, A. S. Incudomalleal joint formation: the roles of apoptosis, migration and downregulation. BMC Dev Biol. 7, 134 (2007).
- Hiruma, T., Nakajima, Y., Nakamura, H. Development of pharyngeal arch arteries in early mouse embryo. Journal of anatomy. 201, 15-29 (2002).
- Treuting, P. M., Dintzis, S. M., Treuting, P. M., Dintzis, S. M. Ch. 22, Special senses: ear. Comparative Anatomy and Histology: A Mouse and Human Atlas. 22, 419-432 (2012).
- Mallo, M., Schrewe, H., Martin, J. F., Olson, E. N., Ohnemus, S. Assembling a functional tympanic membrane: signals from the external acoustic meatus coordinate development of the malleal manubrium. Development. 127, 4127-4136 (2000).
- Anthwal, N., Joshi, L., Tucker, A. S. Evolution of the mammalian middle ear and jaw: adaptations and novel structures. Journal of anatomy. 222, 147-160 (2013).
- Takechi, M., Kuratani, S. History of studies on mammalian middle ear evolution: a comparative morphological and developmental biology perspective. J Exp Zool B Mol Dev Evol. 314, 417-433 (2010).
- Henson, O. W., Keidel, W. D., Neff, W. D. Ch. 3, Comparative Anatomy of the Middle Ear. Handbook of Sensory Physiology. Vol. 1, Auditory System. Anatomy, Physiology (Ear), 39-110 (1974).
- . . Handbook of Histology Methods for Bone and Cartilage. , (2003).
- Kawamoto, T. Use of a new adhesive film for the preparation of multi-purpose fresh-frozen sections from hard tissues, whole-animals, insects and plants. Arch Histol Cytol. 66, 123-143 (2003).
- Kampen, P. N. V. . Gegenbaurs Morphologiesches Jahrbuch. 34, 321-722 (1905).
- Lee, J. H., Park, K., Kang, T. C., Choung, Y. H. Three-dimensional anatomy of the temporal bone in normal mice. Anat Histol Embryol. 38, 311-315 (2009).
- Fleischer, G. Evolutionary principles of the mammalian middle ear. Adv Anat Embryol Cell Biol. 55, 3-70 (1978).
- Lavender, D., Taraskin, S. N., Mason, M. J. Mass distribution and rotational inertia of "microtype" and "freely mobile" middle ear ossicles in rodents. Hear Res. 282, 97-107 (2011).
- Mason, M. J. Of mice, moles and guinea pigs: functional morphology of the middle ear in living mammals. Hear Res. 301, 4-18 (2013).
- Willi, U. B., Ferrazzini, M. A., Huber, A. M. The incudo-malleolar joint and sound transmission losses. Hear Res. 174, 32-44 (2002).
- Richter, C. A., et al. Defects in middle ear cavitation cause conductive hearing loss in the Tcof1 mutant mouse. Hum Mol Genet. 19, 1551-1560 (2010).
- Buytaert, J. A., Johnson, S. B., Dierick, M., Salih, W. H., Santi, P. A. MicroCT versus sTSLIM 3D imaging of the mouse cochlea. J Histochem Cytochem. 61, 382-395 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved