Method Article
哺乳類細胞培養を均一な骨材を生産する O の形をした船で揺れ、軌道
要約
ここで軌道振動の細胞凝集体の培養に特化した O 状の容器を使用するためのプロトコルを提案する.このバッグで育った HEK293 細胞の形で従来の培養容器で栽培したものよりも均一な骨材。
要約
哺乳類の細胞凝集体の培養は医療やバイオ テクノロジーの分野でさまざまなアプリケーションに必要です。使い捨て袋方式は細胞凝集体の大量生産のための最も簡単なテクニックの 1 つが、彼らは培養器の下部中央に集まるときに発生する過剰集計に対する文化は保護されません。この問題を解決するためには、O の形をした皿と中央地域を含むどちらも O 型のバッグを開発しました。どちらかの O 型培養器で成長指標が著しく従来船会合体よりも大きさが均一。組織学的分析には従来の培養皿で集計するには、ほとんど悪い酸素供給による壊死のコアが含まれています。対照的に、であっても従来の培養皿で集計するような直径を持つ O 状の袋で栽培された集計では、壊死のコアが表示されませんでした。これらの結果は、O 状の袋がバッグの素材の酸素透過性により凝集体に十分な酸素を提供することをお勧めします。我々 は、したがって、このガス透過性 O 型培養バッグはバイオ テクノロジーの分野で必要とされる均一な骨材の大量生産に適している提案します。
概要
浮遊細胞培養重要な役割を再生医療1組換えタンパク質生産2のセル生産のスケール アップと時々 以上 10 の7セルまでの高い細胞密度を達成するために簡単だから/mL5。チャイニーズハム スター卵巣 (CHO) 細胞3と人間の萌芽期の腎臓の細胞 293 (HEK293)4浮遊培養で栽培されている、ひと多能性幹細胞 (hPSCs) は、最近の懸濁液培養システムで栽培されている再生治療1,6,7。懸濁培養の使用は今後も増加する予定です。
懸濁培養でいくつかの細胞は単一細胞として成長できないし、集合体を形成する必要があります、したがって、します。たとえば、hPSCs は、凝集体を形成することがなく停止条件で生き残ることはできません。但し、集約された成長のためのこの要件は均一懸濁培養の難しさを示します。1 つ難易度サスペンション文化8の効率を決定する文化の早い期間で均一な骨材の形成であります。別の難しさは、凝集体への栄養素の物質伝達です。特に、酸素供給が集計の最大サイズを制限、貧酸素供給集合体9の中心部に壊死を引き起こします。したがって、細胞凝集塊の懸濁培養は従来の培養よりも得ることは困難です。それにもかかわらず、懸濁培養が重要なためバイオメディカルとバイオ テクノロジーのアプリケーション。
軌道揺動撹拌、インペラー撹拌せず培養培地混合を達成する最も簡単な懸濁液培養システムの 1 つです。分化と細胞の損傷原因になるので、インペラと動的な中型の流れからせん断応力は懸濁培養の大きな問題です。低剪断応力と撹拌を達成するため、研究者や産業が様々 な軌道振動容器システム2,10を開発しました。
しかし、従来の培養容器は文化を振る軌道の設計されていません。軌道船の揺れ、細胞は「アインシュタインの茶葉のパラドックス」11、細胞の不均質の凝集を引き起こすと知られている中型流れの一種で血管の中央下に向かって引き寄せられます。遠心力と培養液と、容器間の摩擦によって引き起こされる循環センター11,12に細胞を一掃します。また、大衆文化の従来の培養バッグは、軌道の振動に適しているない正方形でしょう。
本研究では、軌道振動の文化に適した培養バッグを開発しました。このバッグの目新しさは、その下部センター領域での集まりから細胞を防ぐセンター地域を持たないその O 型です。バイオ テクノロジー用これらの袋の可能性を実証する HEK293 培養でこれらの血管の処理もわかってきました。
プロトコル
1. セルと材料の準備
- ダルベッコ改変イーグル培地を 10% 牛胎児血清 (FBS) と 1% 非必須アミノ酸で HEK293 細胞を養います。6.8 7.6 に培養液の pH を調整します。
- 5 に 7 d のため培養後、0.25% トリプシン-エチレンジアミン四酢酸溶液 (トリプシン-EDTA) と細胞を切り離す、5,000-10,000 のセル/cm2で細胞をシードします。
2. O 状の袋で細胞の播種
- 1.2 の手順で説明するように細胞を分離、培養培地の 2 5 mL でそれらを再懸濁します。
- 単一細胞懸濁液を収集する携帯こし器 (40 μ m) を通って細胞懸濁液をフィルターします。
- トリパン ブルー染色と細胞自動カウンター、セルの数をカウントし、細胞懸濁液 (2.0 × 105セル/mL) 20 mL を準備します。
- O の形をしたバッグ (図 1 a) の入口をプランジャーなしクランプ 50 mL の注射器に接続します。

図 1: 回路図イメージと O 状の容器の写真。(a1)これは O 型のバッグのイメージ図です。(a2)これは O 型のバッグの画像です。(b1)これは O の形をした皿のイメージ図です。(b2)これは O の形をした料理の写真です。O の形をしたバッグの外側と内側の直径は、90 ミリメートル、20 ミリメートル、それぞれ。この図の拡大版を表示するのにはここをクリックしてください。
- O 状の袋にクランプされた注射器を準備した細胞懸濁液をピペットします。
- 最初の固定された注射器を清潔なシリンジに置き換えます。袋を完全に展開する清潔なシリンジをきれいな空気の 55 mL を追加します。
- インレット チューブをクランプし、入口を閉じます。最後に、チューブからクランプを削除します。
- 37 ° C と 5% の CO2の条件で 45 rpm でそれらの動揺によって O の形をした袋に入れてセルを孵化させなさい。
3. 中型の変更 (省略可能)
- 入口から 50 mL のチューブに細胞懸濁液を転送します。
- 常温で 200 x g で 2 分間遠心し、上清を吸引します。
- 培養液 20 mL を加えて、細胞を再懸濁します。
- 次の手順 2.4 2.7 O 状の袋に再懸濁細胞を追加します。
- 37 ° C と 5% の CO2の条件で 45 rpm でそれらの動揺によって O の形をした袋に入れてセルを孵化させなさい。
4. 袋からセルの収集
- 入口から 50 mL のチューブに細胞懸濁液を転送します。
- 生理食塩水 20 ml のカルシウム/マグネシウム無料リン酸緩衝のバッグの内側を洗う [PBS(-)、pH 7.4 7.6 =] とバッグから残りのセルを収集する管に内容を流出します。
- 200 x g、室温で 3 分の収集した細胞懸濁液を遠心分離し、上清を吸引します。
- PBS(-) の 10 mL を追加し、凝集体を洗います。
- 200 x g、室温で 3 分のそれらを遠心し、凝集体を収集するために上清を吸引します。
- 4 mL の PBS とトリプシンの 1 mL を追加し、(オプション) をカウントするため細胞を分離する 37 ° C で 10 分間の集合とそれらを孵化します。
5. (オプション) O の形をした皿の準備
注: O の形をした皿の概略図図 1 bを参照してください。
- 熱いナイフで 60 mm または 35 mm の皿の底を切り取って内部料理として活用をします。
- 100 mm ディッシュのセンターに 60 mm ディッシュの逆さまを置きます。
注: ガイド シートは 60 mm ディッシュの位置を決定するのに役立ちます。 - 必要な場合は、60 mm ディッシュの内側から交連の粘度調整シクロヘキサノンを置きます。
- O の形をした皿を数日間乾燥し、ガンマ線またはエチレン酸化物のガスによって殺菌します。
結果
我々 の測定によると集計が従来の皿に成長していた軌道振動の 5 d の後直径を変化させます。対照的に、集計の 5 d の O の形をした容器で栽培より多くの均一直径があった。O の形をした船の文化に小さい集計 (図 2 a) が含まれていないに対し、従来の料理文化は小さな集計 (50-200 μ m) を示した。イメージ ベースのサイズ測定によるとは、従来の料理文化は骨材粒径の広い偏差を示す 2 つの異なるピーク (図 2b1) を示した。この結果は、従来の皿に集計された異種細胞質になる可能性がある同じカルチャの 2 つの異なる条件を成長している暗示。その一方で、集計 (2 b を図2と2b3) 従来の皿のものより直径で偏差なり単一のピークを示した O 状の容器でより均一な品質のような集計があります示唆しています。
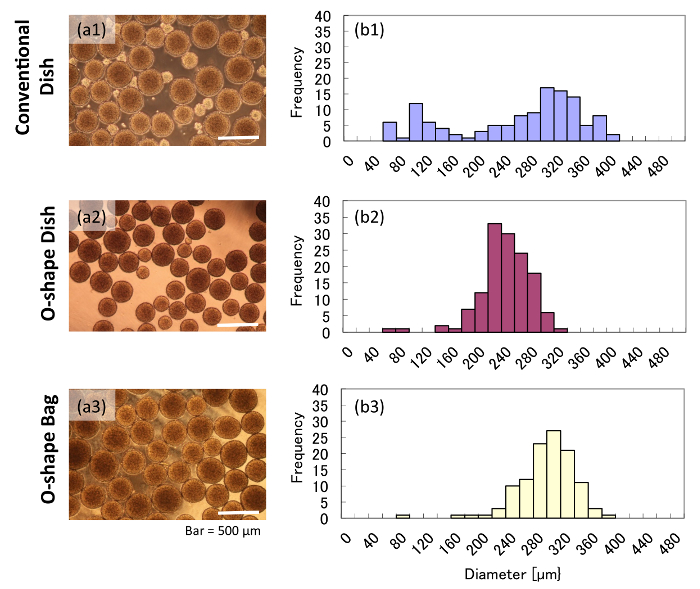
図 2: 形態と様々 な容器で栽培する骨材径。これらのパネル表示 (、) の明視野画像と従来お皿、(a2とb2)、(a1とb1) で栽培の集計 (b) ヒストグラム、O の形をした皿、または (a3とb3) O の形をしたバッグ。この図の拡大版を表示するのにはここをクリックしてください。
ヘマトキシリン ・ エオシン染色集計断面のいくつかの denucleated 細胞と壊死のコア (図 3 a) 従来の皿で会合体を持っていたことを示した。ただし、O 状の容器で栽培の集計は、壊死のコア (図 3 b 3 c) を示さなかった。特に、集計 O 状の袋で栽培従来の皿のものと同じ大きされましたまだ任意の壊死のコア (図 3 c) はありませんでした。ガス透過性バッグに文化に十分な酸素が供給されることが示唆されました。

図 3: 様々 な容器での集計の断面。断面は厚み 12 μ m であり、凍結試料から調製しました。ヘマトキシリンとエオシン細胞を可視化する染色しました。従来の培養で育つ (、) セルの集計は、壊死のコアを示した。O の形をした皿や O 状の袋 (c) (b) の成長細胞凝集塊は、彼らのコアで非常に小さな壊死を認めた。この図の拡大版を表示するのにはここをクリックしてください。
細胞数を示した (図 4 a) 各容器内培養の 5 d の 85% 以上の細胞が存続しました。最後のセル密度は約 1.5-2.0 x 106セル/mL でした。有意差はなかったが、O の形をした袋で成長率だった他の船舶 (図 4 b) のより高かった。従来の皿、O の形をした料理、2 日目と 5 日間 O 状の袋内のセルの特定の成長率は 0.018、直径 0.025 インチ、および 0.020 h-1であった。
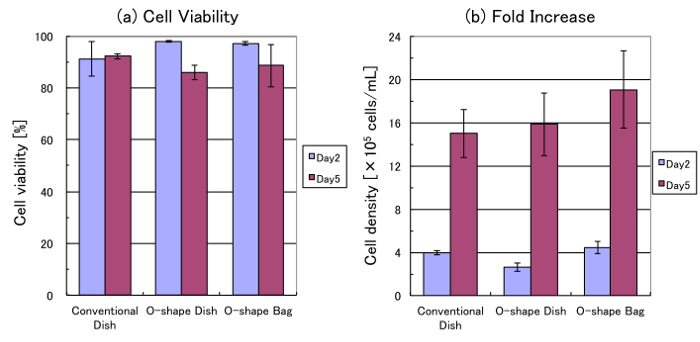
図 4: 細胞生存率および成長します。これらのパネルは、文化 (2 日目) の 2 d 後に様々 な培養容器で (、) 生存率および (b) 細胞の細胞密度 HEK293 細胞を表示および文化 (5 日目) の 5 d。表示値は、3 の独立した実験からの結果の平均を表します。トリパン ブルー染色性細胞セルの自動カウンターで数えられる各実験の値を求めた。誤差範囲は、標準偏差を示します。この図の拡大版を表示するのにはここをクリックしてください。
補足図 1: ビーズは様々 な振動状態で 2 つの異なる料理形式での配布です。このパネルは、従来、O の形をした皿に様々 な振動状態 (30、40、45 rpm) でビーズ分布を示します。このファイルをダウンロードするここをクリックしてください。
ディスカッション
本研究では、O 状の容器を開発し、均一な会合体形成と拡大のために HEK293 培養を行います。従来の培養皿で制服集計 O 状の容器 (図 1) を観測したに対し、文化を振る軌道は集計、直径の異なる 2 つを生産しました。軌道の振動条件下でステンド グラス ビーズの分布の観察によると従来の培養皿の中央下のビーズを収集します。収集は、おそらく集計の様々 なサイズにつながる細胞密度の差を発生します。また、ビーズ センター下の領域 (補足図 1) を持たない O の形をした皿に分布していた。このディストリビューションはおそらく O 状の容器に均一サイズ集計を発生します。別-広く使用される-均一な骨材を生産へのアプローチは、マイクロウェルの養殖が、集計マイクロウェル13から脱落することがなく培養液を供給など、この方法にはいくつかの問題。O 状の容器の場合は、簡易懸濁培養制服集計作ることが出来ます。
文化を振る軌道は、哺乳類細胞に対して利用大衆文化システムです。攪拌槽型バイオリアクター14波合図バッグ15などの哺乳類細胞の大量生産のさまざまな文化がある、ボトルを回転させます。軌道振動文化が媒体を攪拌のため内部の羽根車を含めない、攪拌槽とは違ってバイオリアクターは。この機能は、波合図バッグと回転のボトルと同様です。これら羽根車フリー培養システムは、インペラを囲むせん断力から細胞の損傷を防ぐし、培養における低剪断応力を実現できます。特に、軌道振動培養システムは、高いスケーラビリティと低剪断応力のため哺乳類細胞など重要な細胞の大量生産のため効果的です。
O 状の容器は、団粒形成における軌道振動文化の残りの問題を改善できます。揺れ文化システムの軌道上、浮遊細胞はセンターと「アインシュタインの茶葉のパラドックス」11として知られている容器底に移行します。この移行は、従来の軌道船の揺れの不均一凝集と非一様総生産を引き起こします。本研究では、O 状の容器は軌道振動 O の形をした船で統一集計の理由として推測されますセンター下, 血管に細胞の濃度を防止しました。
組織学的分析は、従来の皿に集計に (図 2 a) denucleated のセルが含まれていることを示した。対照的に、denucleated 細胞は、(図 2 bおよび2 c) O 状の容器から集計に表示されませんでした。Denucleated 細胞が酸素、グルタミン、ブドウ糖9などの基材の不足によって引き起こされたことが可能です。サイズ測定によると O の形をした船集計いた均一径 400 μ m よりも低いです。対照的に、従来の皿にいくつかの集計は、400 μ m よりも大きい直径を持っていた、これらの凝集体に denucleated のセルが含まれています。この結果では、O の形をした容器に均一なサイズの集計を作成する骨材の品質を制御するに有効であることを示唆しています。さらに、それはまたガス透過性ポリエチレン フィルムを通して酸素が O の形をした袋に denucleated のセルの外観を防止推測です。
これらの実験は、均一な骨材を生産するためのシンプルなシステムとしてこれらの O 状の容器の可能性を示した。浮遊培養のため他の培養バッグは開発された15をされていますが、これらの培養バッグは正方形を文化は効果的に軌道振動の混入防止。本研究ではバッグは均一サイズの集合体を生成する軌道振動に適した形状をラウンド小説。船のこの特徴は、大量生産細胞の再現性の高い条件を制御するため重要です。O の形をした容器の可能なアプリケーションは広まっています。それは、幹細胞を扱うときに組換えタンパク質、細胞再生医療を生成するときに使用できます。
結論としては、小説軌道の振盪培養で均一な細胞凝集塊を作り出すに適した O の形をしたバッグを開発しました。バッグは、再生医療など、様々 な医用可能性を示しています。
開示事項
著者が明らかに何もありません。
謝辞
この研究は、フコク株式会社 O 型培養中のバッグのアイデアの提供からのフコク株式会社吉田隆夫とのコラボレーションによってサポートされます。株式会社フコクから孝佐藤 O 型培養中のバッグを開発するため計算シミュレーションの面でこの研究をサポートしました。そのパブリケーションで作業することの対応する著者の現在の所属、大阪大学に感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| HEK293 | RIKEN Bio resorce centre | RCB1637 | |
| DMEM, high glucose, pyruvate | GIBCO | 11995040 | |
| Fetal Bovine Serum, qualified, USDA-approved regions | GIBCO | 10437-028 | |
| MEM Non-Essential Amino Acids Solution, 100X | GIBCO | 11140050 | |
| Trypsin-EDTA (0.25%), phenol red | GIBCO | 25200056 | |
| Dulbecco's PBS (–) | Cell Science & Technology Institute | 1102P05 | |
| Cell Strainer 40µm | CORNING | 352340 | |
| 50 mL Syringe | TERUMO | SS-50ESZ | |
| Shaker | AS ONE | 2-1987-02 | |
| Centrifuge Tube 50 mL | AS ONE | 1-3500-02 | |
| Automated cell counter | BioRad | TC20 |
参考文献
- Mihara, Y., et al. Production of pancreatic progenitor cells from human induced pluripotent stem cells using a three-dimensional suspension bioreactor system. Journal of Tissue Engineering and Regenerative Medicine. 11 (11), 3193-3201 (2017).
- Raven, N., et al. Scaled-up manufacturing of recombinant antibodies produced by plant cells in a 200-L orbitally-shaken disposable bioreactor. Biotechnology and Bioengineering. 112 (2), 308-321 (2015).
- Han, Y., et al. Cultivation of recombinant chinese hamster ovary cells grown as suspended aggregates in stirred vessels. Journal of Bioscience and Bioengineering. 102 (5), 430-435 (2006).
- Portolano, N., et al. Recombinant Protein Expression for Structural Biology in HEK 293F Suspension Cells: A Novel and Accessible Approach. Journal of Visualized Experiments. (92), e51897 (2014).
- Himmelfarb, P., Thayer, P. S., Martin, H. E. Spin filter culture: the propagation of mammalian cells in suspension. Science. 164 (3879), 555-557 (1969).
- Kropp, C., Massai, D., Zweigerdt, R. Progress and challenges in large-scale expansion of human pluripotent stem cells. Process Biochemistry. 59, 244-254 (2017).
- Singh, H., Mok, P., Balakrishnan, T., Rahmat, S. N. B., Zweigerdt, R. Up-scaling single cell-inoculated suspension culture of human embryonic stem cells. Stem Cell Research. 4 (3), 165-179 (2010).
- Horiguchi, I., Sakai, Y. Serum replacement with albumin-associated lipids prevents excess aggregation and enhances growth of induced pluripotent stem cells in suspension culture. Biotechnology Progress. 32 (4), 1009-1016 (2016).
- Sutherland, R. M., et al. Oxygenation and differentiation in multicellular spheroids of human colon carcinoma. Cancer Research. 46 (10), 5320-5329 (1986).
- Hang, H., et al. Computational fluid dynamics modeling of an inverted frustoconical shaking bioreactor for mammalian cell suspension culture. Biotechnology and Bioprocess Engineering. 16 (3), 567-575 (2011).
- Einstein, A. The cause of the formation of meanders in the courses of rivers annd of the so-called bear's law. Die Naturwissenschaften. 14, (1926).
- Tandon, A., Dartmouth, U., Marshall, J. Einstein's tea leaves and pressure systems in the atmosphere. The Physics Teacher. 48, 292-295 (2010).
- Miyamoto, D., Nakazawa, K. Differentiation of mouse iPS cells is dependent on embryoid body size in microwell chip culture. Journal of Bioscience and Bioengineering. 122 (4), 507-512 (2016).
- Olmer, R., et al. Suspension culture of human pluripotent stem cells in cotrolled, stirred bioreactors. Tissue Engineering Part C: Methods. 18 (10), 772-784 (2012).
- Singh, V. Disposable bioreactor for cell culture using wave-induced agitation. Cytotechnology. 30, 149-158 (1999).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved