Method Article
טכניקות ביופסיה בלוטת חלב שור
In This Article
Summary
מאמר זה מציג ביופסיה בלוטת חלב שור באמצעות כלים ביופסיה הליבה ואת המחט. רקמות שנקטפו יכול לשמש עבור תרבית תאים או להעריך פיזיולוגיה החלב וחילוף החומרים כולל ביטוי גנים, ביטוי חלבונים, חלבונים שינויים, אימונוהיסטוכימיה מטבוליט ריכוזים.
Abstract
עטין פרה ביופסיות לאפשר לחוקרים לאסוף דגימות רקמה ללמוד ביולוגיה של התא כולל ביטוי גנים, ניתוח היסטולוגית, איתות המסלולים, ותרגום חלבונים. מאמר זה מתאר שתי טכניקות לביופסיה של בלוטת חלב פרה (מ ג). שלוש פרות חלב בריא של הולשטיין היו הנושאים. לפני ביופסיות, פרות היו לחלוב, לאחר מכן מאופקים מצנח הבקר. מקבל (flunixin meglumine, 1.1 ל 2.2 mg/kg של משקל גוף) היה מנוהל באמצעות תוך ורידי צוואר [IV] הזרקת 15-20 דקות מראש כדי ביופסיה. עבור לעמוד הרגעה, חריגות השירותים הווטרינריים הידרוכלוריד (0.01-0.05 mg/kg של משקל גוף) הוזרק באמצעות כלי coccygeal 5-10 דקות לפני ההליך. ברגע שלמאחה מטושטשת, הביופסיה היה מוכן גילוח ורחיצה כירורגית, מרדימים באופן מקומי עם 6 מ של לידוקאין 2% הידרוכלוריד באמצעות הזרקה תת עורית. באמצעות הטכניקה aseptic, חתך אנכי של 2-3 ס מ בוצע באמצעות איזמל מספר 10. הליבה וכלים ביופסיה מחט שימשו. הכלי ביופסיה ליבה היה מצורף תרגיל אלחוטיים, מוכנס לתוך הרקמה מ"ג דרך החתך באמצעות פעולת תרגיל clock-wise. הכלי ביופסיה מחט הוכנס באופן ידני הוילונות. מיד לאחר הניתוח, עוזרת הפעילה לחץ באזור הניתוח למשך 20 עד 25 דקות באמצעות מגבת נקיה להשיג את hemostasis. תפרי ניתוח פלדת אל-חלד שימשו להתנגד החתך בעור. במקום היו 10 ימים הוסר post-procedure. היתרונות העיקריים של ביופסיות מחט והליבה הוא שתי הגישות הן הליכים זעיר פולשניים שיכולים להתבצע בבטחה ב פרות בריאות. תפוקת החלב בעקבות הביופסיה לא הושפע. הליכים אלה דורשים זמן החלמה קצרה, התוצאה פחות סיכונים של סיבוכים. מגבלות מסוימות עשויות לכלול דימום אחרי הביופסיה הזיהום על הביופסיה. יישומים של טכניקות אלה כוללים אוסף רקמה עבור אבחון קליני, למטרות מחקר, כגון התרבות התא הראשי.
Introduction
ביופסיה היא הליך לקצור מקטע הליבה של רקמה מתוך מקצועות רפואיים או למטרות מחקר. . זו טכניקת פולשנית והשימוש בהם נפוץ כדי לאסוף את רקמת כחלופה המתת חסד1 כדי לאפשר ניתוח של תגובות רקמות טיפול או גורמים אחרים של עניין. דגימות של רקמות בלוטת חלב פרה (מ ג) הם חיוניים עבור חלב מחקר ביטוי גנים וחלבונים, היסטולוגיה, ארגון organelles הסלולר איתות המסלולים, תהליכים מטבוליים בתגובה לשינויים בניהול או סביבה. בנוסף, MG רקמות יש צורך לאבחן מחלות זיהומיות מסוימות, כגון שור mastitis הנגרמת על ידי זיהומים חיידקיים2ומחקר.
עטין של בקר מכיל ארבע בלוטות נפרדים, כל בלוטת מכיל מערכת הפרשה חלב עצמאית שנקראו parenchyma. Alveoli, צינורות אוורור, רקמת חיבור נמצאים parenchyma החלב. Alveoli מיקרוסקופיים מבנים כדוריים חלולים המורכבות לתאי האפיתל על גבי המשטח הפנימי (luminal), myoepithelial מיוחדים תאים על משטח חיצוני (הבסיס). Alveoli אחראים סינתזה הפרשת חלב. רקמת חיבור סיבית נוכח parenchyma יכול להפריד בין קבוצת alveoli מקבוצות אחרות של alveoli, כל קבוצה נקרא lobule3. מספר גורמים יכולים להשפיע את ההתפתחות והתפקוד של הרוסים כולל פיזיולוגיה של בעלי חיים, תזונה, ניהול, גנטיקה, סביבה4. Mastitis גם הוא גורם קריטי המשפיעה לרעה MG פונקציה וחלב איכות5. רעלים שפורסמו על ידי פתוגנים mastitic יכול לגרום לנזק alveoli, זירוז נמק וכתוצאה מכך שינויים ביוכימיים, היסטולוגית ב רקמות מ ג6. לפיכך, היסטולוגיה של תהליכי חילוף החומרים של כל alveoli או lobule במ ג עשויה להיות שונה באופן משמעותי מאחרים. ככזה, ביופסיות כי הם מדגמים מייצגים של בלוטת החלב כולו הם רצויים. ביופסיות קטן עשוי ללכוד רק lobule יחיד או בודדים המכתש, הגבלת המידע שיתקבל מדעית או אבחון. למטרות מחקר, זה הכרחי להיות מודע לכך ביופסיה החלב מספק 'תמונה' של מאפייני הרקמה אבל ביופסיה שלמאחה לא יכולה לאפיין את סה כ פונקציה החלב בהיעדרו של הערכות של בלוטת חלב הכולל המוני.
מספר כלים ביופסיה פותחו במהלך 30 השנים האחרונות לשימוש בבני אדם. כיום, עיבודים של מכשירים אלה זמינים לשימוש עם בעלי חיים. עבור בקר לחלב, דגימות של רקמות MG הושגו באמצעות טכניקות שונות כולל כריתה כירורגית (עמום)7, ביופסיה-מחטים-1,-8ו- core ביופסיה מכשירים9,10. לפיכך, MG טכניקות ביופסיה של פרות חולבות מניקות יש מעבר מיגדרי משגרות באמצעות הרדמה שכיבה עם ניתוח כירורגי באמצעות electrocautery hemostasis ב 19927 לאוסף של הליבה ביופסיות תחת עמידה הרגעה9, 10,11,12. ביופסיה כירורגית היא שיטה פולשנית, אשר יכול להיות יקר יש שכיחות גבוהה יותר של סיבוכים כמו שטף דם, פצע בעיות, הגידול התפשט13. כיום, הליבה ביופסיה, ביופסיית-מחט (המכונה גם ביופסיה טרו-קאט) נרחב שאומצו חלופות ביופסיה כירורגית כמו. היתרונות של ביופסיות מחט והליבה בהשוואה ביופסיה כירורגית כוללים: ההליך היא פולשנית; לסיבוכים נדירים; הרדמה כללית לא נדרש; הנוהל הוא relativley מהירה; זמן ההחלמה הוא קצר; יש מינימלית תופעות שליליות על בריאות עטין, וכן השפעות לטווח קצר בלבד על חלב תשואה ו הלחנה8,9,10; העלות היא ביופסיה כירורגית פחות מ13.
הליך הביופסיה ליבה אחד, תיאר בשנת 1996 להשתמש בצינורית פלדת אל-חלד סטרילית, עם להב לשליפה נשלף כדי להסיר כמות נציג של רקמות מן הרוסים שור ללא הרדמה כללית9,10,11 ,12. במהלך ההליך, המכשיר היה מחובר תרגיל אלחוטיים ליצירת על מהירות נמוכה, תנועה סיבובית אשר נקיה ליבה של רקמות כמו הכלי היה מתקדם לתוך הרקמה. היתרון היה גדול יותר רקמה לטעום (70 מ מ x 4 מ מ בקוטר כ- 0.75-1 g) 9. מחקר האחרונות10 הראה כי ההליך ביופסיה מתוארת על ידי פאר נ ג.et al. 9 יכול לשמש לביצוע חוזרות אוספים רקמות מ ג ללא השפעה שלילית על בריאות עטין וביצועים של פרות חולבות מניקות. לאחרונה, בוצע מחקר14 ב פרות חולבות כדי להעריך ביופסיות חוזרות ונשנות של הרוסים באמצעות נקז גדול יותר (31 ס מ קוטר ארוך, החיצוני של 9.5 מ מ, קוטר פנימי של 8 מ"מ) עם ואקום שהוחל בצינורית נירוסטה פנימי כדי לאסוף את הביופסיה . בשיטה זו משתמשים הרגעה (חריגות השירותים הווטרינריים) בהרדמה מקומית (2% לידוקאין הידרוכלוריד).
מחט הביופסיה היא טכניקה אחרת כדי לאסוף את רקמת החלב. מספר מחקרים אימצו שיטה זו. מחקר אחד1 השתמשו הרגעה (detomidine), הרדמה מקומית (1% לידוקאין) במסגרת ההליך. לאחר הביופסיה, הפרות קיבל טיפול אנטיביוטי מניעתי. בלוטת החלב היה לעסות באופן ידני לפני ואחרי החליבה. הדם בתוך החלב נצפתה עבור עד 84 שעות לאחר הביופסיה. כמות והרכב החלב הושפעו לתקופה קצרה של זמן. לאחרונה, מחקר משמש מחט הביופסיה לביצוע ביופסיות חוזרות MG ב-8פרות חלב. הרגעה (1% איזופרומאזין, תוך שרירית), בהרדמה מקומית (הידרוכלוריד לידוקאין 2%, תת עורית) נוהלו החיות. החיות שלא קיבלו תרופות intramammary או אנטיביוטיקה לפני או אחרי הניתוח, לא נמצאו סימנים של זיהום באתר ביופסיה במהלך התקופה לאחר ניתוח. במחקר זה, ביופסיות חוזרות MG שור באמצעות מחט הייתה השפעה שלילית קטין על ייצור חלב ובריאות עטין של פרות חולבות. באופן כללי, ביופסיית-מחט נראה שיטה פחות פולשנית מאשר מכשיר ביופסיה הליבה. עם זאת, כאמור, זה חיוני הטכניקה ביופסיה לקצור במדגם מייצג של הרקמה MG. המגבלה של ביופסיה מחט היא כי כמות קטנה של רקמת MG שור מתקבל (בערך 20-25 מ"ג)8,15.
כמעט כל המחקרים להשתמש בשילוב של α-2 אגוניסט הרגעה עם הרדמה מקומית8,9,10, אם הביופסיה הייתה באמצעות מחט או גרעין גדול יותר. במ ג שור, רוב עצביים הקשורים עם העור. העצבוב לרקמת parenchymal היא במידה רבה באמצעות מתיחה רצפטורים מסוג דלילה סיבי עצב לזהות כאב כירורגית חדה. כתוצאה מכך, המנגנונים הפיזיולוגיים של כאב עקב ניתוח מניפולציה של הרוסים היא דרך העור, רקמות תת עוריות3 ורקמות עמוק לא כגון רקמות parenchymal. עבור ביופסיות, לכן רק צורך מקומי עזים ומתנגד העור ורקמות תת עורית, כמו חדירה של הרדמה מקומית לתוך רקמות עמוק לא להפחית באופן משמעותי את הכאב כירורגי. לאחר הכנת המתאים לאזור ביופסיה, אי נוחות בעלי חיים הוא, בעיקר, הקשורים עם איפוק.
אוסף של דוגמאות גדול עשוי להגביר היווצרות המטומה ולהגביר את הסיכון לזיהומים בתוך MG parenchyma. לכן, פרי-סוכן פרוטוקולים לעיתים קרובות כוללים ניהול של אנטיביוטיקה parenteral7, למרות שזה לא תפיסתה8. להשיג את hemostasis הוא גם גורם חשוב להפחתת התחלואה פרה. במחקר הנ ל באמצעות של ליבה גדולה ביופסיה כלי14, לחץ ידני היה מוחל על הביופסיה, חזייה פרה שימשה כדי להחיל קרח על הפצעים כבר לפחות שעתיים בעקבות ההליך. למרות כמות גדולה של רקמות שנקטפו, הפחתות התשואה צריכת וחלב הזנה קלה בלבד נצפו ולאחר ההליך חזר על עצמו כל שלושה שבועות ללא השפעות שליליות על הבריאות פרה.
חוקרים ביצוע ביופסיה MG שחלתיות בפרות חלב צריך לשקול את איכות האבחון או אנליטיים הביופסיה וכתוצאה מכך, קלות טכניקה, ותחלואה פרה. טכניקות ניתוחיות מדויק ומתוכנן מראש הם הכרחי כדי להשיג מטרות אלה. עד היום, MG ביופסיה מחקרים התמקדו המתאר את תוצאות הביופסיה, בניגוד המתארת את הטכניקה ביופסיה עצמה, ו תיאורים עבור פרות חולבות מניקות חוסר בפרטים מספיק על מנת לאפשר שכפול. לכן, המטרה של עבודה זו היתה לתאר ביופסיית-מחט והטכניקות גדול הליבה ביופסיה בפירוט מספיק כדי לאפשר שכפול הומאני ובטוח של MG ביופסיה של הבקר.
Protocol
כל השיטות המתוארות אושרו על ידי וירג'יניה טק אכפת חיה מוסדיים ועל שימוש הוועדה (IACUC).
1. סגל
- יש לפחות שני עוזרים עם ניסיון כירורגי וטיפול פרה.
- הרכבת כל המסייעים לפחות שלוש פעמים, אם זה אפשרי באמצעות חומר cadaveric, לפני ביצוע הליכים הקשורים עם פרוטוקול זה בבעלי חיים.
הערה: הכשרה צריך להתנהל ע"י מדריך כי כבר בעבר אימן וביצע את הטכניקה. - יש וטרינר חיות גדולות על-יד עבור ניהול סמים, במקרה זה טיפול חירום הופך להיות הכרחי במהלך ההליך. מצבי חירום שעלולות להתרחש במהלך הליך זה כוללים אך אינם מוגבלים: דימום, α-2 אגוניסט יתר, בצקת ריאות, regurgitation, שאיפה של חומר המזון, כאב, התנגדות המטופל לדרוש הרדמה נוספת.
2. הכנה של מכשירי ניתוח, ציוד, מתקן
- מלאי ולרכוש כל ציוד וחומרי תכשיטנות (ראה טבלה של חומרים).
- נקי, וילונות כירורגי אוטוקלב ביופסיה מכשירים, מחזיקי אזמל, מגבות כירורגי, מלקחיים.
- יש לסחוט בגודל תקין המצנח שער כדי לרסן את הפרות.
- ליצור מרחב עבודה עם שולחן ליד תעלת לסחוט.
- ודא כי אזור העבודה נקי הגביל פרה דרך תנועה.
- לארגן ציוד ואספקה במרחב העבודה של לגישה נוחה.
- יש תאורה מתאימה בתוך מרחב העבודה.
3. הכנה של חיות
- יום אחד לפני הביופסיה מתוזמנת, לשטוף ולקרצף החיה, במיוחד עטין להסרת זבל והחומרים המלוכלכים.
- בצע את ההליכים עבור איפוק הומאני ובטוח של הבקר.
- לפני הביופסיה, שוב בזמן הביופסיה, להעריך את בריאות, מצב גופני וההתנהגות של החיה.
הערה: בדיקה מינימלית כוללת טמפרטורה, הדופק, ואת המחירים הנשימה, כמו גם בחינת דרמטיטיס באתר כירורגית המוצע או באזורים אחרים של זיהום חיידקי. לאסוף דגימות חלב בכל רבעון ולבדוק mastitis. - השתמש רק פרות בריאות.
- לגמרי לחלוב את הפרה.
- להעביר את החיה המצנח לסחוט, ממוקם באופן אידיאלי במרחק 2 h החליבה כדי למזער את נוכחות החלב בבלוטות.
- לרסן את החיה עם שער הראש.
4. שיכוך כאבים וטשטוש
- במקום מחבל התלייה חבל על ראשו של הפרה כדי למנוע אחורה וקדימה התנועה.
- להוציא את הראש של החיה לצד אחד, אקשור את החבל המצנח לסחוט באמצעות קשר שחרור מהיר כדי להחזיק את הראש במקום.
- לנקות את האזור של הזרקת עם מקלון אלכוהול איזופרופיל 70%, לנהל flunixin meglumine (1.1 ל 2.2 mg/kg של משקל גוף) דרך הווריד באמצעות עורק הצוואר 15-20 דקות מראש את הביופסיה.
הערה: בפרוטוקולים מסוימים, תכשירים מנוהלים לאחר הביופסיה אם תרופות אנטי דלקתיות לא תשפיע על תוצאות המחקר.- אתר ומוחלף.
- להעלות ומוחלף על ידי הפעלת לחץ בבסיס של החריץ צוואר.
- בדוק כדי לוודא שאין אין בועות במזרק.
- להכניס את המחט, ומוחלף מוגבה על צייר 0.5 מ של דם לתוך המזרק פעמיים ומערבבים עם התוכן. אם אין דם מראה במזרק, להעביר את המחט. אם המחט הוא תושב בווריד, להזריק את התוכן.
- הסר בעדינות את המחט.
- חלות גזה עם לחץ עדין על ההזרקה כדי למנוע דימום.
- ניהול חריגות השירותים הווטרינריים הידרוכלוריד לווריד (0.01 עד 0.05 mg/kg של משקל גוף) בתוך הכלי coccygeal כ 5-10 דקות לפני ביופסיה כדי לאפשר מספיק זמן עבור הקמת הרגעה.
התראה: בדוק את החיה סימנים של בצקת ריאות. סימנים קליניים של בצקת ריאות כוללים מצוקה נשימתית, קוצר נשימה חמורות, קשיי נשימה, שיעול, ברוק הלאגר ו כחול הלשון. אם הם נצפו סימנים של בצקת ריאות, מומלץ להשתמש tolazine (2-4 mg/kg של משקל גוף) את ההשפעה חריגות השירותים הווטרינריים.- הרימי את רגליה ולנקות את האזור של הזרקת עם מקלון אלכוהול איזופרופיל 70%.
- בדוק כדי לוודא שאין אין בועות במזרק.
- את המחט לתוך כלי הזנב, לצייר 0.2 מ"ל של דם לתוך המזרק ומערבבים עם התוכן על מנת להבטיח שהמחט הוא תושב בתוך הכלי. אם המחט הוא תושב בתוך הכלי, להזריק את תוכן המזרק.
- הסר בעדינות את המחט.
- חלות גזה עם לחץ עדין על ההזרקה.
5. הכנת הביופסיה
- יש עוזרת לקשור את הזנב עבור ההליך.
- בחר את אתר ביופסיה על עטין (בדרך כלל באזור העליון כדי למזער את אוסף של רקמת חיבור וכדי למנוע חדירה לתוך בלוטת בור המים, איור 1), ולהסיר כל חומר המלוכלכת או זבל מאתר שנבחרו ביופסיה.
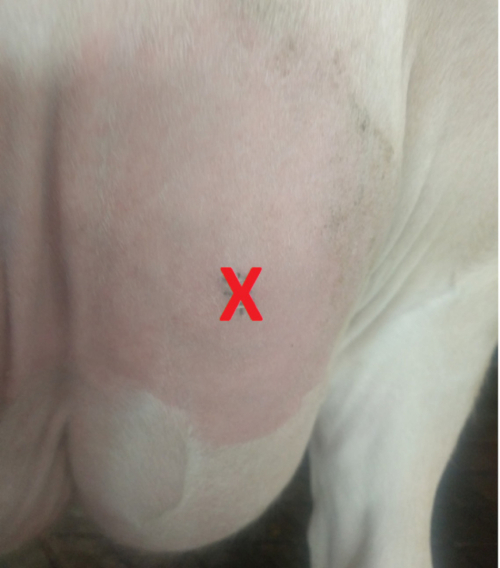
איור 1 . התמונה של עטין פרה הממחישות את הביופסיה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
- לצפות, ימשש העור עם תשומת לב מיוחדת כדי לזהות כל כלי דם תת עורי גדול על מנת להימנע אלו כלי במהלך הביופסיה.
- קליפ על השיער מאזור 15 ס"מ על 15 ס"מ סביב האתר ביופסיה.
- הכינו את האזור ביופסיה עם povidone-יוד (0.75% יוד זמין) או chlorhexidine gluconate סקראב. לסירוגין עם אלכוהול איזופרופיל 70% לפחות שלוש פעמים כדי להסיר את כל פסולת גלויים ובלתי נראה. החל את הפתרון סקראב aseptic איזופרופנול בתנועה סיבובית בגישה הפוכה. ודא כי הפתרון סקראב חיטוי נותר במגע עם העור למשך 5 דקות לפחות.
- השתמש עם אינפוזיה פרפר סט עם מחט 18 גרם כדי להפקיד 6 מ של 2% לידוקאין הידרוכלוריד subcutaneously מקום החתך כדי ליצור קו-בלוק. לא לחדור לרקמות עמוקות יותר.
הערה: המינון של לידוקאין משתנה בין 3 עד 8 מ. - לאפשר הרדמה מקומית על להתפשט עבור 3 עד 5 דקות לבצע חזרה נוספת על פתרון סקראב ואלכוהול לפני החתך. תוך כדי המתנה, להכין את כלי הנגינה ביופסיה.
6. נוהל ביופסיה
- להשתמש טכניקות aseptic בעת טיפול בכלי ביופסיה ועבור את החתך.
- לשטוף את הידיים כדי להסיר את כל זיהום גלוי ולהחיל כפפות כירורגי סטרילי.
- לארגן את מכשירי ניתוח באזור סטרילי לפי סדר השימוש. יש אזמל מספר 10, גזה סטרילית, מכשיר ביופסיה התאספו, מגבת סטרילי hemostasis.
הערה: בצע נוהל 1 לביצוע ביופסיה ליבה או פרוצדורה 2 לבצע ביופסיה מחט.

איור 2 . ייצוג סכמטי של הרכבה וההתקנה של הכלי ביופסיה הליבה מתוארת על ידי נ ג פאר, et al. 9 בר בקנה מידה הוא 1 ס מ. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
- מכשיר ביופסיה הליבה (פאר ואח9)
- להרכיב את המכשיר ביופסיה הליבה תוך שימוש בכפפות סטריליות (איור 2).
- מניחים את חתיכות סטרילי 7 על תלוי סטרילי (איור 2 א).
- הכנס את הלהב (חלק 1) לתוך מערכת עגינה על היצירה 2 (איור 2B ).
התראה: אין למקם את האצבעות ישירות בקו להב. - להוסיף קטע 3 על גבי פיסת 2 (איור 2C) להבטיח כי תחנת העגינה תיישר.
הערה: שימו לב מערכת עגינה בקיר הפנימי של היצירה 4 (איור דו-ממדי). - לעסוק הקצה הסופי של הלהב (חלק 1) לתוך מערכת עגינה של פיסת 4 (איור דו-ממדי).
- לדחוף קדימה חתיכת 4 ולבחון אם היצירה 4 נמצא ליד חלק 3 (2E איור).
- להוסיף חתיכת 5 על המכשיר (להב + קטע 2) (איור 2F).
- להבטיח כי מיושרים בתחנת העגינה (איור 2G).
- להכניס חתיכה 6 פסגת היצירה 2 (בצד הנגדי של הלהב) (איור 2 H)
- להבטיח כי מיושרים בתחנת העגינה (איור 2 H).
- הכנס את בורג הנעילה (חלק 7) בתחנת העגינה (איור 2I).
- לדחוף קדימה חתיכת 3 (שחור) כדי לכסות את בורג הנעילה.
התראה: אין למקם את האצבעות על יציאת להב. - להפעיל את הכלי דוחף קדימה חתיכת 4 ולבחון את הלהב מחוץ הכלי.
- . תחזיר את היצירה 4 כדי לבטל את הלהב לתוך הכלי (מוכן לשימוש)
הערה: הלהב להיות מופעלים רק כאשר הכלי שחדר את המרחק הרצוי בתוך הרקמה להיות ביופסיה.
- ודא הפרה מספיק מורדמת הביופסיה. מספיק הוא מורדם. צובטים את העור כדי להבטיח שום תגובה.
- עושים חתך אנכי 2-3 ס מ דרך העור ורקמות תת עורית של proximal כדי דיסטלי באמצעות איזמל מספר 10.
- לצרף את המכשיר ביופסיה תרגיל אלחוטיים בטכניקה סטרילי.
- למקם את המקדחה נגד הכלי ביופסיה ולבדוק אם הכלי מחובר היטב ל התרגיל.
- להבטיח ריסון הולם על-ידי הפרט לרומם את הזנב במהלך כל ההליך.
- הפעל את התרגיל באמצעות סיבוב עם כיוון השעון, מהירות נמוכה.
הערה: הנוהל אינו סטרילי, המפעיל לא נותר סטרילי בעת שימוש את התרגיל. - לקדם את הכלי ביופסיה כולו (כ- 7.5 ס"מ) לתוך עטין דרך החתך בזמן התרגיל לסובב את האגרה.
- לבטל את הנוהל ולהרחיב באופן ידני את היצירה 4 של הכלי.
- הפעל את התרגיל באמצעות סיבוב עם כיוון השעון, מהירות נמוכה.
- הסר את כלי המכיל רקמות הליבה של עטין.
- הפעילו לחץ חזק מיד על הפצע באמצעות מגבת נקיה של 20 דקות לפחות.
הערה: יש עוזרת לבצע פעולה זו באמצעות האגרוף שלהם כדי להבטיח לחץ נאותה. - להסיר את הרקמה ביופסיה כלי באמצעות פינצטה.
- לשמור את הדגימה מלוחים פוספט x 1 buffered ולהעריך את כמות הרקמה.
- לקחת סימנים חיוניים של הפרה כל 10 דקות לאחר הביופסיה במשך לפחות 30 דקות.
- בדוק אם יש דימום לאחר 20 דקות של הלחץ על הביופסיה. אם ישנן טיפות של דם להמשיך להפעיל לחץ למשך דקות נוספות 5-10.
- סגור את החתכים באמצעות מהדקים פלדת אל-חלד במרווחים של 5 מ מ אחרי כל הדימום הפסיק. השתמש בין 5 ו 8 סטייפלס.
- חלות על תחבושת תרסיס האזור ביופסיה.
- להתבונן החיה למשך 50 דקות לאחר ההליך.
- להרכיב את המכשיר ביופסיה הליבה תוך שימוש בכפפות סטריליות (איור 2).
-
מכשיר ביופסיה מחט
- בצע הוראות היצרן של ההתקן.
- הסר את מחט הביופסיה החבילה באמצעות טכניקות סטרילי.
- למחוק את המחט, אם נזק נצפית.
- לצרף את המחט למכשיר.
- סגור את המכסה, דורך את המכשיר.
- ודא הפרה מספיק מורדמת הביופסיה. מספיק הוא מורדם. צובטים את העור כדי להבטיח שום תגובה.
- עושים חתך אנכי 1 עד 2 ס מ דרך העור ורקמות תת עורית של proximal כדי דיסטלי באמצעות איזמל מספר 10.
הערה: חתך המכשיר מחט הביופסיה ניתן קטנים (1-2 ס מ) מזה עבור כלי ביופסיה הליבה. - הכנס את מחט הביופסיה לתוך מקום החתך (בסביבות 10 עד 13 ס מ עור).
- הפעל את ההתקן מחט ביופסיה כדי לאסוף את הרקמה.
- הסר את המחט עטין.
- הפעילו לחץ מיידית, חזקה על הפצע באמצעות מגבת נקיה של 20 דקות לפחות.
- הסר את רקמת מחט ביופסיה באמצעות פינצטה.
- לשמור את הדגימה מלוחים פוספט x 1 buffered ולהעריך את כמות הרקמה.
- לקחת סימנים חיוניים בכל 10 דקות לאחר הביופסיה במשך לפחות 30 דקות.
- בדוק אם יש דימום לאחר 20 דקות של הלחץ על הביופסיה.
- סגור את החתכים באמצעות מהדקים פלדת אל-חלד אחרי כל הדימום הפסיק.
- חלות על תחבושת תרסיס האזור ביופסיה.
- להתבונן החיה למשך 50 דקות לאחר ההליך.
7. ביופסיה שלאחר טיפול בבעלי חיים
- לתעד את כל התרופות מנוהל על בעלי חיים.
הערה: חלב אבדו במהלך תקופה של 36 שעות לאחר ההליך; בשר הנסיגה היה 4 תקופות גמילה ד עבור בשר בחלב עשויים להשתנות בהתאם למדינה או שיפוט, תרופות המשמשות. בדוק את החוקים המקומיים. - לבדוק הנוכחות של דם פנימה את החלב במשך 7-10 d לאחר הביופסיה.
- יד קרישי דם רצועת מהעיר ביופסיה ב בחליבת הארס הבאים ולהבטיח את החלב המלא להסרת מתרחשת.
הערה: נוכחות של קרישי דם מן העיר ביופסיה עבור 1-3 בחליבת הארס בעקבות ההליך צפוי. דם בכוס החלב עלולים להיות שנצפו עבור 1 עד 6 d לאחר הביופסיה. - להתבונן חלב תשואות, במידת האפשר, היומון בודדים להאכיל צריכת עד תפרי ניתוח הוסרו.
- לפקח על החיה פעמיים ביום, טמפרטורת הגוף, הנשימה, הלב, ובאישיות עד תפרי ניתוח הוסרו.
- בדיקת הביופסיה פעמיים ביום על נפיחות, רגישות, סימנים של ניקוז עד תפרי ניתוח הוסרו. אם אלה הם נצפו, להתייעץ עם וטרינר.
הערה: לשמור את הביופסיה נקי והחלה את התחבושת תרסיס כל אחד עד שלושה ימים לפי הצורך. - הסר במקום החתך ד' 10-14 לאחר הביופסיה, בהתאם קצב הריפוי.
- להתייעץ עם וטרינר אם הם נצפו סימנים של זיהום מקומי או סיסטמי.
תוצאות
בפרוטוקול הנוכחי, הטכניקה ביופסיה הליבה הפיק דגימת הרקמות של 200 עד 600 מ"ג בעוד ביופסיית-מחט הפיק דגימות של 10-30 מ"ג לכל ביופסיה. החיות נצפו פעמיים ביום למשך 10 d לאחר ההליך. אין סיבוכים אירעה במהלך ההליך או בתקופה שלאחר הניתוח, עם פרמטרים חיוניים של הפרות נותרת בגבולות הנורמה (קצב הנשימה ממוצע = ± 31.4 הגנה 7.04 (SD) נשימות לכל מין, קצב הלב ממוצע = 75.9 פעימות ± 8.9 דקות, וממוצע טמפרטורה רקטלית = ± 38.2 0.68 ° C, איור 3).
בעקבות לחץ ידני על האזור ביופסיה להשיג את hemostasis (כ- 25 דקות), הפצע פתוח הראה דימום מינימלי (איור 4). הפרות קיבלו את הדיאטה באותו ad libitum, החיות הוחזקו במתקן דיור אותו במהלך התקופה שלאחר הניתוח. החיות לא הראה סימנים של זיהום באתר ביופסיה; היה ללא כאב, דימום, נפיחות, ניקוז או טמפרטורות גבוהות (איור 5). הפצע החלים בתוך 8 עד 10 ד' של הביופסיה (איור 5C).
חיה אחת פיתחה גירוי בעור קטין עקב פצע שפשוף על יום 8 לאחר ההליך. את הפרה טופל על-ידי ניקוי הביופסיה באמצעות פתרון povidone יוד ואלכוהול איזופרופיל 70%. סיכות פלדה אל חלד הוסרו כדי לאפשר ניקוז, povidone יוד משחה (1%) היה מוחל פעמיים ביום דרך האתר ביופסיה d 2-3. גירוי העור נעלמה 2 d לאחר החלת משחה povidone יוד, הפצע נרפא עם אין סיבוכים נוספים.
קרישי דם הוסרו בידי חסינותו של חלב מהעיר ביופסיה לפני מכונת חליבה. בפרוטוקול הנוכחי, הנוכחות של קרישי דם בתוך החלב נצפתה עבור עד שלושה בחליבת הארס (בערך 36 שעות) לאחר הביופסיה. זיהום בדם של חלב נצפתה עבור עד 48 שעות לאחר הביופסיה. היו אין ההבדלים החזותיים שנצפה בין ביופסיות מחט והליבה יחסית כמות הדם בתוך החלב. החיות לא הראה על ירידה משמעותית בתנובת חלב לאחר ההליך (איור 6). הרכב החלב הממוצע היה 4.37% שומן, 3.34% חלבון ו 4.64% לקטוז. ספירת תאים סומטיים של חלב ממוצע (SCC) היה פחות מ-200,000 תאים לכל mL.
הרקמה MG שהושג יכול לשמש למטרות מחקריות שונות כגון תרביות תאים הראשי (איור 7).
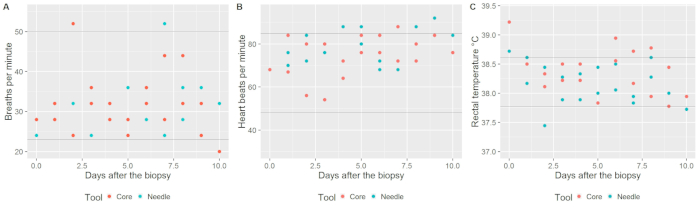
איור 3 . הערכה של אינדיקטורים בעלי חיים בריאות לאחר ביופסיה בלוטת חלב פרה- אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
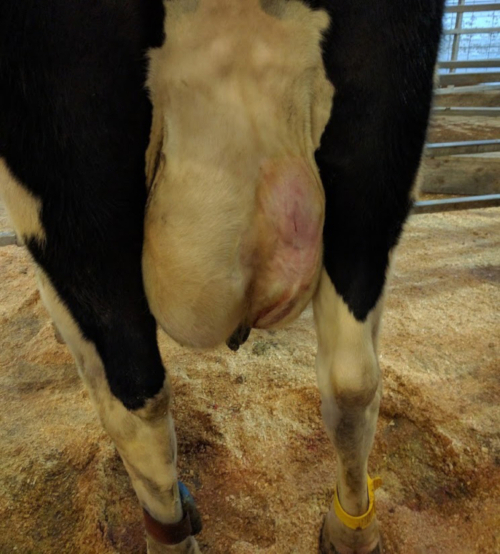
איור 4 . ביופסיה מראה האתר לאחר לחץ ידני היה מוחל על האזור ביופסיה להשיג את hemostasis. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
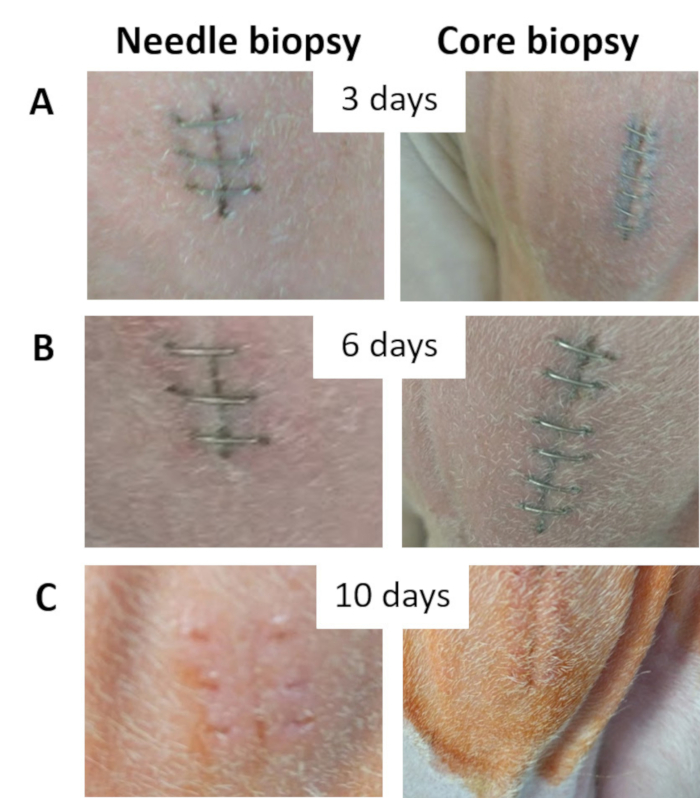
איור 5 . ביופסיה באתר הצילומים. ביופסיה (א) אתר בתלת-ממד לאחר ההליך. ביופסיה (B) באתר 6 d לאחר ההליך. ביופסיה (C) האתר 10 d לאחר ההליך הממחישות הפצע נרפא במידה מספקת. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
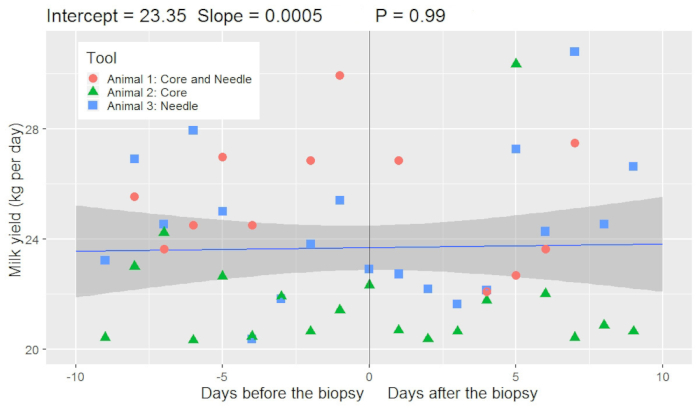
איור 6 . ייצור החלב היומית לפני ואחרי ביופסיה בלוטת חלב פרה (n = 3 פרות). מודל לינארי העריך כי 10 ימים לפני הביופסיה החיות המיוצר 23.35 ק ג של חלב ביום. התשואה חלב לא השתנה באופן משמעותי (P > 0.05) מ- 10 ימים לפני כעשרה ימים לאחר הביופסיה למרות עלייה קלה של חלב התשואה נצפתה (עלייה של 0.0005 kg/d של חלב עבור כל יום מ- 10 ימים לפני הביופסיה). שלוש חיות שהיו בשימוש פרוטוקול זה; חיה אחת היה ביופסיה פעמיים (חיה 1: ליבה ביופסיה בצד שמאל של עטין, מחט ביופסיה בצד ימין של עטין) והיו שתי חיות ביופסיה פעם (חיה 2 ו- 3: רק על הצד הימני של עטין באמצעות ההליך ליבה או מחט). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
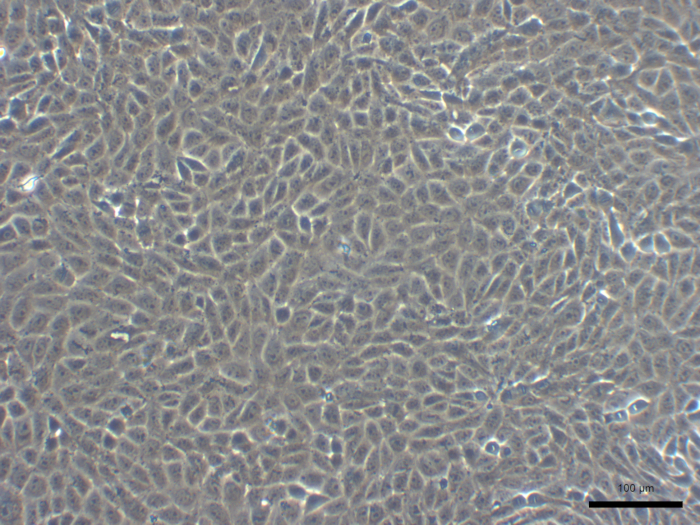
איור 7 . להחליפן בתמונות של תרבות ראשי שור בתאי אפיתל החלב. סולם בר הוא 100 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
הליבה ושיטות ביופסיה מחט תוארו ב9,זה פרוטוקול16. הערכה מפורטת של בעלי חיים בריאות, השכיחות של mastitis14 לפני הביופסיה נדרשת עבור שני הליכים. למטרות מחקר, ביצוע הטכניקה בבעלי חיים עם סימנים ברורים של דלקת או מחלות זיהומיות להימנע. פעולה זו תקטין את הסיכון לסיבוכים במהלך ולאחר ביופסיה. כל ביופסיה והתקניהם צריך להיות נקי מחוטא, מעוקר כדי למנוע זיהום של הביופסיה. לפני ההליך, זה הכרחי למזער את האתר כירורגית זיהומים (. SSI). באופן כללי, SSI מזוהה עם תחלואה בעלי חיים אבודים ודרכי עלויות ייצור גבוהות יותר לפרות חלב. מחקרים דיווח בעבר שיטות למניעת SSI עקב הביופסיה כולל חיתוך השיער סביב באזור הניתוח, שטיפת האזור ביופסיה כדי להסיר זיהום9,14, באמצעות סוכנים חיטוי (70% אלכוהול, יוד כירורגי לשפשף9, 2% chlorhexidine אצטט פתרון14, 10% povidone יוד8) להכנת העור. במחקרים מסוימים, הניהול של אנטיביוטיקה אומצה במהלך7 או מיד לאחר ביופסיה9; עם זאת, טיפול אנטיביוטי מונע לא שימש בשנת העבודה הנוכחית, אין זיהומים של הביופסיה נצפו. כדי למנוע זיהום של הביופסיה פצע, הזנב צריך להיות מאובטח כדי למנוע מגע עם הביופסיה עד התחבושת תרסיס הוחל. ב פרוטוקול זה, סיכות יוסרו כ 10 עד 14 d לאחר הביופסיה.
לפני ביופסיה הליבה, חשוב כמו שצריך להגדיר את הכלי ולחבר אותו הנוהל; בחר מהירות סיבוב איטי, בחר את סיבוב קדימה ולאחר אל תשתמש מצב הפוך של התרגיל. במהלך ההליך, חשוב להשתמש לחץ דיגיטלי משני צידי החתך כדי להפריד את הקצוות העור ויש חתך ארוך מספיק כדי לאפשר כניסה כלי ללא קשר עם העור או רקמת חיבור. אם הליך זה לא נעשה, שאכטה בקצוות החתך במהלך הסיבוב של המכשיר ביופסיה הליבה עלול להתרחש ולגרום טראומת רקמות עור נוספות אשר יגביר את הסיכון של זיהום, עלולה לעכב את ריפוי הפצע. ביופסיה נוכח בהליכים המתוארים תחת פרוטוקול זה בוצעו על ידי מנתח מוסמך בעלי חיים גדולים. ההליכים בוצעו בהצלחה (איור 5). בשתי הטכניקות הן יחסית קל ומהיר לביצוע לעומת הליך כריתה כירורגית.
דימום מאזור הביופסיה נפוצים לאחר ביופסיה MG פרות חולבות8,9,10,14. בפרוטוקול הנוכחי, הדימום ציין היה מינימלי (איור 4), אשר ייתכן עקב יישום של נאותה (חזקה) לחץ על הפצע מיד לאחר הניתוח. לחץ חזק על פחות 20 דקות נדרש, זה ייתכן שתידרש עבור יותר מ 30 דקות במקרים מסוימים. אם בינוני עד דימום חמור הוא ציין לאחר יישום של הלחץ על הביופסיה, מומלץ להמשיך בלחץ, פנו מיד וטרינר.
כמו hemostasis הוא גורם חשוב להפחתת התחלואה פרה, מחקר אחד ארוז רפידות hemostatic לתוך האתר ביופסיה כדי לשלוט הדימום9. אולם, השימוש רפידות hemostatic באופן כזה יש פוטנציאל סיכון גבוה עבור מיקרוביולוגית מזהמים בסביבה רפת. מחקר אחר14 חלה לחץ ידני על הביופסיה בין ביופסיות חוזרות ונשנות, לאחר סגירת ביופסיה של העור, והיא חלים קרח על האתר כבר לפחות שעתיים לאחר הביופסיה. בפרוטוקול הנוכחי, לחץ חזק מוחל על הביופסיה למשך 20 עד 25 דקות היה הולם לשליטה בדימום.
טכניקה מוצלחת ביופסיה צריך לגרום מינימום בדם החלב אשר נמשכת לתקופה קצרה של זמן לאחר ההליך. כדי למנוע הפרעה של הפרשת חלב במהלך זיהומים אכזבה ודלקת חלב, יש להסיר קרישי דם intramammary ביד בנוכחות אחר מתוך10,רבע ביופסיה14. בפרוטוקול הנוכחי, נצפתה הדם פנימה את החלב עד 48 שעות לאחר הביופסיה. עם זאת, במחקר בשימוש מספר גדול יותר של בעלי חיים, דם בכוס החלב נצפתה ברוב המכריע של פרות פחות מ- 6 ימים. בעלי חיים מעטים הראו דם החלב לאחר 6 ימים8. מסיבה זו, התבוננות יומי של חלב המראה הוא הכרחי עבור 6 d לאחר ההליך. חיות לא לא להפגין סימני דלקת mastitis כאשר דגימת רקמה גדול הושג14. עם זאת, מחקרים קודמים אשר ביצעו ביופסיות חוזרות על אותה חיה באמצעות מחט נמצא שכי שכיחות הזיהום mastitis היה בכ-12% בעקבות הליך8. בפרוטוקול הנוכחי, גם בעלי חיים היו סימנים חזותיים של mastitis קליניים זיהום לאחר הניתוח. יש גם בעיה קטנה סיכוי כי מקום החתך יכול להידבק לאחר הביופסיה.
Tolazoline הידרוכלוריד, סם מבטל את ההשפעות של הרגעה, צריכה להיות זמינה במקרה של מנת יתר של חריגות השירותים הווטרינריים. מנה מופרזת של חריגות השירותים הווטרינריים עלול לגרום לבצקת ריאות. סימנים קליניים של בצקת ריאות כוללים מצוקה נשימתית חמורה קוצר נשימה, קשיי נשימה, שיעול, sputum הלאגר. אם הם נצפו סימנים של בצקת ריאות, מומלץ להשתמש tolazine (2-4 mg/kg של משקל גוף) את ההשפעה חריגות השירותים הווטרינריים.
בפרוטוקול הנוכחי מתאר את הטכניקה לבצע ביופסיית-מחט והן הליבה ביופסיה. באופן כללי, היתרון של ביופסיה הליבה לעומת ביופסיית-מחט הוא גדול יותר רקמת מדגם (0.75-1 גרם)9 עם מינימום השפעה שלילית על בריאות עטין. מחט הביופסיה היא שיטה פחות פולשנית מאשר מכשיר ביופסיה הליבה. עם זאת, ביופסיה מרובים מנסה להשיג כמות גדולה של רקמות באמצעות שהליך ביופסיה מחט עלולה להגביר את הסיכון של דימום העיקריים לאחר ההליך, וכן קרישי דם בתוך החלב. בשתי הטכניקות גרם תחלואה מינימלית פרה, הושגו בקלות עם הכשרה מינימלית של צוות כירורגי. שינוי לטווח קצר חלב מדי יום התשואה (8-10% ירידה), קומפוזיציה9 והאטרקציות הפחתת צריכת הזנות14 צפוי לאחר הליבה ואת המחט ביופסיות, בהתאמה. מגבלות של ההליך ביופסיה מחט הן נפח קטן של הרקמה המוסרת עם המחט. המכשיר צריך להיות מופעל רק כאשר המחט בתוך רקמת להיות ביופסיה ניסיונות מרובים לעיתים קרובות נחוצים לקבל כמות מספקת של רקמות, אשר מגביר את הסיכון של דם חלב, mastitis לאחר ההליך. מגבלות של הביופסיה הליבה כוללים סיכון גבוה יותר של דימום לאחר ההליך אם כמות גדולה של רקמות (> 200 מ ג) מתקבל. בנוסף, הכלי הביופסיה קשה יותר לאסוף. הדורש הכשרה נאותה לפני השימוש.
Disclosures
המחברים אין לחשוף.
Acknowledgements
מחקר זה נתמך על ידי תוכנית לאומית של תזונת בעלי חיים ו וירג'יניה טק. סיוע טכני של גברת טארה Pilonero ד ר ג'ולי Settlage, ד ר Izabelle טיישיירה הם הכירו בהכרת תודה.
Materials
| Name | Company | Catalog Number | Comments |
| 70% Isopropyl alcohol | Walmart | 565106257 | 1 L |
| Aerosol spray to kill and repel flies | MWI | 14339 | 1 bottle (if necessary) |
| Biopsy needles, 12 G × 16 cm | C. R. Bard | MN1216 | 2 |
| Butterfly infusion set (18 G needle) | Fisher | 22-258087 | 1 |
| Cell culture dishes | Fisher | 08-772E | 4 |
| Cordless drill (low speed) | Hitachi | DS10DFL | 1 |
| Core biopsy instrument, Farr et al. (1996) | 2, custom metal fabrication. To request the tool contact the authors. | ||
| Cows | cattle healthy | ||
| Flunixin meglumine | MWI/VetOne | 501018 | 1.1 to 2.2 mg/kg of body weight |
| Folding table | Amazon | 1 | |
| Forceps | Fisher | 09-753-50 | 1 |
| Gloves non-sterile | Fisher | 17-200-845 | 9, size dependent |
| Hard brush | Sullivan Supply | 18270 | 1, to wash the cows |
| Head gate | 1, customized for dairy cows | ||
| Lidocaine hydrochloride 2% injectable | MWI/VetOne | 510212 | 6 mL was used, from 3 to 8 mL |
| Livestock body wash | eZall Technologies | 39384 | 1, to wash the cows |
| Needle 18 G (1 to 1/5“) | Fisher | 14-821-15A | 6 |
| Needle 20 G (1 to 1/5“) | Fisher | 14-815-526 | 6 |
| Phosphate buffered saline (0.9%) | Fisher | 20-012-043 | 1 L |
| Povidone Iodine ointment | Jeffers | #VED1A | 500 g (if necessary) |
| Povidone iodine scrub solution (0.75% iodine) | MWI/VetOne | 510094 | 1 L |
| Reusable biopsy instrument | C. R. Bard | MG1522 | 1 |
| Rope halter | Nasco farm and ranch | C10852 | 2, cow size |
| Scalpel blades (#10) | MWI | 033870 | 2 |
| Scalpel holders (#3) | MWI | 602008 | 1 |
| Self seal autoclave pouch 10 x 5.5 in. | Fisher | 19-130-0038 | 1 case of 800 |
| Sterile cotton gauze sponges | Fisher | 22-037-986 | 4 |
| Sterile gauze pads | Fisher | 19-090-735 | 4 |
| Sterile surgical gloves | Surgical gloves | 19-166-679 | 3, size dependent |
| Sterile surgical towels | Fisher | 50-118-0339 | 6 |
| Stethoscope | Littmann Master Classic II | 1392 | 1 |
| Surgical clipper | Oster A5 | 078005-010-003 | 1, preparation of the animal for biopsy |
| Surgical clipper blades (#40 ) | Oster | 78919-016 | 1, preparation of the animal for biopsy |
| Surgical staple remover | MWI | 541 | 1 |
| Surgical stapler pre-loaded | MWI | 17713 | 5 |
| Syringes of 10 mL | Fisher | 14-823-224 | 3 |
| Syringes of 2 mL | Fisher | 22-028854 | 3 |
| Syringes of 20 mL | Fisher | 22-034507 | 3 |
| Syringes of 5 mL | Fisher | 22-028855 | 3 |
| Thermometer | Agri-Pro Enterprises Inc | 72000 | 1 |
| Tolazine hydrochloride | Akorn Animal Health | 61311-486-10 | 2 to 4 mg/kg of body weight (if necessary) |
| Tweezer | Fisher | 14-955-025 | 1, for handle the tissue sample |
| Water hose | Miracle-Gro, Walmart | 554990501 | 1, to wash the cows |
| Water-resistant aerosol bandage (aluminum powder 40 mg) | MWI | 010728 | 1 bottle |
| Xylazine hydrochloride | MWI/VetOne | 510650 | 0.01 to 0.05 mg/kg of body weight |
References
- Khatun, M., Sorensen, P., Ingvartsen, K. L., Bjerring, M., Rontved, C. M. Effects of combined liver and udder biopsying on the acute phase response of dairy cows with experimentally induced E. coli mastitis. Animal. 7 (10), 1721-1730 (2013).
- Buitenhuis, B., Rontved, C. M., Edwards, S. M., Ingvartsen, K. L., Sorensen, P. In depth analysis of genes and pathways of the mammary gland involved in the pathogenesis of bovine Escherichia coli-mastitis. BMC Genomics. 12, 130 (2011).
- Nickerson, S. C., Akers, R. M. Mammary Gland | Anatomy. Fuquay JW, Fox PF and McSweeney PLH (eds.), Encyclopedia of Dairy Sciences, Second Edition. 3, 328-337 (2011).
- Akers, R. M. A 100-Year Review: Mammary development and lactation. Journal of Dairy Science. 100 (12), 10332-10352 (2017).
- Ruegg, P. L. A 100-Year Review: Mastitis detection, management, and prevention1. Journal of Dairy Science. 100 (12), 10381-10397 (2017).
- Zhao, X., Lacasse, P. Mammary tissue damage during bovine mastitis: Causes and control. Journal of Animal Science. 86 (13), 57-65 (2008).
- Knight, C. H., Hillerton, J. E., Teverson, R. M., Winter, A. Biopsy of the bovine mammary gland. British Veterinary Journal. 148 (2), 129-132 (1992).
- Lima, J. A., et al. Effects of bovine mammary gland biopsy and increased milking frequency on post-procedure udder health, histology, and milk yield. Animal. 10 (5), 838-846 (2016).
- Farr, V. C., et al. An improved method for the routine biopsy of bovine mammary tissue. Journal of Dairy Science. 79 (4), 543-549 (1996).
- Weng, X., et al. Short communication: Repeated mammary tissue collections during lactation do not alter subsequent milk yield or composition. Journal of Dairy Science. 100 (10), 8422-8425 (2017).
- Peterson, D. G., Matitashvili, E. A., Bauman, D. E. Diet-induced milk fat depression in dairy cows results in increased trans-10, cis-12 CLA in milk fat and coordinate suppression of mRNA abundance for mammary enzymes involved in milk fat synthesis. Journal of Nutrition. 133 (10), 3098-3102 (2003).
- Baumgard, L. H., Matitashvili, E., Corl, B. A., Dwyer, D. A., Bauman, D. E. trans-10, cis-12 conjugated linoleic acid decreases lipogenic rates and expression of genes involved in milk lipid synthesis in dairy cows. Journal of Dairy Science. 85 (9), 2155-2163 (2002).
- Kasraeian, S., Allison, D. C., Ahlmann, E. R., Fedenko, A. N., Menendez, L. R. A comparison of fine-needle aspiration, core biopsy, and surgical biopsy in the diagnosis of extremity soft tissue masses. Clinical Orthopaedics and Related Research. 468 (11), 2992-3002 (2010).
- de Lima, L. S., et al. A new technique for repeated biopsies of the mammary gland in dairy cows allotted to Latin-square design studies. Canadian Journal of Veterinary Research-Revue Canadienne De Recherche Veterinaire. 80 (3), 225-229 (2016).
- Ollier, S., et al. Whole intact rapeseeds or sunflower oil in high-forage or high-concentrate diets affects milk yield, milk composition, and mammary gene expression profile in goats. Journal of Dairy Science. 92 (11), 5544-5560 (2009).
- Soberon, F., et al. Effects of increased milking frequency on metabolism and mammary cell proliferation in Holstein dairy cows. Journal of Dairy Science. 93 (2), 565-573 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved