Method Article
Ein High-Throughput-Assay zu beurteilen und zu quantifizieren Neutrophilenzahl extrazelluläre Trap Bildung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt einen hochempfindliche und hohen Durchsatz Neutrophilenzahl extrazelluläre Falle (NET) Assay für die halbautomatische Quantifizierung von ex-Vivo NET Bildung durch Immunfluoreszenz dreidimensionale konfokalen Mikroskopie. Dieses Protokoll kann verwendet werden, um NET Bildung und Abbau nach verschiedenen Reize zu bewerten und kann verwendet werden, um mögliche NET gezielte Therapien zu studieren.
Zusammenfassung
Neutrophilenzahl extrazelluläre Traps (NETs) sind immunogen extrazelluläre DNA-Strukturen, die von Neutrophilen auf eine Vielzahl von Triggern ausgelöst werden können. Netze haben als ein wichtiger Wirt Abwehrmechanismus dienen, fallen und tötet Mikroorganismen, nachgewiesen. Auf der anderen Seite haben sie in vielfältigen systemischen Autoimmunerkrankungen verwickelt. Netze sind immunogen und toxischen Strukturen, die einen Pool von entsprechenden Autoantigene, einschließlich Anti-Neutrophilen-cytoplasmatische Antikörper (ANCA) enthalten-assoziierten Vaskulitis (AAV) und systemischer Lupus erythematodes (SLE). Verschiedene Formen der Netze können je nach den Reiz ausgelöst werden. Die Höhe der Netze kann quantifiziert werden, mit verschiedenen Techniken, einschließlich DNA-Release im Überstände, DNA-komplexiert mit NET-Moleküle wie Myeloperoxidase (MPO) oder Neutrophilen Elastase (NE), das Vorhandensein von citrullinierte Messung Messung Messung Histone durch Fluoreszenzmikroskopie oder Fluss durchflusszytometrischen Erfassung von NET-Komponenten, die alle unterschiedliche Eigenschaften in Bezug auf ihre Spezifität, Sensitivität, Objektivität und Menge. Hier ist ein Protokoll, ex Vivo NET Bildung in einer hochsensiblen, Hochdurchsatz-Weise mithilfe von dreidimensionalen Immunfluoreszenz konfokalen Mikroskopie zu quantifizieren. Dieses Protokoll kann angewendet werden, um verschiedene Forschungsfragen über NET Bildung und Abbau in Gesundheit und Krankheit zu beheben.
Einleitung
Die Bildung von Neutrophilen extrazelluläre Traps (NETs) ist der Prozess in der Neutrophilen ihre DNA in eine extrazelluläre dreidimensionale (3D) Web wie komplexiert mit einer breiten Palette von antimikrobiell und gefährliche Moleküle, körnige Struktur veröffentlichen und zytoplasmatischen Enzyme, Peptide und Proteine. Diese immunogen und toxischen Strukturen haben eine wichtige physiologische Rolle in der angeborenen Immunabwehr von gesunden Personen durch fangen und töten infektiösen Erreger1. Sie haben jedoch auch gezeigt worden, Thrombose2 und verschiedenen systemischen Autoimmunerkrankungen, einschließlich Anti-Neutrophilen-cytoplasmatische Antikörper (ANCA) beteiligt sein-Vaskulitis (AAV)3, systemischer Lupus erythematodes (SLE verbunden ),4,5, antiphospholipid-Syndrom (APS)2,6, rheumatoide Arthritis (RA), Psoriasis und Gicht7,8,9.
In-vitro-NET Bildung wurde weithin mit chemische Verbindung Phorbol Myristate-12 13-Acetat (PMA), untersucht die massive NET Bildung induziert. Die meisten physiologischen Reize induzieren jedoch viel niedrigeres Niveau NET Bildung10. Studie NET-Trigger in, z. B. einer Autoimmun-Krankheit ist ein standardisierte, sensibel, Hochdurchsatz-quantitative Assay zu erkennen und zu quantifizieren, NET Bildung erforderlich. Quantifizierung der Netze erweist sich als problematisch und wird derzeit durch verschiedene Methoden, jeweils mit ihren eigenen Vorzüge und Grenzen11durchgeführt. Eine häufig verwendete Methode ist der Nachweis von DNA in die Überstände12, das Ziel aber unterscheidet nicht zwischen dem Ursprung der DNA (Apoptose, nekrotische, Netze), und ist daher nicht sehr spezifisch für Netze. Zweitens, Enzym-linked Immunosorbentprobe Assays (Elisa) der DNA komplexiert mit NET-spezifische Proteine, beispielsweise Myeloperoxidase (MPO) oder Neutrophilen Elastase (NE), einen konkreteren Ansatz, Netze zu erkennen und wurden demonstriert korrelieren gut mit Citrullinierte Histon-3 (CitH3) positive Netze13. Allerdings ist es nicht bekannt, ob diese Methode empfindlich genug ist, um alle Netze (z. B. MPO, NE, und negative NETs CitH3) abholen. Ein dritter Ansatz ist Immunfluoreszenz-Mikroskopie, die verwendet wird, um Co Lokalisierung von NET-assoziierter Moleküle (NE, MPO, CitH3) mit extrazellulärer DNA, Netze zu quantifizieren zu erkennen. Diese Methode ist in der Regel spezifisch für Netze, aber es kann nicht als Hochdurchsatz-Verfahren angewendet werden und ist nicht Ziel wegen Befangenheit Beobachter. Darüber hinaus berücksichtigt diese Methode nicht MPO-, NE-, CitH3-Negative Netze, die häufig abhängig von der verwendeten NET-Trigger14,15vorhanden sind. Flow Cytometry Ansätze erkennen Netze durch eine geänderte vorwärts/seitwärts Streuung (FSC/SSC) Schwellung des Kerns in NET-Ting Neutrophilen16angibt. Diese Methode nimmt berücksichtigt die verschiedenen Formen der NET Formation, die identifiziert wurden, nicht die Schwellung des Kernes, wie vital NET Bildung17nicht einbeziehen könnte. Zu guter Letzt wurde Immunfluoreszenz konfokalen Mikroskopie zu visualisieren und zu quantifizieren NET Bildung durch direkt beflecken extrazelluläre DNA mit einer Zelle-undurchlässig Färbung, die extrazelluläre DNA12,18Flecken angewendet. In der Regel 5 bis 10 Hochleistungs-Felder sind manuell abgeholt und bewertet, die deckt 1-5 % von jedem Bohrloch einer 96-Well-Platte11,17. Manuelle Auswahl der Bilder ist nicht immer Objektiv, anfällig für Verzerrungen und nicht attraktiv für Hochdurchsatz-Analyse. Ein automatisierte, Hochdurchsatz-NET Quantifizierung-Assay wurde vor kurzem entwickelt die abgebildet 11 % des Brunnens in einer 3D Weise über 13 µm durch Z-stacked Immunfluoreszenz konfokalen Mikroskopie, was wiederum zu einer hochsensiblen Technik Netze zu beurteilen, im Vergleich zu den herkömmlichen Methoden10. Der vorliegende Bericht beschreibt das letzte Protokoll um netto Formation durch eine automatisierte, hochsensiblen Assay mit 3D konfokalen Mikroskopie, die abgebildete Gesamtfläche von 45 % von jedem Bohrloch erreicht und umfasst 27 µm durch Z-Stapel zu quantifizieren. Dieses Protokoll eignet sich für niedrige Konzentrationen von Netto Bildung in eine objektive und unvoreingenommene Weise mit einer hohen Empfindlichkeit zu quantifizieren.
Protokoll
Alle Patienten und gesunden Kontrollpersonen zugestimmt zu Biobank LUMC beteiligen. Beide Biobanking Studien wurden durch das LUMC Ethikkommission genehmigt.
1. Isolation von gesunden Neutrophilen
- Erhalten Sie 20 mL des peripheren Blutes eines gesunden Spenders in zwei 10 mL EDTA-beschichteten Rohren.
- 10 mL Blut in eine sterile 50 mL-Tube und hinzufügen Phosphat gepufferte Kochsalzlösung (PBS) bis 32,5 mL.
-
Dichtegradient (z. B.., Ficoll-Amidotrizoaat) unter den Zellen hinzufügen.
- Nehmen Sie 14 mL Dichte Gradienten mit 10 mL pipettieren und Pipettieren Controller.
- Legen Sie das pipettieren, auf den Boden der 50 mL Tube.
- Nehmen Sie das Pipettieren Regler aus pipettieren, so dass der Dichtegradient aus dem Pipettieren durch Schwerkraft zu fließen, bis das Maximum, durch Kapillarwirkung erreicht ist (1-2 mL bleibt), ohne den Motor.
- Pipettieren zu entfernen, indem man einen Daumen auf das pipettieren, wodurch Dichtegradient verhindert Austritt bei der Entnahme der pipettieren.
- Drehen Sie die Rohre für 20 min bei 912 X g und Raumtemperatur (RT) ohne Beschleunigung oder Bremsen.
Hinweis: Erythrozyten (RBC) und Neutrophile haben eine hohe Dichte und sind am unteren Rand der 50 mL Tube. Peripheren mononukleären Zellen (PBMCs) sind getrennt und auf der Oberseite der Dichtegradient als einen weißen Ring. PBS verdünnt Plasma wird über die PBMCs liegen. Bei Bedarf können PBMCs isoliert werden, indem der weiße Ring in eine neue 50 mL-Tube mit weiteren Waschschritten mit PBS übertragen. - Entfernen Sie vorsichtig den weißen Ring mit PBMCs zuerst, gefolgt von Entfernung von PBS verdünnt Plasma und schließlich die Dichte Verlaufsebene so weit wie möglich.
-
Um die Neutrophilen aus den Neutrophilen/Erythrozyten-Mix zu isolieren, lyse Erythrozyten durch kalte sterilem destilliertem Wasser.
- Nehmen Sie kalte sterile destilliertes Wasser Flasche und eine 10 x konzentrierte PBS-Flasche aus dem Kühlschrank.
- Arbeiten Sie schnell für diesen Schritt. 36 mL kalte sterile destilliertem Wasser direkt auf die Tablette und mischen nach sorgfältiger. Fügen Sie 4 mL 10 X PBS nach 20 s eine isotonische Lösung zu machen. Umrühren Sie einmal vorsichtig.
- Schlauch für 5 min bei 739 X g und 4 ° C (für die Entfernung von RBCs) drehen. Neutrophile werden im weißen Pellet.
- Den Überstand sorgfältig zu verwerfen. Führen Sie Schritt 1.6.2 erneut und stellen Sie sicher, dass das Pellet richtig eingestellt ist.
- Spin-Schlauch für 5 min bei 328 X g und 4 ° C.
- Sorgfältig entfernen des Überstands und das Pellet in 5 mL PBS Aufschwemmen. Zählen Sie die Neutrophilen und halten sie auf dem Eis.
Hinweis: Erwartete Rendite aus 1 Röhrchen Blut (10 mL) ist etwa 15 Millionen Neutrophilen.
(2) rot fluoreszierende Zelle Kennzeichnung der Neutrophilen
- Machen Sie eine Neutrophilenzahl Suspension von 10 Millionen Neutrophilen in 2 mL PBS in einer 15 mL Tube.
- Machen Sie eine Lösung aus 2 mL PBS mit 4 µL 2 µM rot fluoreszierende Zelle Linker (siehe Tabelle der Materialien) in eine andere 15 mL-Tube. Fügen Sie diese vorsichtig auf die Neutrophilen Aussetzung und umrühren Sie vorsichtig.
- Brüten Sie im Dunkeln genau 25 Minuten bei 37 ° C, die Neutrophilen mit dem roten fluoreszierenden Zelle Linker zu kennzeichnen.
- Inaktivieren Sie nach sorgfältiger die Kennzeichnung durch Hinzufügen von RPMI 1640 Medium mit 10 % Hitze inaktiviert fötalen Rinderserum (FCS) bei RT bis zu 15 mL und Mix. Stellen Sie sicher, dass das Pellet sorgfältig Nukleinsäuretablette ist, wenn ein Pellet gebildet hat.
- Spin-Schlauch für 5 min bei 328 X g und RT.
- Entfernen den Überstand und Aufschwemmen Pellet in 5 mL RPMI-1640 Phenol Rotfrei-mittlere mit FCS 2 % und 10 % P/S bei RT zählen die Neutrophilen.
Hinweis: Ein Zelle Verlust von 50 % kann nach rot fluoreszierende Zelle Kennzeichnung auftreten.
(3) Induktion von Neutrophilen extrazelluläre Trap Bildung
- Machen Sie eine Zellsuspension von 0,42 x 106 Zellen/mL in Phenol rot RPMI 1640 Medium enthält 2 % FCS und 10 % kostenlos P/S.
- 37.500 Neutrophilen in 90 µL pro Bohrloch in einer schwarzen 96-Well, flacher Bodenplatte hinzufügen.
- Fügen Sie 10 µL des gewählten Stimulus (z. B. Seren von Patienten) in dreifacher Ausfertigung zu eine Konzentration von 10 % in den Brunnen zu erreichen. Immer auch eine Negativkontrolle (Medium) in dreifacher Ausfertigung.
- Die gewünschte Zeit von 30 min bis 2, 4 oder 6 h Inkubation für 4 h vorgeschlagen wird im Dunkeln bei 37 ° C inkubieren.
- Berechnen Sie das Volumen hinzufügen 25 µL 5 µM undurchlässig DNA (siehe Tabelle der Materialien), färben benötigt um eine Endkonzentration von 1 µM in der gut zu erreichen. Gegebenfalls eine Vorverdünnung in RPMI 1640 Medium enthält 2 % FCS und 10 % P/S, eine 5 µM-Konzentration zu erhalten.
- Fügen Sie 25 µL 5 µM undurchlässig DNA-Farbstoff 15 min vor Ende der Inkubationszeit. Für weitere 15 min Inkubation bei 37 ° C im Dunkeln weiter.
- Den überstand (~ 125 µL) sehr vorsichtig entfernen und bei Bedarf zu speichern. 100 µL 4 % Paraformaldehyd (PFA) hinzufügen. Halten Sie in der Dunkelheit, und sofort fahren Sie mit Schritt 4 fort.
4. Netto Visualisierung mit 3D High-Content, hochauflösende Immunfluoreszenz konfokalen Mikroskopie
-
Konfigurieren Sie die Einstellungen auf die Immunfluoreszenz confocal Mikroskop, indem Sie auf die Übernahme-Setup.
- Klicken Sie auf die Registerkarte " konfigurieren ".
- Wählen Sie das Ziel und die Kamera. Wählen Sie das 10 X Apo Lambda-Ziel mit einer Übernahme einer konfokalen 60 µm Lochkamera.
- Klicken Sie auf Platte und wählen Sie die 96-Well-Kunststoffplatte. Wählen Sie die Websites zu besuchen und eine feste Anzahl von Websites zu wählen. Füllen Sie 3 Spalten und 3 Reihen ohne Überlappung (0 µm), die insgesamt 45 % der gut abdecken.
- Klicken Sie auf Übernahme. Wählen Sie aktivieren, laserbasierte konzentrieren. Bei Bedarf Erwerben Z Serie/Time Series auswählen.
- Klicken Sie auf Website-Autofokus.
- Klicken Sie auf Fokus auf Platte unten | Aufrechnung von unten Dicke. Nach der ersten Brunnen die Probe zu finden, wählen die erste Bohrung erworben. Wählen Sie für die Website-Autofokus alle Standorte.
- Klicken Sie auf Wellenlängen.
- Wählen Sie für die Anzahl der Wellenlängen 2. Wählen Sie für die TL Schattierung Verfeinerung Korrekturstufe 2.
- Wählen Sie für die Wellenlänge 1 Texas rot.
- Für die Autofokus-Optionen, wählen Sie Laser mit Z-Offset, post-Laser Versatz 1,1 µm. Verwendung Z-Stapel mit einem benutzerdefinierten Bereich von 200-10.
- Wählen Sie für Wellenlänge 2 FITC.
- Wählen Sie laser für die Autofokus-Optionen mit Z-Offset von w1 0 µm. Verwendung Z-Stapel mit einem benutzerdefinierten Datumsbereich 200-10.
- Wählen Sie für die Akquisition Optionen Z-Serie und 2D-Projektion Bild maximale. Wählen Sie für die Übernahmeoptionen Shading-Korrektur | Aus.
- Wählen Sie Z-Serie. Wählen Sie die Anzahl der Schritte: 10. Wählen Sie die Schrittweite: 3 mm (Gesamtbereich werden 27 µm).
-
Legen Sie die Platte in die Immunfluoreszenz konfokalen Mikroskopie.
- Klicken Sie auf die Registerkarte " laufen ".
- Füllen Sie Platte Namen und eine Beschreibung und wählen Sie den Speicherort aus.
- Wählen Sie die Brunnen, die erworben werden müssen.
- Klicken Sie auf die Registerkarte " laufen ".
- Wählen Sie die Belichtungszeit für Texas Red und FITC.
- Klicken Sie auf Platte erwerben den Erwerb, der dauert ca. 1 h pro Platte zu starten.
5. Analyse der NET Bildung
- Verwenden Sie eine Bildverarbeitungs-Programm zur Analyse von wissenschaftlichen multidimensionalen Bildern (siehe Tabelle der Materialien), NET Bildung zu analysieren.
- Die gewonnenen Bilddaten auf einer separaten Festplatte zu übertragen.
-
Wählen Sie die Farbe hinzufügen Tool.
- Wählen Sie w1 und wählen Sie den Ordner auf der Festplatte, wo die Daten gespeichert werden.
- Wählen Sie w2 und wählen Sie den Ordner auf der Festplatte, wo die Daten gespeichert werden.
Hinweis: Verwenden Sie ein standard-Makro, das verwendet w1 im Dateinamen die Texas Red Bilder rote Farbe hinzu und w2 FITC Bilder grüne Farbe hinzu.
-
Wählen Sie Analyse Makro.
- Wählen Sie w1, den Schwellenwert (Intensität Schwelle), die in der Regel 10. Wählen Sie den gewünschten Pixelwert (Größenschwellenwert, z. B. 100).
- Wählen Sie w2, den Schwellenwert (Intensität Schwelle), die in der Regel 10. Wählen Sie den gewünschten Pixelwert (Größenschwellenwert, z. B. 500).
- Wählen Sie das Ziel für die Kalkulationstabellendatei Analyse führen, und Log-Dateien anschließend speichern.
- Analysieren von Daten in einer Tabellenkalkulation.
Ergebnisse
Neutrophilenzahl extrazelluläre Falle (NET) Bildung ist in gewissem Sinne 3D durch Quantifizierung gefärbten extrazelluläre DNA über 10 Z-Stapel mit 3 µm-Abstand ab aus der Brennebene in jede Vertiefung quantifiziert. Durch die Messung der kumulativen Gegend, die Empfindlichkeit des Tests erhöht (Abbildung 1A). Die isolierten Neutrophile haben eine mittlere Reinheit von 98,7 % mit Standardabweichung (SD) von 1,10 % gemessen in 14 verschiedenen Proben aus verschiedenen Isolationen. Der durchschnittliche Anteil der roten Blutkörperchen ist 1,04 % ± 1,1 % SD und der mittlere Anteil der Monozyten 0,085 % ± 0,17 % SD (Daten nicht gezeigt). Die Gesamtfläche der gefärbten Neutrophilen abgebildet sind nur in der Brennebene in jede Vertiefung, die deutlich mit der Neutrophilen Gesamtzahl in jede Vertiefung mit einem Pearson Korrelationskoeffizient 0,99 (95 % Konfidenzintervall [CI] 0.985 0.997 korrelieren, quantifiziert p < 0,0001) (Abbildung 1 b). Das repräsentative Ergebnis der Quantifizierung der NET Bildung in Neutrophilen angeregt mit 10 % Seren von Patienten AAV oder Medium (MED) als Negativkontrolle, ausgedrückt als kumulative verschmutzten extrazelluläre DNA-Bereich mehr als 10 Z-Stapel pro abgebildeten Neutrophilen (Abbildung 1 C). Schnappschüße repräsentative Darstellungen des unstimulierte Neutrophilen (Abbildung 2A) und der Netze in AAV-stimulierten Neutrophilen (Abb. 2 b) gezeigt.
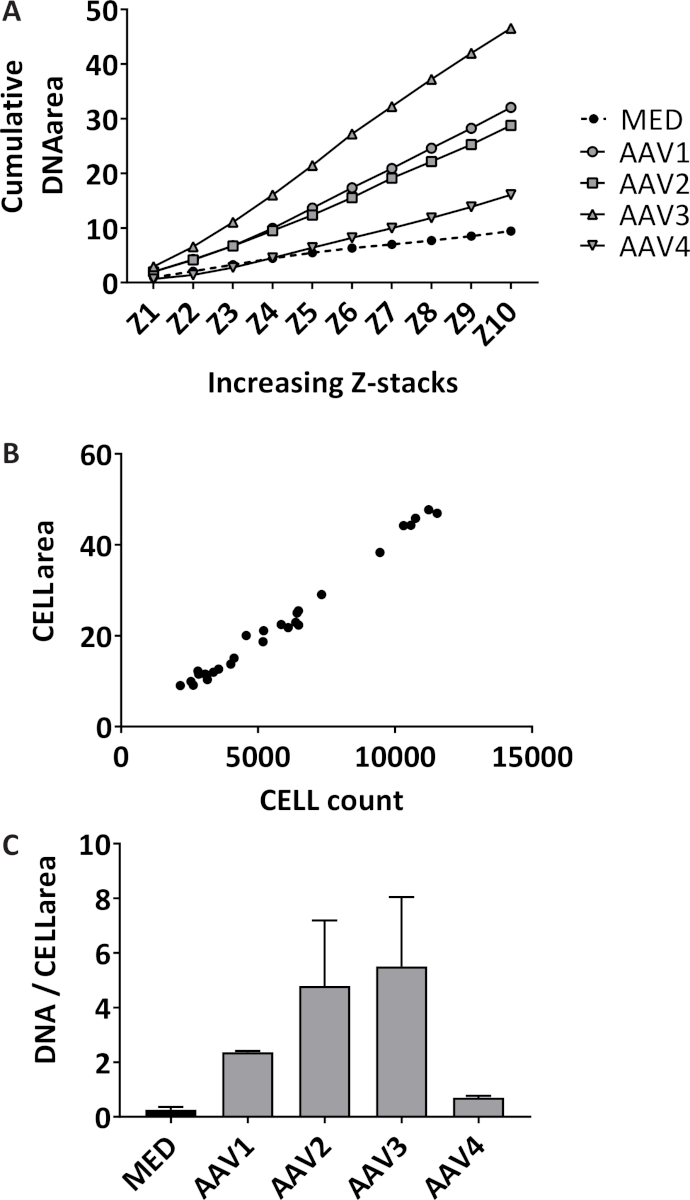
Abbildung 1: Quantifizierung der NET Bildung durch die Messung extrazellulärer DNA und Neutrophilen Graf. (A) Bereich ist kumulativ über 10 Z-Stapel quantifiziert, denn jeder gut für unstimulierte Neutrophilen (MED) und Neutrophile mit 10 % Serum von ANCA-assoziierten Vaskulitis (AAV) Patienten angeregt (n = 4) mit einem Bildbearbeitungsprogramm quantifiziert. Jeder Reiz war in dreifacher Ausführung getestet, jeder Punkt stellt den Medianwert dar. (B) rot fluoreszierende gekennzeichneten Bereich und Zelle Zellzahl wurden durch Bildbearbeitungsprogramm in der Brennebene des jedes gut quantifiziert (R2 = 0,99, p < 0,0001). (C) NET Bildung wird als kumulierte Fläche pro abgebildeten Neutrophilen (Zellbereich) ausgedrückt. Der Mittelwert ± Standardfehler des Mittelwertes (SEM) von jedem dreifacher Ausfertigung wird pro Impuls geplottet. Bitte klicken Sie hier für eine größere Version dieser Figur.
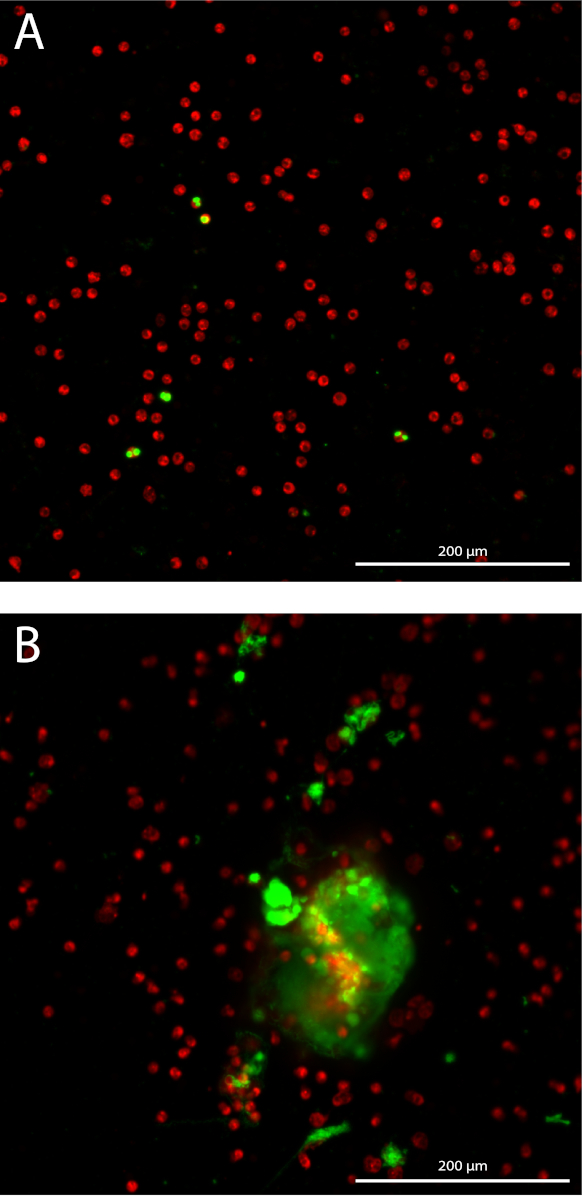
Abbildung 2: Schnappschüsse von Netto Quantifizierung Assay. Fluoreszierende gekennzeichnete Neutrophilen werden in rot angezeigt, und gefärbten extrazelluläre DNA ist in grüner Schrift angezeigt. 10 x Plan Apo Lambda Ziel. (A) unstimulierte Neutrophilen. (B) Neutrophilen mit AAV Serum stimuliert. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Der wichtigste Teil des Assays muss frisch isolierte Neutrophile für jedes Experiment zu verwenden, da Neutrophile kurzlebig sind und sterben, wenn gefroren. Dies erfordert einen gesunden Spenders jedes Mal, die einige Variationen durch Spender Merkmale implizieren könnte. Eine dieser Variationen ist den Aktivierungsstatus der Neutrophilen. Neutrophile konnte bereits in-vivo vor Isolation aktiviert werden. Darüber hinaus Neutrophilen in der Isolierung Schritte aktiviert werden können, insbesondere während der Lyse der Erythrozyten, daher ein erfahrene Handler der Neutrophilen ist erforderlich, um die Aktivierung von Neutrophilen zu minimieren. Im allgemeinen Isolierung der Neutrophilen durchgeführt werden sollte, so bald wie möglich nach Blut zeichnen und das Experiment sollte nicht angehalten werden, um übermäßige spontane Aktivierung zu vermeiden. Zweitens sollte die grobe Behandlung der Neutrophilen vermieden werden. Als solche ist der bemerkenswerten Vorteil des beschriebenen Protokolls die minimale Pipettieren Eingriffe, sobald Neutrophilen in eine 96-Well-Platte ausgesät werden. Wichtig ist, ist der Aktivierungsstatus der Neutrophilen im unstimulierte Zustand am besten beurteilen, dieser Assay empfindlich niedrige Konzentrationen von Netto Bildung erkennen kann. Ein weiterer Faktor, der den Test beeinflussen könnten ist die Verwendung des FCS im Medium. Der Anteil der FCS wurde von 10 % auf 2 % zu vermeiden, die mögliche Unterdrückung der NET Bildung durch antioxidative Aktivität19,20 oder die mögliche Aktivierung von Neutrophilen trotz Hitzeinaktivierung verringert. Kultur ohne FCS oder mit der Nutzung verschiedener Medien ist nicht versucht worden. Eine unstimulierte oder mittlere Kontrolle ist immer mitgenommen bei der Durchführung des Tests müssen einen Hinweis auf das Hintergrundsignal (z. B., Aktivierungsstatus der Neutrophilen). Fachen Anstieg für jede Anregung im Vergleich zu den unstimulierte Probe wird angezeigt, um konsistente Ergebnisse über verschiedene Experimente mit den gleichen Reiz zu erreichen.
Ein wichtiger Faktor für einen möglichen hohen Hintergrund ist der extrazelluläre DNA Färbung, die den Prozess der NET Bildung zusammenhängt. Der vorliegende Test versucht, dies durch Entfernen der extrazellulären DNA Färbung sofort nach der kurzen Inkubationszeit von 15 min und durch die Analyse der Plattenrandes direkt nach der Fixierung zu reduzieren. Daher ist es unerlässlich, eine erweiterte confocal Mikroskop zu verwenden, die genügend Geschwindigkeit und analytische Kraft, die 96-Well-Platte zu erfassen hat innerhalb 1 bis 2 h. automatische Einstellung der Belichtungszeit und konzentrieren wird empfohlen. Als solche kann die Mikroskop-Einstellung variieren zwischen jeder Probe und Experimentieren in Bezug auf die Farbe Intensität Schwelle, die für insgesamt optimale Bildqualität erforderlich ist. Die letztere Einflüsse, die die eventuelle Möglichkeit, Neutrophilen und Netze und die optimale Einstellung korrekt zu quantifizieren sollte daher mithilfe mehrerer Kontrollproben (z. B. Serum von gesunden Kontrollpersonen) bestätigt werden. Bei der Analyse der aufgenommenen Bilder ermöglicht die Verwendung von einem Pixel Schwelle und Größe Schwelle in das Auswertungsprogramm für eine bessere Auswahl der NET Bildung.
Extrazelluläre DNA abgeleitet aus NET-Formation kann unterschiedliche Tod Wege, einschließlich NETosis, Necroptosis, Pyroptosis, Ferroptosis oder sogar nicht-lytische Prozess der lebenswichtigen NET Bildung1zurückzuführen. Als solche ist eine Einschränkung des vorliegenden Tests durch Färbung nur für extrazelluläre DNA gibt es keine Differenzierung zwischen NET Bildung und andere entsprechende Zelle Tod Wege möglich. Es ist möglich, dies zu erreichen, indem entweder selektive Inhibitoren der unterschiedlichen Tod Wege zu unterscheiden zwischen den verschiedenen zugrunde liegenden NET Bildung oder durch separate Immunostainings bestätigen das Vorhandensein spezifischer NET Marker wie citH3 und NE, zusammen lokalisiert mit der DNA. Die Co Lokalisierung von extrazellulärer DNA mit citH3 und NE wurde vor kurzem für diese Probe10bestätigt. Der Vorteil, dass NET spezifische Marker in diesem Test erlaubt es, um alle Formen von Netto Bildung führt zu die Extrusion von DNA von Neutrophilen so vollständig und so objektiv wie möglich mit dem Potenzial von Hochdurchsatz-Screening zu beurteilen. Die Anwendbarkeit dieses Protokolls nachweislich an einem Studium von niedrigen Niveau NET Induktion vermittelt durch Immunkomplexe in Autoimmun-Krankheit, in dem die Fähigkeit, qualitative und quantitative Unterschiede erkennen möglicherweise wichtiger als die Art des Verfahrens mit10,21,22. Zur Veranschaulichung, dass dieser neuartige NET Quantifizierung Assay Mehrwert für verschiedene Forscher untersuchen verschiedene Aspekte des NET Bildung sein kann. Kleine Korrekturen an der Assay lassen sich einfach umsetzen: Anpassung der Stimulationsdauer, die Verwendung eines Lieblings NET Marker auf einen bestimmten Tod Weg NET Bildung konzentrieren, die Verwendung von verschiedenen Vergrößerung oder die Verwendung von verschiedenen NET Kriterien in die Quantifizierung und Analyse.
Zusammenfassend ist das Protokoll zur Verfügung gestellt einen hochsensiblen breit anwendbar-Assay für die halbautomatische Quantifizierung von Netto Bildung für die Bewertung von ex-Vivo Induktion der Netze auf verschiedene Reize.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Arbeit der Eline J. Arends und Y.K Onno Teng wird von der niederländischen Kidney Foundation (17OKG04), Clinical Fellowship von der niederländischen Organisation für wissenschaftliche Forschung (90713460) unterstützt. Laura S. van Dam Arbeit wird von der Foundation for Research in Rheumatologie (FOREUM) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Aqua Sterile H2O | B. Braun, Melsungen, Germany | 12604052 | |
| Fetal bovine serum (FCS) | Bodinco, Alkmaar, The Netherlands | Used in high concentrations it could influcence NET formation | |
| Ficoll 5.7% - amidotrizoaat 9% density 1.077 g/mL | LUMC, Leiden, The Netherlands | 97902861 | |
| Immunofluorescence confocal microscope | Image Xpress Micro Confocal (Molecular Devices, Sunnyvale, CA, USA) | ||
| Neutralization PBS (10x) | Gibco, Paisley, UK | 70011-036 | |
| Penicillin/streptomycin (p/s) | Gibco, Paisley, UK | 15070063 | |
| Phenol red free RPMI 1640 (1x) | Gibco, Paisley, UK | 11835-063 | Phenol red can interfere with the immunofluorescence signal |
| Phosphate-buffered saline (PBS) | B. Braun, Melsungen, Germany | 174628062 | |
| PKH26 2 μM Red fluorescent cell linker | Sigma Aldrich Saint-Louis, MO, USA | PKH26GL-1KT | PKH are patented fluorescent dyes and a cell labeling technology named after their discoverer Paul Karl Horan |
| Program for scientific multidimensional images analysis | ImageJ, Research Services Branch, National Institute of Mental Health, Bethesda, Maryland, USA | ||
| RPMI medium 1640 (1x) | Gibco, Paisley, UK | 52400-025 | |
| Sytox green 5 mM Impermeable DNA dye | Gibco, Paisley, UK | 57020 | |
| Trypan blue stain 0.4% | Sigma Aldrich, Germany | 17942E | |
| 96 well, black, flat bottom, tissue culture treated plate | Falcon, NY, USA | 353219 |
Referenzen
- Jorgensen, I., Rayamajhi, M., Miao, E. A. Programmed cell death as a defence against infection. Nature Reviews Immunology. 17 (3), 151-164 (2017).
- Rao, A. N., Kazzaz, N. M., Knight, J. S. Do neutrophil extracellular traps contribute to the heightened risk of thrombosis in inflammatory diseases?. World Journal of Cardiology. 7 (12), 829-842 (2015).
- Kessenbrock, K., et al. Netting neutrophils in autoimmune small-vessel vasculitis. Nature Medicine. 15 (6), 623-625 (2009).
- Garcia-Romo, G. S., et al. Netting neutrophils are major inducers of type I IFN production in pediatric systemic lupus erythematosus. Science Translational Medicine. 3 (73), 73ra20 (2011).
- Lande, R., et al. Neutrophils activate plasmacytoid dendritic cells by releasing self-DNA-peptide complexes in systemic lupus erythematosus. Science Translational Medicine. 3 (73), 73ra19 (2011).
- Meng, H., Yalavarthi, S., et al. In Vivo Role of Neutrophil Extracellular Traps in Antiphospholipid Antibody-Mediated Venous Thrombosis. Arthritis & Rheumatology. 69 (3), 655-667 (2017).
- Desai, J., et al. Particles of different sizes and shapes induce neutrophil necroptosis followed by the release of neutrophil extracellular trap-like chromatin. Scientific Reports - Nature. 7 (1), 15003 (2017).
- Desai, J., et al. PMA and crystal-induced neutrophil extracellular trap formation involves RIPK1-RIPK3-MLKL signaling. European Journal of Immunology. 46 (1), 223-229 (2016).
- Apel, F., Zychlinsky, A., Kenny, E. F. The role of neutrophil extracellular traps in rheumatic diseases. Nature Reviews Rheumatology. , (2018).
- Kraaij, T., et al. A novel method for high-throughput detection and quantification of neutrophil extracellular traps reveals ROS-independent NET release with immune complexes. Autoimmunity Reviews. 15 (6), 577-584 (2016).
- Masuda, S., et al. NETosis markers: Quest for specific, objective, and quantitative markers. Clinica Chimica Acta. 459, 89-93 (2016).
- Brinkmann, V., Goosmann, C., Kuhn, L. I., Zychlinsky, A. Automatic quantification of in vitro NET formation. Frontiers in Immunology. 3, 413 (2012).
- Nakazawa, D., et al. Enhanced formation and disordered regulation of NETs in myeloperoxidase-ANCA-associated microscopic polyangiitis. Journals of the American Society of Nephrology. 25 (5), 990-997 (2014).
- Konig, M. F., Andrade, F. A Critical Reappraisal of Neutrophil Extracellular Traps and NETosis Mimics Based on Differential Requirements for Protein Citrullination. Frontiers in Immunology. 7, 461 (2016).
- Kenny, E. F., et al. Diverse stimuli engage different neutrophil extracellular trap pathways. Elife. 6, (2017).
- Zhao, W., Fogg, D. K., Kaplan, M. J. A novel image-based quantitative method for the characterization of NETosis. Journal of Immunological Methods. 423, 104-110 (2015).
- Pilsczek, F. H., et al. A novel mechanism of rapid nuclear neutrophil extracellular trap formation in response to Staphylococcus aureus. The Journal of Immunology. 185 (12), 7413-7425 (2010).
- Tanaka, K., et al. In vivo characterization of neutrophil extracellular traps in various organs of a murine sepsis model. PLoS One. 9 (11), e111888 (2014).
- Fuchs, T. A., et al. Novel cell death program leads to neutrophil extracellular traps. Journal of Cell Biology. 176 (2), 231-241 (2007).
- von Köckritz-Blickwede, M., Chow, O., Nizet, V. Fetal calf serum contains heat-stable nucleases that degrade neutrophil extracellular traps. Blood. 114 (25), 5245-5246 (2009).
- Kraaij, T., et al. Excessive neutrophil extracellular trap formation in ANCA-associated vasculitis is independent of ANCA. Kidney International. , (2018).
- Kraaij, T., et al. The NET-effect of combining rituximab with belimumab in severe systemic lupus erythematosus. Journal of Autoimmunity. , (2018).
- Hahn, J., Schauer, C., et al. Aggregated neutrophil extracellular traps resolve inflammation by proteolysis of cytokines and chemokines and protection from antiproteases. The FASEB Journal. (Aug 21), (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten