このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
アミロイドフィブリルスによる脳ミトコンドリアの相互作用と膜透過性
要約
ここで提供されるプロトコルは、異なる組織および脳の様々な領域から分離されたミトコンドリアを有する異なるペプチドおよびタンパク質のネイティブ形態、プレフィブリル、および成熟したアミロイド線維の相互作用を調るためのプロトコルである。
要約
ミトコンドリアなどの内部膜を含む膜透過性は、神経変性疾患におけるアミロイド凝集体誘発毒性の一般的な特徴および一次機構であることを示す証拠の増加体。しかし、膜破壊のメカニズムを説明するほとんどの報告はリン脂質モデルシステムに基づいており、生体膜レベルで発生する事象を直接標的とする研究はまれである。ここで説明するアミロイド毒性のメカニズムを膜レベルで研究するためのモデルである。ミトコンドリア単離のために、密度勾配媒体は、最小限のミエリン汚染で調製物を得るために使用されます。ミトコンドリア膜完全性確認後、α-シヌクレイン、ウシインスリン、および鶏卵白リゾザイム(HEWL)から生じるアミロイド線維の相互作用をラット脳ミトコンドリアと、インビトロ生物学的モデルとして調べた。結果は、線維アセンブリを有する脳ミトコンドリアの治療が異なる程度の膜透過性およびROS含有量増強を引き起こす可能性があることを示している。これは、アミロイド線維とミトコンドリア膜との間の構造依存的相互作用を示す。アミロイド線維の生物物理学的特性とミトコンドリア膜への特異的結合は、これらの観察の一部について説明を提供してもよいことが示唆される。
概要
アミロイド関連障害は、アミロイドードとして知られており、異なる組織および器官における不溶性タンパク質沈着物の出現によって定義される疾患の大きなグループを構成する1、2。中でも、神経変性疾患は、タンパク質凝集体が中枢または末梢神経系2に現れる最も頻繁な形態である。アミロイド凝集体3の毒性に関与するメカニズムの数が提案されているが、アミロイド病理4の主なメカニズムとして細胞膜破壊および透過性を指摘する証拠の増大するボディは、 5.血漿膜に加えて、内部オルガネラ(すなわち、ミトコンドリア)も影響を受ける可能性があります。
興味深いことに、新しい証拠は、ミトコンドリア機能障害がアルツハイマー病およびパーキンソン病6、7を含む神経変性疾患の病因において重要な役割を果たしていることを示唆している。この問題に関連して、多くの報告は、ミトコンドリア8、9、10にアミロイドβ-ペプチド、α-シヌクレイン、ハンチンチン、およびALS連結変異体SOD1タンパク質の結合と蓄積を示しています。11.アミロイド凝集体による膜透過化のメカニズムは、離散チャネル(細孔)の形成または非特異的洗剤様機構5,12を介して起こると考えられている。 13.これらの結論のほとんどは、リン脂質モデルシステムに関する報告に基づいており、生体膜で起こる事象を直接標的とする研究はまれである。明らかに、これらの人工脂質二重層は、異種構造であり、多種多様なリン脂質およびタンパク質で構成されるミトコンドリアを含む生体膜の本質的特性を必ずしも反映していない。
本研究では、ラット脳から単離されたミトコンドリアをインビトロ生物学的モデルとして用い、α-シヌクレイン(アミロイド原性タンパク質として)、ウシインスリン(モデルペプチドとして)から生じるアミロイド線維の破壊効果を調べる。注射局所的アミロイドーシスに関与するヒトインスリンとの重要な構造相同性、および鶏卵白リソザイム(HEWL;アミロイド凝集の研究のための共通モデルタンパク質として)。アミロイド線維によって誘導されるミトコンドリア膜の相互作用と損傷の可能性は、ミトコンドリアマレートデヒドロゲナーゼ(MDH)(ミトコンドリアマトリックス内に位置する)およびミトコンドリア活性酸素の放出を観察することによって調べられた。種(ROS)の強化。
プロトコル
すべての動物実験は、テヘラン大学の医学の機関動物ケアと使用委員会(IACUC)に従って行われました。ギロチンブレードを研ぎ、刃の断固たる迅速な動きを適用することにより、ラットへの苦しみと有害な影響を最小限に抑えるために最大限の努力がなされました。
1. 脳の均質化とミトコンドリア分離
注:ミトコンドリア単離のためのすべての試薬は、シムズとアンダーソン14に従って調製されました。
- ミトコンドリア分離のためのバッファーの調製
- 100 mMトリス-HCl溶液を準備する:トリス-HClの0.605グラムの重量を量り、ビーカーで約40 mLの脱イオン水(DW)に溶解します。溶液を50 mLの容積フラスコに移し、DWを加えることで最終容積を50mLに増やします。
- 10 mM EDTA溶液を準備する:EDTAの0.202 gの重量を量り、ビーカーで約40 mLのDWに溶解します。溶液を50 mLの容積フラスコに移し、DWを加えることで最終容積を50mLに増やします。
注:両方の溶液は、少なくとも4週間4°Cで保存することができます。 - トリス-HCl/EDTA/スクロースストックソリューションを準備する:ビーカーに10mMトリス-HClの30 mLと10mM EDTAの30 mLを追加します。スクロースの32.86グラムの重量を量り、磁気攪拌機で攪拌しながらビーカーに追加します。スクロースが溶解したら、溶液を100mLの容積フラスコに移し、DWを加えて最終容積を100mLに増やす。
注:この溶液は、最大3日間4°Cで保存することができます。 - 絶縁バッファー(IB):約150 mLのDWに100mLのトリスHCl/EDTA/スクロースストックを追加します。0.1 M HCl を追加して pH を 7.4 に調整します DW を追加して最終体積を 300 mL に増やします。
- 1.5 mL の密度勾配媒体を 8.5 mL のコールド IB に加えて IB で 15%(v/v)密度勾配媒体を準備します。
- 10 mg/mL ウシ血清アルブミン(BSA)溶液を調製:脂肪酸フリーBSAの重量20mgを量り、2mLバイアルで約1.5mL DWに溶解する。DWを加えて最終容積を2mLに増やし、使用するまで氷の上に保管します。
注:ミトコンドリア分離の日にステップ1.1.4-1.1.6からソリューションを新たに準備し、使用するまで氷の上に保管してください。
- ラット脳の分離
注:オスラットの切断および脳除去(150-200 g)は、シムズとアンダーソン14に従って行われた。- アイスバケツに30mLビーカーを入れ、ビーカーに10mLの冷たいIBを加えます。
- 小動物のギロチンでラットを切断し、ミトコンドリア特性の悪化を制限するために、切断の1分以内に頭蓋骨から脳を取り除きます。
- 急速に冷たいIBを含むビーカーに脳を転送します。
- 脳の均質化とミトコンドリアの調製
注:ミトコンドリア画分は、シムズとアンダーソン14によって記述されたプロトコルに従って分離され、前述の15と同様にいくつかの変更を加えた。迅速に作業し、手順を通じて氷の上にすべてを保つことが重要です。- IBの30 mLで組織2xを洗浄し、冷たいIBを含むビーカーに移し、はさみで脳を細かくミンチする。
- 予冷IBの10巻(ラット脳当たりIBの約10 mL)を追加します。
- 組織懸濁液を20mLの冷たいダンスホモジナイザーに移します。
- 電動ペトルを使用して9つの上下ストロークを使用して組織片を均質化します。
注:均質化ストロークを3回セットした後、約30sの氷の上に混合物を残し、均質性が冷たく保たれるようにします。 - ホモジネートを予め冷やされた10 mL遠心管と遠心分離機に1,300x gおよび4 °Cで3分間移します。
- 慎重に上清をデカントし、10分間4°Cで21,000x gで予冷10mL遠心管と遠心分離機に移します。
- 上清を捨て、ピペットで混合物を静かに撹拌することにより、冷たい15%密度勾配媒体溶液(各脳に対して5mL)でペレットを再懸濁する。
- 低速加速(0 rpmから500rpmまで45s、通常の加速)と減速(ブレーキなし)を使用して、4°Cで30,700x gの固定角度ローターで遠心分離機を5分間使用します。これは、材料の2つの異なるバンドを生成する必要があります(図1A、左)。
- パストゥールピペットを使用して、主にミエリンを含むグラデーションの上部に蓄積された材料の鋭いバンドを削除します。次いで、バンド2で濃縮されたミトコンドリア画分を失うことなく、材料(バンド2)の上に密度勾配媒体溶液を可能な限り除去する。
注:バンド2は、シナプスと非シナプスミトコンドリアの両方が含まれています。 - ピペットで混合物を穏やかに攪拌しながら、ミトコンドリア画分にIBの8 mLを追加します。
- 4°Cで16,700x gの遠心分離機を10分間、上清を慎重に取り除き、底の緩いペレットを邪魔しないままにします。
- 遠心管に10mg/mL脂肪酸フリーBSAの1 mLを加え、ピペットの先端と穏やかに撹拌する。IB を追加することにより、脳あたり 5 mL に最終体積を増加します。.
- 10分間4°Cで6,900x gの遠心分離機を使用し、しっかりとしたペレットを生成する必要があります(図1A、右)。
- 上清をデカントし、IBでミトコンドリアペレットを穏やかに再濁し、0.5 mLチューブにアリコートし、使用するまで液体窒素中に保存します。
2. タンパク質濃度決定
注:タンパク質濃度は、Lowry et al.16の方法を用いて測定される。
- ローリーアッセイのためのソリューションの準備
- 溶液A:NaOHの0.4gとNa2CO3の2gを重み付けし、80mLのDWに溶解し、溶液を100mLの容積フラスコに移し、DWを添加して体積を100mLに増やす。
- 溶液B:水酸カリウムナトリウムの0.1gとCuSO4の0.05gを量り、DWの8 mLに溶解し、溶液を10mL体積フラスコに移し、DWを添加して体積を10mLに増やす。
注:溶液AとBの両方が最大6ヶ月間4°Cで安定したままにすることができます。 - 溶液Cを調味する:DWの7.5 mLに0.5 mLのフォリン溶液を加えます。
注:溶液Cを新鮮に準備し、使用するまで光から遠ざけてください。 - 0、20、40、60、80、100、および 120 μg/mL の最終濃度を持つ BSA 規格を、それぞれ 1 mg/mL BSA の 0、20、40、60、80、100、および 120 μL を組み合わせて、1mg/mL BSA の 1000 μL を作るのに十分な DW で調付けます。
- タンパク質濃度測定
注: 精度を高めるには、この手順を三つ三つ書きして実行します。- 標準溶液の50 μLとミトコンドリア均質を96ウェルプレートの各ウェルに加え、続いて45μLの溶液Aを添加する。次いで、50°Cに設定された温水浴で10分間プレートをインキュベートする。
- 溶液Bの5 μLを追加し、室温(RT)で暗い場合に10分間プレートをインキュベートします。
- 溶液Cの150 μLを追加し、50°Cに設定された温水浴で10分間プレートをインキュベートします。
- プレートリーダーにプレートをロードし、標準およびミトコンドリアサスペンションの吸光度値を650nmで記録します。次に、較正曲線を用いて、ミトコンドリアのタンパク質含有量を算出する。
3. ミトコンドリア膜完全性判定
注:ミトコンドリア膜の完全性は、トリトンX-100による膜破壊の前後に単離されたミトコンドリアにおけるマールト脱水素酵素(MDH)活性を測定することによって確認される。
- ミトコンドリアを冷たいIBで1mg/mLに希釈し、2本の1.5mLチューブ(通常195μLのミトコンドリア/チューブ)に入れます。
- 20%(v/v)トリトンX-100(DWで希釈)の5 μLを1つのチューブに(最大酵素活性の正の対照として)、5μLのDWを別のチューブ(対照用)に加え、その後スターラーと混合します。
- 30°Cに設定された温水浴で10分間チューブをインキュベートします。
- 固定角ローター中のチューブの遠心分離によるペレットミトコンドリアを16,000 x gおよび4°Cで15分間使用する。
- 以下のセクションに記載の標準的な分光光測定アッセイを用いてミトコンドリアMDHの活性をアッセイするための得られた上清を慎重に収集する。
- ミトコンドリア膜の完全性を次のように計算します。
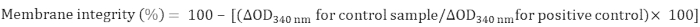
4. MDH活動決定
注:MDH活性は、Sottocasaら17によって説明されているように分光光度で測定した。
- MDH活性アッセイに対するソリューションの準備
- 50 mMトリス-HCl溶液(pH = 7.5):トリス-HClを使用してDWで7.9mg/mL溶液を調製し、1.0M NaOHで25°Cで7.5にpHを調整します。
- 50 mMオキサロ酢酸溶液を調製する:トリス-HClでオキサロ酢酸塩を使用して6.6mg/mL溶液を調製する。
注: このソリューションは、ソリューション内で一度安定していないので、使用する直前に準備する必要があります。 - 10 mM β-NADH溶液を調製する:トリス-HClでβ-NADHを用いて7.81mg/mL溶液を調製する。
- MDH 活動決定
注:1.0 mL反応混合物中の最終アッセイ濃度は、50mMトリス-HCl、5mMオキサロ酢酸塩、および0.1mM β-NADHである。- 分光光度計を25°Cと340nmに設定します。ピペット890 μLトリス-HClバッファー、オキサロ酢酸溶液の100μL、および空のキュベットおよび880 μLトリス-HClバッファーへのNADH溶液の10μL、およびサンプルキュベットにNADH溶液の10μL。
- 分光光度計でキュベットを3~4分間インキュベートし、ブランクに対する参照を行います。
- 次いで、サンプルキュベットに10μLのミトコンドリアホモジネート(1mg/mL)を加え、直ちに反転して混合し、NADH酸化による吸光度が1分間340nm低下した。
5. インビトロαシヌクレイン、ウシインスリン、HEWL線維形成
- タンパク質製剤
- α-シヌクレイン:
注:組換えα-シヌクレインの発現および精製は、いくつかの修飾を伴うHoyer et al.18によって説明されているように行われ、α-シヌクレインの純度はSDS-PAGEによって確認される。- 透析は、リン酸緩衝生理食べ物(PBS)に対して一晩精製されたα-シヌクレインを精製した。
- 275 nm19で 5600 M-1 cm-1の絶滅係数を使用してタンパク質濃度を決定します。
- アリコトタンパク質を1.5mLチューブに入れ、使用するまで-80°Cで保存します。
- 牛インスリンとHEWL:
- 牛のインスリンとHEWLの両方を提供します。
- 各タンパク質を50mMグリシンバッファーに溶解させる(pH = 1.6;HClでpHを調整)。
- 276 nm および 280 nm の 1.0 mg/mL に対して 1.0 および 2.63 の絶滅係数を使用して牛インスリンおよび HEWL 濃度を決定し、それぞれ20,21.
- α-シヌクレイン:
- アミロイド細動誘導
- アミロイド細動のためのソリューションの準備:
- チオブラビンT(ThT)バッファーを準備する:NaH2 PO4の0.3gの重量を量り、DWの80 mLに溶解し、pHを6.5に調整し、DWを加えて体積を100mLに増やす。
- ThTストック溶液(5mM)を調製する:ThTの重量を量り、ThTバッファーの1 mLに溶解し、0.22 μmのフィルターペーパーを通過し、使用するまで4°Cで光から遠ざけます。
注:この溶液は、最大4週間4°Cで保存することができます。 - ThT溶液(1 mM)を調出す:ThTストック溶液(5mM)の200 μLをThTバッファーの800 μLに追加します。
注:この解決は1週間まで4 °Cで貯えることができる。
- インビトロα-シヌクレインアミロイド線維形成:
- タンパク質溶液(200μM)のアリコート(294 μL)と6 μLのThT溶液(1mM)を1.5mLチューブに加え、撹拌します。
- サーモミキサーでチューブを37°Cでインキュベートし、800rpmで4日間一定の撹拌を行います。
- 一定の時間間隔後にインキュベートされたサンプルのアリコット(10 μL)を取り、ThTバッファーの490 μLを加え、完全に混合し、RTで5分間インキュベートします。
- 励起と発光スリット幅をそれぞれ5nmと10nmに設定し、蛍光分光光計を用いて440nmで励起し、485nmで発光してThT蛍光を測定する。
- インビトロウシインスリンアミロイド線維形成:
- タンパク質溶液(250 μM)を1.5 mLチューブに637μLを追加します。次いで、ThT溶液(1mM)の13μLを加え、続いて撹拌する。
- 透明な底付き96ウェルプレートの各ウェルに20μM ThTを含むタンパク質溶液(250μM)のアリコット(200 μL)を追加し、透明シールテープでプレートをシールします。
- 蛍光プレートリーダーにプレートをロードし、攪拌することなく57°Cでインキュベートします。
- ThT蛍光を30分間隔で測定し、励起を440nmで、発光を485nmで12時間測定します。
注:各測定の前に5sのためにプレートを振ります。
- インビトロHEWLアミロイド線維形成:
- 透明な底付き96ウェルプレートの各ウェルに20 μM ThTを含むタンパク質溶液(200μL)1mMのアリコート(200μL)を追加し、透明シールテープでプレートを密封します。
- 蛍光プレートリーダーにプレートをロードし、攪拌することなく57°Cでインキュベートします。
- ThT蛍光を2時間間隔で測定し、励起を440nmで、発光を485nmで4日間測定します。
注:3つのタンパク質すべてについて、アミロイド線維形成は原子間力顕微鏡検査によって確認される(図2B)。
- アミロイド細動のためのソリューションの準備:
6. アミロイド線維、MDH放出アッセイ、ROS測定によるミトコンドリアの治療
- アミロイド線維を用した単離されたミトコンドリアのインキュベーション
- 遠心分離機と温水浴をオンにし、それぞれ4°Cと30°Cに設定します。
- IFを用いて、ミトコンドリアを1mg/mLの最終濃度に希釈する。
- ミトコンドリア同質を含む1.5mLチューブの2シリーズを調圧します(MDH放出アッセイ用シリーズとミトコンドリアROS測定用の1シリーズ)。
- α-シヌクレイン、ウシインスリン、またはHEWLの新鮮またはアミロイド線維のアリコートを追加します(最終濃度5μM、10 μM、20 μM、および25 μM;コントロールとしてPBSまたはグリシンバッファーを使用)ミトコンドリアホモゲネート(最終容積=200μL)(表1参照) と、表3)に続いて、ピペットで溶液を静かに撹拌する。
注:MDH放出アッセイでは、最大酵素放出の陽性対照としてトリトンX-100(最終濃度0.5%[v/v])を使用してください。 - ミトコンドリア懸濁液を含むチューブを温水浴で30°Cに30分間インキュベートします。
- セクション 6.2 および 6.3 で概説されているように、ミトコンドリア MDH リリースと ROS コンテンツを測定します。
- ミトコンドリアMDHリリースアッセイ
- インキュベートされたミトコンドリア均質を15分間16,000 x gで遠心分離し、次いで、セクション4に記載されているようにミトコンドリアMDHの活性をアッセイするための得られた上清を慎重に収集する。
- MDHの放出を最大効果(トリトンX-100)の一部として以下のように計算します。
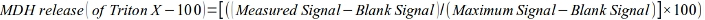
- ミトコンドリアROS測定
注:ミトコンドリアROS含有量は、酸化感受性フッ素前駆体ジヒドロジクロロカルボクシフルオレセインジアセチン(DCFDA)22と共に決定される。- ミトコンドリアROS測定のためのソリューションを準備します。メタノールに溶解して50μM DCFDA溶液を調作し(新鮮な調液)とDWに溶解して200mMのコハク酸溶液を調出します。
- ピペット191 μLのインキュベートミトコンドリア均質化を96ウェルプレートの各ウェルに加え、50μM DCFDAの4μL(1μM最終濃度)と200mMコハク酸の5μL(5mM最終濃度)を加えます。
- 30°Cに設定された温水浴で30分間プレートをインキュベートし、穏やかに撹拌します。
- 蛍光プレートリーダーにプレートをロードし、蛍光強度を測定し、励起を485nmで、発光を530nmで測定します。
7. 統計分析
- トリプリケートアッセイで少なくとも2倍または3倍のすべての実験を行い、適切な統計試験を実施します。ここで、結果は平均±SDとして提示され、学生の対対t検定を用いて統計的有意性を計算した。0.01 および 0.05 未満の P 値は統計的に有意と見なされました (*p < 0.05; **p < 0.01)。
結果
このプロトコルは、インビトロ生物学的モデルとしてラット脳ミトコンドリアとのアミロイド線維の相互作用を研究するためのモデルを記述する。ミトコンドリア調製に関しては、15%(v/v)密度勾配培地を用いて、脳組織14の主要な汚染としてミエリンを除去した。図1Aに示すように、30,700 x gの遠心分離は、ミエリン(バ...
ディスカッション
豊富な実験結果は、フィブリル凝集体の細胞毒性が生体膜4、5と相互作用し透過する能力と有意に関連しているという仮説を支持する。しかし、データのほとんどは、リン脂質およびタンパク質の多種多様な異種構造である生体膜の本質的特性を必ずしも反映しない人工脂質二層層に基づいています。ここで、脳ミトコンドリアをインビトロ生体膜...
開示事項
著者は何も開示していない。
謝辞
この研究は、イランのザンジャン基礎科学研究所(IASBS)の助成を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 2′,7′-Dichlorodihydrofluorescein diacetate | Sigma | 35845 | |
| Ammonium sulfate | Merck | 1012171000 | |
| Black 96-well plate | Corning | ||
| Black Clear-bottomed 96-well plate | Corning | ||
| Bovine insulin | Sigma | I6634 | |
| Bovine Serum Albumin (BSA) | Sigma | A2153 | |
| BSA essentially fatty acid-free | Sigma | A6003 | |
| Centrifuge | Sigma | ||
| Crystal clear sealing tape | Corning | ||
| CuSO4 | Sigma | 451657 | |
| Dialysis bag (cut off 2 KDa) | Sigma | D2272 | |
| Dounce homogenizer | Potter Elvehjem | ||
| EDTA | Sigma | E9884 | |
| Fluorescence plate reader | BioTek | ||
| Fluorescence spectrophotometer | Cary Eclipse VARIAN | ||
| Folin | Merck | F9252 | |
| Glycine | Sigma | G7126 | |
| Guillotine | Made in Iran | ||
| HCl | Merck | H1758 | |
| Hen Egg White Lysozyme (HEWL) | Sigma | L6876 | |
| Na2CO3 | Sigma | S7795 | |
| NaH2PO4 | Sigma | S7907 | |
| NaOH | Merck | S8045 | |
| Oxaloacetate | Sigma | O4126 | |
| Percoll | GE Healthcare | ||
| Phosphate Buffer Saline (PBS) | Sigma | CS0030 | |
| PMSF | Sigma | P7626 | |
| Potassium sodium tartrate | Sigma | 217255 | |
| Quartz cuvette | Sigma | ||
| Spectrophotometer | analytik jena | SPEKOL 2000 model | |
| Succinate | Sigma | S2378 | |
| Sucrose | Merck | 1076871000 | |
| Thermomixer | Eppendorph | ||
| Thioflavin T | Sigma | T3516 | |
| Tris-HCl | Merck | 1082191000 | |
| Triton X-100 | Sigma | T9284 | |
| Tryptone | QUELAB | ||
| Water bath | Memmert | ||
| Yeast Extract | QUELAB | ||
| β-NADH | Sigma | N8129 |
参考文献
- Merlini, G., Bellotti, V. Molecular mechanisms of amyloidosis. New England Journal of Medicine. 349, 583-596 (2003).
- Berg, I. . Modeling amyloid disease in Drosophila melanogaster, Linköping Studies in Science and Technology Dissertation No. 1320. , (2010).
- Kagan, B. L., Uversky, V. N., Fink, A. L. Protein aggregation, ion channel formation, and membrane damage. Protein Misfolding, Aggregation, and Conformational Diseases. , 223-236 (2006).
- Demuro, A., et al. Calcium dysregulation and membrane disruption as a ubiquitous neurotoxic mechanism of soluble amyloid oligomers. The Journal of Biological Chemistry. 280, 17294-17300 (2005).
- Kayed, R., et al. Permeabilization of lipid bilayers is a common conformation-dependent activity of soluble amyloid oligomers in protein misfolding diseases. The Journal of Biological Chemistry. 279, 46363-46366 (2004).
- Manczak, M., Park, B. S., Jung, Y., Reddy, P. H. Differential expression of oxidative phosphorylation genes in patients with Alzheimer's disease: implications for early mitochondrial dysfunction and oxidative damage. Neuromolecular Medicine. 5, 147-162 (2004).
- Vila, M., Ramonet, D., Perier, C. Mitochondrial alterations in Parkinson's disease: new clues. Journal of Neurochemistry. 107, 317-328 (2008).
- Petersen, C. A. H., et al. The amyloid β-peptide is imported into mitochondria via the TOM import machinery and localized to mitochondrial cristae. Proceedings of the National Academy of Sciences of the United States of America. 105, 13145-13150 (2008).
- Devi, L., Raghavendran, V., Prabhu, B. M., Avadhani, N. G., Anandatheerthavarada, H. K. Mitochondrial import and accumulation of α-synuclein impair complex I in human dopaminergic neuronal cultures and Parkinson disease brain. The Journal of Biological Chemistry. 283, 9089-9100 (2008).
- Costa, V., Scorrano, L. Shaping the role of mitochondria in the pathogenesis of Huntington's disease. EMBO Journal. 31, 1853-1864 (2012).
- Vande Velde, C., Miller, T. M., Cashman, N. R., Cleveland, D. W. Selective association of misfolded ALS-linked mutant SOD1 with the cytoplasmic face of mitochondria. Proceedings of the National Academy of Sciences of the United States of America. 105, 4022-4027 (2008).
- Kagan, B. L., Azimov, R., Azimova, R. Amyloid peptide channels. The Journal of Membrane Biology. 202, 1-10 (2004).
- Lashuel, H. A., Hartley, D., Petre, B. M., Walz, T., Lansbury, P. T. Neurodegenerative disease: amyloid pores from pathogenic mutations. Nature. 418, 291 (2002).
- Sims, N. R., Anderson, M. F. Isolation of mitochondria from rat brain using Percoll density gradient centrifugation. Nature Protocols. 3, 1228-1239 (2008).
- Ghobeh, M., et al. Interaction of Aβ (25-35) Fibrillation Products with Mitochondria: Effect of Small-Molecule Natural Products. Peptide Science. 102, 473-486 (2014).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the folin phenol reagent. The Journal of Biological Chemistry. 193, 265-275 (1951).
- Sottocasa, G. L., Kuylenstierna, B., Ernester, L., Bergstrand, A. Separation and some enzymatic properties of the inner and outer membrane of rat liver mitochondria. Methods in Enzymology. 10, 448-463 (1967).
- Hoyer, W., et al. Dependence of a-Synuclein Aggregate Morphology on Solution Conditions. Journal of Molecular Biology. 322, 383-393 (2002).
- Weinreb, P. H., et al. NACP, a protein implicated in Alzheimer's disease and learning, is natively unfolded. Biochemistry. 35, 13709-13715 (1996).
- Porter, R. R. Partition chromatography of insulin and other proteins. The Biochemical Journal. 53, 320-328 (1953).
- Goldberg, M. E., Rudolph, R., Jaenicke, R. A kinetic study of the competition between renaturation and aggregation during the refolding of denatured reduced egg white lysozyme. Biochemistry. 30, 2790-2797 (1991).
- Young, T. A., Cunningham, C. C., Bailey, S. M. Reactive oxygen species production by the mitochondrial respiratory chain in isolated rat hepatocytes and liver mitochondria: studies using myxothiazol. Archives of Biochemistry and Biophysics. 405, 65-72 (2002).
- Meratan, A. A., Ghasemi, A., Nemat-Gorgani, M. Membrane integrity and amyloid cytotoxicity: a model study involving mitochondria and lysozyme fibrillation products. Journal of Molecular Biology. 409, 826-838 (2011).
- Katebi, B., Mahdavimehr, M., Meratan, A. A., Ghasemi, A., Nemat-Gorgani, M. Protective effects of silibinin on insulin amyloid fibrillation, cytotoxicity and mitochondrial membrane damage. Archives of Biochemistry and Biophysics. 659, 22-32 (2018).
- Fink, A. L. The aggregation and fibrillation of alpha-synuclein. Accounts of Chemical Research. 39, 628-634 (2006).
- Diraviyam, K., Stahelin, R. V., Cho, W., Murray, D. Computer modeling of the membrane interaction of FYVE domains. Journal of Molecular Biology. 328, 721-736 (2003).
- Van Rooijen, B. D., Claessens, M., Subramaniam, V. Lipid bilayer disruption by oligomeric α-synuclein depends on bilayer charge and accessibility of the hydrophobic core. Biochimica et Biophysica Acta. 1788, 1271-1278 (2009).
- Kourie, J. I., Henry, C. L. Ion channel formation and membrane-linked pathologies of misfolded hydrophobic proteins: the role of dangerous unchaperoned molecules. Clinical and Experimental Pharmacology & Physiology. 29, 741-753 (2002).
- Bucciantini, M., et al. Inherent toxicity of aggregates implies a common mechanism for protein misfolding diseases. Nature. 416, 507-511 (2002).
- Bolognesi, B., et al. ANS binding reveals common features of cytotoxic amyloid species. ACS Chemical Biology. 5, 735-740 (2010).
- Posse, E., De Arcuri, B. F., Morero, R. D. Lysozyme interactions with phospholipid vesicles: relationships with fusion and release of aqueous content. Biochimica et Biophysica Acta. 1193, 101-106 (1994).
- Roqanian, S., et al. Polyphenols protect mitochondrial membrane against permeabilization induced by HEWL oligomers: possible mechanism of action. International Journal of Biological Macromolecules. 103, 709-720 (2017).
- Ulmer, T. S., Bax, A., Cole, N. B., Nussbaum, R. L. Structure and dynamics of micelle-bound human alphasynuclein. The Journal of Biological Chemistry. 280, 9595-9603 (2005).
- Stockl, M., Fischer, P., Wanker, E., Herrmann, A. Alpha-synuclein selectively binds to anionic phospholipids embedded in liquid-disordered domains. Journal of Molecular Biology. 375, 1394-1404 (2008).
- Devi, L., et al. Mitochondrial import and accumulation of α-synuclein impair complex I in human dopaminergic neuronal cultures and Parkinson disease brain. The Journal of Biological Chemistry. 283, 9089-9100 (2008).
- Ghio, S., Kamp, F., Cauchi, R., Giese, A., Vassallo, N. Interaction of α-synuclein with biomembranes in Parkinson's disease-role of cardiolipin. Progress in Lipid Research. 61, 73-82 (2016).
- Petersen, C. A. H., et al. The amyloid β-peptide is imported into mitochondria via the TOM import machinery and localized to mitochondrial cristae. Proceedings of National Academy of Sciences of the United States of America. 105, 13145-13150 (2008).
- Costa, V., Scorrano, L. Shaping the role of mitochondria in the pathogenesis of Huntington's disease. EMBO Journal. 31, 1853-1864 (2012).
- Vande Velde, C., Miller, T. M., Cashman, N. R., Cleveland, D. W. Selective association of misfolded ALS-linked mutant SOD1 with the cytoplasmic face of mitochondria. Proceedings of National Academy of Sciences of the United States of America. 105, 4022-4027 (2008).
- Oladzad Abbasabadi, A., et al. Disruption of mitochondrial membrane integrity induced by amyloid aggregates arising from variants of SOD1. International Journal of Biological Macromolecules. 61, 212-217 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved