Method Article
Affinity Kromatografi Reçiyatlarının Hızlı Gelişimi İçin Aktif Çapraz Bağlantılı Agarose - Örnek Olay Olarak Antikor Yakalama
Bu Makalede
Özet
Bu prosedürde, Bir DsRed tabanlı epitop ligand protein A alternatif olarak, ham bitki özleri veya hücre kültürü supernatants monoklonal antikorların yakalanması için son derece seçici afinite reçine üretmek için immobilize edilir.
Özet
Monoklonal antikorların (mAbs) saflaştırılması genellikle protein A affinity kromatografisi ile elde edilir, bu da genel proses maliyetlerinin %25'ini karşılayabilir. Alternatif, uygun maliyetli yakalama adımları bu nedenle, tek bir mAb büyük miktarlarda üretilen endüstriyel ölçekli üretim için değerlidir. Burada, Protein A kullanmadan, HIV nötralize edici antikor 2F5'in ham bitki özlerinden seçici olarak yakalanmasına olanak tanıyan çapraz bağlantılı agarose reçine DsRed tabanlı epitop ligand'ın immobilizasyonu için bir yöntem salıyoruz. Lineer epitop ELDKWA ilk olarak genetik olarak floresan protein DsRed ile kaynaşmış ve füzyon proteini transgenik tütün(Nicotiana tabacum)bitkilerinde immobilize metal-iyon afinite kromatografisi ile saflaştırmadan önce ifade edilmiştir. Ayrıca, aktif çapraz bağlı agarose dayalı bir yöntem yüksek ligand yoğunluğu, verimli bağlantı ve düşük maliyetler için optimize edilmiştir. PH ve tampon bileşimi ve çözünür ligand konsantrasyonu, deneylerin tasarımı yaklaşımı kullanılarak geliştirilmiş olan bağlantı işlemi sırasında ki en önemli parametrelerdi. Ortaya çıkan afinite reşin seçici bir ham bitki ekstresi hedef mAb bağlamak için yeteneği için test edildi ve elüsyon tampon yüksek mAb kurtarma, ürün aktivitesi ve yakınlık reşin istikrar için optimize edilmiştir. Bu yöntem doğrusal epitopslarla diğer antikorlara kolayca adapte edilebilir. Yeni reçinler Protein A'dan daha nazik elüsyon koşullarına izin verir ve aynı zamanda mAb üretimi için ilk yakalama adımının maliyetini azaltabilir.
Giriş
Biyofarmasötik ürünler tıbbın hemen hemen her dalında hastalıklarıngeniş bir yelpazede tedavisi için önemlidir 1. Monoklonal antikorlar (mAbs) biyofarmasötik pazarına hakim, dünya çapında satış 20202yılında yaklaşık 110 milyar € ulaşması bekleniyor. mAbs için tercih edilen ifade platformu Çin hamster over hücre hatları, genellikle kültür supernatant3,410 g'L-1 kadar yüksek mAb titreleri üretmek vardır. Ancak, memeli hücre kültürlerinde mAbs üretimi orta yüksek maliyet ve steril fermantasyonihtiyacı nedeniyle pahalı 5. Bitkiler gibi alternatif ifade platformları potansiyel endüstriyel üretim için daha hızlı, basit, daha az pahalı ve daha ölçeklenebilir bir yaklaşım sunuyoruz6,7.
Memeli hücre kültürleri ile ilgili maliyetlere ek olarak, protein a a affinity kromatografisinin ürün yakalamada yaygın kullanımı, mAbs'lerin endüstriyel üretimi için önemli bir maliyet itici gücüdür. Protein A doğal Staphylococcus aureus hücrelerinin yüzeyinde bulunan ve bazı murine ve insan antikorlarının parça kristalize (Fc) bölgeye bağlanır, bu nedenle mizahi bağışıklık sistemi kaçınmak için bir savunma mekanizması olarak hareket8. Protein A hücre kültürü supernatants mAbs yakalamak için sanayi altın standart haline gelmiştir ve aynı zamanda yaygın olarak araştırma topluluğu tarafından son derece seçici olduğu için kullanılır, genellikle tek bir adımda ~ 95% mAb saflıkları elde8. Beklendiği gibi, son yirmi yılda Protein A satışları yakından mAbs satış yansıtmıştır8. Üretim ölçeğine bağlı olarak, Protein A'nın maliyeti toplam proses maliyetlerinin %25'inden fazlasına karşılık gelebilir ve bu nedenle 2.000 € g-15,9€'yakadar olabilir terapötik mAbs, piyasa fiyatını etkileyebilir. Bu nedenle, benzer bir arıtma performansına sahip alternatif kromatografi reçinejleri üretim maliyetlerini önemli ölçüde düşürme potansiyeline sahiptir, bu da antikor bazlı tedavileri daha fazla sayıda hasta için erişilebilir hale getirir10,11 ,12. Bu tür alternatifler, düşük pH'daki sert elüsyon koşulları da dahil olmak üzere Protein A kromatografisinin dezavantajlarını da aşabilir (tipik olarak <3.5) mAbs'nin agregasyonu teşvik eden konformasyonel değişikliklere uğramasına neden olabilir13 . Daha da önemlisi, Protein A sadece belirli IgG alt sınıflarının Fc bölgesi için seçicidir, bu nedenle kesilen bağlayıcı etki alanları olan işlevsel olmayan moleküller bozulmamış ürün5ile birlikte arındırılabilir, oysa mAb tek zincirli değişken parçaları gibi türeyen Protein A'ya hiç bağlanmaz.
Burada, doğrusal epitop ELDKWA (bir harf amino asit kodu)5,14kullanarak HIV nötralize mAb 2F5 yakalamak için alternatif bir yakınlık kromatografi reçine açıklar. 2F5 epitopunu, taşıyıcı ve muhabir molekül olarak işlev gören floresan protein DsRed'in C-terminusuna genetik olarak erittin ve transgenik tütünde Ortaya çıkan DsRed-2F5-Epitop (DFE) proteinini ürettik ( Nicotiana tabacum) bitkiler. DFE tek adımlı immobilize metal-iyon afinite kromatografisi (IMAC) ile saflaştırılmıştı. Saflaştırılmış DFE afinite ligand bir çapraz bağlı agarose resin üzerine immobilizasyon n-hidroksisuccinimid kullanılarak kimyasal kaplin elde edildi (NHS)-aktive çapraz bağlı agarose sütunlar. İstatistiksel deneysel tasarımlar daha sonra immobilizasyon prosedürü ve kaplin verimliliği optimize etmek için kullanılmıştır15. mAb 2F5 için arınma stratejisi antikor saflığı, verim ve ligand stabilitesi açısından değerlendirilmiştir. Fc bölgesini bağlayan Protein A'nın aksine, DFE 2F5'in tamamlayıcılık belirleyici bölgesine bağlı karak, moleküllerin sağlam bir paratopla arınmasını sağlar. Konseptimiz herhangi bir mAb'ye doğrusal epitop ile veya mikrodizi çalışmaları ile kolayca tespit edilebilen diğer peptid bazlı afinite ligandlara kolayca adapte edilebilir16.
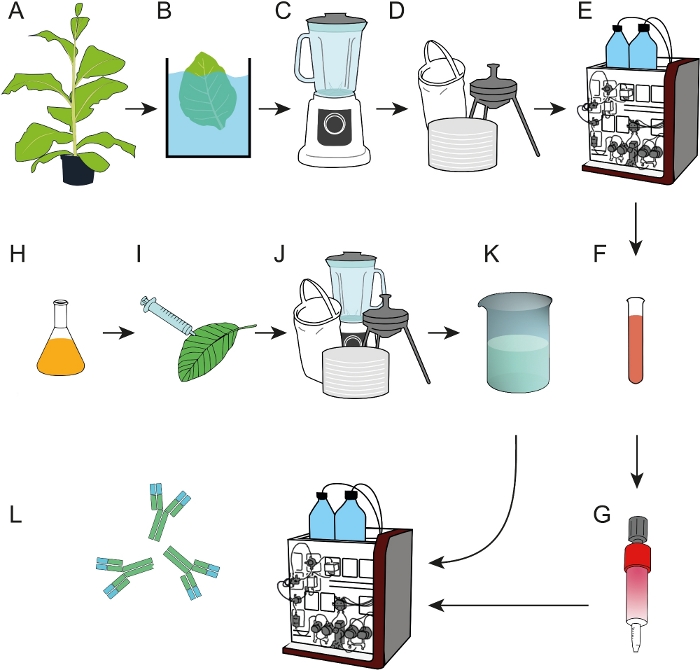
Şekil 1: Ham bitki özlerinden veya hücre kültürü süpernatantlarından mAbs yakalama için kullanılabilecek epitop afinite reçinelerinin hazırlanması için proses akış şeması. (A) Transgenik tütün bitkilerinde ligand DFE yakınlığı ifade edilebistir. Hasat edilenyapraklar homojenize edilmeden önce bir ısı yağış adımı (B) dahil edilmiştir (C). (D) Ham bitki özü torba filtrasyon, derinlik filtrasyon ve 0,2 μm steril filtrasyon ile açıklığa kavuşturulmuştur. (E) DFE daha sonra IMAC tarafından arındırıldı. (F, G) Saflaştırılmış DFE yakınlık ligand EDC / NHS-aktif çapraz bağlı agarose sütunlar üzerinde immobilize edildi. (H) T-DNA kodlayıcı antikor 2F5 taşıyan bakteri kültürleri, fitotronda yetişen N. benthamiana bitkilerindegeçiciifade için kullanılmıştır. (J) N. benthamiana yaprakları hasat edildi ve D. (K) mAb 2F5'te açıklandığı gibi işlendi, DFE yakınlık sütunları (L) kullanılarak açıklık ekstresinden arındırıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
1. Transgenik Tütün Bitkileri yetiştirmek
NOT: DFE füzyon proteintasarımı ve transgenik bitkilerin üretimi başka bir yerde açıklanmıştır5,17.
- Topraktaki transgenik tütün fidelerini çimleştirin. Bitkileri 1,0 g· ile sulamak L-1 gübre çözeltisi. Bitkilerin ~0,04 m çapa ulaştıklarında tek, 100 mm x 100 mm x 60 mm (uzunluk, genişlik, yükseklik) kaplara aktarın.
- 16-h fotoperi (25/22 °C ışık/karanlık sıcaklık rejimi) ile bir serada transgenik tütün bitkileri yetiştirmek, 70% bağıl nem ve otomatik gübreleme ile 1.0 g· L-1 gübre çözeltisi her saat 15 dk.
- 7 hafta sonra, bitki kök tabanında dört cotyledon yaprakları dışında tüm yaprakları hasat. Hasat edilen yaprakları aşağıda açıklandığı gibi hemen işleme.
2. Konak Hücre Proteinlerinin Isı Yağışı
- Paslanmaz çelik ısıtmalı kapta (0,3 m x 0,3 m x 0,3 m) 20 L çalışma hacmine sahip bir su banyosu ayarlayın. Başlangıçta, 5 L dk-1akışı ile sıvı kalıcı olarak ajite su banyosu bir manyetik pompa yerleştirin. Sıcaklık kontrolü için su banyosuna ayarlanabilir bir termostat monte edin (adım 2.4 ve 2.8).
DİkKAT: 2.10'a kadar olan tüm aşağıdaki adımlar sıcak sıvının işlenmesini içerir. Termal yalıtımlı eldiven ler ve gözlükler de dahil olmak üzere uygun kişisel koruyucu ekipman giyin. - Su banyosuna 15 L deiyonize su ekleyin ve sıvıyı 70 °C'ye ısıtın.
- Manyetik bir karıştırıcı üzerine 5 L deiyonize su dolu 10 L kova yerleştirin. 120 mM'lik son konsantrasyona sodyum fosfat ekleyin. 10 M hidroklorik asit kullanarak pH'ı 8,14'e ayarlayın. Tüm bileşenler çözündüğünde, elde edilen konsantre beyazlatma tamponunu (5 L) 2.2 adımdan su banyosuna ekleyin.
- Sıcaklık 70 °C'ye ulaşana kadar su banyosunu çalkalayın. Gerekirse pH'ı 8,14'e ayarlamak için 10 M hidroklorik asit kullanın. Gerekli sıcaklık ve pH'a ulaşıldıktan sonra en az 15 dakika boyunca ajitasyona devam edin ve tüm montajın termal dengede olduğundan emin olun.
- ~17 °C sıcaklıkta deiyonize su ile doldurulmuş 20 L kova (0,3 m x 0,3 m x 0,3 m) hazırlayın (adım 2.9 için gereklidir).
- Adım 1.3 hasat tütün yaprakları 400 g aliquots hazırlayın. Delikli sepete bir aliquot yerleştirin (0,2 m x 0,2 m x 0,2 m; gözenek genişliği en az 0,02 m x 0,02 m). Sepetin bitki malzemesi yle aşırı doldurulmasını veya dokuya zarar vermemek için yaprakları çok sıkı bir şekilde paketlemekten kaçının.
- 2.4 adımdan itibaren sepeti sıcak beyazlatma tamponuna batırın ve tüm yaprakların sıvı yüzeyin altında kaldığından emin olun. Gerekirse yüzey altında yaprakları tutmak için bir termokararlı silikon kaşık kullanın.
- Pompa hala sıvı ajitasyon ise tütün beyazlatma sıvısı 1,5 dakika için bırakır kuluçka. Tüm kuluçka dönemi boyunca sıvı sıcaklığını izleyin. Tütün yaprakları ile pompa girişi engelleme kaçının.
- 30 s. Soğuk su ile dolu kova sepeti aktarın (adım 2.5) ve 30 s. için yaprakları batırmak için 30 s. Le gelen artık su boşaltmak için yaprakları beyazlatma tampon ve drenaj artık tampon dan tütün yaprakları sepeti çıkarın homojenizasyondan önce 30 s aves (adım 3).
- 2,6'dan 2,9'a kadar taze aliquots ile tüm hasat biyokütle işlenir kadar adımları tekrarlayın. Su banyosundaki blanching tamponunun pH'sını ve sıcaklığını sürekli olarak izleyin ve ayarlayın.
NOT: Blanched bitki malzemesi tüm biyokütle işlemek için birkaç beyazlatma döngüleri gerektiğinde 30 dakika kadar buz üzerinde saklanabilir. Blanched yaprakları da vakum mühürlü torbalarda saklanabilir -80 °C en az 3 hafta. Ancak, uzun süreli depolama DFE verimini azaltabileceğinden hemen işlenmesi önerilir.
3. Protein Ekstraksiyonu ve Açıklama
DİkKAT: Aşağıdaki adımlar, dönen bıçakları ile bir blender içerir. Motor ünitesine güç verdiğinde veya monte edildiğinde blender kabında çalışmayın.
- Blender kabına 150 g (ıslak kütle) beyazlatılmış tütün yaprağı (adım 2.9) yerleştirin ve 450 mL ekstraksiyon tamponu ekleyin (50 mM sodyum fosfat, 500 mM sodyum klorür, 10 mM sodyum disülfür, pH 7.5). Bitki materyalinin veya tamponun dökülmesini önlemek için blender kapağını sıkıca kapatın.
- 30 s için 3x için yaprakları homojeize, her darbe arasında 30 s tatili ile. Tüm yaprakların homojen olduğundan ve hiçbirinin blender kabının üstüne yapışmadığından emin olun. Gerekirse, tatili sırasında blender açın ve temiz bir silikon kaşık kullanarak, kabın üst kısmında sopa yaprakları aşağı itin.
- Homojenizasyondan sonra, sonraki analiziçin homojenin 1.0 mL numunesini alın (adım 7).
- Homojeni yeterli büyüklükte bir kapta toplayın (örn. toplam biyokütle 1,0 kg ile çalışıyorsanız, en az 5 L kapasiteli bir kap kullanın). 3.1 ile 3.3 adımlarını tüm beyazlatılmış biyokütle homojenleşene kadar tekrarlayın.
- Bir filtre yuvasına bir torba filtresi yerleştirin ve montajın altına yeterli büyüklükte başka bir kap yerleştirin (bkz. 3.4). Homojeni torba filtresine ~0,15 L dk-1oranında uygulayın. Sonraki analiz (adım 7) için her litreden sonra çanta filtrasyon örneklerini alın ve bir türbidimetre veya benzeri bir cihaz kullanarak ekstraksiyon tampon 1:10 seyreltme olarak çanta filtrate havuzunun bulanıklık ölçmek.
- Ayrıca 0.02 m2 k700 (üst) ve KS50 (alt) derinlik filtre katmanı kombinasyonu çanta filtrate havuzu litre başına kullanarak çanta filtrat havuzu açıklığa kavuşturmak. Maksimum 0,2 MPa basınca kadar 3,0 L min-1·m-2 akış hızı uygulayın. Daha sonra daha önce açıklandığı gibi 0,2 μm steril filtre ile açıklık filtrat geçirerek artık parçacıkları kaldırmak5.
4. DFE Affinity Ligand saflaştırma
- Elütion tamponu (10 mM sodyum fosfat, 300 mM imidazol, pH 7.4), yıkama tamponu (10 mM sodyum fosfat, pH 7.4) ve equilibration tampon (20 mM sodyum fosfat, 500 mM sodyum klorür, pH 7.4) ile kızartarak hızlı protein sıvı kromatografi sistemi hazırlayın. Yaprak biyokütlesinin kilogramı başına ~50 mL şelat çapraz bağlı agarose reçine içeren bir sütun monte edin (~2.5 L derinlik filtrat).
- 200 mM nikel sülfat çözeltisi 5 kolon hacmi (CV) uygulayarak koloni nikel iyonları ile şarj edin ve 5 CV elüsyon tamponu ile yıkayın. 50 cm h-1 akış hızı kullanın ve sonraki tüm kromatografi adımları için UV sinyallerini 260, 280 ve 558 nm'de izleyin.
- Sütunu 10 CV'lik denge arabelleği ile dengeleyin. Daha sonra, açıklığa kavuşturulmuş bitki ekstresinin 50 CV'sini (3.6 adımdan) şartlı sütuna yükleyin.
- Sütunu 10 CV yıkama tamponu ile yıkayın. 5 CV elüsyon tamponu ile DFE füzyon proteinini yakınve 280 nm ve 558 nm'deki UV sinyalleri taban çizgisinin üzerinde 5 mAU'dan fazla arttıktan sonra ürün içeren fraksiyonu toplayın.
- Toplam çözünür protein (TSP) konsantrasyonu (adım 7.1), DFE konsantrasyonu (adım 7.2 ve 7.3) ve DFE saflığını (adım 7.4) ölçmek için elüsyon fraksiyonundan 0,2 mL numune alın.
- Kromatografi sistemine ~50 mL çapraz bağlı dekstran reçine içeren bir kolon monte edin. Kolonu 5 CV bağlantı tamponu (200 mM HEPES, 500 mM sodyum klorür, pH 8,5) ile dengeleyin. Tampon değişimi için DFE elüsyon fraksiyonunun 10 mL'sini (adım 4.4) enjekte edin ve UV emiciliğini 280 ve 558 nm'de izleyin.
- 280 nm ve 558 nm'deki UV sinyalleri taban çizgisinin üzerinde 5 mAU'dan fazla bir artış yaptıktan sonra DFE içeren fraksiyonu toplayın. 0,2 mL numune alın ve TSP konsantrasyonu, DFE konsantrasyonu ve DFE saflığını belirleyin (adım 7).
- Saflaştırılmış DFE örneğini (adım 4.7'den 15 g L -1'e, 3.000 x g'de 4 °C'de 30 dk'da bir santrifüjde santrifüjde bir santrifüj de santrifüj lüzumlu bir konsantratör tüp kullanarak 15 g L-1'e yoğunlaştırın. Kaplin reaksiyonuna devam edin (adım 5).
NOT: Konsantrasyon veya kaplin adımları hemen gerçekleştirilemiyorsa DFE çözeltisini 4 °C'de saklayın.
5. Aktive Çapraz bağlı Agarose Resin dfe kaplin
NOT: Bağlantı için tüm ekipman ve çözümler hazır olana kadar NHS tarafından etkinleştirilen kolonlar için kullanılan izopropanol'ü değiştirmeyin. Sütunların kurumasına asla izin vermeyin.
- DFE'nin aktif rezorna bağlantısını pH, tampon bileşimi ve DFE konsantrasyonu ile optimize etmek için bir deneme (DoE) modeli tasarla. DoE yönteminin ayrıntıları başkabir yerde 15 açıklanmıştır.
- Afinite ligand çözeltisini (adım 4.8'den) 0.5-15 g· konsantrasyon aralığında hazırlayın. L-1 veya DoE'da tanımlandığı gibi ve kaplin reaksiyonu hazır olana kadar buzüzerinde saklayın (adım 5.5). En az on 2 mL şırıngayı DFE çözeltisi ile doldurun ve şırıngaları 1,0 mL yatak hacmine sahip NHS tarafından etkinleştirilen çapraz bağlantılı agarose sütunlara monte etmek için bir adaptör hazırlayın.
- Bağlantı için kullanılan her 10 kolon için 30 mL deaktivasyon çözeltisi (0,5 M etanolin, 0,5 M sodyum klorür, pH 8,3), 30 mL düşük pH çözeltisi (0,1 M sodyum asetat, 0,5 M sodyum klorür, pH 4,0) ve 10 mL depolama çözeltisi (0,05 M disodyum fosfat , %0.1 (m/v) sodyum azit, pH 7.0).
- Bir tüpte 1 mM hidroklorik asit20 mL hazırlayın ve en az 20 dakika buz üzerinde kuluçka. Bağlantı reaksiyonu sırasında tüm adımlar için akış-through fraksiyonları izlemek için hassas bir ölçek hazırlayın (adım 5.7).
- Mühürlü bir NHS tarafından etkinleştirilen çapraz bağlı agarose sütunu açın ve şırınga adaptörlerini sütun girişine monte edin. Şırıngaya bağlamadan önce bağdaşör girişine bir damla arabellek uygulayarak kolona giren havayı önleyin.
- <1 mL min-1 akış hızında 6 mL buz gibi 1 mM hidroklorik asit (adım 5.4'ten) ile kolonu yıkayın ve hemen adım 5.7'ye geçin.
- <1 mL min-1 akış hızında 2 mL şırınga kullanarak 1,5 mL DFE çözeltisi (adım 5.2) enjekte edin ve sonraki analiziçin akış için fraksiyonu hassas bir ölçekte (adım 5.4) toplayın (adım 7). DoE kurulumuna bağlı olarak kolonu her iki uçta ve 22 °C'de 15-45 dk kuluçkaya yatırın.
- 6 mL deaktivasyon çözeltisi enjekte edin ve ardından 6 mL düşük pH çözeltisi <1 mL min-1 akış hızında nakış hızıyla kovalent bağlı olmayan ligandları reçineden çıkarın. Daha sonra 6 mL deaktivasyon çözeltisi enjekte edin ve kolonu 15 dk kuluçkaya yatırın.
- Kolona 6 mL düşük pH çözeltisi enjekte edin, ardından 6 mL devre dışı bırakma çözeltisi. Ardından kolona 6 mL daha düşük pH çözeltisi enjekte edin.
- Kolona 2 mL depolama çözeltisi enjekte edin ve 4 °C'de depolayın.
6. Açıklık Bitkiler Özlerinden MAbs Saflaştırma Test
- 2F55 içeren 100 mL açıklıklı bitki ekstresi veya yine 2F5 içeren tercih edilen hücre tabanlı ifade sisteminden supernatant hazırlayın.
- Denge tamponu (20 mM sodyum fosfat, 500 mM sodyum klorür, pH 7,4), düşük pH elüsyon tamponu (0,05 M sitrat, 0,05 M sodyum klorür, pH 4,0-3,25) ve yüksek iyonik mukavemetli elüs tamponu (1.0-4.0 M magnezyum klorür, 0.1 M HEPES, pH 8.0)
- Renkbilim sistemini tamponlarla temizle. Kromatografi sistemine bir DFE yakınlık sütunu (adım 5.10'dan itibaren) monte edin ve 1,0 mL min-1akış hızında 5 CV denge tamponu ile dengeleyin. UV emiciliğini 280 nm'de izleyin.
NOT: Sütunüzerine bitki ekstresi veya hücre kültürü supernatant yükleme backpressure bir artışa neden olabilir. Kromatografi sistemine veya DFE sütununa zarar vermemek için 0,2 MPa'da yüksek basınç uyarısı ayarlayın. - 2 dk temas süresini garanti lemek için 0,5 mL min-1 akış hızında kolonun üzerine açıklığa kavuşturulmuş bitki ekstresinin veya süpernatantın 80 mL'ini (adım 6.1) yükleyin. Anında numune analizi mümkün değilse, akış tantana örneklerini 4 °C'de saklayın.
- Sütunu 6 CV'lik denge arabelleği ile yıkayın. Bu adımın başında, ortasında ve sonunda yıkama bir örnek toplayın.
-
Elute mAb 2F5 düşük pH elüsyon tampon veya yüksek iyonik mukavemetli elüsyon tampon (0.1 M HEPES, 1.25 M magnezyum klorür, pH 8.0) 5 CV ile. UV 280 nm sinyali taban çizgisinin üzerinde 5 mAU'ya yükseldiğinde DFE fraksiyonu toplayın.
- Her epitop-antikor çifti için elüsyon tamponu optimize edin. 2F5 için, 1.25 M magnezyum klorür ürün geri kazanımı ve ligand stabilitesi arasında optimum bir denge sağladı.
NOT: Magnezyum klorür çözeltisi yağış eğilimli. Bu nedenle, magnezyum klorür çözün ~ 700 mL su. HEPES'i 100 mL suda ayrı ayrı çözün ve pH'ı 8.0'a ayarlayın. Çözünmüş magnezyum klorür çözeltisini HEPES çözeltisine ekleyin ve 1,0 L'lik son hacmine su ekleyin. Bu yağış neden olur, çünkü magnezyum klorür erittikten sonra pH ayaryapmayın.
- Her epitop-antikor çifti için elüsyon tamponu optimize edin. 2F5 için, 1.25 M magnezyum klorür ürün geri kazanımı ve ligand stabilitesi arasında optimum bir denge sağladı.
- 6.4-6.6 adımlarında alınan tüm örnekleri Bradford yöntemi, lityum dodecylsülfat poliakrilamid jel elektroforezi (LDS-PAGE) ve yüzey plazmon rezonans (SPR) spektroskopisi (adım 7) kullanarak analiz edin.
7. Örnek Analiz
- Bradford yöntemi 18 ,19kullanarak TSP konsantrasyonu ölçün.
- Triplicate olarak, pipet 2.5 μL her örnek 96-well plaka tek bir kuyu içine. 0-2.000 mg· aralığıkapsayan triplicate sekiz büyükbaş serum albumin (BSA) standartları kullanın· L-1.
- Her kuyuya 200 μL Bradford reaktifi ekleyin ve yavaşça yukarı ve aşağı boru lar ekleyerek karıştırın. Sonraki okuma bozan kabarcıklar oluşumunu önlemek için pipet seviyesini tutun.
- Plakayı 22 °C'de 10 dakika kuluçkaya yatırın ve emiciliği 595 nm'de spektrofotometrede ölçün. BSA referans noktaları üzerinden standart bir eğriyi temel alarak numunelerde TSP konsantrasyonu hesaplayın.
- Florimetri ile DFE'yi ölçün
- Triplicate olarak, pipet 50 μL siyah 96-iyi yarım alan plaka tek kuyular içine her örnek. 0-225 mg· aralığını kapsayan altı DsRed standardı içerir· L-1.
- Floresan'ı 530 ± 30 nm uyarma filtresi ve spektrofotometrede 590 ± 35 nm emisyon filtresi kullanarak iki kez ölçün. Örneklerdeki DFE konsantrasyonu, DsRed referans noktaları aracılığıyla standart bir eğriyi temel alarak hesaplayın.
- SPR spektroskopisi 20ile 2F5 konsantrasyonu ölçün.
- HBS-EP çalışan tampon (10 mM 4-(2-hidroksitil)-1-piperazineeesulfonik asit (HEPES), 3 mM etilendiamintetraasetik asit (EDTA), 150 mM sodyum klorür, 0.005% v/v Tween-20, pH 7.4) hazırlayın ve 2μμ0 üzerinden geçerek filtre ile sterilize 2 μμμ şişe üstü filtre. Tamponu 15 dk degas.
- Karboksimetilleştirilmiş dekstran yüzey yongasını yerleştirmeden önce HBS-EP çalışan tamponu SPR cihazına bağlayın ve asal işlevi kullanarak sistemi dengeleyin. 30 μL min-1 akış hızıyla manuel çalıştırmaya başlayın ve 30 mM hidroklorik asit ve 25 mM sodyum hidroksit (her biri iki enjeksiyon) akış hücreleri 1 ve 2'yi 1 dk için 30 μL min-1 akış hızında dönüşümlü olarak enjekte ederek talaş yüzeyini koşullandırma.
- 500 mg' ın 300 μL'sini hazırlayın· L-1 Protein 10 mM sodyum asetat çözeltisi (pH 4.0). 0.4 M 1-etil-3-(3-dimethylaminopropyl) karbodiimid hidroklorür (EDC) ve 0.1 M NHS ve santrifüj içeren çözülme şişeleri 1 dk için 1 6.000 x g EDC 70 μL ve 70 μL NHS karıştırmadan önce.
- EDC/NHS karışımını ve Protein A çözeltisini 7 mm plastik numune şişelerine aktarın ve numune rafına yerleştirin. 10 dk-1 akış hızında EDC/NHS karışımını akış hücreleri 1 ve 2'ye enjekte ederek karboksimetillenmiş dekstran talaş yüzeyini etkinleştirin.
- Çift Protein A aktif karboksimetillenmiş dextran yüzeyine 15 μL min akış hızında akış hücre 2 üzerinde Protein A çözeltisi enjekte ederek 15 dk-1 için.
- Protein A'yı bağlarken, 1,0 M etanolin hidroklorür (pH 8,5) ve 1 dk. 150 μL'lik bir şişeyi 7 mm plastik şişeye aktarın ve aletin içine yerleştirin. Adım 7.3.5 tamamlandığında, 7 dakika boyunca 10 μL min-1 akış hızında akış hücreleri 1 ve 2 üzerine etanolamin çözeltisi enjekte ederek talaş yüzeyini devre dışı bırakın.
- 30 mM hidroklorik asit ve 25 mM sodyum hidroksit (her biri iki enjeksiyon) akış hücreleri 1 ve 2'nin üzerine 30 μL min-1 akış hızıyla 0,5 dakika boyunca dönüşümlü olarak enjekte ederek talaş yüzeyini koşullandırma.
- HBS-EP çalışan tamponda 500 μg· konsantrasyonda antikor 2F5 standartlarını hazırlayın· HBS-EP'de 2F5 içeren L-1 ve seyreltik numuneler 20-1.000 μg· aralığında son konsantrasyona kadar L-1. 3 dk için 30 μL min-1 akış hızında akış hücreleri 1 ve 2 üzerinden numune ler ve standartlar enjekte edin.
- Her örnek için akış hücresi 2 (ölçüm hücresi) sinyalinden akış hücresi 1'in (referans hücresi) göreli birimlerini (RU) çıkarın ve 2F5 standart enjeksiyonların RU sinyaline dayalı antikor konsantrasyonu hesaplayın.
- Her numune veya standart enjeksiyondan sonra, akış hücreleri 1 ve 2 üzerinde 0,5 dakika boyunca 30 μL min-1 akış hızında 30 mM hidroklorik asit enjekte ederek talaş yüzeyini yeniden kurun.
- 2F5 atılım eğrisi elde etmek için hacim üzerinden akış karşı adım 6.4 her akış yoluyla örnek için 2F5 konsantrasyonu çizin. %10 dinamik bağlama kapasitesini (DBC) elde etmek için yükleme 2F5 konsantrasyonunun %10'una ulaşıldığında enjekte edilen 2F5 miktarını hesaplayın.
- LDS-PAGE ile protein örneklerini analiz edin.
- Kullanıma hazır %4-12 BisTris LDS poliakrilamid jelaçınve elektroforez modülüne yerleştirin. 800 mL çalışan tamponu (50 mM MES, 50 mM Tris taban, 0,1% (m/v) SDS, 1 mM EDTA, pH 7,3) modüle aktarın ve 0,5 mL antioksidan çözelti ekleyin.
- 1,5 mL'lik bir reaksiyon tüpünde, 10 μL yükleme tamponu ile 4 μL azaltma maddesi ve 26 μL protein numunesini karıştırın. Tüpü 80 °C'de 10 dakika boyunca bir ısı bloğunda kuluçkaya yatırın. Tüpü 30 s için 500 x g'de santrifüj edin.
- LDS poliakrilamid jelini (şerit başına 10 μL numune) yükleyin ve 5 μL önceden lekeli protein standardını (10-180 kDa) ayrı bir şeride yükleyin.
- Elektroforez odasını kapatın ve güç kaynağını bağlayın. Elektroforez 40 dakika ve sabit 200 V'de çalışmalıdır.
- Jeli elektroforez odasından çıkarın. Jel yığılmayı açın ve 19 rpm bir shaker üzerinde 15 dakika suda jel yıkayın. 19 rpm bir shaker üzerinde boyama çözeltisi 1 saat için jel leke.
- 19 rpm bir shaker üzerinde suda 1 saat için jel destain. Bir film tarayıcısı kullanarak jeltini tarayın.
Sonuçlar
İfade ve yakınlık ligand arınma
Füzyon proteinI DFE bir serada yetiştirilen transgenik tütün bitkileri ifade edildi. Verim ~ 120 mg·kg-1 yaprak kütlesi bitki başına ~ 130 g ortalama biyokütle idi. DFE saflığı beyazlatma dan önce ham bitki özlerinde TSP'nin %5'i ydi ancak 70 °C'de ısıl işlemden sonra 1,5 dakika boyunca ~%40'a yükseldi ve bu da konak hücre proteinlerinin %97'sini çöktürdü. Beyazlatma adımı kolayca hasat ve çıkarma rutin entegre edildi (Şekil1) ve su banyosu kurma da dahil olmak üzere ekstra zaman az 2 saat sürdü. DFE'nin genel geri kazanımı 23.5 mg kg1 ve saflık >%90 idi. Ürün kaybından sorumlu adımlar beyazlatma, derinlik filtrasyon ve IMAC idi ve bunlar sırasıyla %40, %27 ve %45'lik özel kayıplara neden oldu. Derinlik filtre kapasitesi ortalama 135 ± 36 L m-2 (±SD, n=3) ve böylece literatürde bildirilen değerlerin üst aralığında21idi. Bitki yaşı ile birlikte DFE verimi artmıştır (Şekil 2).
NHS-aktive kromatografi kolonlarında afinite ligandın immobilizasyonu
İlk kaplin testlerinde HEPES tamponu (pH 8.3) kaplin verimliliğini %89 ± 6 'ya (±SD, n=3) yükselttiği, üretici tarafından önerilen bikarbonat tamponu için %78 ± 9 (±SD, n=3) olduğunu bulduk. Bu nedenle, HEPES sonraki tüm bağlantı deneyleri için kullanılmıştır. DFE'nin NHS tarafından etkinleştirilen çapraz bağlantılı agarose regin'e bağlantı verimliliğini optimize etmek için bir DoE yaklaşımı seçildi. Reçine üzerinde hareketsiz dfe mutlak miktarı sütuniçine enjekte ve ~ 15 g· platolanmış DFE kütlesi ile arttı L-1 ise daha fazla DFE enjekte edildikçe kaplin verimi sürekli olarak azalmıştır (Şekil 2). Kaplin verimi de >50% daha düşük bir asidik tampon, bir vaka-by-case bazında her ligand için uygun kaplin koşulları için ekran ihtiyacı gösteren oldu. DoE yazılımının sayısal optimizasyon aracı kullanılarak bağlantı verimi açısından ideal koşullar, hareketsiz DFE ve sütun maliyetlerinin mutlak miktarı belirlenmiştir. En çok arzu edilen koşullar (pH 9.0 ve 7.0 mg DFE 1 mL çapraz bağlı agarose reçine) büyük bir plato üzerinde yer almakta ve bu nedenle sağlamdı. DFE molekülleri kaplinden sonra bile kırmızı floresanlarını korudular ve renk yoğunluğu hareketsiz DFE'nin toplam miktarına karşılık gelirdi (Şekil 2). Bu nedenle, sütun rengi bağlantı verimliliğini ve sütun kalitesini tahmin etmek için basit bir kalite kontrol parametresi olarak kullanılabilir. Floresan ayrıca DFE füzyon proteininin tetramerik olarak biraraya geldiğini doğruladı.
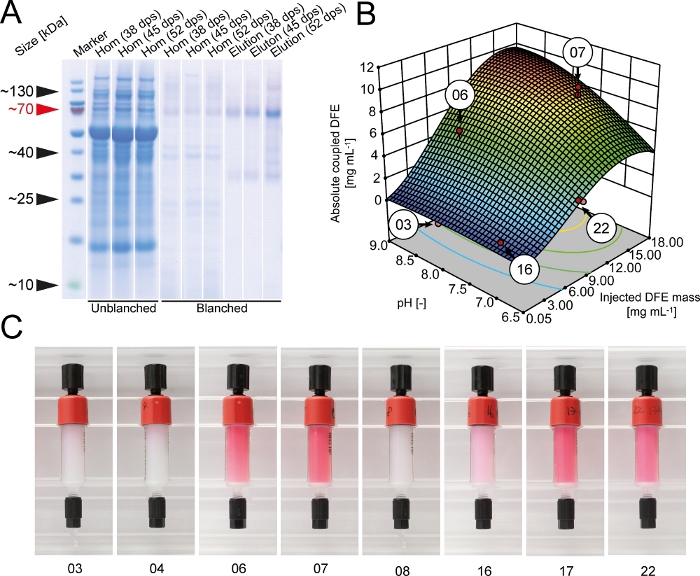
Şekil 2: DFE immobilizasyonunun NHS tarafından aktive edilen çapraz bağlantılı agarose regin'e optimizasyonu. (A) LDS-PAA jel homojen ve elüsiyon örnekleri nin batı leke blay ile unblanched ve blanched transgenik DFE bitki özleri. Bitkilerin hasadı tohumlamadan 38, 45 veya 52 gün sonra yapıldı. Batı lekeleri bir anti-His6-antikorlar kullanılarak yapıldı5. (B) NHS tarafından aktive edilen çapraz bağlı agarose sütunlarına enjekte edilen pH ve saflaştırılmış DFE'nin toplam kütlesi nin bağlı olduğu toplam dfe afinite ligand miktarı. Kırmızı noktalar, yanıt yüzeyi modelini oluşturmak için yapılan gerçek deneyleri gösterir. (C) Bağlama işleminden sonra DFE yakınlık sütunları. Sayılar panel B. dps = gün sonrası tohumlama vurgulanan kaplin koşullarına karşılık gelir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
DFE afinite reçiyinkullanarak 2F5 izolasyontest
Rekombinant 2F5 antikor geçici bir fitotron5yetiştirilen Nicotiana benthamiana bitkilerde üretildi. Ham bitki ekstresinden 2F5'in ele geçirilmesi ~ 7.0 mg saflaştırılmış DFE (adım 6) ile birleştiğinde yakınlık sütunları kullanılarak test edilmiştir. Protein A reisinler elution genellikle asidik bir tampon içerir (pH ~ 3.3)13. Bu nedenle, başlangıçta DFE sütunları için farklı düşük pH elüsasyon arabelleklerini (pH 6.0-3.25) değerlendirdik. 2F5'in elüsasyonu 4.5'in altındaki pH değerlerinde başarılı oldu ve pH 3.25'te ~%35'lik en yüksek iyileşme ile başarılı oldu. Ancak, düşük pH elution hem antikor (SPR spektrometresi tarafından doğrulandı) ve DFE ligand (renk kaybı ve alt DBC ile gösterildiği gibi, Şekil3) inaktive. İkincisi, pH <4.022,23de yerli DsRed denatüre verilen beklenen oldu . Ürün ve ligand denatürasyonu önlemek için, daha önce diğer affinity reçine 24 mAbs eute için kullanılan çünküalternatif bir elüsülasyon ajanı olarak magnezyum klorür test etti. Magnezyum klorür konsantrasyonu 1.25 M'lik bir magnezyum klorür konsantrasyonu DFE afinite rekarinin 2F5'i 105 ± %11 (±SD, n=3) ve %97 ± 3 saflık (±SD, n=3) ile yakınlaştırmaya yeterliydi. Bu performans Protein A reisins25,26karşılaştırılabilir oldu. DFE saflaştırılmış 2F5 antikorve sentetik ligand Fuzeon denge dissosilasyon sabiti (K D) 791 pM ise Protein A-saflaştırılmış muadili 763 pM5idi . Ayrıca reçinde toplam 25 bağlama ve elute döngüsünde önemli bir renk kaybı gözlenmedi. DFE yakınlık reseninin DBC değeri %10 2F5 atılımı ile 25 döngü boyunca doğrusal olarak gerilerekbaşlangıç değerinin ~%15'ine düşmüştür (Şekil 3).
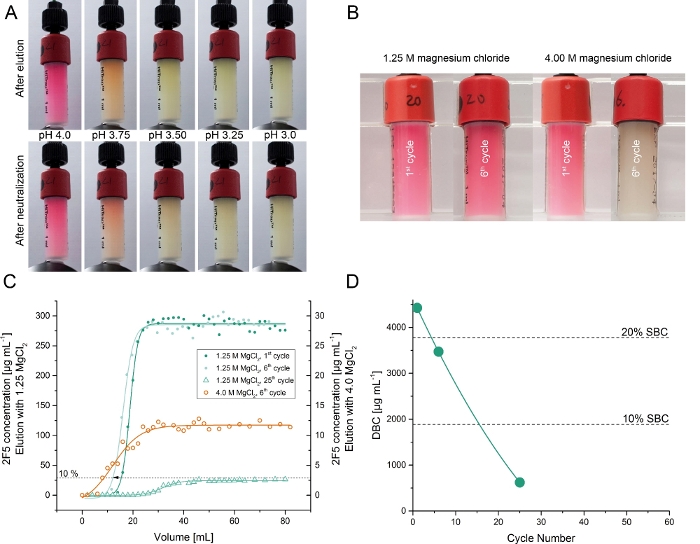
Şekil 3: DFE afinite reçinelerini kullanarak 2F5'in açıklıklı bitki özlerinden izolasyonunun test edilmesi. (A) DFE yakınlık, 4.0-3.0 aralığında farklı pH değerlerine sahip arabellekler ve pH 6.0'da nötralizasyon adımından sonra aynı reçiyleri kullanarak bir elüsyon döngüsünden sonra reçiyit reçiner. (B) DFE yakınlık eluent olarak 1,25 M veya 4,00 M magnezyum klorür kullanarak 2F5 arıtma bir ve altı döngüsonra reçines. (C) DFE reçinesinin elüent olarak magnezyum klorür kullanarak çevrime bağlı dinamik bağlama kapasitesini belirlemek için frontal yükleme deneylerinin (break-through eğrileri) kromatogramları. Kırılma eğrileri 4.0 M ve 1.25 M magnezyum klorür elüsyon tamponları ve çeşitli çevrim numaraları için ölçüldü. (D) DFE'nin çevrime bağlı dinamik bağlama kapasitesi 1,25 M magnezyum klorür eluent olarak kullanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Roman affinity resin uygulamaları
MAbs'nin yakalanması için özel yakınlık kromatografi reçinelerinin, NHS tarafından aktive edilen çapraz bağlı agarose'a mAb'ye özgü bir epitop içeren bir ligandın immobilize edilerek üretilebildiği gösterilmiştir. Böyle bir rezorin tasarlamak için epitop dizisini bilmek ve lineer bir epitop kullanmak gerekiyordu. Ortaya çıkan rejenler mAbs'nin yakalanması için avantajlıdır, çünkü pahalı Protein A affinity kromatografi adımlarının yerini alabilir. Olgu tetkiklerimizde 2F5 ve DFE arasındaki etkileşim epitop-paratop bağlanması ile aracılık edilebildi, bu nedenle ligandımız protein A'dan daha seçici olmalıdır, bu da çoğu murine ve insan IgG'nin Fc bölgesine bağlanır. Her mAb için bireysel ligandlar gerekli olduğundan, yöntemimiz başlangıçta çok büyük ölçekte üretilen antikorlar için uygun görünebilir. Ancak, hızlı bitki bazlı geçici protein ekspresyonu ile yaklaşımımızı birleştirerek, yeni afinite ligands az 2 hafta içinde hazırlanabilir27 minimal çabaile 28. Bu nedenle, yöntem de küçük ölçekli mAb arıtma için uygundur.
Üretim ve yakınlık ligand potansiyel iyileştirmeler
Bitkiler yakınlık ligandsiçinhızlı ve güvenli bir üretim platformu sunuyoruz 5,29,30, DFE füzyon proteini gibi bizim vaka çalışmasıözellikli. Bitki materyalinin beyazlatma büyük ölçüde tek bir adımda konak hücre proteinlerinin miktarını azalttı ve kolayca standart bir açıklama rutin entegre edildi. Ancak, ligand kurtarma mevcut kurulum düşük, muhtemelen orta termal stabilite ve filtre katmanları bazı non-spesifik bağlama nedeniyle, diğer ürünler için bildirilen31,32,33. Mühendislik taşıyıcı termal istikrarı artırmak için bu nedenle gelecekte ligand verimi artırmak için yardımcı olabilir, sıtma aşısı adayı CCT için açıklandığı gibi, antitümör enzim PpADI veya mezofilik β-glukozidaz34, 35,36. Aynı protein mühendisliği filtre malzemesi37non-spesifik bağlama azaltmaya yardımcı olabilir derinlik filtrasyon adım için geçerlidir. DFE ve benzeri ligandlar için üretim maliyetleri de flocculants veya filtre katkı maddeleri kullanarak açıklama genel verimliliğini artırarak azaltılabilir38,39.
DsRed taşıyıcı olarak kullanıldığında tetramerik bir kompleks oluşturur. Bu, ligand başına epitopsayısı artar, çünkü avantajlıdır, ama aynı zamanda afinite kromatografi sırasında demontaj veya denatürasyon ligand daha duyarlı hale getirebilir. Düşük pH40kararlı olduğu için mCherry gibi monomerik taşıyıcı protein tercih edilebilir, ve epitop tandem tekrarları dahil ligand avidite artacak ve böylece reçine kapasitesini artırmak5, 26.000 , 41. Basit taşıyıcı-epitop proteinler için (yani, disülfür bağı veya çeviri sonrası modifikasyonları olmayanlar) mikrobiyal üretim sistemleri üretim maliyetlerini azaltabilir ve ligandları Protein A ile daha rekabetçi hale getirebilir. Örneğin, yeşil floresan protein ~ 1 g·kg-1 biyokütle verimi ile bakteri hücrelerinde ifade edilmiştir, hangi önemli ölçüde ligand üretim maliyetlerini azaltacak42.
Ne olursa olsun ifade ana bilgisayar, saflaştırılmış bir yakınlık ligand aksi takdirde reçine seçicilik ve kapasitesini azaltabilir konak hücre proteinleri veya medya bileşenlerinin immobilizasyonen en aza indirmek için kaplin sırasında gerekli oldu. IMAC arınma için bir poli-histidin etiketi dahil tek bir adımda ~ 90% saflık arttı, hızlı ve ucuz ligand üretimi kolaylaştırmak5,43,44. Ancak, bu steral epitop bağlanmasını engellemek veya taşıyıcı45veya epitop ya dekolte indüklemek için potansiyele sahiptir çünkü füzyon etiketinin konumu önemlidir 45,46.
NHS-aktive kromatografi kolonlarında afinite ligandın immobilizasyonu
İmmobilizasyon el ile veya kromatografi sistemi kullanılarak gerçekleştirildi. Sütun başına küçük tampon hacimleri manuel kullanımdan yana görünüyordu (örn. minimum atık hacimleri nedeniyle). Ancak, birden fazla/daha büyük sütun gerekiyorsa, kromatografi sistemi bağlantı koşullarını kontrol etmeyi kolaylaştırır (örn. düzenlenmiş akış hızları) ve bu nedenle DBC açısından tekrarlanabilir sonuçlar elde etme olasılığı daha yüksektir. Verilerimiz, bağlantı arabelleği ve pH'ın bağlantı verimliliği ve genel sütun maliyetleri üzerinde önemli bir etkiye sahip olduğunu göstermektedir. Kaplin reaksiyonunu etkileyen tarama faktörleri ve her taşıyıcı protein için ayarlanması (hatta her taşıyıcı-ligand füzyonu için) bu nedenle bağlantı verimliliğini ve reçin performansını artırabilir ve bu yaklaşımı öneriyoruz.
DFE afinite reçiyinkullanarak 2F5 izolasyontest
Ürün verimi ve saflık rekarne performansının önemli yönleridir ve DFE durumunda 105 ± %11 (±SD, n=3) ve %97 ± 3 saflık (±SD, n=3) elde ettik ve bu da kıyaslama Protein A rekarnelerinin performansıyla karşılaştırılabilir25 ,26. Genel olarak rekarneler için bir diğer önemli performans göstergesi (ve özellikle afinite ligands dayalı olanlar için) DBC% 10 ürün atılım, bu parametre belirli bir işlem ve böylece maliyetleri için gerekli rekarin miktarını etkilediği için. DFE ligand için, ilk DBC ~4 g· L-1 rezorin, benzer koşullar altında Protein A için karşılık gelen değerin ~% 13 (sadece 2 dk temas süresi)25,47 ama yaklaşık 15 kat daha yüksek gibi diğer özel afinite recins göre anti-FSH-immünafinite ligand 2 dk48aynı ikamet süresi kullanarak . DFE DBC 25 bind-ve-elute döngüleri sonra başlangıç değerinin% 15'e geriledi, 50'den fazla döngüleri ticari Protein A reisins49DBC aynı kaybı için gerekli ise . Ancak, taşıyıcımızın henüz protein A ile aynı ölçüde optimize edilmemiş olduğunu belirtmek önemlidir, bu da son 40yılda kapsamlı bir şekilde araştırılmış ve geliştirilmiştir 8.
Şimdiye kadar düşük pH elüsyon tampon magnezyum klorür yüksek konsantrasyon (Şekil3),daha önceki çalışmalarda tavsiye 13 geçişyaparak rezorin stabilitesi ve ürün kurtarma geliştirdik. Yakınlık ligand karakteristik kırmızı renk 25 bind-ve-elute döngüleri sırasında önemli ölçüde solmaya vermedi, bu yüzden açıklık bitki özleri endojen bitki proteses31 kesilmiş olabilir ve böylece epitop inaktive ligand. Bu nedenle, taşıyıcı ve epitop bağlamak için proteaz dirençli bağlayıcılar tasarımı döngüleri uzun sayıda üzerinde ilk DBC korumak için yardımcı olabilir. DFE ligandının hızlı ve basit bir şekilde ifade edilip saflaştırılması, ticari kromatografi reçinelerine bağlanması ve mükemmel ürün verimi ve saflığı göz önüne alındığında, yöntemimizin Protein A'ya uygun bir alternatif sunduğuna inanıyoruz. özellikle taşıyıcı ve bağlayıcıdaki iyileştirmeler DBC ve ligand stabilitesini iyileştirebiliyorsa, Protein A'ya bağlanmayan mAb'lerin ve antikor türevlerinin saflaştırılması. Bu varsayım DFE saflaştırılmış ve Protein A-saflaştırılmış 2F5 antikor5dissosilasyon sabitindeki küçük fark tarafından desteklenerek, yeni yakınlık ligand'ımızın yüksek kaliteli mAbs'lerin geri kazanılmasına olanak sağladığını göstermiştir.
Yöntemin yararları ve mevcut sınırlamaları
Taşıyıcı protein ile genetik füzyon olarak yakınlık ligand üretmek sulu tamponlarda çözünürlüğü ve böylece tipik ligand kaplin koşulları ile uyumluluğu artırır. Buna karşılık, katı faz peptid sentezinden elde edilen boş peptidler,mAb tarafından tanınan epitopun amino asit dizisi tarafından dikte edildiği için değiştirilememiştir, 50 sırası nedeniyle bu koşullar altında sınırlı çözünürlüğe sahip olabilir. arındırılabilir. Diğerleri bu nedenle peptit ligands bir on-rekarne sentezi kullanmış51. Elde edilen reçinenin statik bağlama kapasitesi yüksekti (~80 g· L-1), ancak reçine hazırlama süreci uzundur, dinamik bir bağlama kapasitesi rapor edilmemiş ve elde edilen saflık ve geri kazanım yaklaşımımıza göre daha düşüktür. Laboratuvar ölçeğinde bir füzyon protein ligand ek bir avantajı ligand ve bunların varyantları hızla üretilebilir, saflaştırılmış ve kolay kullanımı yüksek ekspresyon sistemi52en az çaba ile test edilebilir.
Burada sunulan yöntemin iki güncel sınırlaması 3 g· düşük dinamik bağlama kapasitesidir. L-1 ve 25 bind-ve-elute döngüleri5boyunca% 90 azalma . Bu sınırlamalar gelecekte daha az sıkı yükleme koşulları uygulanarak ve geçerli DsRed taşıyıcısının sırasıyla tasarlanmış, daha kararlı bir varyantla değiştirilmesiyle giderilebilir. Örneğin, geçerli temas süresini 2 ila 4 dakika arasında iki katına çıkarmak, bazı Protein A reçinekleri26'dagösterildiği gibi dinamik bağlama kapasitesini iki katına çıkarma potansiyeline sahiptir.
Sorun giderme
Aşağıdaki tablo, bu protokol sırasında karşılaşılabilen olası sorunları vurgular ve bunlarınnasıl çözüleceğiniz hakkında ipuçları sağlar (Tablo 1).
| Tablo 1: Karşılaşılabilen olası sorunlar ve olası düzeltmeler. | |||
| Protokol adımı | Sorun | Sebebi | Düzeltmek |
| 1 | Bitkiler yetişmiyor | Uzlaşmalı büyüme koşulları | Gübrenin pH'sını ve iletkenliğini kontrol edin |
| Sıcaklık ve ışık koşullarını kontrol edin | |||
| 2 ve 3 | Ekstraksiyondan sonra büyük miktarlarda konak hücre proteinleri bulunur. | Eksik yağış | Beyazlatma sırasında sıcaklığı kontrol edin |
| Beyazlatma banyosundaki ajitasyonu kontrol edin | |||
| 2 ve 3 | Bitki ekstresinde ürün bulunamadı | Beyazlatma sıcaklığı çok yüksek | Beyazlatma sırasında sıcaklığı ve pH'ı kontrol edin |
| pH beyazlatma tampon çok düşük | |||
| 3 | Büyük sap veya yaprak parçaları çıkarmadan sonra kalır | Blender'da eksik karıştırma | Tesis malzemesinin blender'da fiş oluşturmadığından emin olun |
| 3 | Derinlik filtrasyonu sırasında hızlı basınç artışı | Yanlış filtre seçimi ve/veya yönlendirme | Filtre türünü ve yönünü kontrol edin |
| 4 | Elüzyon sırasında küçük füzyon proteini / akış yoluyla füzyon protein bir sürü | IMAC reşini metal iyonları ile şarj edilmedi | IMAC reşinini iyonlarla doğru şekilde şarj edip olmadığını kontrol edin |
| Füzyon proteini afinite etiketini kaybetti | Bitki yetiştiriciliği sırasında yoğun güneş ışığından ve yüksek sıcaklıklardan kaçının | ||
| 4 | Konsantrasyon sırasında kaybedilen füzyon proteini | Membrana bağlı füzyon proteini | Membran türünü kontrol edin |
| Konsantrasyon faktörünün çok yüksek olmadığından emin olun | |||
| 5 | Düşük bağlantı verimi | Bağlantı reaktifi ekinin yanlış sırası | Reaktif etiketlerini ve ekleme sırasını kontrol edin |
| Bağlantıdan önce sütunların yanlış hazırlanması | Sütun preparaton koşullarını kontrol edin | ||
| 5 ve 6 | Düşük mAb verimi | Bitki biyokütlesinde düşük mAb ekspresyonu | Biyokütlede test mAb ekspresyonu |
| Düşük ligand yoğunluğu | Füzyon protein preparatının saflığını kontrol edin | ||
| 7 | Bradford satoklarında çok düşük/yüksek protein konsantrasyonları | Pipetleme sırasında kabarcık oluşumu | 96-iyi palte kabarcıklar için kontrol edin |
| 7 | SPR ölçümü sırasında düşük mAb konsantrasyonu | Tehlikeye Protein Bir çip | Bilinen konsantrasyon ile standart mAb sonuçları ile karşılaştırın |
| Yanlış numune seyreltme | Seyreltme oranını ve tamponu kontrol edin | ||
Tablo 1: Sorun giderme.
Açıklamalar
Yazarların ifşa etmesi gereken çıkar çatışmaları yok.
Teşekkürler
İbrahim Al Amedi'ye transgenik tütün bitkilerini yetiştirdiği için ve Dr. Thomas Rademacher'e tütün ekspresyonu vektörü sağladığı için teşekkür etmek istiyoruz. Yazarlar DFE yakınlık ligand yapısı hakkında verimli tartışmalar için editoryal yardım ve Markus Sack için Dr Richard M. Twyman teşekkür etmek istiyorum. Bu çalışma kısmen Hibe No altında Fraunhofer-Gesellschaft İç Programları tarafından finanse edilmiştir. 125-600164 çekmek ve Leistungszentrum hibe no 423 altında Kuzey-Ren-Vestfalya devlet "Ağ, adaptif üretim". Bu çalışma Deutsche Forschungsgememeinschaft (DFG) tarafından Araştırma Eğitim Grubu "Tümör hedefli İlaç Dağıtımı" hibe 331065168 çerçevesinde desteklenmiştir. GE sağlık bu makalenin açık erişim yayın destekledi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10 L/20 L Bucket | n/a | n/a | Blanching equipment |
| 2100P Portable Turbidimeter | Hach | 4650000 | Turbidimeter |
| ÄKTApure | GE Helthcare | 29018226 | Chromatography system |
| Allegra 25R | Beckman Coulter | 369434 | Centrifuge |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Antibody 2G12 | Fraunhofer IME | n/a | Standard for SPR quantification |
| Blender | Waring | 800EG | Blender |
| BP-410 | Fuhr | 2632410001 | Bag filter |
| CanoScan 5600F | Canon | 2925B009 | Scanner |
| Centrifuge tube 50 mL self-standing | Labomedic | 1110504 | Reaction tube |
| Chelating Sepharose FF | GE Helthcare | 17-0575-01 | Chromatography resin |
| Cond 3320 | WTW | EKA 3338 | Conductometer |
| Design-Expert(R) 8 | Stat-Ease, Inc. | n/a | DoE software |
| Discovery Compfort | Gilson | F81029 | Multichannel pipette |
| Disodium phosphate | Carl Roth GmbH | 4984.3 | Media component |
| Diverse bottles | Schott Duran | n/a | Glas bottles |
| Dri Block DB8 | Techne | Z381373 | Heat block |
| DsRed | Fraunhofe IME | n/a | Standart |
| EDTA | Carl Roth GmbH | 8043.2 | Buffer component |
| EnSpire | Perkin Elmer | 2390-0000 | Plate reader |
| ETHG-912 | Oregon Scientific | 086L001499-230 | Thermometer |
| F9-C | GE Helthcare | 29027743 | Fraction collector |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| HEPES | Carl Roth GmbH | 9105.3 | Buffer component |
| Hettich Centrifuge Mikro 200 | Hettich | 2400 | Centrifuge |
| HiPrep 26/10 | GE Helthcare | GE17-5087-01 | Chromtography column |
| HiTrap NHS-activated Sepharose HP, 1 mL | GE Helthcare | 17-0716-01 | Chromatography columns |
| Hydrochloric acid | Carl Roth GmbH | 4625.1 | Buffer component |
| Imidazole | Carl Roth GmbH | 3899.2 | Buffer component |
| K700 | Pall | 5302305 | Depth filter layer |
| KM02 basic | IKA | n/a | Magnetic stirrer |
| KS50P 60D | Pall | B12486 | Depth filter layer |
| L/S 24 | Masterflex | SN-06508-24 | Tubing |
| Lauda E300 | Lauda Dr Wobser GmbH | Z90010 | Immersion circulator |
| Magnesium chloride | Carl Roth GmbH | KK36.2 | Buffer component |
| Masterflex L/S | Masterflex | HV-77921-75 | Peristaltic pump |
| Minisart 0.2 µm | Sartorius | 16534K | Filter unit |
| Nalgene Rapid-Flow PES bottle top filter | Thermo Fischer Scientific | 595-4520 | Vacuum filtration of SPR buffers |
| Nickel sulphate | Carl Roth GmbH | T111.1 | Buffer component |
| Novex NuPAGE 4-12% BisTris LDS gels | Invitrogen | NP0336BOX | LDS-PAA gels |
| Novex X-cell Mini Cell | Invitrogen | EI0001 | PAGE chamber |
| NuPAGE 20x running buffer | Invitrogen | NP0002 | Buffer concentrate |
| NuPAGE antioxidant | Invitrogen | NP0005 | Antioxidant |
| PageRuler protein ladder (10-180 kDa) | Invitrogen | 26616 | Protein standart |
| Perforated bucked | n/a | n/a | Blanching |
| PH 3110 | WTW | 2AA110 | PH meter |
| PowerPac HC | Biorad | 1645052 | Electrophoresis module |
| Protein A from Staphylococcus aureus | Sigma-Aldrich | P7837-5MG | Coating of SPR chips |
| Sephadex G-25 fine, cross linked dextran | GE Helthcare | 17003301 | Chromatography resin |
| Silicone spoon | n/a | n/a | Spoon |
| Simply Blue SafeStain | Invitrogen | LC6060 | Gel staining solution |
| Sodium acetate | Carl Roth GmbH | 6773.1 | Buffer component |
| Sodium acetate | Carl Roth GmbH | X891.1 | Media component |
| Sodium azide | Sigma Aldrich | S2002-100G | Media component |
| Sodium chloride | Carl Roth GmbH | P029.2 | Buffer component |
| Sodium citrate | Carl Roth GmbH | HN13.2 | Buffer component |
| Sodium bisulfite | Carl Roth GmbH | 243973-100G | Media component |
| Sodium phosophate | Carl Roth GmbH | T877.2 | Media component |
| SPR Affinity Sensor - High Capacity Amine | Sierra Sensors GmbH/Bruker Daltonics | SPR-AS-HCA | SPR chip |
| SPR-2/4 Surface Plasmon Resonance Analyzer | Sierra Sensors GmbH/Bruker Daltonics | n/a | SPR device |
| SSM3 | Stuart | 10034264 | Mini Gyro-rocker |
| Heated vessel, 20 L | Clatronic | n/a | Blanching chamber |
| Sterile syringes, 2 mL | B. Braun | 4606027V | Syringes |
| Syringe adpter (Union Luer F) | GE Helthcare | 181112-51 | Syringe adapter |
| TE6101 | Sartorius | TE6101 | Precision scale |
| Tween-20 (Polysorbate) | Merck | 8170721000 | Buffer component |
| Unicorn 6.4 | GE Helthcare | 29056102 | Chromatography software |
| Vacuum bags | Ikea | 203.392.84 | Plant storge |
| VelaPad 60 | Pall | VP60G03KNH4 | Filter housing |
| Vortex-Genie 2 | Scientific industries | SI-0236 | Vortex |
| XK-26/20 column housing | GE Helthcare | 28-9889-48 | Chromtography column |
Referanslar
- Kesik-Brodacka, M. Progress in biopharmaceutical development. Biotechnology and Applied Biochemistry. 65 (3), 306-322 (2018).
- Ecker, D. M., Jones, S. D., Levine, H. L. The therapeutic monoclonal antibody market. MAbs. 7 (1), 9-14 (2015).
- Jayapal, K., Wlaschin, K. F., Hu, W. S., Yap, M. G. S. Recombinant Protein Therapeutics from CHO Cells - 20 Years and Counting. Chemical Engineering Progress. 103, 40-47 (2007).
- Kunert, R., Reinhart, D. Advances in recombinant antibody manufacturing. Applied Microbiology and Biotechnology. 100 (8), 3451-3461 (2016).
- Rühl, C., Knödler, M., Opdensteinen, P., Buyel, J. F. A linear epitope coupled to DsRed provides an affinity ligand for the capture of monoclonal antibodies. Journal of Chromatography A. 1571, 55-64 (2018).
- Edgue, G., Twyman, R. M., Beiss, V., Fischer, R., Sack, M. Antibodies from plants for bionanomaterials. Nanomedicine and Nanobiotechnology. 9 (6), e1462 (2017).
- Buyel, J. F., Fischer, R. Very-large-scale production of antibodies in plants: The biologization of manufacturing. Biotechnology Advances. 35 (4), 458-465 (2017).
- Bolton, G. R., Mehta, K. K. The role of more than 40 years of improvement in protein A chromatography in the growth of the therapeutic antibody industry. Biotechnology Progress. 32 (5), 1193-1202 (2016).
- Kelley, B. Industrialization of mAb production technology: the bioprocessing industry at a crossroads. MAbs. 1 (5), 443-452 (2009).
- Brochier, V., Ravault, V. High throughput development of a non protein A monoclonal antibody purification process using mini-columns and bio-layer interferometry. Engineering in Life Sciences. 16 (2), 152-159 (2016).
- Arakawa, T., Futatsumori-Sugai, M., Tsumoto, K., Kita, Y., Sato, H., Ejima, D. MEP HyperCel chromatography II: binding, washing and elution. Protein Expression and Purification. 71 (2), 168-173 (2010).
- Barroso, T. B., Aguiar-Ricardo, R. J., Roque, A. C. Structural evaluation of an alternative Protein A biomimetic ligand for antibody purification. Journal of Computer-aided Molecular Design. 28 (1), 25-34 (2014).
- Mazzer, A. R., Perraud, X., Halley, J., O'Hara, J., Bracewell, D. G. Protein A chromatography increases monoclonal antibody aggregation rate during subsequent low pH virus inactivation hold. Journal of Chromatography A. 1415, 83-90 (2015).
- Sack, M., et al. Functional analysis of the broadly neutralizing human anti-HIV-1 antibody 2F5 produced in transgenic BY-2 suspension cultures. FASEB Journal. 21 (8), 1655-1664 (2007).
- Buyel, J. F., Fischer, R. Characterization of Complex Systems Using the Design of Experiments Approach: Transient Protein Expression in Tobacco as a Case Study. Journal of Visualized Experiments. (83), 51216 (2014).
- Trasatti, J. P., Woo, J., Ladiwala, A., Cramer, S., Karande, P. Rational design of peptide affinity ligands for the purification of therapeutic enzymes. Biotechnology Progress. 34 (4), 987-998 (2018).
- Buyel, J. F., Gruchow, H. M., Boes, A., Fischer, R. Rational design of a host cell protein heat precipitation step simplifies the subsequent purification of recombinant proteins from tobacco. Biochemical Engineering Journal. 88, 162-170 (2014).
- Simonian, M. H., Smith, J. A. Spectrophotometric and colorimetric determination of protein concentration. Current Protocols in Molecular Biology. 76 (Chapter 10), (2006).
- Buyel, F. J., Kaever, T., Buyel, J., Fischer, R. Predictive models for the accumulation of a fluorescent marker protein in tobacco leaves according to the promoter/5'UTR combination. Biotchnology and Bioengeneering. 110 (2), 471-483 (2013).
- Piliarik, M., Vaisocherova, H., Homola, J. Surface plasmon resonance biosensing. Methods in Molecular Biology. 503, 65-88 (2009).
- Buyel, J. F., Fischer, R. Scale-down models to optimize a filter train for the downstream purification of recombinant pharmaceutical proteins produced in tobacco leaves. Biotechnology Journal. 9 (3), 415-425 (2014).
- Baird, G. S., Zacharias, D. A., Tsien, R. Y. Biochemistry, mutagenesis, and oligomerization of DsRed, a red fluorescent protein from coral. Proceedings of the National Academy of Sciences, USA. 97 (22), 11984-11989 (2000).
- Vrzheshch, P. V., Akovbian, N. A., Varfolomeyev, S. D., Verkhusha, V. V. Denaturation and partial renaturation of a tightly tetramerized DsRed protein under mildly acidic conditions. FEBS Letters. 487 (2), 203-208 (2000).
- Firer, M. A. Efficient elution of functional proteins in affinity chromatography. Journal of Biochemical and Biophysical Methods. 49 (1-3), 433-442 (2001).
- Pabst, T. M., et al. Engineering of novel Staphylococcal Protein A ligands to enable milder elution pH and high dynamic binding capacity. Journal of Chromatography A. 1362, 180-185 (2014).
- Müller, E., Vajda, J. Routes to improve binding capacities of affinity resins demonstrated for Protein A chromatography. Journal of Chromatography B. 1021, 159-168 (2016).
- Shamloul, M., Trusa, J., Vadim, M., Vidadi, Y. Optimization and Utilization of Agrobacterium-mediated Transient Protein Production in Nicotiana. Journal of Visualized Experiments. (86), 51204 (2014).
- Rademacher, T., et al. Plant cell packs: a scalable platform for recombinant protein production and metabolic engineering. Plant Biotechnology Journal. , (2018).
- Saxena, L., Iyer, B. K., Ananthanarayan, L. Purification of a bifunctional amylase/protease inhibitor from ragi (Eleusine coracana) by chromatography and its use as an affinity ligand. Journal of Chromatography. B. 878 (19), 1549-1554 (2010).
- Kurppa, K., Reuter, L. J., Ritala, A., Linder, M. B., Joensuu, J. J. In-solution antibody harvesting with a plant-produced hydrophobin-Protein A fusion. Plant Biotechnology Journal. 16 (2), 404-414 (2018).
- Menzel, S., et al. Optimized Blanching Reduces the Host Cell Protein Content and Substantially Enhances the Recovery and Stability of Two Plant-Derived Malaria Vaccine Candidates. Frontiers in Plant Science. 7 (159), 1-7 (2016).
- Yigzaw, Y., Piper, R., Tran, M., Shukla, A. A. Exploitation of the adsorptive properties of depth filters for host cell protein removal during monoclonal antibody purification. Biotechnology Progress. 22 (1), 288-296 (2006).
- Menzel, S., et al. Downstream processing of a plant-derived malaria transmission-blocking vaccine candidate. Protein Expression and Purification. 152, 122-130 (2018).
- Vöpel, N., Boes, A., Edgü, G., Beiss, V. Malaria vaccine candidate antigen targeting the pre-erythrocytic stage of Plasmodium falciparum produced at high level in plants. Biotechnology Journal. 9 (11), 1435-1445 (2014).
- Lee, C. W., Wang, H. J., Hwang, J. K., Tseng, C. P. Protein thermal stability enhancement by designing salt bridges: a combined computational and experimental study. PLoS ONE. 9 (11), e112751 (2014).
- Zhu, L., Cheng, F., Piatkowski, V., Schwaneberg, U. Protein engineering of the antitumor enzyme PpADI for improved thermal resistance. Chembiochem. 15 (2), 276-283 (2014).
- Khanal, O., et al. Contributions of depth filter components to protein adsorption in bioprocessing. Biotechnology and Bioengineering. 115 (8), 1938-1948 (2018).
- Buyel, J. F., Fischer, R. Downstream processing of biopharmaceutical proteins produced in plants: the pros and cons of flocculants. Bioengineered. 5 (2), 138-142 (2014).
- Buyel, J. F. Procedure to Evaluate the Efficiency of Flocculants for the Removal of Dispersed Particles from Plant Extracts. Journal of Visualized Experiments. (110), e53940 (2016).
- Fink, D., et al. Ubiquitous expression of the monomeric red fluorescent protein mCherry in transgenic mice. Genesis. 48 (12), 723-729 (2010).
- Gagnon, P. Technology trends in antibody purification. Journal of Chromatography A. 1221, 57-70 (2012).
- Figueira, M., Laramée, L., Murrell, J. C., Groleau, D., Míguez, C. Production of green fluorescent protein by the methylotrophic bacterium Methylobacterium extorquens. FEMS Microbiology Letters. 193 (2), 195-200 (2001).
- Bornhorst, J. A., Falke, J. J. Purification of proteins using polyhistidine affinity tags. Methods in enzymology. 326, 245-254 (2000).
- Sainsbury, F., Jutras, P. V., Vorster, J., Goulet, M., Michaud, D. A. Chimeric Affinity Tag for Efficient Expression and Chromatographic Purification of Heterologous Proteins from Plants. Frontiers in Plant Science. 7, 141-141 (2016).
- Krupka, M., et al. The Position of His-Tag in Recombinant OspC and Application of Various Adjuvants Affects the Intensity and Quality of Specific Antibody Response after Immunization of Experimental Mice. PLoS ONE. 11 (2), e0148497 (2016).
- Goel, A., et al. Relative position of the hexahistidine tag effects binding properties of a tumor-associated single-chain Fv construct. Biochimica et Biophysica Acta. 1523 (1), 13-20 (2000).
- Tustian, A. D., et al. Development of a novel affinity chromatography resin for platform purification of bispecific antibodies with modified protein a binding avidity. Biotechnology Progress. , (2018).
- Zandian, M., Jungbauer, A. An immunoaffinity column with a monoclonal antibody as ligand for human follicle stimulating hormone. Journal of Separation Science. 32 (10), 1585-1591 (2009).
- Kelley, B. Very large scale monoclonal antibody purification: the case for conventional unit operations. Biotechnology Progress. 23 (5), 995-1008 (2007).
- Petrou, C., Sarigiannis, Y., S, K. o. u. t. s. o. p. o. u. l. o. s. Ch. 1. Peptide Applications in Biomedicine, Biotechnology and Bioengineering. , 1-21 (2018).
- Menegatti, S., et al. Design of protease-resistant peptide ligands for the purification of antibodies from human plasma. Journal of Chromatography A. 1445, 93-104 (2016).
- Rademacher, T., et al. Plant cell packs: a scalable platform for recombinant protein production and metabolic engineering. Plant Biotechnology Journal. , 1-7 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır