Method Article
Erişkin Drosophila melanogaster Hemositlerin Yaşa Özgü Fagositik Yeteneğinin In Vivo Fagositoz Islımı Ile Değerlendirilmesi
Bu Makalede
Özet
Bu protokol, genç ve yaşlı Drosophila melanogaster hemositlerin fagositoz bakterilere yeteneğini değerlendirmek ve ölçmek için kullanılan fagositozun in vivo testinitanımlar.
Özet
Fagositoz doğuştan gelen bağışıklık yanıtının önemli bir fonksiyonudur. Bu işlem, birincil işlevi çok çeşitli parçacıkları tanımak ve mikrobiyal patojenleri yok etmek olan fagositik hemositler tarafından gerçekleştirilir. Organizmalar yaşlandıkça, bu süreç azalmaya başlar, henüz altta yatan mekanizmalar veya immünosenescence genetik temeli hakkında çok az bilinmektedir. Burada, erişkin Drosophila'da Drosophila hemositlerde fagositik olayları ölçerek fagositozun farklı yönlerindeki yaşa bağlı değişiklikleri değerlendirmek için kullanılan bir enjeksiyon, birçok nedenden dolayı bağışıklık fonksiyonundaki yaşa bağlı değişiklikleri araştırmak için ideal bir model haline gelmiştir. İlk olarak, fagositoz da dahil olmak üzere doğuştan gelen bağışıklık yanıtının birçok genetik bileşeni ve fonksiyonları, Drosophila ve memeliler arasında evrimsel olarak korunur. Bu nedenle, bu protokolü kullanarak elde edilen sonuçlar organizmaların çeşitli yaşa bağlı değişiklikler anlamak için yaygın olarak ilgili olması muhtemeldir. Ayrıca, bu yöntemin hemosit fagositik yeteneğin nicel tahminlerini sağladığını ve çeşitli araştırma konuları için yararlı olabileceğini ve yaşlanma çalışmalarıyla sınırlı kalmaması gerektiğini unutmayın.
Giriş
Enfeksiyona karşı fiziksel ve kimyasal engellerin yanı sıra hücresel bileşenlerden oluşan doğuştan gelen bağışıklık sistemi, çok hücreli organizmalar arasında korunmuş evrimsel dir1,2. Savunma ilk satırı olarak, doğuştan gelen bağışıklık sistemi tüm hayvanlarda işgal patojenler mücadelede kritik bir rol oynar1,2,3. Doğuştan gelen bağışıklık yanıtının bileşenleri, özgüllük ve immünolojik bellekeksikliği2,3,4temelinde sınıflandırılır hücre tipleri geniş bir yelpazede içerir. İnsanlarda, Bu hücre tipleri fagositik monositler ve makrofajlar, nötrofiller ve sitotoksik doğal katil hücreleriçerir 4,5. Fonksiyonel bir bağışıklık sistemine sahip olmak konak sağkalım için zorunlu olmakla birlikte, bağışıklık hücrelerinin işlevini yaşla birlikte azalır açıktır, immünosenescence olarak bilinen bir fenomen5,6. Fagositoz sürecinin farklı yönleri de dahil olmak üzere bağışıklık yanıtıyaşa bağlı değişiklikleri değerlendirmek için güçlü olmak, immünosenescence anlayışımızda yardımcı olabilir. Burada tanımladığımız prosedür, Drosophila melanogaster'deki hemositler tarafından fagositik olayları değerlendirmek ve ölçmek için etkili ve tekrarlanabilir bir yaklaşım sağlar.
Drosophila birçok nedenden dolayı bağışıklık yanıtı eğitimi için ideal bir modeldir. Birincisi, mümkün bir doku bağımlı bir şekilde gen ekspresyonu işlemek için yapmak genetik araçlar geniş bir dizi mevcuttur7. Bu araçlar mutantlar bir koleksiyon içerir, RNA girişim stokları, GAL4/UAS stokları, ve drosophila Genetik Referans Paneli hangi içeren 205 farklı inbred hatları hangi tüm genom dizileri kataloglanır8. Drosophila kısa yaşam döngüsü ve bireylerin üretilen çok sayıda araştırmacılar kontrollü bir ortamda birden fazla kişi test etmek için izin, kısa bir süre içinde. Bu büyük ölçüde genotipler arasında enfeksiyona bağışıklık yanıtları ince farklılıkları belirlemek için yeteneğini geliştirir, cinsiyetler arasında veya yaşlar arasında. Daha da önemlisi, birçok genetik bileşenleri ve doğuştan gelen bağışıklık yanıtı fonksiyonları, fagositoz da dahil olmak üzere, evrimsel Drosophila ve memeliler arasında korunur1,2.
Drosophila'da, enfeksiyonu takip eden fagositoz süreci, memeli makrofajlarına eşdeğer olan plazmatosit adı verilen fagositik hemositler tarafından gerçekleştirilir9. Hemositler parçacıkların geniş bir yelpazede tanımak ve mikrobiyal patojenler9,10,11,,12,13temizlenmesi için gereklidir. Bu hücreler, benlik olmayan kendini ayırt etmeli reseptörleri çeşitli ifade ve fagositik süreci10,11,12,13,14,15yürütmek için gerekli sinyal olayları başlatmak . Bir parçacık bağlandıktan sonra, bir fagositik fincan 11 oluşturan, bir fagositik fincan11,12,13,14oluşturarak, parçacık etrafında genişletmek için plazma membranı yeniden yapılanma ve plazma membran remodeling tarafından içselleştirilmeye başlar. Bu işlem sırasında, sinyallerin başka bir dizi daha fagositik fincan kapatarak parçacık içselleştirmek için hücre söyler, bir membran bağlı fagozom oluşturan11,12,13,14,15. Fagozom sonra bir olgunlaşma sürecinden geçer, farklı proteinler ile ilişkilendirme ve lizozomlar ile eritme, asidik fagojik oluşan11,12,13,14,15. Bu noktada, parçacıklar verimli bir şekilde bozulabilir ve11, 12,13,1314,,15ortadan kaldırılabilir. Drosophila çalışmaları yaşlı sinekler (4 yaş 4 hafta) genç sinekler (1 haftalık) ile karşılaştırıldığında bir enfeksiyon temizlemek için azaltılmış bir yeteneği olduğunu ortaya koymuştur , muhtemelen nedeniyle, en azından kısmen, fagositoz bazı yönleriyle bir düşüşiçin 16,17.
Burada açıklanan yöntem, fagositozun iki farklı yönünü değerlendirmek için biri standart florofor, diğeri pH duyarlı olan iki ayrı floresan etiketli ısı lı E. coli parçacığı kullanmaktadır: parçacıkların ilk yutulması ve fagolyzozomdaki parçacıkların bozulması. Bu töplinde, floro-parçacık floresan, parçacıklar hemositler tarafından bağlanıp yutulduğunda gözlemlenebilirken, pH'ya duyarlı parçacıklar sadece fagozomun düşük pH koşullarında floresan. Floresan olaylar daha sonra dorsal damar boyunca lokalize hemositler görülebilir. Biz dorsal damar lokalize hemositler odaklanmak, hangi bakteriyel açıklığa katkıda bulunduğu bilinen hemositler bulmak için anatomik bir dönüm noktası sağlamak, ve sürekli onları izole etmek için. Ancak, vücudun diğer bölgelerinde hemositler ve hemolenf de açıklık için önemlidir. Bu hücre popülasyonu üzerinde çalışmamış olmamıza rağmen, genel prosedürümüz bu hücrelerin fagositik tahlilleri için de geçerli olabilir. Yaklaşımımızın bir avantajı, fagositik olayları tek tek hemositler içinde ölçebilmektir, bu da fagositik süreçlerdeki ince değişimi tespit etmemize olanak sağlar. 18 ,19 18küttürüile floresan olayları görselleştiren diğer çalışmalar, toplam hemosit sayısı nın17yaşla birlikte değişmesi beklendiği için bizim olgumuzda özellikle dikkate alınması gereken hemosit sayısındaki farklılıklara dikkat etmemaktadır.
Protokol
1. Toplamak ve yaş Drosophila
- Fagositoz test etmek için aynı yaşlı F1 sinekler oluşturmak için, taze sinek gıda içeren bir şişe için uygun genotipler 5-10 bakire kadın ve 5 erkek ekleyin. Biz bir mısır unu pekmezi agar bazlı gıda20kullanın, ama yöntem sinekler yetiştirilen diyet türüne bakılmaksızın çalışması gerekir. Bu deney için Biz Hemese kullanılır (O)-GAL4; UAS-GFP hemositleri genetik olarak etiketlemek için uçar.
NOT: Daha fazla sinek kullanılabilir, ancak D. melanogaster bazı satırları çiftleşemez veya aşırı kalabalık larva gelişimi21 ve fagositoz üzerinde olumsuz etkileri olabilir. - İstenilen deneysel koşullar altında sinekler korumak. Bu deney için He-GAL4'ün bakımını koruyun; UAS-GFP 24 °C'de uçar. Yetişkin sineklerin bir hafta çiftleşmesine izin verin ve yetişkinleri çıkarın. F1 sinekleri daha sonra deneysel kullanım için klozyon sonra bu şişelerden toplanır.
- Hafta boyunca veya sinek istenilen sayıda toplanana kadar bakire sinek toplamak. Bakireler gerekli değildir; ancak, miating bağışıklık yanıtını etkileyebilir. F1 sinekleri bakire olarak test edilecekse, klozyon dan sonraki 8 saat içinde erkekleri ve dişileri ayırın ve çiftlemesini önlemek için ayrı şişelerde muhafaza edin. Her yaş başına en az 10 sinekte fagositozun değerlendirilmesine izin verecek kadar sinek toplayın.
- Bir hafta sinek yaşlanma varsa, enjekte edilecek her parçacık, ya floro-parçacıklar veya pH duyarlı parçacıklar için tedavi durumu başına en az 50 sinek toplam veya 20 sinek toplamak. Bu, deney sırasında titretmek için en az 10 sinek sağlayacaktır.
- Yaşlanma 3 haftadan fazla sinekler, toplam en az 100-150 sinek toplamak, ya da 50-75 fagosityolis ölçmek için yeterli sinek olduğundan emin olmak için tedavi durumu başına sinekler. Laboratuvarda yaşlanma sinekleri, genellikle 12:12 L:D 24 °C'de muhafaza böcek kafesleri kullanın koşulları ve her gün gıda değiştirin. Kafesler yerine şişeler kullanılıyorsa, uç şişedeki yiyeceğin durumuna bağlı olarak her 3-5 günde bir yeni şişelere dönüşür. İhtiyaç duyulan sinek sayısı, yaş fagositozunun ne kadar geç analiz edileceğine ve belirli bir çevresel durumda genotipin yaşa özgü sağkalım oranlarına bağlıdır.
- Eğer genç ve yaşlı sinekler değerlendirilecekse, 1 haftalık ve yaşlı sineklerin aynı gün enjekte edilmesi için buna göre planlayın. Bu, deneyler arasındaki parçacık konsantrasyonu değişimlerini en aza indirecek ve yaşın fagositik ölçüm üzerindeki etkisinin, talın yapıldığı günün etkisiyle şaşkın olmamasını sağlayacaktır.
- Toplanan sinekleri 5-7 günlük olana kadar 24 °C'de barındırın veya sinekleri istenilen yaşa kadar koruyun.
2. Floresan etiketli parçacıklar hazırlayın
- Isıda öldürülen E. coli floro-partiküllerini veya pH duyarlı E. coli partiküllerini sırasıyla 20 mg/mL veya 1 mg/mL stok konsantrasyonuna yeniden oluşturun. Diğer bakteriler, bazı deneyler için daha uygun olabilecek, ancak uygun stok konsantrasyonları için üreticinin talimatlarına bakın kullanım için kullanılabilir.
- Floro partiküller için 990 μL 1x PBS (pH 7.4) veya tercih edilen tampon ve 10 μL 2 mM (%20) ekleyin sodyum azit. Girdap karıştırmak için.
NOT: Sodyum azit atlanabilecek bir koruyucudur; ancak sodyum azitolmadan hazırlanan partiküller uzun sürmez. Floro-partiküller 24 saat içinde, pH'a duyarlı parçacıklar ise 7 gün içinde kullanılmalıdır. - PH'a duyarlı parçacıklar için 1.980 μL 1x PBS (pH 7.4) veya tercih edilen tampon ve 20 μL 2 mM (%20) ekleyin sodyum azit. Girdap karıştırmak için.
- 1,5 mL mikrosantrifüj tüplerinde birden fazla tek kullanımlık 20 μL aliquot yapın. Floro-partikülleri bir yıla kadar -20 °C'de, pH'ya duyarlı parçacıkları ise 4 °C'de 6 aya kadar ışıktan koruyun.
- Floro partiküller için 990 μL 1x PBS (pH 7.4) veya tercih edilen tampon ve 10 μL 2 mM (%20) ekleyin sodyum azit. Girdap karıştırmak için.
- Enjeksiyon gününde, kullanmadan önce parçacıklardan sodyum aziti çıkarın. Bunu yapmak için, oda sıcaklığında 15.000 x g 5 dakika için parçacıkları santrifüj.
- 1x PBS veya tercih edilen tampon 50 μL resuspend tarafından supernatant ve yıkama parçacıkları iki kez çıkarın ve 15.000 x g5 dakika için santrifüj .
- İkinci yıkamadan sonra, 1x PBS veya tercih edilen tampon 100 μL'lik süpernatant ve resuspend partiküllerini çıkarın. Çözümü tüpte tutun ve deney boyunca ışığa maruz kalmamayı en aza indirin. Sodyum azid çıkarıldıktan sonra, 24 saat içinde floro-parçacıklar kullanın ve 5-7 gün içinde kullanılan pH duyarlı parçacıklar kullanın.
NOT: Daha önceki deneylerimizde, bu parçacık konsantrasyonunun fagositik olayların sayılabilir sayılarını sağladığını ve hemositler tarafından fagositoz için mevcut olan parçacıkların sayısının17'yisınırlamadığını gördük. Ancak, bu protokolün kullanıcıları deney koşullarında hemositler tarafından fagositoz için yeterli sayıda parçacık olduğundan emin olmak için sonuçları diğer konsantrasyonları kullanarak karşılaştırmak isteyebilirler.- Sodyum azit atlanırsa, parçacıklar enjeksiyonlar için hazırlanan tampon daki 1:5 partikülleri seyreltin.
- Parçacıklara bir damla (~10 μL) yeşil gıda boyası ekleyin. Bu, sineklerin enjekte edilmesini kolaylaştırır.
3. Sinekleri enjekte edin
- Enjeksiyonlar için cam iğneler hazırlayın.
- Pipet çekmecesi kullanarak cam iğneleri çekin. Pipet çekmece ısıtıcısını 55 °C'ye, solenoidi ise 45'e ayarlayın. Diğer iğnelerin aynı hassasiyetle çalışacağı garanti olmadığı için sadece enjektörle birlikte verilen iğneleri kullanın.
- 1 mL'lik steril şırıngayı mineral yağla doldurun ve nano-enjektörle birlikte verilen 30 göstergeli hipodermik (G) iğneyi takın.
- 30 G iğneyi çekilen cam iğnenin künt ucuna yerleştirerek çekilen kılcal iğneyi geri doldurun ve mineral yağla doldurun. 30 G iğneyi yavaşça çıkarın, bu da yanlış enjeksiyon hacimlerine neden olabileceğinden, iğne boyunca hava kabarcıkları olmamasını sağlar. Enjektör iğneyi geri doldurmadan düzgün çalışmaz.
- Forseps kullanarak, çözeltinin atılmasına izin vermek için bir açıklık oluşturmak için iğnenin ucunu kırın.
- Nano enjektörü birleştirin.
NOT: Diğer enjektörler kullanılabilir. Aşağıda açıklanan yöntem nano-enjektör için geçerlidir. Diğer enjekte edenler için talimatlar için kullanım kılavuzuna başvurun.- Enjektörü istenilen hacimde ayarlayın (46 nL ile 69 nL arasında).
- Koltu çıkarın ve sızdırmazlık O-halkası yerleştirin, girintisi kadar iğnenin arka ucunu almak için bakan beyaz spacer, ve metal piston üzerine büyük O-halka, bu sırada. Sıkmadan kolleti yeniden takın.
- Metal pistonu yağ dolu cam iğnenin künt ucuna yerleştirin. İğneyi yavaşça aşağı doğru itin ve daha büyük O-halkasına takın. Güvenli olana kadar kollet sıkın.
NOT: Metal piston koltu ötesine uzanmazsa, piston görünür olana kadar 'BOŞ' tuşuna basın ve basılı tutun. Bu, pistonun iğneye yerleştirildiğinden emin olmayı kolaylaştırır. - Enjektör arılar kadar 'BOŞ' tuşuna basın ve tutun. Bu iğne den mineral yağ çoğu çıkar, yağ küçük bir hacim bırakarak iki sıvı arasında bir bariyer olarak hareket etmek, hem de hava kabarcıkları kaldırır.
- Hazırlanan parçacıkları içeren mikrosantrifüj tüpüiçine cam iğneucu ekleyerek ya floro-parçacıklar veya pH duyarlı parçacıklar ile iğne doldurun.
- Enjektör arılar kadar 'FILL' tuşuna basın ve tutun.
- Enjeksiyon
- Boş bir şişeye enjekte edilecek sinekleri aktarın. Şişeyi buza yerleştirerek sinekleri hareketsiz hale getirin. CO2 de sinekleri hareketsiz leştirmek için kullanılabilir. Ancak, pH'a duyarlı parçacıklar kullanılırken, yüksek CO2 düzeylerinin kullanılan tamponları yapay olarak asitlendirebileceğini ve arka plan floresanını yükseltebileceğini unutmayın.
- Sinekleri toraksın sternopleural plakasını enjekte edin (Şekil 1A). Yeşil boya sinek içine gidiyor görülürse enjeksiyon başarılı olur (Şekil 1B). Sinek yeşile dönmezse, iğnenin tıkanmaydığından emin olun.
NOT: Alternatif olarak, sinekler karın enjekte edilebilir, ancak enjeksiyon alanı tüm deneyler boyunca tutarlı tutun. - İlk ve son sinek enjekte edildiği zamana dikkat çekerek, enjekte edilen sinekleri yeni bir besin şişesine yerleştirin. Enjeksiyonların tamamlanması için gereken süre nedeniyle deneysel hatayı en aza indirmek için enjeksiyonları zamanında tamamlayın. Uygulama ile, sinek bir dizi enjekte etmek için en fazla 10 dakika sürer. Tüm sinekler iyileşene kadar şişeyi yan tarafına yatırın, sineklerin yiyeceklere yapışmasını önlemek için.
- Sinekler 60-90 dakika, deneysel koşullara bağlı olarak kurtarmak için izin verin. Burada 60 dk'lık bir iyileşme süresi kullanılmıştır. Bu iyileşme süresi aralığı Horn ve ark. çalışmada deneysel koşullarda fagositik olayları saymak için en uygun olduğunu unutmayın17. Ancak, bazı koşullar altında, bu tedavi grupları arasında fagositoz ince farklılıklar tespit etmek için çok uzun olabilir. Kontrol ve deneysel sonuçlar arasındaki maksimum farklılıkları ortaya çıkaracak iyileşme süresini belirlemek için daha önce17'de yapıldığı gibi zaman kursu deneylerinin yapılması yararlı olabilir. Ne olursa olsun iyileşme süresi seçilirse seçilsin, tüm deneysel tedaviler de bunu tutarlı tutun.
- Aynı gün floro-parçacıklar ve pH'ya duyarlı parçacıklar enjekte ediyorsanız, her çözelti için yeni bir iğne kullanın. Her ikisi de floresan kırmızı ise her iki parçacık ile bireysel sinekenjekte etmeyin, sonuç fagositoz iki yönü arasında ayrım olmaz, parçacık bağlama / yutma ve parçacık dahil fagozom.
4. Dorsal damarın kesilmesi
- Sinekler 60-90 dakika boyunca iyileştikten sonra, tüm canlı sinekleri boş bir şişeye aktarın ve buz üzerinde hareketsiz kalın.
- Bir seferde bir fly'ı silikon elastomer diseksiyonu plakasına aktarın.
NOT: Oda sıcaklığında kür leme durumunda, kullanımdan en az 1 hafta önce diseksiyon plakaları hazırlayın. Bunu yapmak için, elastomer hazırlamak ve yaklaşık yarım çanak doldurarak, 33 mm x 10 mm Petri kabına dökün. Hava kabarcıklarını en aza indirmek için çanak düz bir yüzeye hafifçe dokunun. Tabaklar en az bir hafta boyunca oda sıcaklığında, rahatsız edilmeden oturun.- Bir diseksiyon stereo mikroskobu altında, sinek ventral tarafı yukarı doğru yönlendirmek.
- Böcek pimleri kullanarak, toraks ve karın en arka ucundan başka bir iğne ile cinsel organ yakın bir iğne takarak plaka üzerine sinek pin(Şekil 2A). Diseksiyonu engellememek için numuneyi sabitlemeden önce pimleri ikiye kesmek yararlı olabilir. Diseksiyon plakası başına en fazla 10 sinek ile tekrarlayın.
NOT: İsteğe bağlı: Plakaya uçup sabitlemeden önce kanatları ve bacakları çıkarın. Bu ortam eklendiğinde sinek etrafında oluşan bir kabarcık önlemeye yardımcı olacaktır. - Tüm sinekler tabağa sabitlendikten sonra, bir transfer pipeti kullanarak sinekleri (~1 mL) kapsayacak kadar diseksiyon ortamı ekleyin.
- Forceps veya mite makas kullanarak, baş çıkarın.
- Miteklik makas kullanarak, iki yatay kesi ler yapmak: bir karın arka pin üzerinde doğrudan, ve karın en ön ucunda başka, nerede toraks ve karın karşılamak (Şekil 2B, C). Şekil2'de, baş yönünü netleştirmek için sağlam bırakılmıştır.
- İki yatay kesiyi birbirine bağlayan dikey bir kesi yapın (üç kesik I harfine benzer). Bu karın boşluğu açılacaktır (Şekil 2D).
- Forceps kullanarak, dorsal damar kaçınarak, iç organları ve doku kaldırmak. Eğer rahatsız edilmeden, şeffaf sırt damarı genellikle karın ön ucuna yakın zonklayan görülebilir. İlave iğneler, miğdelerin yeni kesilmiş uçlarını sabitlemek için kullanılabilir(Şekil 2E, F).
- Miğfif makas kullanarak, toraks çıkarın. Alternatif olarak, toraks bir mikroskop slayt üzerine diseksiyon lu cuticles ve dorsal damar montaj önce kaldırılabilir.
- Kalan sinekler ile tekrarlayın. fagositik oranda olası varyasyonları en aza indirmek için, zamanında sinekler diseksiyon. Tüm sinekler kesildikten sonra, plakaya sabitlenmiş bağlı sırt damarı ile cuticles bırakın. 5. adımın tamamı diseksiyon plakasında yapılacaktır. Bu, adımlar arasında piriçlerin zarar vermesini veya yanlışlıkla atılmasını önler.
5. Fiksasyon ve boyama
- %4 paraformaldehit (PFA) ekli sırt damarı ile kesilen cuticles düzeltmek.
- Her adım için yeni bir tek kullanımlık aktarım pipeti kullanarak, diseksiyon ortamını atın ve 1 mL%4 PFA ile değiştirin. Fiksasyon ve boyama boyunca, diseksiyonları mümkün olduğunca ışıktan koruyun.
- 20 rpm sallanan ile 15 dakika oda sıcaklığında kuluçka. Bu doku zarar başlayabilir gibi diseksiyon, 20 dakikadan fazla fiksatif oturup izin vermeyin.
- 1x PBS + %0.1 Tween (PBST) içinde 2x cuticles yıkayın.
- Fiksatif çıkarın ve 1 x PBST 1 mL ile değiştirin.
- Sallayarak 15 dakika oda sıcaklığında yıkayın.
- 1x'i tekrarlayın.
NOT: İncelenen sabit doku, ilk yıkamadan sonra taze PBST ile değiştirilerek ışıktan korunarak, 4 °C'de 3 güne kadar saklanabilir. Antikor lar kullanılacaksa sabit doku saklamayın. Antikorlar en iyi sonuçları için taze doku ile kullanılmalıdır.
- İsteğe bağlı: Antikor boyama. Antikorlar açıkça dorsal damar görselleştirmek için kullanılabilir (Şekil 3), veya hemosit spesifik belirteçleri tespit etmek için. Bu dorsal damar boyunca sadece hücrelerin sayılır veya hemositlerin membran işaretlemek için sağlayabilir.
- İkinci yıkama çıkarın, uygun seyreltme birincil antikor ekleyin. Gece boyunca 4 °C'de, sallanan.
- Birincil antikor çıkarın ve sallanan ile 15 dakika PBST ile iki kez yıkayın.
- Floresan ikincil antikor ekleyin. Floresan partikülleri gizlememesi için yeşil floresan antikor öneriyoruz. 2 saat oda sıcaklığında inkübül, sallanan ile.
- Sekonder antikor çıkarın, PBST ile her biri 15 dakika boyunca iki kez yıkayın.
- DAPI ile leke.
- Son yıkamayı çıkarın ve PBST'de seyreltilmiş 1 mL DAPI (1:1000) ile değiştirin.
- Oda sıcaklığında sallanan ile 20 dakika boyunca leke.
- DAPI'yi çıkarın ve 2x yıkayın (adımı 5.2'yi tekrarlayın).
- Son yıkamayı taze 1x PBST ile değiştirin.
NOT: Sinekler 4 °C'de, ilk yıkamadan sonra taze PBST ile değiştirilerek ışıktan 3 güne kadar saklanabilir.
6. Mikroskop slaytlarına pirilerin montajı ve görüntüleme
- Kesilmiş piriçleri hazırlayın.
- Diseksiyon stereomikroskop altında, görüntüleme engelleyebilir aşırı mite kupülü kesti.
- Forceps kullanarak, bağlı sırt damarı ile cuticles transfer 1.5 mL mikrosantrifüj tüp içeren 70% gliserol. Gliserol içinde cuticles yerleştirerek PBST kaldırmak yardımcı olacak ve görüntüleme sırasında daha net bir görüntü sağlar.
- Mikroskop slayt üzerine cuticles monte.
- Bir mikroskop slayt% 70 gliserol birkaç damla ekleyin.
- Forceps kullanarak, gliserol tüpünden cuticles kaldırmak ve slayt gliserol yer.
- Diseksiyon stereo mikroskobu altında, cuticles ventral tarafı yukarı yönlendirmek için forceps kullanın, dorsal damar görünür olmasını sağlamak. Miğdekoyu koyu pigment yüz üstü olacak.
- Gerekirse gliserol ek bir damla ekleyin. Bu hava kabarcıkları önlemeye yardımcı olur ve daha net bir görüntü sağlar.
- Hafifçe tırnak cilası ile cuticles ve mühür kenarları üzerinde bir coverslip yerleştirin. Devam etmeden önce 10-15 dakika kurumasını bekleyin. Sinekleri hemen görüntüleyin veya 4 °C'de ışık geçirmez bir kutuda saklayın.
- Dorsal damarı görüntüle.
- Floresan mikroskop kullanarak, dorsal damarın optik bölümleri oluşturmak için yapısal girişim sistemini kullanın. Bir konfokal mikroskop alternatif olarak ek doğruluk sağlayabilir kullanılabilir. 20x objektif ve tercih edilen görüntüleme yazılımı kullanarak sırt damarının Z-yığın görüntülerini elde edin. 10 mm'lik bir ölçek çubuğu ekleyin ve görüntüleri tiff dosyaları(Şekil 4)veya istenilen biçim olarak düzgün bir şekilde etiketleyin ve kaydedin.
NOT: Elde edilen Z-stack görüntülerinin sayısı diseksiyonlar arasında farklılık gösterebilir ve dorsal kabın ne kadar iyi parçalara geçirildiklerine ve görüntüler arasında istenilen adım boyutuna bağlıdır. Burada, adım boyutu 0.49 mm olarak ayarlandı. Bu sayı, deneyimlerimizde yığın başına 3 ila 40 görüntü arasında değişebilir.
- Floresan mikroskop kullanarak, dorsal damarın optik bölümleri oluşturmak için yapısal girişim sistemini kullanın. Bir konfokal mikroskop alternatif olarak ek doğruluk sağlayabilir kullanılabilir. 20x objektif ve tercih edilen görüntüleme yazılımı kullanarak sırt damarının Z-yığın görüntülerini elde edin. 10 mm'lik bir ölçek çubuğu ekleyin ve görüntüleri tiff dosyaları(Şekil 4)veya istenilen biçim olarak düzgün bir şekilde etiketleyin ve kaydedin.
7. Görüntüleri analiz edin
- ImageJ kullanarak floresan olayları ölçün.
- Görüntüleri açın ve yığın: Resim à Stacks à Images to Stack.
- Her olaydan her biri sinek başına en az 10 hücreden, enjekte edilen parçacık türü başına yaş başına en az 10 sinekten tıklayarak, DAPI pozitif bir çekirdeğe odaklanmış 10 mm çapındaki 10 mm çapındaki floresan sinyalleri sayın: Eklentiler à Analyze à Hücre Sayıcı Bildirimi ( Şekil5A). Hücre karşı bildirim aracı izlenen her hücreye farklı bir renk atar ve bu hücre içinde tıklanan her floresan olaya karşılık gelen renkli bir nokta ile.
- Her noktayla ilişkili sayaç ve yığın konumunu listelemek için, Analiz sekmesi nin altında 'm' tuşuna basın veya Ölçüle'yi seçin veya her hücrede sayılan olay sayısını bir sonuç tablosunda görüntülemek için 'alt +y'(Şekil 5B)tuşuna basın.
- Hücre sayımlarını istatistiksel analiz için kullanılacak bir elektronik tabloya aktarın.
- İstatistiksel analiz yapın.
- Sabit efektli ANOVA veya karma model iç içe geçmiş ANOVA'yı kullanarak fagositik olaylardaki farklılıkları analiz edin. Karışık modeller yaş ve genotip ve her genotip17içinde yuvalanmış bireylerin rasgele etkisini ana sabit etkilerini test etmek için kullanılabilir.
NOT: Araştırmacılar, verileri analiz etmek için kullanılan herhangi bir istatistiksel yordamın varsayımlarını test etmede titiz olmalıdır.
- Sabit efektli ANOVA veya karma model iç içe geçmiş ANOVA'yı kullanarak fagositik olaylardaki farklılıkları analiz edin. Karışık modeller yaş ve genotip ve her genotip17içinde yuvalanmış bireylerin rasgele etkisini ana sabit etkilerini test etmek için kullanılabilir.
Sonuçlar
Açıklanan enjeksiyon yöntemlerini göstermek için Şekil 1A, Drosophila melanogaster'deki enjeksiyon bölgesini ve gıda boyasının sineğin enjekte edildiğinin görsel bir teyidine nasıl izin verdiğini göstermektedir (Şekil 1B). Gıda boyası eklenmesi de tıkanmış bir iğne tanınmasına yardımcı olur. Enjeksiyonlar karın içinde yapılabilir, ancak enjeksiyon alanı deneyler arasında tutarlı tutun. Bu, her deneme arasındaki olası varyasyonları en aza indirmeye yardımcı olur.
Dorsal damar boyunca yerleşik hemositler içinde floresan etiketli parçacıkları görselleştirmek için, dorsal damar ve bağlı karın mitesi diseksiyon. Şekil 2A-F diseksiyon yöntemlerini özetler.
Genç ve yaşlı sineklerin fagositoz yapma kabiliyetini değerlendirmek için, dorsal damar boyunca hemositler floresan mikroskop kullanılarak görselleştirilmektedir. Sadece dorsal damar boyunca hücrelerin sayıldığından emin olmak için, bazı kan hücresi belirteçleri veya kalp spesifik kollajen için antikorlar veya GFP etiketli genler, Hemese ve Hemolectin gibi, veya Pericardin (Şekil 3), sırasıyla, kullanılabilir22,23,24. Floresan olarak etiketlenmiş E. coli partikülleri 1 mm uzunlukta, hemositler ise 10 mm çapında17mm'dir. Sadece DAPI pozitif bir çekirdek üzerinde ortalanmış 10 mm çapında bulunan floresan olaylar sayılır(Şekil 4). Floresan olayları ölçmek için ImageJ yazılımı kullanılır (Şekil 5).

Şekil 1: Enjeksiyon yeri ve görsel doğrulama. (A) Toraksın lateral tarafı pull-kılcal iğne ile delinmiş. (B) Enjeksiyonlar parçacık çözeltisine yeşil gıda boyası eklenerek görsel olarak doğrulanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
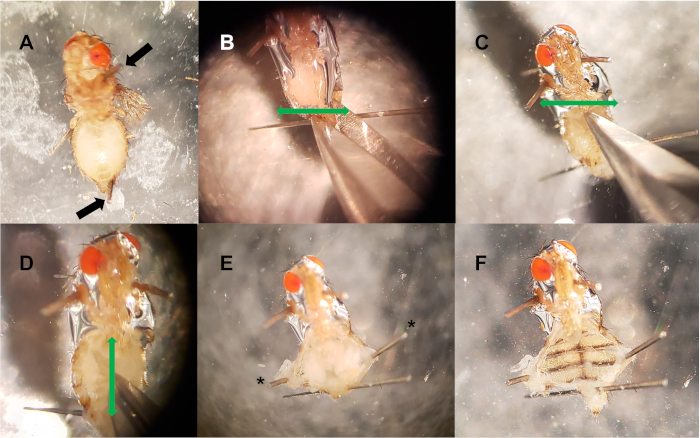
Şekil 2: Dorsal damar diseksiyonu. (A) Pinler toraks ve arka karın (siyah oklar) yerleştirilir. (B-C) Karın arka ucunda(B)ve ön uçta(C)iki yatay kesi (yeşil ok) yapılır. (D) İki yatay kesiği birbirine bağlayan, karın ortasından aşağı doğru dikey bir kesi (yeşil ok) yapılır. (E) İsteğe bağlı iğneler (*) karın boşluğunu açmak için kullanılır, iç doku açığa. (F)İç doku (kırpma, bağırsak, rahim, yumurtalıklar, yağ organları) çıkarılır, dorsal damar açığa. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
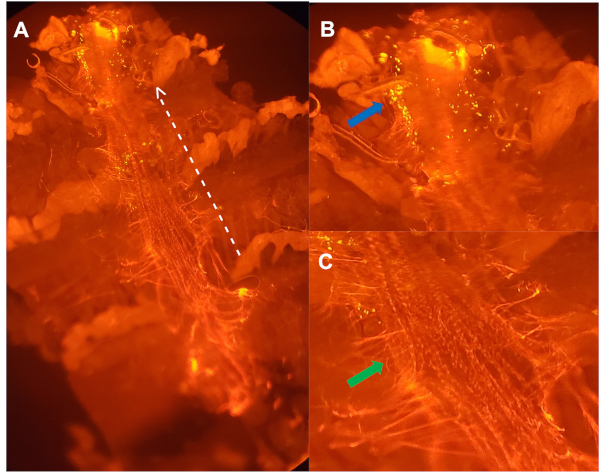
Şekil 3: Perikardin(A) karşı yönlendirilmiş antikor ile boyanmış, pH duyarlı parçacıklar enjekte 5 haftalık bir kadın dan diseksiyon lu dorsal damar Ventral görünümü . Noktalı beyaz çizgi ön bölgeye işaret eden ok ile, sırt damarının yan tarafında özetliyor. (B) (A) (A) (A)genişlemiş görüntüsü: dorsal kabın ilk aort odası içinde, aktif olarak bakterileri alçaltan hemosit (mavi ok) kümeleri. (C) (A) ekstrasellüler matris özetleyen genişletilmiş görüntü (ECM) kollajen benzeri protein, Pericardin (yeşil ok), yerinde dorsal damar tutan24. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
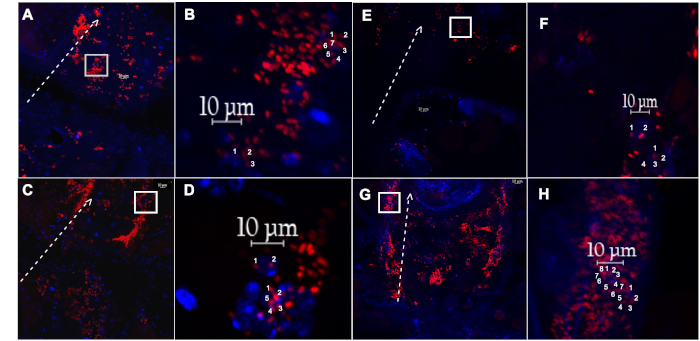
Şekil 4: PH'a duyarlı parçacıklar veya floro-parçacıklar enjekte edilen dişi sinekten kesilen dorsal damar ve ilişkili hemositler. (A) Dorsal damar ve ilişkili hemositler ile yuttu pH hassas etiketli E. coli parçacıkları (kırmızı), veya (E) floro etiketli E. coli parçacıkları (kırmızı), 1 haftalık bir sinek izole, 60 dakika için kurtarma sonra (B,F) Büyütülmüş inset (A) ve (E) (beyaz kutu), sırasıyla, tek tek iki hemosit sayısı ile sayım ile iki hemosit. (C) Dorsal damar ve ilişkili hemositler ile yuttu pH hassas etiketli E. coli parçacıkları (kırmızı), veya ( G) floro etiketli E. coli parçacıkları (kırmızı), 5 haftalık bir sinek izole, 60 dakika için kurtarma sonra (D,H) Büyütülmüş inset (C) ve (G) (beyaz kutu), sırasıyla, tek tek iki hemosit sayısı ile sayım ile iki hemosit. Noktalı beyaz çizgi ön bölgeye işaret eden ok ile, sırt damarının yan tarafında özetliyor. Dapi (mavi) ile boyanmış çekirdekler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
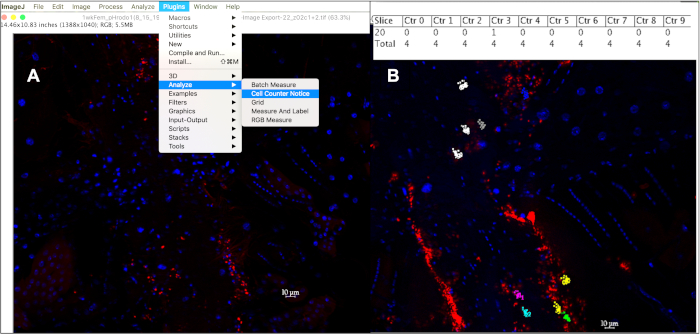
Şekil 5: ImageJ'deki hücre sayacını kullanarak 10 mm hemosit içindeki fagositik olayların ölçülmesi. (A) ImageJ'de görüntü(ler) açıldıktan sonra, Hücre Sayacı Bildirimi aracı hücre başına fagositik olayları izlemek için kullanılabilir. (B) Bu araç, sayılmak üzere seçilen her hücreye farklı bir renk atayacaktır ve her nokta o hücre içindeki floresan olaya karşılıkgelir. 'alt+y' tuşuna basıldığında, hücre başına sayılan olay sayısını gösteren bir tablo görüntülenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada açıklanan protokol, fagositözün farklı yönlerini kontrollü deneysel koşullar altında ölçmenin güvenilir bir yoludur. Biz sadece gram negatif bakteriyel parçacıklar ile bu prosedürü test ettik ve gram pozitif bakteriyel parçacıklar kullanılırsa sonuçları farklı olabilir unutmayın. Gerçekten de, farklı deneysel koşullarda hem gram negatif hem de gram pozitif bakterilere fagositik yanıtları karşılaştırmak ilginç olacaktır. Nano-enjektör kullanımı enjeksiyon hacimleri üzerinde hassas kontrol sağlar, her sinek parçacıkların aynı hacimde enjekte edilmesini sağlamak. Protokole sınırlama bir parçacık preparatları tutarsızlıklar geliyor. Parçacıklar dondurulduktan sonra toplanır, bu yüzden seyreltme hacimleri veya girdap eksikliğindeki küçük değişimler deneyler arasındaki parçacık konsantrasyonunu etkileyebilir. Yaşlar arasındaki partikül konsantrasyonlarında olası değişimleri en aza indirmek için, aynı iğne ve parçacık solüsyonu kullanarak aynı gün 1-5 haftalık sinekler enjekte etmek yararlıdır. Başka bir potansiyel dezavantajı diseksiyon sırasında, sırt damarı ve / veya mite kolayca pimleri düzgün ele değilse zarar görebilir. Dorsal damarı bozmamak için, diseksiyon başına kullanılan pim sayısını en aza indirin. Bu diseksiyon yönteminin avantajı, diseksiyon plakasında tüm fiksasyon, yıkama ve boyama adımlarının yapIlebilmektedir. Cuticles aşağı sabitlenmiş olduğundan, bu basamaklar arasında kaybolan cuticles önler.
Mevcut yöntemlerle karşılaştırıldığında18,19,25,26,27,28,29, açıklanan protokolün avantajları ve sınırlamaları vardır. Dorsal damarı inceleyerek, bu konumdaki tek tek hemositleri görselleştirebilir ve ölçebiliriz. Bu, deney grupları arasındaki fagositik aktivitedeki ince varyasyonları algılamayı mümkün kılar. Diğer yöntemler bir Bleed / Kazıma titre19kullanarak hemositler toplayarak floresan etiketli parçacıklar görselleştirmek19,25,26,27, veya bozulmamış ventral cuticle18,19,28,29; ancak dorsal miteile görüntülendiğinde bireysel hemositler değerlendirilemez. Bu protokolün avantajı, Bleed / Kazıma yöntemi ile karşılaştırıldığında bizim yöntem bize sadece dorsal damar ile ilişkili hemositler değerlendirmek için izin verir, ve dolaşım hücreleri veya vücut duvarı boyunca olanlar için hesap yok, hangi fonksiyonel olarak farklı olabilir. Dorsal damar diseksiyon da bir floresan quencher ile enjeksiyonlar ikinci bir tur dahil etmek ihtiyacını ortadan kaldırır, Trypan mavi gibi19,26. Bunun nedeni, bir hücreye bağlı olmayan veya yutulmayan parçacıkların yıkama adımları sırasında yıkanmasıdır. Tersine, diseksiyon gerektirmedikleri için alternatif yöntemlerin yapılması daha kolay olabilir. Dorsal damar diseksiyon öğrenmek kolay olsa da, bu adım bazı deneysel tasarımlarda mümkün olmayabilir karmaşıklık düzeyi ekler.
Bu in vivo fagositoz testinin açıklanan kullanımı farklı yaşlar arasındaki fagositik olayları değerlendirmek ve ölçmek için olsa da, bu protokol son derece uyarlanabilir ve genotip, cinsiyet veya doku tipi arasındaki fagositozun farklı yönlerini analiz etmek için kullanılabilir. Fagositozun çoğu hücreli hayvan için merkezi öneme sahip olması nedeniyle, bu sürecin yaşla birlikte nasıl azaldığını anlamak yaşlanan popülasyon için daha iyi tedavi edici tedavilere yol açabilir. Bu yaklaşım, fagositöz özel olarak, bağışıklık yanıtındaki yaşa bağlı değişikliklerin yönlerini açıklamak için uzun vadeli bir potansiyel sunmaktadır.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma Ulusal Sağlık Enstitüleri R03 AG061484-02 ve UMBC Doğa ve Matematik Bilimleri Fakültesi Becton Dickinson Fakültesi Araştırma Fonu'ndan gelen hibelerle desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.10 mm Insect pins | Fine Science Tools | 26002-10 | Here: pins are cut in half, and the sharp end is used |
| 1 mL sterile syringes | Becton Dickinson | 309602 | Filled with mineral oil to load needle |
| 15% Fetal Bovine Serum (FBS) | Gibco | 16000-044 | for dissection media |
| 16 % Paraformaldehyde | Electron Microscopy Sciences | 15710 | EM-grade, 4% working, diluted in 1X PBS |
| 1x Phosphate buffered saline (PBS) | Sigma | P3813 | |
| 3 mL Trasnfer Pipet | Falcon | 357524 | |
| 3.5" Glass Capillaries | Drummond | 3-000-203-G/X | 1.14mm O.D X 3.5" length X 0.53" I.D |
| 35x10 mm Petri dishes | Becton Dickinson | 351008 | Used as dissection plate, filled half way with Sylgard |
| 6x penicillin/streptomycin | Life Technologies | 15140-122 | for dissection media |
| 70% Glycerol | Sigma | G9012 | |
| Analog Vortex mixer | VWR | 58816-121 | |
| Biological point forceps, Dumont No. 5 | Fine Science Tools | 11295-10 | |
| DAPI (4',6-diamidino-2-phenylindole) | Life Technologies | D1306 | Diluted 1:1000 in 1x PBST |
| Drosophila strain | w[*]; P{w[+mC]=He-GAL4.Z}85, P{w[+mC]=UAS-GFP.nls}8 | ||
| E. coli (K-12 strain) BioParticles™, Alexa Fluor™ 594 conjugate | Life Technologies | E23370 | |
| Glass slides | Premiere | D17026102 | |
| Live cell imaging solution | Life Technologies | A14291DJ | preferred buffer for particle preparation and dilutions |
| Mineral oil | Mpbio | 194836 | |
| Nanoject II automatic nanoliter injector | Drummond | 3-000-204 | |
| Narrow Polystyrene Super Bulk Drosophila Vials | Genesee | 32-116SB | Size: 25 X 95 mm |
| Nutating Mixer | Fisher Scientific | 88-861-043 | Speed used: 20 rpm |
| pHrodo™ Red E. coli BioParticles™ Conjugate for Phagocytosis | Life Technologies | P35361 | |
| Schneider's Drosophila cell culture media (1x) | Gibco | 21720-024 | Dissection media, combine: Schneiders, FBS, and pen/strep; filter sterilize |
| Sodium azide | Sigma-Aldrich | S2002 | 2mM (or 20%) working |
| Spring scissors | Fine Science Tools | 15000-00 | |
| Sylgard 184 Silicone elastomer | Electron Microscopy Sciences | 24236-10 | Prepare according to provided protocol |
| Tween 20 | Sigma | P1379 | For PBS + 0.1% tween |
| Vertical Pipette Puller Model 700C | David Kopf Instruments | 812368 | Heater: 55? Solenoid: 45 |
| Zeiss AxioImager.Z1 fluorescent microscope | Zeiss | Here: Apotome structural interference system with Zeiss Zen imaging software |
Referanslar
- Abhyankar, V., Kaduskar, B., Kamat, S. S., Deobagkar, D., Ratnaparkhi, G. S. Drosophila DNA/RNA methyltransferase contributes to robust host defense in ageing animals by regulating sphingolipid metabolism. The Journal of Experimental Biology. 221, (2018).
- DeVeale, B., Brummel, T., Seroude, L. Immunity and aging: the enemy within. Aging Cell. 3 (4), 195-208 (2004).
- Gomez, C. R., Nomellini, V., Faunce, D. E., Kovacs, E. J. Innate immunity and aging. Experimental Gerontology. 43 (8), 718-728 (2008).
- Panda, A., et al. Human innate immunosenescence: causes and consequences for immunity in old age. Trends in Immunology. 30 (7), 325-333 (2009).
- Aw, D., Silva, A. B., Palmer, D. B. Immunosenescence: emerging challenges for an ageing population. Immunology. 120 (4), 435-446 (2007).
- Min, K. -. J., Tatar, M. Unraveling the molecular mechanism of immunosenescence in Drosophila. International Journal of Molecular Sciences. 19 (9), 2472 (2018).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Hales, K. G., Korey, C. A., Larracuente, A. M., Roberts, D. M. Genetics on the fly: a primer on the Drosophila model system. Genetics. 201 (3), 815-842 (2015).
- Banerjee, U., Girard, J. R., Goins, L. M., Spratford, C. M. Drosophila as a genetic model for hematopoiesis. Genetics. 211 (2), 367-417 (2019).
- Rämet, M., Manfruelli, P., Pearson, A., Mathey-Prevot, B., Ezekowitz, R. A. B. Functional genomic analysis of phagocytosis and identification of a Drosophila receptor for E. coli. Nature. 416 (6881), 644-648 (2002).
- Garschall, K., Flatt, T. The interplay between immunity and aging in Drosophila. F1000Research. 7, (2018).
- Brennan, C. A., Anderson, K. V. Drosophila: The genetics of innate immune recognition and response. Annual Review of Immunology. 22 (1), 457-483 (2004).
- Rosales, C., Uribe-Querol, E. Phagocytosis: a fundamental process in immunity. BioMed Research International. 9042851, (2017).
- Kinchen, J. M., Ravichandran, K. S. Phagosome maturation: going through the acid test. Nature Reviews. Molecular Cell Biology. 9 (10), 781-795 (2008).
- Stuart, L., et al. A systems biology analysis of the Drosophila phagosome. Nature. 445 (7123), 95-101 (2007).
- Mackenzie, D. K., Bussière, L. F., Tinsley, M. C. Senescence of the cellular immune response in Drosophila melanogaster. Experimental Gerontology. 46 (11), 853-859 (2011).
- Horn, L., Leips, J., Starz-Gaiano, M. Phagocytic ability declines with age in adult Drosophila hemocytes. Aging Cell. 13 (4), 719-728 (2014).
- Elrod-Erickson, M., Mishra, S., Schneider, D. Interactions between the cellular and humoral immune responses in Drosophila. Current Biology. 10 (13), 781-784 (2000).
- Garg, A., Wu, L. P. Drosophila Rab14 mediates phagocytosis in the immune response to Staphylococcus aureus. Cellular Microbiology. 16 (2), 296-310 (2014).
- . Bloomington Drosophila Stock Center: Indiana University Bloomington Available from: https://bdsc.indiana.edu/innformation/recipes/molassesfood.html (2019)
- Fellous, S., Lazzaro, B. P. Larval food quality affects adult (but not larval) immune gene expression independent of effects on general condition. Molecular Ecology. 19 (7), 1462-1468 (2010).
- Kurucz, E., et al. Hemese, a hemocyte-specific transmembrane protein, affects the cellular immune response in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 100 (5), 2622-2627 (2003).
- Goto, A., et al. A Drosophila haemocyte-specific protein, hemolectin, similar to human von Willebrand factor. Biochemical Journal. 359, 99-108 (2001).
- Cevik, D., Acker, M., Michalski, C., Jacobs, J. R. Pericardin, a Drosophila collagen, facilitates accumulation of hemocytes at the heart. Developmental Biology. 454 (1), 52-65 (2019).
- Ghosh, S., Mandal, S., Mandal, L. Detecting proliferation of adult hemocytes in Drosophila by BrdU incorporation and PH3 expression in response to bacterial infection. Wellcome Open Research. 3, (2018).
- Hao, Y., Yu, S., Luo, F., Jin, L. H. Jumu is required for circulating hemocyte differentiation and phagocytosis in Drosophila. Cell Communication and Signaling. 16 (1), 95 (2018).
- Petraki, S., Alexander, B., Brückner, K. Assaying blood cell populations of the Drosophila melanogaster larva. Journal of Visualized Experiments. (105), (2015).
- Gyoergy, A., et al. Tools allowing independent visualization and genetic manipulation of Drosophila melanogaster macrophages and surrounding Tissues. G3: Genes, Genomes, Genetics. 8 (3), 845-857 (2018).
- Bosch, P. S., et al. Blood cells of adult Drosophila do not expand, but control survival after bacterial infection by induction of Drosocin around their reservoir at the respiratory epithelia. BioRxiv. 578864, (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır