Method Article
Activación 3D de todo el cerebro y mapeo de conectividad funcional en ratones utilizando imágenes de ultrasonido funcional transcraneal
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe la cuantificación de las variaciones hemodinámicas cerebrales volumétricas en el cerebro del ratón mediante ultrasonido funcional (fUS). Los procedimientos para el mapa de activación funcional 3D después de la estimulación sensorial, así como la conectividad funcional en estado de reposo se proporcionan como ejemplos ilustrativos, en ratones anestesiados y despiertos.
Resumen
La ecografía funcional (fUS) es una nueva modalidad de imagen cerebral que se basa en la medida de alta sensibilidad del volumen sanguíneo cerebral lograda por la angiografía doppler ultrarrápida. Como la perfusión cerebral está fuertemente vinculada a la actividad neuronal local, esta técnica permite el mapeo 3D de todo el cerebro de la activación regional inducida por tareas, así como la conectividad funcional en estado de reposo, de forma no invasiva, con una resolución espacio-temporal inigualable y simplicidad operativa. En comparación con la resonancia magnética funcional (fMRI), una de las principales ventajas de las imágenes fUS consiste en permitir una compatibilidad completa con los experimentos con animales despiertos y que se comportan. Además, el mapeo cerebral de fMRI en ratones, el modelo preclínico más utilizado en Neurociencia, sigue siendo técnicamente desafiante debido al pequeño tamaño del cerebro y la dificultad para mantener condiciones fisiológicas estables. Aquí presentamos un protocolo simple, confiable y robusto para imágenes de fUS de todo el cerebro en ratones anestesiados y despiertos utilizando un sistema fUS comercial listo para usar con un transductor lineal motorizado, que produce una activación cortical significativa después de la estimulación sensorial, así como un patrón de conectividad funcional 3D reproducible para la identificación de la red.
Introducción
En las últimas dos décadas, la neuroimagen se ha convertido en una herramienta importante para estudiar la función y la organización del cerebro, lo que permite a los investigadores hacer importantes descubrimientos en el campo de la neurociencia. Hoy en día, la resonancia magnética funcional (fMRI) se ha convertido en la técnica de neuroimagen clínica estándar de oro para evaluar la activación cerebral evocada por tareas o medicamentos y para mapear la conectividad funcional en reposo. Mientras que la resonancia magnética funcional humana tiene una alta confiabilidad y sensibilidad, la resonancia magnética funcional con ratones sigue siendo técnicamente desafiante por numerosas razones1. En primer lugar, la resonancia magnética funcional tiene una resolución espacial y temporal deficiente. El pequeño tamaño del cerebro del ratón requiere el uso de campos magnéticos fuertes utilizando escáneres costosos para lograr una resolución espacial razonable. En segundo lugar, mantener parámetros fisiológicos estables dentro del rango estrecho que permite un acoplamiento neurovascular eficiente es muy difícil en ratones anestesiados. Finalmente, la señal dependiente del nivel de oxígeno en la sangre (BOLD) en la que se basan los estudios de fMRI tiene una sensibilidad relativamente pobre, lo que lleva a una baja relación señal-ruido cuando se aplica a ratones y, a menudo, requiere una presentación de estímulo repetida durante una adquisición prolongada para detectar pequeñas variaciones. Siendo el ratón el modelo animal más utilizado en la investigación biomédica preclínica, estas limitaciones son en parte responsables de la brecha traslacional en la neuropsiquiatría, lo que dificulta la transposición de nuevas dianas terapéuticas prometedoras en el banco en tratamientos efectivos a pie de cama.
La ecografía funcional (fUS) es una técnica de neuroimagen desarrollada recientemente basada en doppler ultrarrápido2. Al muestrear directamente el volumen sanguíneo cerebral, esta técnica permite sondear la actividad cerebral en tiempo real a través del acoplamiento neurovascular. En comparación con otras técnicas de neuroimagen, fUS produce una resolución espacial de 100 μm y una resolución temporal en decenas de milisegundos. Esta técnica permite obtener imágenes de todo el cerebro de secciones coronales completas del cerebro del ratón, de forma completamente no invasiva. Además, es totalmente compatible con animales conscientes y de comportamiento3,4,5. Una de las principales limitaciones actuales de fUS es su característica 2D, que permite grabar un solo plano coronal al mismo tiempo. Si bien el fUS 3D volumétrico que utiliza transductores de matriz 2D ya se ha demostrado con éxito enratas 6 y se ha confirmado en ratones7,su falta actual de sensibilidad requiere una craneotomía completa, así como un promedio de un número importante de ensayos para detectar un ligero cambio de actividad. Alternativamente, los transductores lineales se pueden escalonar a través de múltiples posiciones y realizar imágenes funcionales plano por plano para cubrir todo el cerebro. Sin embargo, esta técnica requiere numerosas repeticiones de paradigmas experimentales y como tales largos tiempos de adquisición (3-4 horas para el cerebro delratón) 8,9.
En el presente trabajo, describimos una plataforma experimental robusta que incluye un ecógrafo funcional disponible comercialmente y un transductor lineal de conmutación rápida de plano con procedimientos para adquirir datos fUS 3D en ratones anestesiados y despiertos, lo que permite un mapeo funcional volumétrico y transcraneal del cerebro del ratón, de forma no invasiva, sin agente de contraste y en tiempos de adquisición cortos. Ilustramos esta característica mediante el mapeo de la activación de la corteza somatosensorial después de la estimulación del bigote, así como la conectividad funcional en estado de reposo. Además de la preparación animal y la recopilación de datos, también describimos el procedimiento para la visualización, el registro del atlas y el análisis de las señales fUS en tiempo real.
Protocolo
Todos los procedimientos presentados aquí se han realizado de acuerdo con la Directiva del Consejo de la Comunidad Europea de 22 de septiembre de 2010 (010/63/UE) y nuestro comité de ética local (Comité d'éthique en matière d'expérimentation animale número 59, 'Paris Centre et Sud', proyecto #2017-23). Los ratones adultos (macho C57BL/ 6 Rj, de 2-3 meses de edad, 20-30 g, de Janvier Labs, Francia) fueron alojados 4 por jaula con un ciclo de luz / oscuridad de 12 horas, temperatura constante a 22 ° C y comida y agua ad libitum. Antes del comienzo de los experimentos, los animales reciben un período mínimo de aclimatación de una semana a las condiciones de alojamiento.
1. Preparación animal para imágenes de fUS anestesiadas
- Anestesia
- Pesa el ratón.
- Preparar una mezcla de ketamina y xilazina a 10 mg/ml y 2 mg/ml, respectivamente, en solución salina estéril. Administrar 0,2 ml de la solución de ketamina/xilazina por vía intraperitoneal utilizando una aguja calibre 26 y una jeringa desechable de 1 ml. Después de unos minutos, coloque al animal en el marco estereotáxico, asegurándose de que la cabeza esté plana.
- Administrar un segundo volumen de anestésicos para alcanzar una dosis total de 100 mg/kg de ketamina y 20 mg/kg de xilazina (teniendo en cuenta la dosis inicial).
NOTA: La anestesia debe durar 1 h. Para mantener una sedación constante durante más tiempo, inyecte 0,05 ml de la mezcla de ketamina/xilazina cada 30 minutos por vía intraperitoneal.
-
Preparación animal para la sesión de imágenes anestesiadas
- Aplique un poco de ungüento para los ojos (por ejemplo, Ocry-Gel) en los ojos del ratón para evitar la formación de cataratas durante la sesión de imágenes. Afeitar la cabeza del ratón con un recortador. Aplique un poco de crema depilatoria y enjuague después de un par de minutos. Repita hasta que el vello se elimine por completo.
- Inserte alfileres subcutáneos en las extremidades para el registro del electrocardiograma (ECG). Coloque el gel de ultrasonido centrifugado (1500 rpm, 5 min) en la cabeza.
- Controlar la profundidad de la anestesia durante toda la duración de los experimentos (inducción de anestesia incluida). Mantenga la temperatura de los animales a 37 °C mediante el uso de una manta calefactora acoplada a una sonda rectal.
- Monitorizar los siguientes parámetros fisiológicos que son indicadores indirectos de la profundidad de la anestesia: Frecuencia cardíaca (220-250 latidos por minuto - monitorizada a través del electrocardiograma electrodos delgados implantados por vía subcutánea), y Frecuencia respiratoria (130-140 respiraciones por minuto - monitorizada mediante un espirómetro conectado al sistema de adquisición de ECG).
NOTA: En la figura 1se muestra una descripción de la configuración experimental.
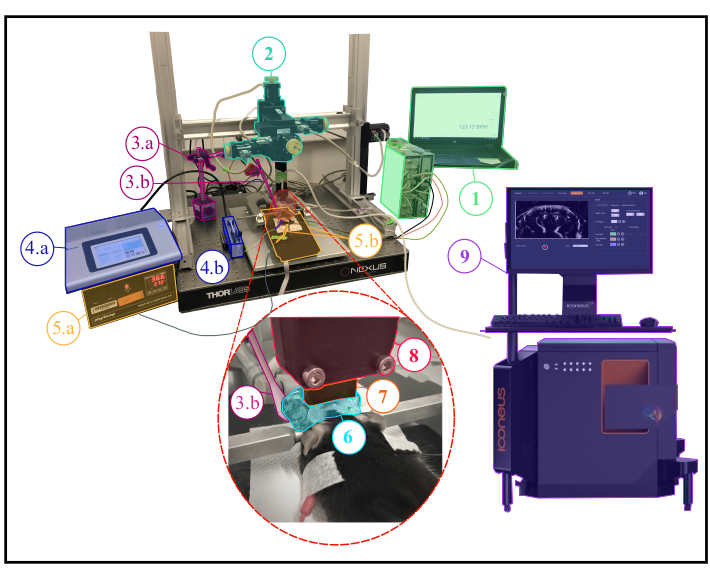
Figura 1: Configuración experimental para experimentos fUS anestesiados. Descripción de la configuración experimental que muestra todo el equipo científico necesario durante un experimento anestesiado. 1. Monitoreo fisiológico: visualización en vivo de frecuencias respiratorias y cardíacas. 2. Módulo motor de cuatro ejes (tres traslaciones y una rotación) monitoreado por el sistema Iconeus One (9) y que permite realizar escaneos tomográficos transcraneales 3D o adquisiciones 4D. 3a. Servomotor que impulsa el estimulador del bigotes (3b.) El servomotor está controlado por una tarjeta arduino uno que se interactúa con el sistema Iconeus One (9) para sincronizar los patrones de estimulación con las secuencias de imágenes. 4.a. Controlador de bomba de jeringa. 4.b. Soporte de jeringa. 5.a. Monitor de placa de temperatura que controla la placa de calentamiento. 5.b. Placa calefactora y termómetro rectal con interfaz con el monitor de placa de temperatura (5.a.). 6. Gel de ultrasonido colocado entre la cabeza del animal y la sonda de ultrasonido, proporcionando acoplamiento acústico entre ellos. 7. Sonda de ultrasonido de 15 MHz. 8. Soporte de sonda que conecta la sonda (7) con el módulo del motor (2). 9. Equipo y software Iconeus One, que permite programar diferentes secuencias de imágenes y controlar el módulo de motores (2) que impulsa la sonda (7). Haga clic aquí para ver una versión más grande de esta figura.
2. Preparación animal para experimentos con ratones despiertos con cabeza fija
- Cirugía de placas frontales
- Coloque el animal anestesiado (pasos 1.1-1.2) en el marco estereotáxico sobre una almohadilla térmica (37 °C). Aplicar gel protector para los ojos y administrar lidocaína s.c. (0,2 ml, 2 %) debajo de la piel del cuero cabelludo con una aguja calibre 26 y esperar unos minutos.
NOTA: Controle el nivel de anestesia cada 10-30 minutos por respuesta (ausencia de) a un pellizco firme en el dedo del dedo del día. - Realice una incisión después de la sutura sagital desde detrás del hueso occipital hasta el comienzo del hueso nasal. Usando tijeras quirúrgicas, extirpa la piel sobre ambos hemisferios.
- Limpie el cráneo con una solución de yodo al 1% y elimine el periostio restante. Usando la placa de cabeza como plantilla, perfore dos orificios (1 mm de diámetro) en el cráneo para colocar los tornillos de anclaje.
PRECAUCIÓN: Tenga cuidado de no perforar completamente a través del cráneo para evitar daños cerebrales o inflamación de la duramadre. - Coloque la placa frontal con los tornillos. Use cemento dental para fijar los tornillos y la placa frontal en la parte delantera y en la parte posterior del marco para mantener un buen agarre del implante.
PRECAUCIÓN: Tenga cuidado de no aplicar cemento dentro de la ventana del marco, ya que disminuye en gran medida la calidad de la señal. Cubra el cráneo con una capa delgada de pegamento quirúrgico para proteger el hueso y sellar las heridas en el costado de la ventana de imágenes. - Retire al animal del marco estereotáxico después de que el cemento esté seco y revierta la anestesia mediante una inyección subcutánea de atipemozol a 1 mg / kg. Se administra una administración profiláctica de meloxicam (5 mg/kg/día, s.c.) para el dolor postoperatorio.
- Coloque al animal en una jaula de recuperación sobre una almohadilla térmica (37 °C). El ratón puede devolver su jaula de origen con compañeros de camada en unas pocas horas. Coloque una tapa magnética impresa en 3D (material de ácido poliáctico con inserciones magnéticas) sobre la placa frontal para su protección (Figura 2A). Deje que el ratón se recupere durante 4 a 6 días antes del comienzo de la habituación a la jaula de la casa móvil (MHC).
NOTA: El peso total de la tapa y la placa frontal es de 2,8 g.
- Coloque el animal anestesiado (pasos 1.1-1.2) en el marco estereotáxico sobre una almohadilla térmica (37 °C). Aplicar gel protector para los ojos y administrar lidocaína s.c. (0,2 ml, 2 %) debajo de la piel del cuero cabelludo con una aguja calibre 26 y esperar unos minutos.
- Manipulación y habituación
- En el día 1 después de la recuperación (PR), sostenga suavemente el mouse en la mano durante 5-10 minutos varias veces al día.
- En el día 2 PR, repita el manejo como en el día 1 y deje al animal durante 5-10 minutos explorando libremente MHC.
NOTA: Reproducir música de fondo en la habitación puede ayudar a reducir el estrés de los animales. - En el día 3 PR, deje que el animal explore libremente el MHC durante 5-10 minutos. Después, agarra con cuidado la placa de la cabeza y colóquela suavemente en la abrazadera, moviendo manualmente la jaula de carbono para acompañar al mouse. Habitúe al animal en la posición fija de la cabeza durante 5-10 min. Limpie el MHC entre las sesiones de entrenamiento con una solución de etanol al 70% y enjuague con agua del grifo.
NOTA: Asegúrese de que el MHC reciba un flujo de aire suficiente según lo recomendado por el fabricante. La altura de la abrazadera de la cabeza debe ajustarse manualmente para proporcionar una posición cómoda. - En los días 4 y 5 PR, sujete repetidamente el MHC del ratón y aumente gradualmente el tiempo fijo de la cabeza, a partir de 5 minutos y hasta 30 minutos. Aplique un poco de solución salina y gel de ultrasonido en la ventana de imágenes para habituar.
- En el día 6 PR, repita el protocolo del día 4/5 PR y coloque la sonda sobre la cabeza del animal siguiendo el paso 3.1.
- El día del experimento, proceda como se describió anteriormente. Luego, humidifique la ventana de imágenes con solución salina y aplique un poco de gel de ultrasonido. Comience el seguimiento del animal y proceda al posicionamiento de la sonda (ver más abajo).
NOTA: La sujeción en el MHC también se puede hacer envolviendo el mouse en un trapo. En ese caso, los ratones deben habituarse al procedimiento de envoltura antes de la fijación de la cabeza. En la Figura 2Bse proporciona una descripción de una configuración experimental completa para imágenes despiertas.
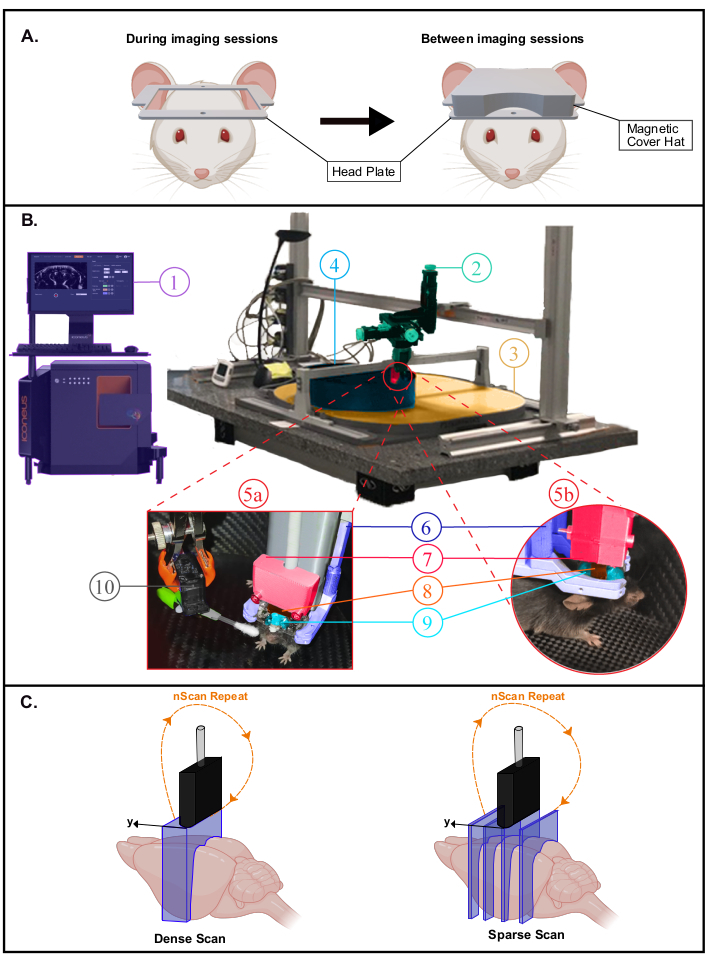
Figura 2: Configuración experimental para experimentos fUS despiertos. Un. Ilustración esquemática de la cubierta magnética de la placa frontal que protege la ventana de imágenes (creada con BioRender.com). Durante las sesiones de imágenes (izquierda), la cubierta se retira para escanear el cerebro en la gran abertura que ofrece la placa de la cabeza. B. Fotografía de la configuración experimental para imágenes transcraneales despiertas en ratones de comportamiento libre fijo en la cabeza. 1. Sistema y software Iconeus One, que permite configurar diferentes secuencias de imágenes y controlar el módulo de motores. 2. Módulo de motores de cuatro ejes (tres traslaciones y una rotación) monitoreado por el sistema Iconeus One(1)y que permite escaneos tomográficos 3D o adquisiciones 4D. 3. Mesa dispensadora de aire. 4. Jaula de casa móvil (MHC). 5a,5b. Fotografías que muestran vistas más cercanas del entorno del animal dentro del MHC. 6. Sistema de fijación de la cabeza que sujeta la placa de la cabeza. 7. Soporte de sonda que conecta la sonda con el módulo del motor (2). Sondaultrasónica de 8 . 15 MHz. 9. Gel de ultrasonido colocado entre la cabeza del ratón y la sonda de ultrasonido, proporcionando acoplamiento acústico entre ellos. 10. Servomotor que acciona el estimulador del bigotes. El servomotor está controlado por una tarjeta Arduino Uno que se interfa con el sistema Iconeus One a través de la señal TTL (1) para sincronizar los patrones de estimulación con las secuencias de imágenes. C. Ilustración de las diferentes posibilidades de muestreo espacial (creadas con BioRender.com): en cada caso, la sonda se escalona desde la primera posición hasta la última y se registra una imagen Doppler en cada posición para reconstruir el volumen apilado. Este proceso se repite continuamente durante todo el tiempo de adquisición. Exploración densa (izquierda): el paso entre cortes debe ser lo suficientemente pequeño (típicamente 400 μm, que corresponde a la resolución de elevación) para permitir imágenes volumétricas. Escaneo disperso (derecha): si se dirigen a regiones funcionales distantes (en diferentes posiciones), también es posible disminuir el muestreo espacial para obtener imágenes de diferentes cortes que intersectan estas regiones sin comprometer el muestreo temporal. Haga clic aquí para ver una versión más grande de esta figura.
3. Posicionamiento de la sonda
- Inicie el software (por ejemplo, IcoScan) y cree una sesión de experimento. Vaya al menú Mover sonda para ajustar la posición de la sonda de ultrasonido con el teclado de navegación.
NOTA: La sonda debe colocarse aproximadamente 1 mm por encima de la cabeza del animal. Es crucial asegurarse de que la sonda esté en contacto con el gel de ultrasonido antes de comenzar cualquier secuencia de imágenes. - Inicie la adquisición de Live View y ajuste la posición de la sonda si es necesario a través de imágenes en tiempo real del CBV (volumen de sangre cerebral) del animal. Alinea el cerebro en el centro de la imagen. Optimice los parámetros de imagen para capturar la relación señal-ruido más alta.
NOTA: En experimentos con ratones despiertos, el tamaño de la apertura debe reducirse para evitar artefactos inducidos por la contracción de los músculos laterales.
4. Gammagrafía angiográfica y registro del atlas
- Abra la opción Angio 3D en el software de adquisición. En el panel preestablecido, ajuste los parámetros de escaneo (primer segmento, último corte y tamaño de paso) para escanear todo el cerebro(Figura 3A,B)e inicie la adquisición.
NOTA: Al configurar los parámetros de escaneo, asegúrese de que el escaneo cubra la parte posterior del cerebro - Deje abierto el software de adquisición e inicie el software para el análisis y la visualización de datos (por ejemplo, IcoStudio) y cargue el escaneo angio 3D. Navegue por el volumen de adquisición utilizando el panel de 3 vistas y seleccione la Dirección de escaneo coronal:antero-posterior o postero-anterior.
- Vaya al Panel de Registro Cerebral. Cargue la plantilla de referencia del mouse que será necesaria para el proceso de registro. Registre el escaneo en allen Mouse Common Coordinates Framework utilizando los modos de registro totalmente automático o manual ( Figura3C).
- Compruebe el resultado observando la superposición del escaneo angio 3D y la plantilla de referencia o mirando la superposición del escaneo y el atlas de referencia de Allen usando el panel Atlas Manager (Figura 3D). Guarde el registro como un archivo .bps.
NOTA: El archivo de registro se puede reutilizar para cualquier otra adquisición realizada durante la misma sesión de experimento.
5. Sistema de posicionamiento cerebral (BPS)
- En el software IcoStudio, asegúrese de que el escaneo angiográfico y su archivo .bps (generado en el paso 4.4) estén cargados.
- Vaya al Panel de navegación cerebral. En el panel Atlas Manager, navegue por el atlas cerebral Allen del ratón con el navegador de árbol padre/hijo. Encuentre las regiones anatómicas específicas y selecciónelas para superponerlas a su escaneo en las 3 vistas.
- Visualice las regiones de destino en el panel de 3 vistas y elija un plano de imagen que se superponga a las regiones de destino para el experimento. Para ello, establezca manualmente dos marcadores en la posición coronal que incluye las regiones de interés.
- Haga clic en Sistema de posicionamiento cerebral (BPS) para extraer las coordenadas motoras resultantes. Estas coordenadas corresponden a la posición de la sonda que permite obtener imágenes del plano objetivo. Verifique la vista previa de la imagen que se calcula a partir de la angio exploración.
- En el software IcoScan, ingrese al panel de posicionamiento de la sonda y haga clic en Ingresar coordenadas BPS. Aplique las coordenadas dadas en el paso 5.4. La sonda se mueve y se alinea en el plano de imagen objetivo.
- Realice una adquisición de vista en vivo y compruebe que el plano de imagen actual corresponde a la predicción dada en el paso 5.4.
NOTA: También es posible seleccionar planos parasagitales/no ortogonales.
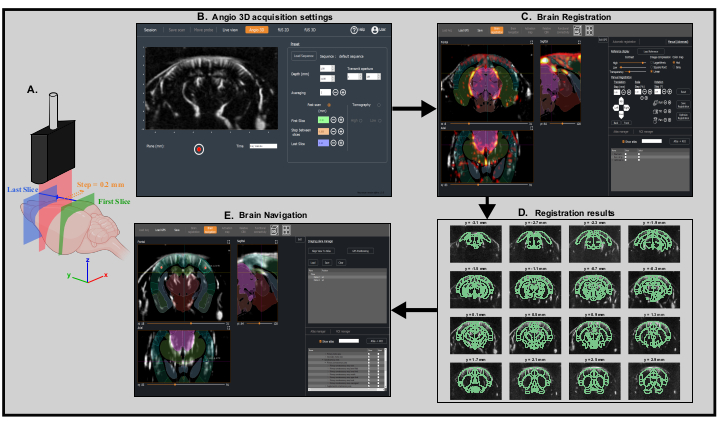
Figura 3: Exploración angiográfica transcraneal rápida y registro cerebral para un posicionamiento preciso de la sonda. Un. Representación esquemática del cerebro del ratón escaneado transcranialmente por la sonda ultrasónica desde la primera rebanada coronal (verde) hasta la última rebanada coronal (azul) durante una exploración angiográfica rápida. La rebanada actual de la imagen (representada en rojo) se mueve paso a paso desde la parte posterior (verde) hasta la parte delantera (azul) del cerebro. Creado con BioRender.com B. Captura de pantalla del software de adquisición IcoScan en el panel Angio 3D. Los parámetros preestablecidos a la derecha configuran el escaneo rápido. Las posiciones en mm de la primera rebanada, la última rebanada y el tamaño del paso deben estar bien elegidas para escanear linealmente todo el cerebro. C. Captura de pantalla del software de procesamiento IcoStudio. El escaneo rápido de Angio 3D se registra automáticamente en una plantilla de referencia del cerebro del ratón. Las tres vistas (izquierda) muestran la superposición de la vasculatura y el atlas Allen del cerebro del ratón en las vistas coronal, sagital y axial. D. Diseño lineal (montaje) de 16 rebanadas (de 31) de la angio exploración 3D, con el atlas de referencia de Allen registrado superpuesto a la vasculatura. E. Captura de pantalla del panel Brain Navigation que muestra el plano de imagen predicho correspondiente a las coordenadas motoras calculadas por el software gracias a los dos marcadores colocados en el centro de la corteza somatosensorial primaria izquierda y derecha, región de los campos de barril. Haga clic aquí para ver una versión más grande de esta figura.
6. Experimento evocado por tareas: estimulación de bigotes
- Predefinir la secuencia de estimulación, incluyendo el tiempo de estimulación, el tiempo de interestimulación y el número de repeticiones.
- Ejecute una secuencia fUS 3D definiendo el tiempo total de adquisición, el número de posiciones y el tiempo muerto entre posiciones. En caso de estimulación automática sincronizada con el sistema de adquisición a través de la entrada TTL, seleccione la opción Trig-IN antes de iniciar la adquisición.
NOTA: Para los resultados presentados en este trabajo, la estimulación se entregó utilizando un hisopo de algodón colocado de tal manera que permita la desviación de la mayoría de los bigotes en la dirección dorsal / ventral. Se fijó en un servomotor accionado por una tarjeta Arduino UNO, vinculada al sistema Iconeus One para garantizar la sincronización. Los parámetros recomendados para la estimulación son 30 s ON, 30 s OFF, amplitud de 20° y frecuencia de 4 Hz. Alternativamente, la estimulación también se puede administrar manualmente desviando los bigotes en los momentos definidos durante la adquisición. - Abra la adquisición en el software IcoStudio e ingrese al menú Mapa de activación. Rellene el campo del patrón de activación con las horas de inicio y finalización y calcule el mapa de activación. Ajuste los parámetros de visualización para la visualización. Exporte el mapa de activación como un archivo .h5 para el análisis fuera de línea.
NOTA: La activación se estima utilizando un enfoque de modelo lineal generalizado (GLM) con el estímulo contornizado por una respuesta hemodinámica del ratón (HRF) predeterminada. Alternativamente, la activación se puede visualizar directamente estimando la correlación de Pearson entre el patrón de estimulación y la señal hemodinámica de cada vóxel.
7. Conectividad funcional 4D
- Ejecute una secuencia fUS 3D definiendo el tiempo total de adquisición, el número de posiciones del plano de imagen, así como el tiempo muerto entre posiciones.
NOTA: Para la conectividad funcional 4D, recomendamos un tiempo de adquisición entre cada volumen < 2,5 s (frecuencia de muestreo de al menos 0,4 Hz) y un tiempo total de adquisición de al menos 10 min (número de puntos de tiempo > 180). - Guarde la adquisición y cárgándola en el software IcoStudio. Si es necesario, cargue el archivo .bps y el marco de coordenadas del cerebro del ratón Allen. En el gestor atlas, seleccione las regiones del atlas como regiones de interés (ROI).
- Ingrese al menú Conectividad funcional y seleccione las regiones deseadas en el administrador de ROI. Visualice los resultados como matriz de conectividad (análisis supervisado) o mapa de correlación basado en semillas (no supervisado). Seleccione y ajuste los filtros de ancho de banda como desee y exporte los resultados de correlación para el análisis estadístico.
NOTA: En el modo de imagen 3D fUS, las posiciones relativas de la sonda se establecen manualmente. Por lo tanto, dos tipos de exploraciones son posibles y se pueden elegir dependiendo de la aplicación funcional: exploraciones densas versus exploraciones dispersas(Figura 2C).
Resultados
Este protocolo describe la cuantificación 3D de las variaciones hemodinámicas cerebrales transcranialmente en el cerebro del ratón, en reposo o en respuesta a la estimulación sensorial. La estimulación de bigotes, un paradigma estándar para mapear la activación funcional cerebral en roedores, ha sido seleccionada como un ejemplo de respuesta evocada por estimulación sensorial. La Figura 4 muestra un mapa de activación representativo en respuesta a la estimulación mecánica de bigotes en un ratón anestesiado obtenido mediante imágenes transcraneales de fUS. El tiempo total de prueba fue de 760 s, con una línea de base de 60 s (antes y después de la estimulación), una estimulación de 80 s y un tiempo de recuperación de 60 s, repetido 5x. La activación significativa se determinó con la resolución de un modelo lineal general (GLM) utilizando una función de respuesta hemodinámica (HRF) de ratón predeterminada. Las regiones activadas (puntuaciones Z con valor p >0.0000006 después de una estricta corrección de Bonferroni para comparación múltiple) se muestran como valores codificados por colores superpuestos en la plantilla de marco de coordenadas común de Allen. El curso temporal de la corteza somatosensorial primaria contralateral, región de campo de barril (S1BF) reveló un aumento del 15-20% del CBV en comparación con la línea de base.
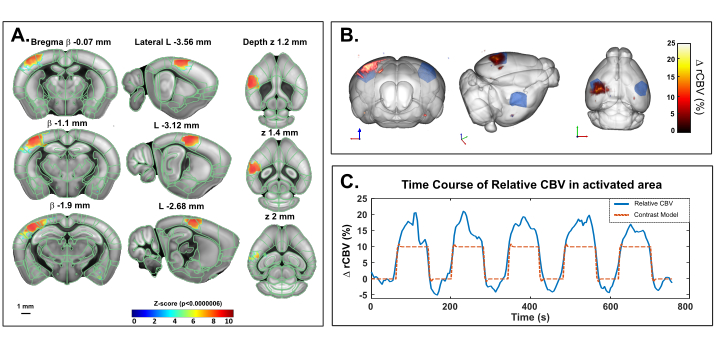
Figura 4: Activación transcraneal Mapas y curso de tiempo rCBV después de la estimulación de bigotes en ratones anestesiados con ketamina/xilazina. Un. Mapa de activación que muestra vóxeles significativamente activados después de la estimulación mecánica de los bigotes derechos (80 s ON, 60 s OFF, 5x) bajo anestesia con ketamina / xilazina. Los mapas se obtuvieron mediante el cálculo de puntuaciones Z basadas en el análisis de modelo lineal general (GLM) con corrección de Bonferroni para comparación múltiple. Las puntuaciones Z (codificadas por colores) se superponen en la plantilla Allen brain 3D (después del registro con el sistema de posicionamiento cerebral) y se muestran en tres vistas: coronal (izquierda), sagital (centro) y axial (derecha). Las regiones anatómicas del marco de coordenadas comunes del cerebro del ratón Allen se muestran como referencia. Los vóxeles activados están bien ubicados dentro de la corteza S1BF izquierda. Barra de escala: 1 mm. Cada volumen de muestra se escaneó en más de 2,8 mm (correspondiente a 7 cortes en la dirección de elevación) en 3,85 s, lo que permite registrar 20 muestras volumicas durante cada respuesta funcional. B. Representación 3D del aumento del volumen sanguíneo cerebral relativo (rCBV) evocado por la estimulación del bigote en comparación con el nivel basal. La delineación anatómica del S1BF se indica en azul. C. Curso de tiempo de las variaciones del CBV en el S1BF izquierdo (azul) y el estímulo correspondiente aplicado (rojo). Haga clic aquí para ver una versión más grande de esta figura.
El mismo paradigma se ha aplicado en un ratón de comportamiento fijo en la cabina móvil utilizando el preset despierto de IcoScan. La Figura 5 presenta el mapa de activación después de un experimento de estimulación de bigotes múltiples utilizando la configuración experimental descrita en la Figura 2. Se estimularon algunos bigotes posteriores y caudales con el siguiente patrón: 30 s basales seguidos de cinco ensayos consecutivos de 30 s ON (4 Hz) y 30 s OFF(Figura 5C). La estimulación se realizó utilizando un servomotor accionado por una tarjeta Arduino UNO que activa la secuencia de adquisición de imágenes para la sincronización. La activación significativa se determinó con la resolución de un modelo lineal general (GLM) utilizando una función de respuesta hemodinámica (HRF) de ratón predeterminada. La corrección de comparación múltiple se realizó con el método de Bonferroni. El nivel alfa convencional de 0,05 se normalizó por el número total de vóxeles en el volumen de adquisición, lo que resultó en un umbral estricto final de 0,000003.
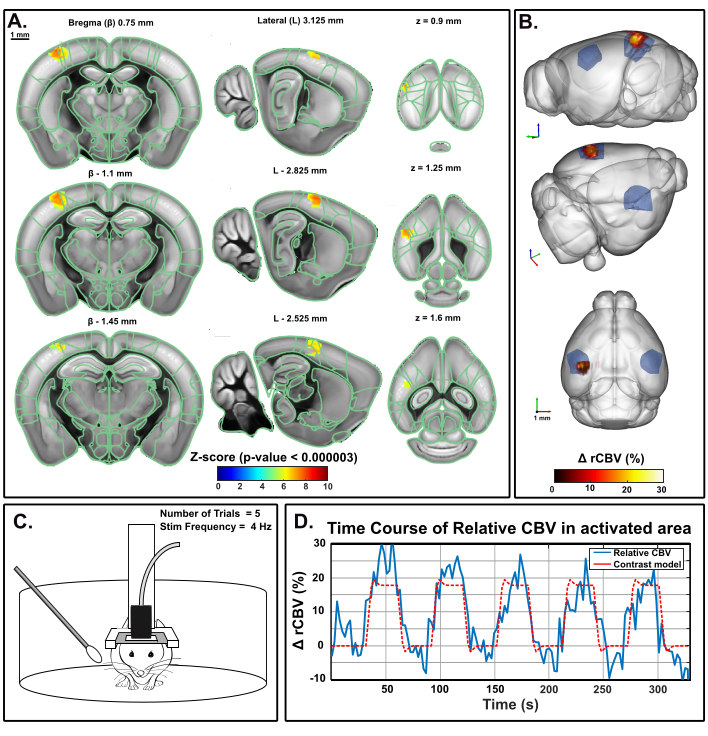
Figura 5: Mapas de activación y curso de tiempo rCBV después de la estimulación de bigotes en ratones despiertos que se comportan. Un. Mapa de activación que muestra vóxeles significativamente activados después de la estimulación mecánica de los bigotes derechos (30 s ON, 30 s OFF, 5x) en un ratón despierto en la casa móvil. Los mapas se obtuvieron mediante el cálculo de puntuaciones Z basadas en el análisis de modelo lineal general (GLM) con corrección de Bonferroni para comparación múltiple (normalización por el número total de vóxeles). Las puntuaciones Z (codificadas por colores) se superponen en la plantilla 3D del cerebro de Allen (después del registro en el Sistema de Posicionamiento Cerebral) y se muestran en tres vistas: coronal (izquierda), sagital (centro) y axial (derecha). Las regiones anatómicas del Marco de Coordenadas Comunes del Cerebro de Ratón de Allen se muestran como referencia. Los vóxeles activados están bien ubicados dentro de la corteza S1BF izquierda. Barras de escamas, 1 mm. Cada volumen de muestra se escaneó a más de 1,6 mm (correspondiente a 3 cortes en la dirección de elevación) en 3,85 s, lo que permite registrar 17 muestras volumicas durante cada respuesta funcional. B. Representación 3D del aumento relativo del volumen sanguíneo cerebral (rCBV) evocado por la estimulación del bigote en comparación con el nivel basal. La delineación anatómica del S1BF se indica en azul. C. Ilustración del ratón en la casa móvil durante el experimento de estimulación del bigote derecho, durante el cual se realizaron cinco ensayos de 30 s para un tiempo total de adquisición de 330 s. D. Curso de tiempo cbV relativo instantáneo extraído dentro del área activada (azul), con el estímulo correspondiente superpuesto (rojo). Haga clic aquí para ver una versión más grande de esta figura.
La Figura 6 muestra las correlaciones temporales de las fluctuaciones espontáneas normalizadas de cbV de baja frecuencia (<0,2 Hz) entre las regiones cerebrales 3D (identificadas a partir del registro al marco de coordenadas comunes de Allen) en un ratón anestesiado con ketamina-xilazina. El tiempo total de adquisición fue de 20 min (1200 s). El análisis supervisado por Atlas reveló fuertes patrones de conectividad interhemisférica, con valores de coeficiente de correlación resultantes de hasta 0,8. El análisis basado en semillas en el hipocampo dorsal reveló una conectividad interhemisférica significativa entre el hipocampo derecho e izquierdo, así como las regiones retrohipocampales profundas y las cortezas piriformes. Una región de semilla seleccionada en el S1BF también resultó en un patrón de correlación simétrica (cortico-cortical), como se describió anteriormente.
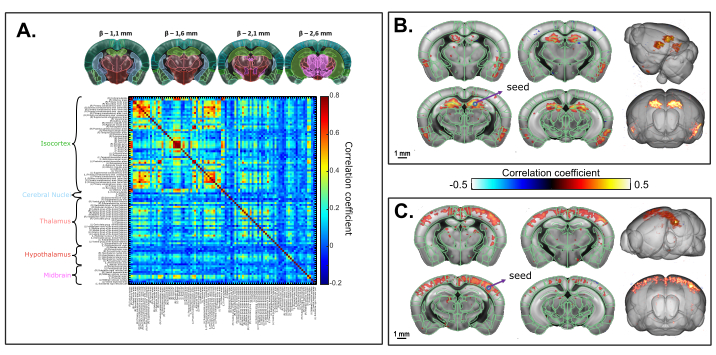
Figura 6:Conectividad funcional transcraneal volumétrica en estado de reposo del cerebro del ratón bajo anestesia con ketamina/xilazina evaluada en una adquisición de fUS 3D de 20 min. Un. Matriz de correlación basada en regiones 3D del marco de coordenadas comunes de Allen registradas en la adquisición funcional transcraneal. La matriz se obtiene calculando la correlación normalizada de Pearson de fluctuaciones espontáneas de baja frecuencia (<0,1 Hz) de las señales de tiempo promedio de todos los vóxeles incluidos en cada ROI identificado después de la corrección de tiempo de corte. Cada volumen muestreado se escaneó sobre 1,6 mm en la dirección de elevación (correspondiente a 4 rebanadas) adquiridas sobre 2,2 s. B. Análisis basado en semillas proyectado en una plantilla 3D. La semilla se seleccionó dentro del hipocampo dorsal derecho a β - 2.1 mm. El mapa de correlación se obtiene calculando el coeficiente de correlación de Pearson entre las señales temporales de la semilla y cada vóxel de toda la adquisición después de la corrección de tiempo de corte. C. Mapa de correlación 3D basado en análisis basado en semillas con región de semilla seleccionada dentro del S1BF a β - 2.1 mm. Barras de escala: 1 mm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los métodos de imágenes cerebrales completas son herramientas cruciales para comprender mejor la fisiología y la patología del cerebro. El método descrito aquí permite la cuantificación precisa de las señales hemodinámicas en el cerebro vivo directamente en el banco. La sensibilidad inigualable y la resolución espacio-temporal del ultrasonido funcional son particularmente adecuadas para la fisiología del ratón. Las respuestas funcionales y las redes de estado de reposo se pueden mapear dentro de tiempos de adquisición cortos, longitudinalmente y sin tener que promediar ensayos o sujetos para obtener una medida confiable. La combinación relevante de sondas lineales ultrasónicas de alta sensibilidad y configuraciones motorizadas rápidas permite realizar imágenes volumétricas transcraneales de fUS en ratones dentro de tiempos de adquisición razonables. Este protocolo se puede realizar en ratones anestesiados o despiertos utilizando una jaula de casa móvil.
La estimulación del bigotes, el estímulo sensorial utilizado como ejemplo ilustrativo en este manuscrito, es un paradigma de activación funcional estándar en roedores y una lectura fiable para estudiar el procesamiento sensorial, el acoplamiento neurovascular y sus alteraciones5,6,10,11. Si bien el cepillado manual grueso de los bigotes puede ser preferido por su facilidad de uso, este método carece de precisión espacial y temporal. El uso de un estimulador automático, como el aquí descrito activado con el escáner de imágenes fUS, permite un mejor control de varios parámetros, incluido el momento de inicio, el desplazamiento de amplitud, la frecuencia y el ángulo de la punta Q / peine, lo que resulta en una mejor reproducibilidad inter-animal. Además, un momento más preciso de la estimulación permite el modelado de la Función de Respuesta Hemodinámica (FCR) mediante la determinación del tiempo hasta el inicio y el tiempo hasta el pico de los parámetros12,13. Para garantizar una mejor precisión en el número de bigotes desviados durante la estimulación (y por lo tanto en el área de la región activada), se pueden adaptar estimuladores más sofisticados a este protocolo. Muchos otros estímulos como la luz8,el sonido14 o la presentación del olor15 se pueden implementar utilizando el mismo protocolo.
La compatibilidad de la ecografía funcional con animales despiertos y de comportamiento es una ventaja importante en comparación con otras técnicas de neuroimagen, lo que permite el mapeo de activación funcional sin el sesgo de anestesia. El uso de una plataforma móvil con elevación neumétrica es una buena alternativa a otros aparatos fijos de cabeza existentes, como las cintas de correr lineales o esféricas. Mientras está firmemente fijo en la cabeza, el movimiento de la casa le da al ratón la ilusión de navegar por el entorno, lo que permite acoplar una amplia gama de pruebas de comportamiento a fUS imaging16. Sin embargo, el procedimiento de habituación a la fijación de la cabeza constituye un paso importante para disminuir el estrés, especialmente para experimentos donde puede considerarse un factor de confusión. El procedimiento detallado aquí (6 días de manipulación y habituación a la fijación de la cabeza) proporciona resultados sólidos para la estimulación sensorial y la conectividad funcional en estado de reposo. Sin embargo, podría ser necesario extender el período de habituación para pruebas de comportamiento más refinadas17.
Divulgaciones
Jeremy Ferrier y Bruno-Félix Osmanski son empleados de Iconeus. Thomas Deffieux, Zsolt Lenkei, Bruno-Félix Osmanski y Mickael Tanter son cofundadores y accionistas de Iconeus.
Agradecimientos
Este trabajo fue apoyado por la Beca Avanzada N° 339244-FUSIMAGINE del Consejo Europeo de Investigación (ERC), la Agencia Nacional de Investigación que financia 'Pinch' (ANR-18-CE37-005), el Inserm Research Technology Accelerator in Biomedical Ultrasound, el núcleo técnico ElfUS del IPNP, Inserm U1266, el programa de investigación europeo FUSIMICE del Proyecto Cerebro Humano, y EMBO Short-Term Fellowship 8439 a Andrea Kliewer.
Materiales
| Name | Company | Catalog Number | Comments |
| BD Plastipak 1 mL syringes | Dutscher, France | 303172 | |
| BD Microlance 26 Gauge needles | Dutscher, France | 303800 | |
| Animal Temperature Controller (heating Plate coupled with a rectal probe) | Physitemp | TCAT-2DF | |
| Arduino | Arduino | Arduino Uno-Rev3 | |
| Atipamezole | Orion Pharma, France | Antisedan® | 5 mg/ml injectable solution |
| Dental Ciment | Sun Médical, Shiga, japan | Superbond C&B | |
| Depilatory cream | Klorane | N/A | |
| Eye Ointment | TVM, UK | Ocry-gel | |
| Hair trimmer | Wella Profesionnals | N/A | |
| Head plates | Neurotar, Finland | Model 14 | |
| Iconeus One standard package for fUS | Iconeus, France | Iconeus One | |
| IcoScan acquisition software (v1.0) | Iconeus, France | IcoScan | |
| IcoStudio analysis software (v1.0) | Iconeus, France | IcoStudio | |
| Isoflurane Anesthesia station | Minerve, Esternay, France | ||
| Ketamine | Virbac, France | Ketamine1000 | 100 mg/ml injectable solution |
| Lidocaine | Vetoquinol | Lurocaine® | 20 mg/ml injectable solution |
| Medetomidine | Orion Pharma, France | Domitor® | 1 mg/ml injectable solution |
| Meloxicam | Boehringer lingelheim | Metacam® | 0.5 mg/ml injectable solution |
| Mobile HomeCage Large with tracking capability | Neurotar, Finland | MHC-L-T-V4 | |
| Monitoring of ECG and breathing rate | AD Systems, (USA) and LabChart software | ||
| Servomotor | Feetech | FT90B | |
| Stereotaxic frame | David Kopf (Tujunga, USA) | 900-WA | Using Mouse Adaptor (Ref: 922) and Non-Rupture Ear Bars (ref: 922) |
| Surgical glue | 3M, USA | Vetbond | |
| Syringe Pump | KD Scientific, USA | Legato® 130, Cat# 788130 | |
| Ultrasound gel | DREXCO medical, France | Medi'Gel | |
| Xylazine 2% | Bayer, France | Rompun® | 20 mg/ml injectable solution |
Referencias
- Hoyer, C., Gass, N., Weber-Fahr, W., Sartorius, A. Advantages and challenges of small animal magnetic resonance imaging as a translational tool. Neuropsychobiology. 69 (4), 187-201 (2014).
- Deffieux, T., Demene, C., Pernot, M., Tanter, M. Functional ultrasound neuroimaging: a review of the preclinical and clinical state of the art. Current Opinion in Neurobiology. 50, 128-135 (2018).
- Rabut, C., et al. Pharmaco-fUS: Quantification of pharmacologically-induced dynamic changes in brain perfusion and connectivity by functional ultrasound imaging in awake mice. NeuroImage. 222, 117231 (2020).
- Tiran, E., et al. Transcranial functional ultrasound imaging in freely moving awake mice and anesthetized young rats without contrast agent. Ultrasound in Medicine and Biology. 43 (8), 1679-1689 (2017).
- Ferrier, J., Tiran, E., Deffieux, T., Tanter, M., Lenkei, Z. Functional imaging evidence for task-induced deactivation and disconnection of a major default mode network hub in the mouse brain. Proceedings of the National Academy of Sciences of the United States of America. 117 (26), 15270-15280 (2020).
- Rabut, C., et al. 4D functional ultrasound imaging of whole-brain activity in rodents. Nature Methods. 16 (10), 994-997 (2019).
- Brunner, C., et al. A platform for brain-wide volumetric functional ultrasound imaging and of circuit dynamics in awake mice. Neuron. 108 (5), 861-875 (2020).
- Gesnik, M., et al. 3D functional ultrasound imaging of the cerebral visual system in rodents. NeuroImage. 149, 267-274 (2017).
- Macé, &. #. 2. 0. 1. ;., et al. Whole-brain functional ultrasound imaging reveals brain modules for visuomotor integration. Neuron. 100 (5), 1241-1251 (2018).
- Macé, E., Montaldo, G., Cohen, I., Baulac, M., Fink, M., Tanter, M. Functional ultrasound imaging of the brain. Nature Methods. 8 (8), 662-664 (2011).
- Tiran, E., et al. Transcranial functional ultrasound imaging in freely moving awake mice and anesthetized young rats without contrast agent. Ultrasound in Medicine and Biology. 43 (8), 1679-1689 (2017).
- Claron, J., et al. Large scale functional ultrasound imaging of the spinal cord reveals in depth spatiotemporal responses of spinal nociceptive circuits in both normal and inflammatory state. Pain. , (2020).
- Aydin, A. K., et al. Transfer functions linking neural calcium to single voxel functional ultrasound signal. Nature Communications. 11 (1), 2954 (2020).
- Bimbard, C., et al. Multi-scale mapping along the auditory hierarchy using high-resolution functional ultrasound in the awake ferret. eLife. 7, 35028 (2018).
- Boido, D., et al. Mesoscopic and microscopic imaging of sensory responses in the same animal. Nature Communications. 10 (1), 1110 (2019).
- Kislin, M., et al. Flat-floored air-lifted platform: A new method for combining behavior with microscopy or electrophysiology on awake freely moving rodents. Journal of Visualized Experiments. (88), e51869 (2014).
- Juczewski, K., Koussa, J. A., Kesner, A. J., Lee, J. O., Lovinger, D. M. Stress and behavioral correlates in the head-fixed method: stress measurements, habituation dynamics, locomotion, and motor-skill learning in mice. Scientific Reports. 10 (1), 12245 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados