Method Article
Ativação 3D do cérebro inteiro e mapeamento de conectividade funcional em camundongos usando imagens de ultrassom funcional transcranário
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo descreve a quantificação de variações hemodinâmicas cerebrais volumosas no cérebro do camundongo usando ultrassom funcional (fUS). Procedimentos para mapa de ativação funcional 3D após estimulação sensorial, bem como conectividade funcional de estado de repouso são fornecidos como exemplos ilustrativos, em camundongos anestesiados e acordados.
Resumo
A imagem de ultrassom funcional (fUS) é uma nova modalidade de imagem cerebral que se baseia na medida de alta sensibilidade do volume sanguíneo cerebral alcançado pela angiografia doppler ultrarrápida. Como a perfusão cerebral está fortemente ligada à atividade neuronal local, essa técnica permite o mapeamento 3D do cérebro inteiro da ativação regional induzida por tarefas, bem como conectividade funcional de estado de repouso, não invasivamente, com resolução spatio-temporal incomparável e simplicidade operacional. Em comparação com a ressonância magnética (ressonância magnética funcional), uma das principais vantagens da imagem fUS consiste em permitir uma compatibilidade completa com experimentos animais acordados e comportados. Além disso, o mapeamento cerebral de ressonância magnética em camundongos, o modelo pré-clínico mais utilizado na Neurociência, permanece tecnicamente desafiador devido ao pequeno tamanho do cérebro e à dificuldade de manter condições fisiológicas estáveis. Aqui apresentamos um protocolo simples, confiável e robusto para imagens de fUS cérebro inteiro em camundongos anestesiados e acordados usando um sistema fUS comercial fora da prateleira com um transdutor linear motorizado, produzindo ativação cortical significativa após estimulação sensorial, bem como padrão de conectividade funcional 3D reprodutível para identificação de rede.
Introdução
Nas últimas duas décadas, a neuroimagem tornou-se uma importante ferramenta para estudar a função e a organização do cérebro, permitindo que os pesquisadores façam descobertas importantes no campo da neurociência. Hoje, a ressonância magnética funcional (fMRI) tornou-se a técnica de neuroimagem clínica padrão ouro para avaliar tarefa ou ativação cerebral evocada por drogas e mapear a conectividade funcional em repouso. Embora o fMRI humano tenha alta confiabilidade e sensibilidade, o fMRI do mouse permanece tecnicamente desafiador por inúmeras razões1. Primeiro, a ressonância magnética tem uma resolução espacial e temporal ruim. O pequeno tamanho do cérebro do camundongo requer o uso de campos magnéticos fortes usando scanners caros para alcançar uma resolução espacial razoável. Em segundo lugar, manter parâmetros fisiológicos estáveis dentro da faixa estreita permitindo um acoplamento neuro vascular eficiente é muito difícil em camundongos anestesiados. Finalmente, o sinal dependente do nível de oxigênio no sangue (BOLD) no qual os estudos de ressonância magnética dependem tem sensibilidade relativamente ruim, levando a baixa relação sinal-ruído quando aplicado a camundongos e muitas vezes requer apresentação repetida de estímulos durante a aquisição longa para detectar pequenas variações. Sendo o camundongo o modelo animal mais utilizado em pesquisas biomédicas pré-clínicas, essas limitações são parcialmente responsáveis pela lacuna translacional na neuropsiquiatria, dificultando que novos alvos terapêuticos promissores no banco sejam transpostos em tratamentos eficazes ao lado da cama.
Ultrassom funcional (fUS) é uma técnica de neuroimagem recentemente desenvolvida baseada em dopplerultrarrápido 2. Ao amostrar diretamente o volume sanguíneo cerebral, esta técnica permite sondar a atividade cerebral em tempo real através do acoplamento neurovascular. Em comparação com outras técnicas de neuroimagem, a FUS produz uma resolução espacial de 100 μm e uma resolução temporal nas dezenas de milissegundos. Esta técnica permite imagens cerebrais inteiras de seções coronais completas do cérebro do camundongo, completamente não invasivamente. Além disso, é totalmente compatível com animais conscientes e comportados3,4,5. Uma das principais limitações atuais do fUS é o seu recurso 2D, permitindo gravar um único plano coronal ao mesmo tempo. Embora o fUS 3D volumoso usando transdutores de matriz 2D já tenha sido demonstrado com sucesso em ratos6 e confirmado em camundongos7, sua atual falta de sensibilidade requer uma craniotomia completa, bem como uma média de um número importante de ensaios para detectar uma ligeira mudança de atividade. Alternativamente, transdutores lineares podem ser pisados em várias posições e realizar imagens funcionais plano por plano para cobrir todo o cérebro. No entanto, essa técnica requer inúmeras repetições de paradigma experimentais e, como esses longos tempos de aquisição (3-4 horas para o cérebro do camundongo)8,9.
No presente trabalho, descrevemos uma plataforma experimental robusta, incluindo um scanner de ultrassom funcional comercialmente disponível e um transdutor linear de mudança de avião rápido com procedimentos para adquirir dados fUS 3D em camundongos anestesiados e acordados, permitindo mapeamento funcional volumétrico e transcranário do cérebro do camundongo, não invasivamente, sem agente de contraste e em curtos tempos de aquisição. Ilustramos esse recurso mapeando a ativação do córtex somatosensorial após a estimulação do bigode, bem como a conectividade funcional de estado de repouso. Além da preparação animal e coleta de dados, descrevemos também o procedimento de visualização, registro de atlas e análise de sinais fUS em tempo real.
Protocolo
Todos os procedimentos aqui apresentados foram realizados de acordo com a Diretiva do Conselho Comunitário Europeu de 22 de Setembro de 2010 (010/63/UE) e nosso comitê de ética local (Comité d'éthique en matière d'expérimentation animale número 59, 'Paris Centre et Sud', projeto #2017-23). Os camundongos adultos (C57BL/6 Rj masculino, idade de 2-3 meses, 20-30 g, de Janvier Labs, França) foram alojados 4 por gaiola com um ciclo claro/escuro de 12h, temperatura constante de 22 °C e comida e ad libitum. Antes do início dos experimentos, os animais recebem um período mínimo de uma semana de aclimatação às condições de moradia.
1. Preparação animal para imagens anestoetizadas de fUS
- Anestesia
- Pesar o rato.
- Prepare uma mistura de cetamina e xilazina a 10 mg/mL e 2 mg/mL, respectivamente, em soro fisiológico estéril. Administre 0,2 mL da solução de cetamina/xilazina intraperitoneally utilizando uma agulha de calibre 26 e uma seringa descartável de 1 mL. Após alguns minutos, posicione o animal sobre o quadro estereotaxic, certificando-se de que a cabeça está plana.
- Administre um segundo volume de anestésicos para atingir uma dose total de 100 mg/kg de cetamina e 20 mg/kg de xilazina (levando em conta a dose inicial).
NOTA: A anestesia deve durar 1h. Para manter uma sedação constante por mais tempo, injete 0,05 mL da mistura cetamina/xilazina a cada 30 min intraperitoneally.
-
Preparação animal para sessão de imagem anestesiada
- Aplique alguma pomada ocular (por exemplo, Ocry-Gel) nos olhos do rato para evitar qualquer formação de catarata durante a sessão de imagem. Raspe a cabeça do rato usando um aparador. Aplique um pouco de creme depilatório e enxágue depois de alguns minutos. Repita até que o cabelo esteja completamente removido.
- Insira pinos subcutâneos nos membros para gravação de eletrocardiograma (ECG). Coloque gel de ultrassom centrifusado (1500 rpm, 5 min) na cabeça.
- Monitore a profundidade da anestesia durante a duração completa dos experimentos (indução de anestesia incluída). Mantenha a temperatura dos animais a 37 °C usando uma manta de aquecimento acoplado a uma sonda retal.
- Monitore os seguintes parâmetros fisiológicos que são indicadores indiretos da profundidade da anestesia: Frequência cardíaca (220-250 batidas por minuto - monitorada através dos eletrocardiogramas finos implantados subcutâneamente) e taxa respiratória (130-140 respirações por minuto - monitorada usando um espirômetro conectado ao sistema de aquisição do ECG).
NOTA: Uma descrição da configuração experimental é retratada na Figura 1.
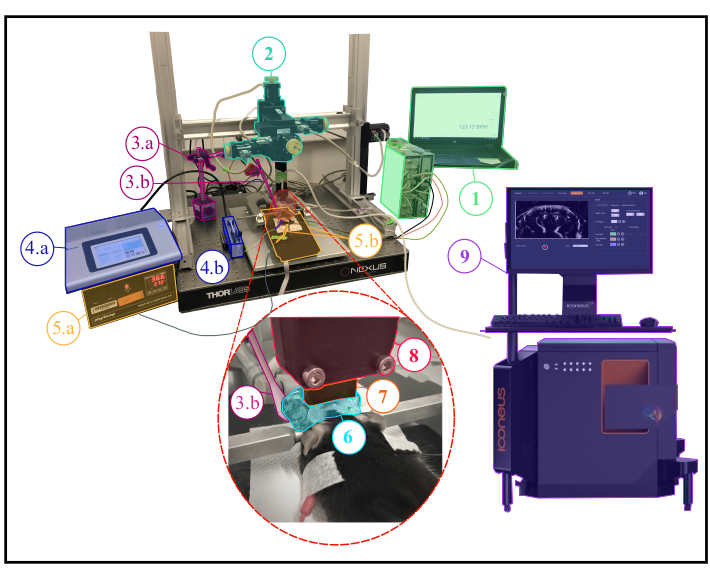
Figura 1: Configuração experimental para experimentos de fUS anestesiados. Descrição da configuração experimental mostrando todos os equipamentos científicos necessários durante um experimento anestesiado. 1. Monitoramento fisiológico: exibição ao vivo de frequências respiratórias e cardíacas. 2. Módulo motor de quatro eixos (três traduções e uma rotação) monitorado pelo sistema Iconeus One (9) e permitindo realizar varreduras tomográficas 3D transcranais ou aquisições 4D. 3a. Servo-Motor dirigindo o estimulador de whisker (3b.) O servo-motor é controlado por uma placa arduino uno que é interface com o sistema Iconeus One (9) a fim de sincronizar padrões de estimulação com sequências de imagem. 4.a. Controlador da bomba de seringa. 4.b. Porta-seringas. 5.a. Monitor de placa de temperatura controlando a placa de aquecimento. 5.b. Placa de aquecimento e termômetro retal interagiram com o monitor da placa de temperatura (5.a.). 6. Gel de ultrassom colocado entre a cabeça do animal e a sonda de ultrassom, proporcionando acoplamento acústico entre eles. 7. Sonda de ultrassom de 15 MHz. 8. Suporte da sonda ligando a sonda(7)ao módulo do motor (2). 9. Iconeus Um equipamento e software, permitindo programar diferentes sequências de imagem e controlar o módulo de motores (2) condução da sonda (7). Clique aqui para ver uma versão maior desta figura.
2. Preparação animal para experimentos de camundongos com cabeça fixa acordada
- Cirurgia de cabeça
- Coloque o animal anestesiado (passos 1.1-1.2) no quadro estereotaxico em uma almofada de aquecimento (37 °C). Aplique gel protetor para os olhos e administre lidocaína.c. (0,2 mL, 2 %) sob a pele do couro cabeludo usando uma agulha de calibre 26 e espere alguns minutos.
NOTA: Monitore o nível de anestesia a cada 10-30 minutos por resposta (ausência de) a uma pitada firme do dedo do dedo do dedo. - Realize uma incisão após a sutura sagital de trás do osso occipital até o início do osso nasal. Usando uma tesoura cirúrgica, extiria a pele sobre ambos os hemisférios.
- Limpe o crânio com 1% de solução de iodo e remova qualquer periosteum restante. Usando a placa de cabeça como modelo, faça dois furos (1 mm de diâmetro) no crânio para posicionar os parafusos de ancoragem.
ATENÇÃO: Tenha cuidado para não perfurar completamente o crânio para evitar danos cerebrais ou inflamação dura - Posicione a placa com os parafusos. Use cimento dental para fixar os parafusos e a placa na frente e na parte de trás da armação para manter uma boa aderência do implante.
ATENÇÃO: Tenha cuidado para não aplicar cimento dentro da janela do quadro, pois diminui muito a qualidade do sinal. Cubra o crânio com uma fina camada de cola cirúrgica para proteger o osso e selar as feridas na lateral da janela de imagem. - Retire o animal da estrutura estereotaxa depois que o cimento estiver seco e reverta a anestesia por uma injeção subcutânea de atipamezole a 1 mg/kg. Uma administração profilactática de meloxicam (5 mg/kg/dia, s.c.) é administrada para dor pós-operatória.
- Coloque o animal em uma gaiola de recuperação em uma almofada de aquecimento (37 °C). O rato pode retornar sua gaiola com companheiros de lixo em poucas horas. Coloque uma tampa magnética impressa em 3D (material de ácido poliáctico com pastilhas de ímã) sobre a placa da cabeça para proteção(Figura 2A). Deixe o mouse se recuperar por 4 a 6 dias antes do início da habituação para a gaiola doméstica móvel (MHC).
NOTA: O peso total da tampa e da placa é de 2,8 g.
- Coloque o animal anestesiado (passos 1.1-1.2) no quadro estereotaxico em uma almofada de aquecimento (37 °C). Aplique gel protetor para os olhos e administre lidocaína.c. (0,2 mL, 2 %) sob a pele do couro cabeludo usando uma agulha de calibre 26 e espere alguns minutos.
- Manuseio e habitação
- No primeiro dia de pós-recuperação (PR), segure suavemente o mouse na mão por 5-10 min várias vezes ao dia.
- No dia 2 pr, repita o manuseio como no primeiro dia e deixe o animal por 5-10 min explorando livremente o MHC.
NOTA: Tocar música de fundo na sala pode ajudar a reduzir o estresse do animal. - No dia 3 pr, deixe o animal explorar livremente o MHC por 5-10 min. Depois, pegue cuidadosamente a placa da cabeça e coloque-a suavemente no grampo, movendo-se manualmente a gaiola de carbono para acompanhar o mouse. Habituar o animal na posição fixa da cabeça por 5-10 min. Limpe o MHC entre as sessões de treinamento com solução de 70% de etanol e enxágue com água da torneira.
NOTA: Certifique-se de que o MHC receba um fluxo de ar suficiente, conforme recomendado pelo fabricante. A altura do grampo da cabeça precisa ser ajustada manualmente para fornecer uma posição confortável. - Nos dias 4 e 5 de RP, fixar repetidamente o mHC do mouse e aumentar gradualmente o tempo fixo na cabeça, começando de 5 min e até 30 min. Aplique um pouco de soro fisiológico e gel de ultrassom na janela de imagem para habituar.
- No dia 6 de RP, repita o protocolo a partir do dia 4/5 PR e posicione a sonda acima da cabeça do animal após o passo 3.1.
- No dia do experimento, prossiga como descrito acima. Em seguida, umidifice a janela de imagem com soro fisiológico e aplique um pouco de gel de ultrassom. Inicie o rastreamento do animal e prossiga para o posicionamento da sonda (veja abaixo).
NOTA: A fixação no MHC também pode ser feita envolvendo o mouse em um pano. Nesse caso, os camundongos precisam ser habituados ao procedimento de embrulho antes da fixação da cabeça. Uma descrição de uma configuração experimental completa para imagens acordadas é fornecida na Figura 2B.
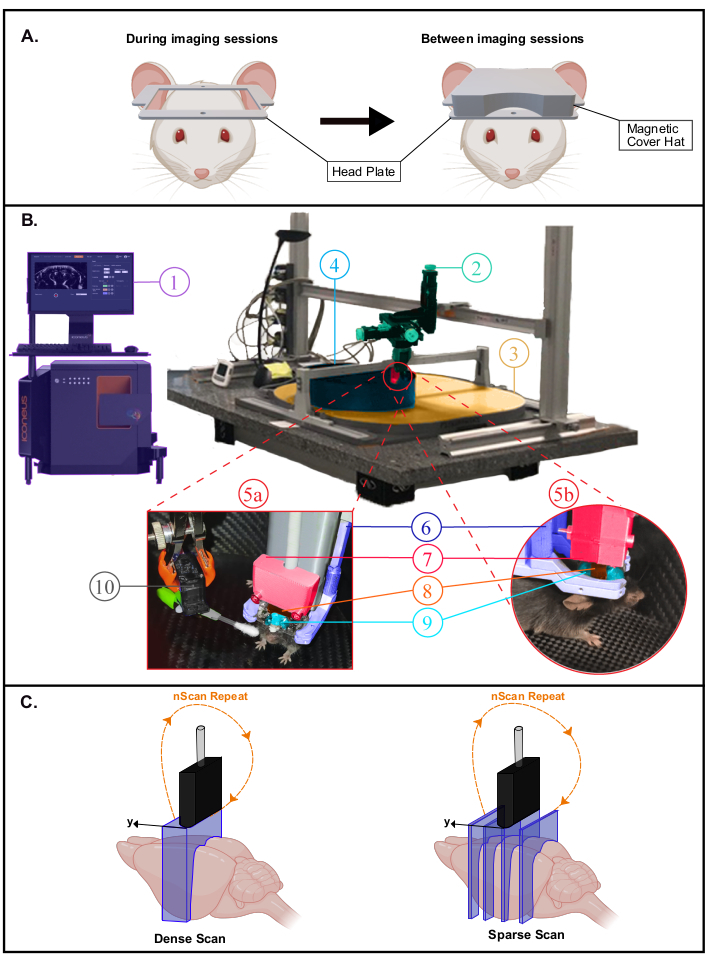
Figura 2: Configuração experimental para experimentos acordados com fUS. Um. Ilustração esquemática da tampa magnética da placa de cabeça protegendo a janela de imagem (criada com BioRender.com). Durante as sessões de imagem (Esquerda), a tampa é removida para escanear o cérebro na grande abertura oferecida pela placa da cabeça. B. Fotografia da configuração experimental para imagens transcranárias acordadas em camundongos de cabeça fixas livremente comportando-se. 1. Iconeus Um sistema e software, permitindo configurar diferentes sequências de imagem e controlando o módulo de motores. 2. Módulo de motores de quatro eixos (três traduções e uma rotação) monitorado pelo sistema Iconeus One (1) e permitindo varreduras tomográficas 3D ou aquisições 4D. 3. Mesa de distribuição de ar. 4. Gaiola Doméstica Móvel (MHC). 5a,5b. Fotografias mostrando vistas mais próximas do ambiente do animal dentro do MHC. 6. Sistema de fixação da cabeça que prende a placa da cabeça. 7. Suporte da sonda ligando a sonda ao módulo do motor (2). 8. 15 MHz sonda ultrassônica. 9. Gel de ultrassom colocado entre a cabeça do rato e a sonda de ultrassom, proporcionando acoplamento acústico entre eles. 10. Servo-Motor dirigindo o estimulador de bigode. O Servo-Motor é controlado por uma placa Arduino Uno que é interface com o sistema Iconeus One através do sinal TTL (1) a fim de sincronizar padrões de estimulação com sequências de imagem. C. Ilustração das diferentes possibilidades de amostragem espacial (criadas com BioRender.com): em cada caso, a sonda é pisada da primeira posição para a última e uma imagem doPpler é registrada em cada posição para reconstruir o volume empilhado. Esse processo é continuamente repetido durante todo o tempo de aquisição. Scan denso (à esquerda): o passo entre as fatias deve ser pequeno o suficiente (tipicamente 400 μm, que corresponde à resolução de elevação) para permitir imagens volumosas. Escaneamento esparso (à direita): se regiões funcionais distantes forem alvo (em diferentes posições), também é possível diminuir a amostragem espacial para imagens de diferentes fatias que cruzam essas regiões sem comprometer a amostragem temporal. Clique aqui para ver uma versão maior desta figura.
3. Posicionamento da sonda
- Inicie o software (por exemplo, IcoScan) e crie uma sessão de experimentos. Vá para o menu Mover sonda para ajustar a posição da sonda de ultrassom usando o teclado de navegação.
NOTA: A sonda deve ser posicionada aproximadamente 1 mm acima da cabeça do animal. É crucial garantir que a sonda esteja em contato com o gel de ultrassom antes de iniciar qualquer sequência de imagem. - Inicie a aquisição do Live View e ajuste a posição da sonda, se necessário, através de imagens em tempo real do animal CBV (volume sanguíneo cerebral). Alinhe o cérebro no centro da imagem. Otimize os parâmetros de imagem para capturar a maior relação sinal-ruído.
NOTA: Em experimentos de camundongos acordados, o tamanho da abertura precisa ser reduzido para evitar artefatos induzidos pela contração muscular lateral.
4. Digitalização angiográfica e registro de atlas
- Abra a opção Angio 3D no software de aquisição. No painel predefinido, ajuste os parâmetros de digitalização (primeira fatia, última fatia e tamanho da etapa) a fim de escanear todo o cérebro(Figura 3A,B), e iniciar a aquisição.
NOTA: Ao configurar os parâmetros de varredura, certifique-se de que a varredura cobrirá a parte posterior do cérebro - Deixe o software de aquisição aberto e inicie o software para análise e visualização de dados (por exemplo, IcoStudio) e carregue a varredura angio 3D. Navegue pelo volume de aquisição usando o painel de 3 visualizações e selecione a Direção de Varredura Coronal: antero-posterior ou postero-anterior.
- Vá para o Painel de Registro cerebral. Carregue o modelo de referência do mouse que será necessário para o processo de registro. Registre a varredura no Allen Mouse Common Coordinates Framework usando os modos de registro totalmente automáticos ou manuais(Figura 3C).
- Verifique o resultado olhando para a superposição da varredura angio 3D e do modelo de referência ou olhando para a superposição da digitalização e do atlas de referência Allen usando o painel Atlas Manager (Figura 3D). Salve o registro como um arquivo .bps.
NOTA: O arquivo de registro pode ser reutilizado para qualquer outra aquisição realizada durante a mesma sessão de experimento.
5. Sistema de Posicionamento Cerebral (BPS)
- No software IcoStudio, certifique-se de que a varredura angiográfica e seu arquivo .bps (gerado na etapa 4.4) estejam carregados.
- Vá para o Painel de Navegação Cerebral. No painel do Atlas Manager, navegue pelo atlas cerebral allen do mouse com o navegador de árvore pai/filho. Encontre as regiões-alvo anatômicas e selecione-as para sobrepor-as à sua varredura nas três visualizações.
- Visualize as regiões-alvo no painel de 3 visualizações e escolha um plano de imagem que se sobreponha às regiões-alvo para o experimento. Para isso, defina manualmente dois marcadores na posição coronal que inclui as regiões de interesse.
- Clique no Sistema de Posicionamento Cerebral (BPS) para extrair as coordenadas do motor resultantes. Essas coordenadas correspondem à posição da sonda que permite a imagem do plano alvo. Verifique a visualização da imagem que é computada a partir da varredura angio.
- No software IcoScan, digite o painel de posicionamento do Teste e clique nas coordenadas Enter BPS. Aplique as coordenadas dadas na etapa 5.4. A sonda se move e se alinha no plano de imagem alvo.
- Realize uma aquisição de visualização ao vivo e verifique se o plano de imagem atual corresponde à previsão dada na etapa 5.4.
NOTA: Também é possível selecionar aviões parasagittal/non ortogonal.
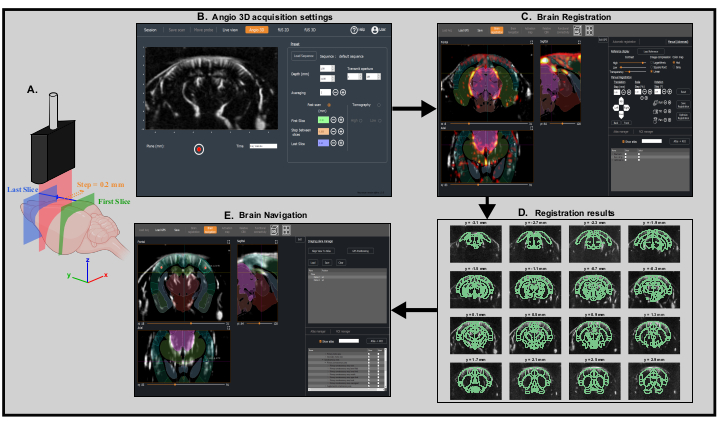
Figura 3: Varredura angiográfica transcranária rápida e registro cerebral para posicionamento preciso da sonda. Um. Representação esquemática do cérebro do camundongo sendo escaneado transcranicamente pela sonda ultrassônica desde a primeira fatia coronal (verde) até a última fatia coronal (azul) durante uma varredura angiográfica rápida. A fatia de imagem atual (representada em vermelho) se move passo a passo da parte de trás (verde) para a frente (azul) do cérebro. Criado com BioRender.com B. Captura de tela do software de aquisição IcoScan no painel Angio 3D. Os parâmetros predefinidos à direita configuram a varredura rápida. As posições em mm da primeira fatia, a última fatia e o tamanho do passo devem ser bem escolhidos para digitalizar linearmente todo o cérebro. C. Captura de tela do software de processamento IcoStudio. A varredura 3D rápida do Angio é registrada automaticamente em um modelo de referência do cérebro do mouse. As três visões (esquerda) mostram a superposição da vasculatura e do cérebro do rato Allen atlas nas vistas coronal, sagital e axial. D. Linear lay-out (montagem) de 16 fatias (de 31) da varredura 3D angio, com o atlas de referência Allen registrado sobreposto à vasculatura. E. Captura de tela do painel de navegação cerebral mostrando o plano de imagem previsto correspondente às coordenadas do motor computadas pelo software graças aos dois marcadores colocados no centro do córtex somatosensorial primário esquerdo e direito, região dos campos de barril. Clique aqui para ver uma versão maior desta figura.
6. Experimento evocado por tarefas: estimulação do bigode
- Predefine a sequência de estimulação, incluindo tempo de estimulação, tempo de interestimulação e número de repetições.
- Execute uma sequência 3D fUS definindo o tempo total de aquisição, o número de posições, bem como o tempo morto entre as posições. Em caso de estimulação automática sincronizada com o sistema de aquisição através de entrada TTL, selecione a opção Trig-IN antes de iniciar a aquisição.
NOTA: Para os resultados apresentados neste trabalho, foi fornecida a estimulação utilizando-se cotonete posicionado, como permitir a deflexão da maioria dos bigodes na direção dorsal/ventral. Foi fixado em um servo-motor conduzido por uma placa UNO Arduino, ligado ao sistema Iconeus One para garantir a sincronização. Os parâmetros recomendados para estimulação são 30 s ON, 30 s OFF, amplitude de 20° e 4 Hz de frequência. Alternativamente, a estimulação também pode ser entregue manualmente desviando os bigodes nos horários definidos durante a aquisição. - Abra a aquisição no software IcoStudio e insira no menu do mapa de ativação. Preencha o campo de padrão de ativação com os tempos de início e fim e calcule o mapa de ativação. Ajuste os parâmetros do visor para visualização. Exporte o mapa de ativação como um arquivo .h5 para análise off-line.
NOTA: A ativação é estimada usando uma abordagem de modelo linear generalizado (GLM) com o estímulo convolved por uma resposta hemodinâmica padrão do mouse (HRF). Alternativamente, a ativação pode ser visualizada diretamente estimando a correlação de Pearson entre o padrão de estimulação e o sinal hemodinâmico de cada voxel.
7. Conectividade funcional 4D
- Execute uma sequência 3D fUS definindo o tempo total de aquisição, o número de posições de avião de imagem, bem como o tempo morto entre as posições.
NOTA: Para conectividade funcional 4D, recomendamos tempo de aquisição entre cada volume < 2,5 s (frequência amostral de pelo menos 0,4 Hz) e um tempo total de aquisição de pelo menos 10 minutos (número de pontos de tempo > 180). - Salve a aquisição e carregue-a no software IcoStudio. Se necessário, carregue o arquivo .bps e a estrutura de coordenadas do cérebro do rato Allen. No gerente da Atlas,selecione regiões do atlas como regiões de interesse (ROI).
- Digite o menu conectividade funcional e selecione as regiões desejadas no gerenciador de ROI. Visualize os resultados como matriz de conectividade (análise supervisionada) ou mapa de correlação baseado em sementes (não supervisionado). Selecione e ajuste os filtros de largura de banda conforme desejado e exporte resultados de correlação para análise estatística.
NOTA: No modo de imagem fUS 3D, as posições relativas do teste são definidas manualmente. Assim, dois tipos de varreduras são possíveis e podem ser escolhidas dependendo da aplicação funcional: varreduras densas versus esparsas(Figura 2C).
Resultados
Este protocolo descreve a quantificação 3D de variações hemodinâmicas cerebrais transcranicamente no cérebro do camundongo, em repouso ou em resposta à estimulação sensorial. A estimulação do whisker, um paradigma padrão para mapear a ativação funcional cerebral em roedores, foi selecionada como um exemplo de resposta sensorial evocada por estimulação. A Figura 4 mostra um mapa de ativação representativo em resposta à estimulação mecânica do bigode em um rato anestesiado obtido usando imagens transcranianas fUS. O tempo total de ensaio foi de 760, com uma linha de base de 60 s (antes e depois da estimulação), uma estimulação de 80 s e um tempo de recuperação de 60 s, repetido 5x. A ativação significativa foi determinada com a resolução de um modelo linear geral (GLM) utilizando uma função de resposta hemodinâmica padrão do mouse (HRF). As regiões ativadas (escores Z com valor p >0,0000006 após a rigorosa correção de Bonferroni para comparação múltipla) são exibidas como valores codificados por cores sobrepostos ao modelo de estrutura de coordenadas comum allen. O curso de tempo do córtex somatosensorial primário contralateral, região do campo de barril (S1BF) revelou um aumento de 15-20% do CBV em comparação com a linha de base.
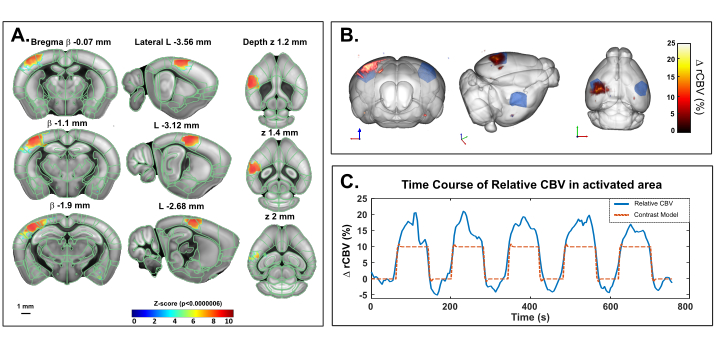
Figura 4: Ativação transcraniana Mapas e curso de tempo rCBV seguindo estimulação de bigodes em ketamina/xilazine anesthetized mouse. Um. Mapa de ativação mostrando voxels significativamente ativados após estimulação mecânica dos bigodes certos (80 s ON, 60 s OFF ,5x) sob anestesia cetamina/xilazina. Os mapas foram obtidos por cálculo de escores Z com base na análise geral do modelo linear (GLM) com correção de Bonferroni para comparação múltipla. As pontuações Z (codificadas por cores) são sobrepostas no modelo 3D cerebral Allen (após o registro no sistema de posicionamento cerebral) e exibidas em três pontos: coronal (esquerda), sagital (meio) e axial (direita). Regiões anatômicas do cérebro do rato Allen são exibidas para referência. Os voxels ativados estão bem localizados dentro do córtex S1BF esquerdo. Barra de escala: 1 mm. Cada volume amostral foi escaneado acima de 2,8 mm (correspondendo a 7 fatias na direção de elevação) em 3,85 s, permitindo registrar 20 amostras volumicas durante cada resposta funcional. B. Renderização 3D do volume sanguíneo cerebral relativo evocado pela estimulação do bigode (rCBV) aumenta em comparação com o nível de linha de base. O delineamento anatômico do S1BF é indicado em azul. C. Curso de tempo das variações cbv no S1BF esquerdo (azul) e o estímulo correspondente aplicado (vermelho). Clique aqui para ver uma versão maior desta figura.
O mesmo paradigma foi aplicado em um mouse de comportamento fixo na base móvel usando o predefinição acordado do IcoScan. A Figura 5 apresenta o mapa de ativação após um experimento de estimulação de bigode múltiplo usando a configuração experimental descrita na Figura 2. Alguns bigodes posteriores e caudais foram estimulados com o seguinte padrão: linha de base de 30 s seguida por cinco ensaios consecutivos de 30 s ON (4 Hz) e 30 s OFF(Figura 5C). A estimulação foi fornecida usando um servo-motor conduzido por um cartão UNO Arduino desencadeando a sequência de aquisição de imagem para sincronização. A ativação significativa foi determinada com a resolução de um modelo linear geral (GLM) utilizando uma função de resposta hemodinâmica padrão do mouse (HRF). A correção de comparação múltipla foi realizada com o método Bonferroni. O nível alfa convencional de 0,05 foi normalizado pelo número total de voxels no volume de aquisição, resultando em um limite final rigoroso de 0,000003.
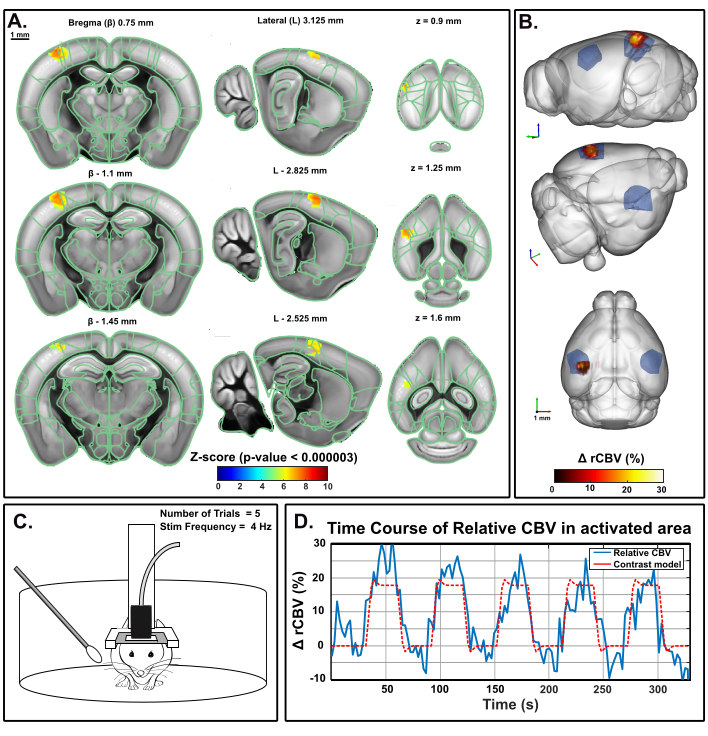
Figura 5: Mapas de ativação e curso de tempo rCBV seguindo a estimulação dos bigodes no mouse de comportamento acordado. Um. Mapa de ativação mostrando voxels significativamente ativados após estimulação mecânica dos bigodes certos (30 s ON, 30 s OFF, 5x) em um mouse acordado na base móvel. Os mapas foram obtidos por pontuação de Z-scores com base na análise geral do modelo linear (GLM) com correção de Bonferroni para comparação múltipla (normalização pelo número total de voxels). As pontuações Z (codificadas por cores) são sobrepostas no modelo 3D cérebro Allen (após o registro no Sistema de Posicionamento cerebral) e exibidas em três pontos: coronal (esquerda), sagital (médio) e axial (direita). Regiões anatômicas do Allen Mouse Brain Common Coordinate Framework são exibidas para referência. Os voxels ativados estão bem localizados dentro do córtex S1BF esquerdo. Barras de escala, 1 mm. Cada volume amostral foi escaneado acima de 1,6 mm (correspondendo a 3 fatias na direção de elevação) em 3,85 s, permitindo registrar 17 amostras volumicas durante cada resposta funcional. B. Renderização 3D do volume sanguíneo relativo (rCBV) evocado pela estimulação do bigode (rCBV) aumenta em comparação com o nível de linha de base. O delineamento anatômico do S1BF é indicado em azul. C. Ilustração do mouse na homecage móvel durante o experimento de estimulação do bigode direito, durante o qual cinco ensaios de 30 foram realizados para um tempo total de aquisição de 330 s. D. Curso de tempo relativo instantâneo cbv extraído dentro da área ativada (azul), com o estímulo correspondente sobreposto (vermelho). Clique aqui para ver uma versão maior desta figura.
A Figura 6 mostra as correlações temporais de flutuações espontâneas de CBV de baixa frequência (<0,2 Hz) entre regiões cerebrais 3D (identificadas desde o registro para a estrutura coordenada comum de Allen) em um camundongo anesthetizado de cetamina xylazina. O tempo total de aquisição foi de 20 min (1200 s). A análise supervisionada pelo Atlas revelou fortes padrões de conectividade interhemisférica, com valores de coeficiente de correlação resultantes de até 0,8. A análise baseada em sementes no hipocampo dorsal revelou uma conectividade interhemisférica significativa entre o hipocampo direito e esquerdo, bem como regiões retro-hipocampais profundas e cortices piriformes. Uma região de sementes selecionada no S1BF também resultou em um padrão de correlação simétrico (cortico-cortical), como descrito anteriormente.
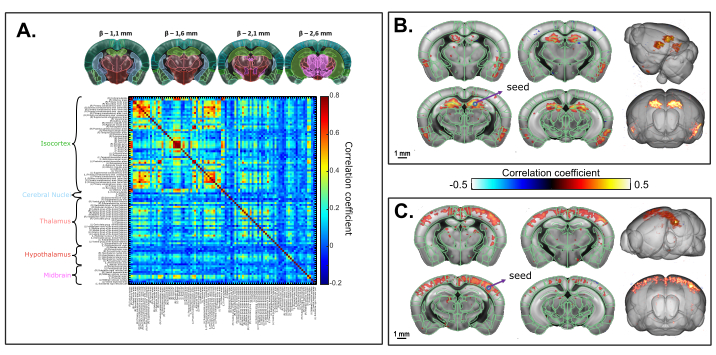
Figura 6: Conectividade funcional de estado de repouso volátrico transcranal do cérebro do camundongo sob anestesia cetamina/xilazina avaliada em uma aquisição de 20 min 3D fUS. Um. Matriz de correlação baseada em regiões 3D da estrutura coordenada comum de Allen registrada na aquisição funcional transcranária. A matriz é obtida pela computação da correlação normalizada de Pearson de flutuações espontâneas de baixa frequência (<0,1 Hz) dos sinais de tempo médio de todos os voxels incluídos em cada ROI identificado após correção de tempo de fatia. Cada volume amostrado foi escaneado ao longo de 1,6 mm na direção de elevação (correspondente a 4 fatias) adquiridos ao longo de 2,2 s. B. Análise baseada em sementes projetada em um modelo 3D. A semente foi selecionada dentro do hipocampo dorsal direito em β - 2,1 mm. O mapa de correlação é obtido computando o coeficiente de correlação de Pearson entre os sinais temporais da semente e cada voxel de toda a aquisição após correção do tempo da fatia. Mapa de correlação 3D com base na análise baseada em sementes com região de sementes selecionada dentro do S1BF em β - 2,1 mm. Barras de escala: 1 mm. Clique aqui para ver uma versão maior desta figura.
Discussão
Métodos de imagem cerebral inteiros são ferramentas cruciais para entender melhor a fisiologia cerebral e a patologia. O método descrito aqui permite a quantificação precisa de sinais hemodinâmicos no cérebro vivo diretamente no banco. A sensibilidade incomparável e a resolução espátula-temporal do ultrassom funcional é particularmente adequada para a fisiologia do camundongo. Respostas funcionais e redes de estado de repouso podem ser mapeadas em curtos tempos de aquisição, longitudinalmente e sem ter que fazer testes ou sujeitos médios para obter uma medida confiável. A combinação relevante de sondas lineares ultrassônicas de alta sensibilidade e configurações motorizadas rápidas permite realizar imagens fUS volumétricas transcranais em camundongos dentro de tempos razoáveis de aquisição. Este protocolo pode ser realizado em camundongos anestesiados ou acordados usando uma gaiola doméstica móvel.
A estimulação do whisker, o estímulo sensorial usado como exemplo ilustrativo neste manuscrito, é um paradigma de ativação funcional padrão em roedores e uma leitura confiável para estudar o processamento sensorial, o acoplamento neurovascular e suas alterações5,6,10,11. Embora a escovação manual grosseira dos bigodes possa ser preferida por sua facilidade de uso, este método carece de precisão espacial e temporal. O uso de um estimulador automático, como o descrito aqui acionado com o scanner de imagem fUS, permite um melhor controle de vários parâmetros, incluindo o tempo de início, o deslocamento da amplitude, a frequência, bem como o ângulo da ponta Q/pente, resultando em uma melhor reprodutibilidade entre animais. Além disso, um tempo mais preciso de estimulação permite a modelagem da Função de Resposta Hemodinâmica (HRF) determinando o tempo de início e o tempo para os parâmetros de pico12,13. Para garantir melhor precisão no número de bigodes desviados durante a estimulação (e, portanto, na área da região ativada), estimuladores mais sofisticados podem ser adaptados a este protocolo. Muitos outros estímulos como luz8,som14 ou apresentação de odor15 podem ser implementados usando o mesmo protocolo.
A compatibilidade do ultrassom funcional com animais acordados e comportados é uma vantagem importante em relação a outras técnicas de neuroimagem, permitindo o mapeamento de ativação funcional sem o viés da anestesia. O uso de uma base doméstica móvel levantada a ar é uma boa alternativa para outros aparelhos fixos na cabeça existentes, como esteiras lineares ou esféricas. Ao ser firmemente fixado na cabeça, o movimento da base dá ao mouse a ilusão de navegar pelo ambiente, permitindo que uma ampla gama de testes comportamentais seja acoplado à imagem fUS16. No entanto, o procedimento de habitação para fixação da cabeça constitui um passo importante para diminuir o estresse, especialmente para experimentos onde pode ser considerado um fator de confusão. O procedimento aqui detalhado (6 dias de manuseio e habituação à fixação da cabeça) dá resultados robustos para estimulação sensorial e conectividade funcional de estado de repouso. No entanto, pode ser necessário estender o período de habituação para testes comportamentais mais refinados17.
Divulgações
Jeremy Ferrier e Bruno-Félix Osmanski são funcionários da Iconeus. Thomas Deffieux, Zsolt Lenkei, Bruno-Félix Osmanski e Mickael Tanter são co-fundadores e acionistas da Iconeus.
Agradecimentos
Este trabalho foi apoiado pelo European Research Council (ERC) Advanced Grant N° 339244-FUSIMAGINE, a Agência Nacional de Pesquisa financiando 'Pinch' (ANR-18-CE37-005), o Inserm Research Technology Accelerator in Biomedical Ultrasound, o núcleo técnico do IPNP, o Inserm U1266, o programa europeu de pesquisa FUSIMICE do Projeto Cérebro Humano, e a EmBO Short-Term Fellowship 8439 para Andrea Kliewer.
Materiais
| Name | Company | Catalog Number | Comments |
| BD Plastipak 1 mL syringes | Dutscher, France | 303172 | |
| BD Microlance 26 Gauge needles | Dutscher, France | 303800 | |
| Animal Temperature Controller (heating Plate coupled with a rectal probe) | Physitemp | TCAT-2DF | |
| Arduino | Arduino | Arduino Uno-Rev3 | |
| Atipamezole | Orion Pharma, France | Antisedan® | 5 mg/ml injectable solution |
| Dental Ciment | Sun Médical, Shiga, japan | Superbond C&B | |
| Depilatory cream | Klorane | N/A | |
| Eye Ointment | TVM, UK | Ocry-gel | |
| Hair trimmer | Wella Profesionnals | N/A | |
| Head plates | Neurotar, Finland | Model 14 | |
| Iconeus One standard package for fUS | Iconeus, France | Iconeus One | |
| IcoScan acquisition software (v1.0) | Iconeus, France | IcoScan | |
| IcoStudio analysis software (v1.0) | Iconeus, France | IcoStudio | |
| Isoflurane Anesthesia station | Minerve, Esternay, France | ||
| Ketamine | Virbac, France | Ketamine1000 | 100 mg/ml injectable solution |
| Lidocaine | Vetoquinol | Lurocaine® | 20 mg/ml injectable solution |
| Medetomidine | Orion Pharma, France | Domitor® | 1 mg/ml injectable solution |
| Meloxicam | Boehringer lingelheim | Metacam® | 0.5 mg/ml injectable solution |
| Mobile HomeCage Large with tracking capability | Neurotar, Finland | MHC-L-T-V4 | |
| Monitoring of ECG and breathing rate | AD Systems, (USA) and LabChart software | ||
| Servomotor | Feetech | FT90B | |
| Stereotaxic frame | David Kopf (Tujunga, USA) | 900-WA | Using Mouse Adaptor (Ref: 922) and Non-Rupture Ear Bars (ref: 922) |
| Surgical glue | 3M, USA | Vetbond | |
| Syringe Pump | KD Scientific, USA | Legato® 130, Cat# 788130 | |
| Ultrasound gel | DREXCO medical, France | Medi'Gel | |
| Xylazine 2% | Bayer, France | Rompun® | 20 mg/ml injectable solution |
Referências
- Hoyer, C., Gass, N., Weber-Fahr, W., Sartorius, A. Advantages and challenges of small animal magnetic resonance imaging as a translational tool. Neuropsychobiology. 69 (4), 187-201 (2014).
- Deffieux, T., Demene, C., Pernot, M., Tanter, M. Functional ultrasound neuroimaging: a review of the preclinical and clinical state of the art. Current Opinion in Neurobiology. 50, 128-135 (2018).
- Rabut, C., et al. Pharmaco-fUS: Quantification of pharmacologically-induced dynamic changes in brain perfusion and connectivity by functional ultrasound imaging in awake mice. NeuroImage. 222, 117231 (2020).
- Tiran, E., et al. Transcranial functional ultrasound imaging in freely moving awake mice and anesthetized young rats without contrast agent. Ultrasound in Medicine and Biology. 43 (8), 1679-1689 (2017).
- Ferrier, J., Tiran, E., Deffieux, T., Tanter, M., Lenkei, Z. Functional imaging evidence for task-induced deactivation and disconnection of a major default mode network hub in the mouse brain. Proceedings of the National Academy of Sciences of the United States of America. 117 (26), 15270-15280 (2020).
- Rabut, C., et al. 4D functional ultrasound imaging of whole-brain activity in rodents. Nature Methods. 16 (10), 994-997 (2019).
- Brunner, C., et al. A platform for brain-wide volumetric functional ultrasound imaging and of circuit dynamics in awake mice. Neuron. 108 (5), 861-875 (2020).
- Gesnik, M., et al. 3D functional ultrasound imaging of the cerebral visual system in rodents. NeuroImage. 149, 267-274 (2017).
- Macé, &. #. 2. 0. 1. ;., et al. Whole-brain functional ultrasound imaging reveals brain modules for visuomotor integration. Neuron. 100 (5), 1241-1251 (2018).
- Macé, E., Montaldo, G., Cohen, I., Baulac, M., Fink, M., Tanter, M. Functional ultrasound imaging of the brain. Nature Methods. 8 (8), 662-664 (2011).
- Tiran, E., et al. Transcranial functional ultrasound imaging in freely moving awake mice and anesthetized young rats without contrast agent. Ultrasound in Medicine and Biology. 43 (8), 1679-1689 (2017).
- Claron, J., et al. Large scale functional ultrasound imaging of the spinal cord reveals in depth spatiotemporal responses of spinal nociceptive circuits in both normal and inflammatory state. Pain. , (2020).
- Aydin, A. K., et al. Transfer functions linking neural calcium to single voxel functional ultrasound signal. Nature Communications. 11 (1), 2954 (2020).
- Bimbard, C., et al. Multi-scale mapping along the auditory hierarchy using high-resolution functional ultrasound in the awake ferret. eLife. 7, 35028 (2018).
- Boido, D., et al. Mesoscopic and microscopic imaging of sensory responses in the same animal. Nature Communications. 10 (1), 1110 (2019).
- Kislin, M., et al. Flat-floored air-lifted platform: A new method for combining behavior with microscopy or electrophysiology on awake freely moving rodents. Journal of Visualized Experiments. (88), e51869 (2014).
- Juczewski, K., Koussa, J. A., Kesner, A. J., Lee, J. O., Lovinger, D. M. Stress and behavioral correlates in the head-fixed method: stress measurements, habituation dynamics, locomotion, and motor-skill learning in mice. Scientific Reports. 10 (1), 12245 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados