בניית מודלים לעור עבור יישומים רבים - החל ממונוקולטורה דו-ממדית (2D) ועד רב-תרבותיות תלת-ממדית (3D)
* These authors contributed equally
In This Article
Summary
כאן, אנו מציגים הליכים זולים ופשוטים להצגת מודלים שונים של עור תלת ממדי למחקר שגרתי במעבדה לתרביות תאים. חוקרים יכולים ליצור מודלים המותאמים לצרכיהם מבלי להסתמך על מודלים זמינים מסחרית.
Abstract
בשל המבנה המורכב והתפקודים החשובים של העור, זהו מודל מחקרי מעניין לתעשיות הקוסמטיקה, התרופות והרפואה. באיחוד האירופי חל איסור מוחלט על ניסויים במוצרי קוסמטיקה ומרכיביהם על בעלי חיים. במקרה של תרופות ותרופות, אפשרות זו מוגבלת כל הזמן. בהתאם לעיקרון 3Rs, זה הופך להיות נפוץ יותר ויותר לבדוק תרכובות בודדות, כמו גם ניסוחים שלמים על מודלים שנוצרו באופן מלאכותי. הזולים והנפוצים ביותר הם המודלים הדו-ממדיים, המורכבים מחד-שכבה של תאים אך אינם משקפים את האינטראקציות האמיתיות בין התאים ברקמה. למרות מודלים 3D זמין מסחרית לספק ייצוג טוב יותר של הרקמה, הם אינם משמשים בקנה מידה גדול. הסיבה לכך היא שהם יקרים, זמן ההמתנה ארוך למדי, והדגמים הזמינים מוגבלים לעתים קרובות רק לאלה המשמשים בדרך כלל.
על מנת להעביר את המחקר שנערך לרמה גבוהה יותר, ביצענו אופטימיזציה של ההליכים של תכשירים שונים במודל עור תלת ממדי. ההליכים המתוארים זולים ופשוטים להכנה, שכן ניתן ליישם אותם במעבדות רבות ועל ידי חוקרים בעלי ניסיון שונה בתרבית תאים.
Introduction
העור הוא מבנה מתמשך עם אינטראקציות multicell לחשוף את תפקוד תקין הומאוסטזיס של איבר מורכב זה. הוא בנוי משכבות שונות מבחינה מורפולוגית: השכבה הפנימית - דרמיס, והשכבה החיצונית - האפידרמיס. על גבי האפידרמיס, אנו מבחינים בנוסף בשכבת הקרנית (המורכבת מתאים מתים שטוחים - קורנוציטים), המספקת את ההגנה הגדולה ביותר מפני הסביבה החיצונית. חלק מהתפקודים הפסיביים והאקטיביים החשובים ביותר של העור הם הגנה על הגוף מפני גורמים חיצוניים, השתתפות בתהליכים אימונולוגיים, הפרשה, ספיגה מחדש, ויסות תרמי וחישה 1,2,3. מכיוון שהוא נחשב לאחד האיברים הגדולים בגוף, אי אפשר להימנע ממגע עם פתוגנים שונים, אלרגנים, כימיקלים, כמו גם קרינה אולטרה סגולה (UV). לכן, הוא בנוי עם סוגים רבים של תאים עם פונקציות ספציפיות. סוגי התאים העיקריים הקיימים באפידרמיס הם קרטינוציטים (כמעט 90% מכלל התאים, בעלי תפקידים מבניים ואימונולוגיים בחלקים העמוקים יותר של האפידרמיס, אך בהמשך עוברים את תהליך הקרטיניזציה כדי להפוך לקורנוציטים בשכבה העליונה של האפידרמיס), מלנוציטים (רק 3%-7% מאוכלוסיית תאי האפידרמיס, המייצרים את הפיגמנט מגן UV מלנין) ותאי לנגרהנס (ממערכת החיסון). במקרה של הדרמיס, התאים העיקריים הם פיברובלסטים (המייצרים גורמי גדילה וחלבונים), תאים דנדריטיים ותאי פיטום (שני סוגי התאים של מערכת החיסון)4,5,6. יתר על כן, העור מצויד במספר חלבונים חוץ-תאיים (כגון קולגן מסוג I ו- IV, פיברונקטין ולמינין; איור 1) וסיבי חלבון (קולגן ואלסטין), המבטיחים את המבנה הספציפי של העור אך גם מעודדים קשירת תאים, הידבקות תאים ואינטראקציות אחרות7.
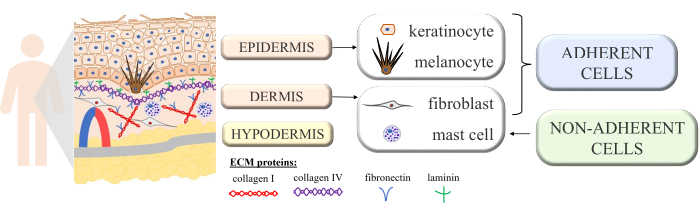
איור 1: סכמטי המראה את מבנה העור. מבנה העור סימן ארבעה סוגי תאים בסיסיים המופיעים בשכבות הנפרדות שלו והבחין בין חלבונים של המטריצה החוץ תאית. דמות זו נוצרה באמצעות MS PowerPoint. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
הבטיחות של מוצרי קוסמטיקה ותרופות היא נושא חשוב מאוד, והגנה על בריאות הצרכנים והמטופלים היא בראש סדר העדיפויות8. עד לאחרונה, זה היה אמור להיות מובטח על ידי ניסויים רבים, כולל מחקרים שנערכו על בעלי חיים. למרבה הצער, אלה דרשו לעתים קרובות שימוש בשיטות דרסטיות, הגורמות כאב וסבל לבעלי חיים המשמשים למטרות מחקר (לעתים קרובות עכברים, חולדות וחזירים). בשנת 1959 הוצגו עקרונות טכניקת הניסוי ההומאנית (עקרון 3Rs): (1 - החלפה) החלפת בעלי חיים במחקר במודלים במבחנה, סיליקו או אקס ויוו, (2 - הפחתה) הפחתת מספר בעלי החיים המשמשים למחקר, ו (3 - עידון) שיפור רווחתם של בעלי החיים שעדיין נחוצים למחקר ובמקביל שיפור השיטות החלופיות שפותחו9. יתר על כן, באיחוד האירופי, ניסויים קוסמטיים על בעלי חיים מוסדרים בחוק. החל מה-11 בספטמבר 2004 נכנס לתוקף האיסור על מוצרי קוסמטיקה שנוסו על בעלי חיים. ב-11 במרץ 2009 אסר האיחוד האירופי על ניסויים בבעלי חיים של רכיבים קוסמטיים. מכירת מוצרי קוסמטיקה העשויים מרכיבים חדשים שנוסו על בעלי חיים נאסרה; עם זאת, בדיקת המוצרים על בעלי חיים עבור בעיות בריאות אנושיות מורכבות כגון רעילות מינון חוזר, רעילות רבייה וטוקסיקוקינטיקה עדיין הייתה מקובלת. החל מה-11 במרץ 2013, באיחוד האירופי, אסור למכור מוצרי קוסמטיקה שבהם המוצר המוגמר או מרכיביו נוסו על בעלי חיים10. לכן, כיום, בקוסמטולוגיה, המחקר מתבצע בשלוש רמות: in vitro (תאים), ex vivo (רקמות אמיתיות), ו in vivo (מתנדבים)11. במקרה של תרופות, הצורך בניסויים בבעלי חיים נותר בעינו; עם זאת, הוא מופחת באופן משמעותי ונשלט בקפידה12.
כשיטות חלופיות לניסויים בבעלי חיים ולהערכה ראשונית של יעילותו של חומר פעיל חדש, נעשה שימוש בתרביות תאי עור במבחנה . בידוד סוגים שונים של תאי עור וגידולם בתנאי מעבדה סטריליים מאפשר להעריך את הבטיחות והרעילות של חומרים פעילים. קווי תאי עור הם גם מודלים מוכרים למחקר מכיוון שהתאים נמכרים על ידי חברות מוסמכות והתוצאות יכולות להיות דומות במעבדות שונות. בדיקות אלה מבוצעות בדרך כלל על מודלים דו-ממדיים פשוטים של מונוקולטורה של תאי עור אנושיים. חלק מהמודלים המתקדמים יותר הם התרביות המשותפות שלהם (כגון קרטינוציטים עם פיברובלסטים וקרטינוציטים עם מלנוציטים), כמו גם המודלים התלת-ממדיים, הכוללים תרביות ללא פיגומים (כדורים) ומקבילות עור מבוססות פיגומים של האפידרמיס, הדרמיס או אפילו התחליפים בעובי מלא של העור13. ראוי להזכיר כי מלבד הסוג האחרון (שווה ערך לעור), השאר אינם זמינים מסחרית, ואם יש צורך, מדען חייב להכין אותם בעצמו.
למרות שרבים מהדגמים הללו נשמרו ונמכרים כיום באופן שגרתי (טבלה 1), כל הזמן נדרשים דגמים נוספים כדי לאמת את רוב התוצאות. לפיכך, המודלים החדשים שהונדסו צריכים לשחזר טוב יותר את האינטראקציות האמיתיות המתרחשות בגוף האדם. כאשר תערובת של תאים מסוגים שונים משמשת ליצירת מודלים כאלה, ניתן להשיג את הרבייה של ההיבט הרב-תאי של רקמה in vivo . כתוצאה מכך מתפתחת תרבית אורגנוטיפית (איור 2).
| שם | תיאור | |||||
| עור רגיל | אפיסקין | אפידרמיס אנושי משוחזר - קרטינוציטים על קרום קולגן | ||||
| SkinEthic RHE | אפידרמיס אנושי משוחזר - קרטינוציטים על קרום פוליקרבונט | |||||
| SkinEthic RHE-LC | מודל אפידרמיס אנושי תאי לנגרהנס - קרטינוציטים ותאי לנגרהנס על קרום פוליקרבונט | |||||
| SkinEthic RHPE | אפידרמיס פיגמנטי אנושי משוחזר - קרטינוציטים ומלנוציטים על קרום פוליקרבונט | |||||
| טי-סקין | מודל עור משוחזר בעובי מלא אנושי - קרטינוציטים על שכבת פיברובלסטים, שגודלו על קרום פוליקרבונט | |||||
| פניון FT דגם עור | קרטינוציטים ופיברובלסטים בהידרוג'ל | |||||
| עור עם מחלה | מלנומה FT מודל עור | קרטינוציטים ופיברובלסטים רגילים שמקורם בבני אדם עם קו תאי מלנומה ממאיר אנושי A375 | ||||
| מודל רקמת פסוריאזיס | קרטינוציטים ופיברובלסטים אנושיים רגילים | |||||
טבלה 1: המקבילות הפופולריות ביותר לעור מסחרי עבור מחקרים שונים.
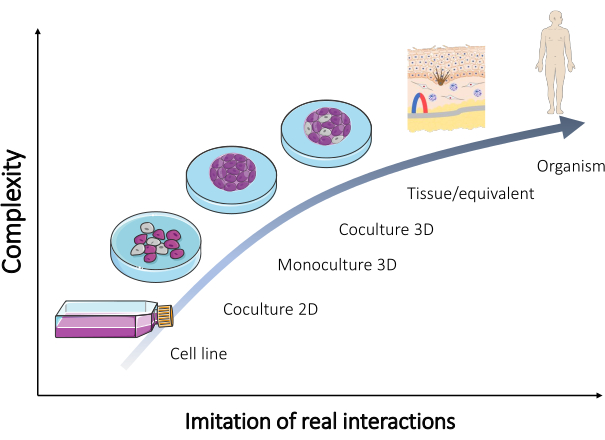
איור 2: סיבוכיות של מודלים שונים במבחנה . הקשר בין המורכבות של מודלים שונים במבחנה כדי ליצור מחדש אורגניזם לבין אינטראקציות אמיתיות המתרחשות ישירות בגוף האדם. האיור שונה מהסט "מיקרוביולוגיה ותרבית תאים" מתוך Servier Medical Art מאת Servier (https://smart.servier.com/). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
אחת המגבלות החשובות ביותר של המקבילות המסחריות היא זמינותם של מודלים מחקריים כלליים מאוד בלבד עם כמה סוגים של תאים (בדרך כלל 1-2, לעתים רחוקות 3). עם זאת, ישנם תאים רבים יותר בעור, והאינטראקציה שלהם זה עם זה יכולה להבטיח סבילות טובה יותר או גרועה יותר של מרכיבים שונים14. מחסור בכמה רכיבים חיסוניים יכול להפחית את ערכו במספר סוגים של מחקרים, כולל אימונותרפיה. זוהי בעיה רצינית שכן מלנומה היא סרטן עור מסכן חיים עקב התפרצות מוקדמת של גרורות והתנגדות תכופה לטיפול היישומי15. כדי לשפר את מודל העור המלאכותי, חוקרים מנסים לבסס תרבית משותפת של תאי חיסון עם קווי תאים ואורגנואידים16 וזה נחשב לשיפור גדול של המודלים הנחקרים. לדוגמה, תאי פיטום לוקחים חלק בתהליכים פיזיולוגיים רבים (ריפוי פצעים, עיצוב רקמות) ופתולוגיים (דלקת, אנגיוגנזה והתקדמות הגידול) בעור17. לפיכך, הופעתם במודל יכולה לשנות באופן משמעותי את תגובת המודל לתרכובת הנחקרת. לבסוף, מידע רב הקשור לעור עדיין חסר, אשר ניתן לגלות רק על ידי ביצוע מחקר בסיסי. זו הסיבה שיצירה וזיקוק של מודלים שונים של עור מלאכותי (טבלה 2) היא מאמץ חשוב כל כך. מאמר זה מציג מספר הליכים ליצירת מודלים מתקדמים של עור, כולל כדורים ומקבילות עור.
| דוגמנית עור במבחנה | ניסיון לשחזר אינטראקציות המתרחשות ברקמה | דוגמאות לתאים הנמצאים בשימוש |
| תרבית תאים דו-ממדית או תלת-ממדית | האפידרמיס | קרטינוציטים |
| מלנוציטים | ||
| קרטינוציטים + מלנוציטים | ||
| דרמיס | פיברובלסטים | |
| תאי פיטום | ||
| פיברובלסטים + תאי פיטום | ||
| עור | קרטינוציטים + פיברובלסטים | |
| קרטינוציטים + תאי פיטום | ||
| מלנוציטים + פיברובלסטים | ||
| מלנוציטים + תאי פיטום | ||
| קרטינוציטים + פיברובלסטים + מלנוציטים | ||
| קרטינוציטים + פיברובלסטים + תאי פיטום |
טבלה 2: דוגמאות לתערובת מסוג תאים ליצירת רקמת עור בתרבית דו-ממדית ותלת-ממדית.
Protocol
המחקר נערך בהתאם להנחיות הצהרת הלסינקי ואושר על ידי ועדת האתיקה של האוניברסיטה הרפואית של ורשה (KB/7/2022). הסכמה מדעת התקבלה מכל הנבדקים המעורבים במחקר.
הערה: ההליכים המתוארים של הכנת מודל העור המתקדם יכולים להתבצע עם שימוש בתאי עור ראשוניים זמינים מסחרית וקווי תאים או עם התאים הראשוניים שבודדו מהמטופלים. תאים מסחריים מסופקים עם המסמכים הרלוונטיים, והשימוש בהם במחקר עבור רוב המדינות אינו דורש אישור נוסף. עם זאת, עבור מדינות מסוימות, זה חובה, ולכן, זה חייב להיבדק עם תקנות ועדת האתיקה המקומית. אם יש להשתמש בתאים הראשוניים שבודדו מחולים במחקר, ראשית, המחקר חייב להיות מאושר על ידי הוועדה האתית המקומית, והוא צריך להתבצע על פי ההנחיות המחמירות שלהם. כמו כן, יש לאסוף הסכמה מדעת בכתב מכל תורמי רקמת העור. הבידוד של תאי עור ראשוניים לא היה הנושא של מאמר זה, אך ניתן למצוא הליכי בידוד לדוגמה ב- Kosten et al. (keratinocytes)18, Ścieżyńska et al. (melanocytes)19, Kröger et al. (fibroblasts and mast cells)20. לרוב תאי העור וקווי התאים הרגילים יש רמת בטיחות של BSL1; הם לא גורמים לאיומים. עם זאת, ציוד המעבדה המשומש צריך לעמוד בתקנים לתרבית תאים של בעלי חיים ובני אדם בתנאים מבוקרים.
1. תרבית תאי עור
הערה: תרביות תאי עור חייבות להתבצע בצלוחיות המוקדשות לתאים דבקים או תרחיפים (בהתאם לסוג התא) בטמפרטורה של 37°C ותכולת פחמן דו חמצני של 5% באינקובטור. פעילויות הקשורות לגידולם ולשימוש בהם למחקר דורשות תנאים סטריליים ויש לבצען בתא למינרי לאחר חשיפה לקרניים אולטרה סגולות C (UVC) למשך 15-30 דקות. השגת תרחיפים של תאים, אשר משמשים לאחר מכן ליצירת מודלים דו-ממדיים ותלת ממדיים, דורשת יישום של הליכים בהתאם לסוג התא (עבור תאים דבקים כגון קרטינוציטים, פיברובלסטים ומלנוציטים - שלב 1.1, עבור תאים לא דבקים של תאי פיטום - שלב 1.2) (איור 3). עבור גדלים שונים של בקבוקי תרבית, הנפחים של כל הריאגנטים (כגון מלוחים בינוניים, מלוחים חוצצי פוספט או תמיסת טריפסין) המשמשים בשיטות המתוארות מפורטים בטבלה 3. פרמטרים התלויים בסוג התאים (למשל, ריכוז והרכב ריאגנטים, שיטת צנטריפוגה וכו') ממוינים בטבלה 4. צפיפויות תאים המשמשות לזריעה מוצגות בטבלה 5. כל הטבלאות הללו כלולות בסוף סעיף זה.
איור 3: גידול תאים דבקים ולא דבקים. ההליך הכללי שלב אחר שלב של טיפוח תאים דבק ולא דבק (מספרים תואמים את התיאורים של שלבים 1.1 ו -1.2). הדמות נוצרה באמצעות MS PowerPoint. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- קבלת השעיה של תאים דבקים
- מוציאים את המדיום מבקבוק התרבית.
- שטפו בעדינות את התאים במי מלח חוצצי פוספט (PBS, טבלה 3).
- הוסף תמיסת טריפסין באתילן דיאמין טטרה חומצה אצטית (תמיסת טריפסין-EDTA, טבלה 3). לדגור על הבקבוק ב 37 ° C ולשלוט על ניתוק של תאים מפני השטח על המיקרוסקופ האופטי.
- השהה את התאים המנותקים בכמות כפולה לפחות של מדיום גידול מלא או מנטרל טריפסין כדי להשבית טריפסין (2:1) (עבור נפחים, עיין בטבלה 3, ועבור ריאגנטים, עיין בטבלה 4). כמותית להעביר את התוכן של בקבוק לתוך צינור 15 מ"ל.
- קח נפח קטן (20 μL) של תרחיף התא לתוך צינור 1.5 מ"ל וספור את התאים עם המוציטומטר ידני או אוטומטי.
- צנטריפוגה את הצינור (פרמטרים בטבלה 4), מסירים את רוב הסופרנטנט, ומשעימים מחדש את כדורית התא בכמות הקטנה של הנוזל שנותר. לאחר מכן, הוסף מספיק מדיום טרי כדי לקבל את נפח קדם-הצנטריפוגה (נפח בטבלה 3) אם צפיפות התא מתאימה לזרע או לחשב מחדש את הנפח הנדרש של התווך החדש.
הערה: תאים מסוימים, כגון מלנוציטים, רגישים מאוד לצנטריפוגה, ולכן נמנע הצורך לצנטריפוגה אותם שוב במרחק זמן קצר. - הכינו את תרחיף התא בצפיפות הנדרשת (תאים/מ"ל, צפיפות התא בטבלה 5) לניסוי (מונו-ממד דו-ממדי או תלת-ממדי רב-תרביות של תאי עור).
הערה: אם רוצים תרבית נוספת של תאים, החזירו 5,000-8,000 תאים/מ"ל לבקבוק חדש והוסיפו מדיום טרי (נפח בטבלה 3).
- קבלת השעיה של תאים שאינם דבקים
- הסר את המדיום עם תרחיף התא מן בקבוק התרבית ולהעביר אותו כמותית לתוך צינור 15 מ"ל.
- קח נפח קטן (20 μL) של תרחיף התא לתוך צינור חדש 1.5 מ"ל. לספור את התאים עם hemocytometer ידני או אוטומטי.
- צנטריפוגה את הצינור (פרמטרים בטבלה 4), מסירים את רוב הסופרנטנט, ומשעימים מחדש את התאים בכמות קטנה מהנוזל שנותר. לאחר מכן, הוסף מדיום טרי כדי לקבל את נפח קדם-הצנטריפוגה (כפי שמצוין בטבלה 3) אם צפיפות התא מתאימה לזרע או לחשב מחדש את הנפח הנדרש של התווך החדש.
- הכינו את תרחיף התאים בצפיפות הנדרשת (תאים למ"ל, כפי שמוצע בטבלה 5) לניסוי (2D/3D mono- או multi-cultures of skin cells).
הערה: אם רוצים להמשיך בתרבית תאים, להחזיר 5,000-8,000 תאים/מ"ל לבקבוק חדש ולהוסיף תווך טרי.
| 25 ס"מ2 צלוחיות תרבית | 75 ס"מ2 צלוחיות תרבות | |
| מדיום תרבות [מ"ל] | 4–5 | 8–12 |
| PBS [מ"ל] | 5 | 10 |
| טריפסין–EDTA [מ"ל] | 0.5–1 | 1–2 |
| אמצעי נטרול [mL] | 1–2 | 2–4 |
טבלה 3: נפחים של ריאגנטים המשמשים במהלך גידול והכנה של תרחיפים תאים.
| מונוקולטורה של תאי עור | טריפסין | מנטרל טריפסין | צנטריפוגה | סוג בינוני למונוקולטורה דו-ממדית | |
| קרטינוציטים | 0.25% | עם מנטרל טריפסין | 300 x גרם, 5 דקות, RT | מדיום גידול קרטינוציטים 2 | |
| פיברובלסטים | 0.25% | עם מדיום | 300 x גרם, 5 דקות, RT | DMEM, 10% FBS | |
| מלנוציטים | 0.025% | עם מנטרל טריפסין | 300 x גרם, 3 דקות, RT | בינוני 254, ללא PMA תוסף צמיחה של מלנוציטים אנושיים-2 | |
| תאי פיטום | לא נדרש | לא נדרש | 300 x גרם, 3 דקות, RT | IMDM, 10% FBS, 1% חומצות אמינו לא חיוניות, 226 מיקרומטר α-מונותיוגליצרול | |
טבלה 4: טריפסיניזציה, פרמטרי צנטריפוגה וסוג מדיה תלויים בסוג התא.
| סוג דגם | צפיפות תאים [תא/מ"ל] | ||
| דו-ממד | מונולייר | פיברובלסטים | 2 x 105 |
| תאי פיטום | |||
| קרטינוציטים | |||
| מלנוציטים | |||
| תלת מימד | כדור (שיטת טיפה תלויה) | פיברובלסטים | 5 x 105 |
| תאי פיטום | |||
| קרטינוציטים | |||
| מלנוציטים | |||
| ערבוב תאים | |||
| כדור (שיטת הגבלת הידבקות תאים) | פיברובלסטים | 2 x 105 | |
| תאי פיטום | |||
| קרטינוציטים | |||
| מלנוציטים | |||
| ערבוב תאים | |||
| שווה ערך | פיברובלסטים | 1 x 105 | |
| תאי פיטום | 1 x 104 | ||
| קרטינוציטים | 8 x 105 | ||
| מלנוציטים | 5 x 104 | ||
טבלה 5: צפיפות זריעת תאים עבור סוגים שונים של דגמי עור.
2. הכנת כדורי תאי עור
הערה: כדי ליצור כדורים, השימוש בשיטת הטיפה התלויה מתואר בשלב 2.1 (איור 4), בעוד שהגישה המתמקדת בהגבלת הידבקות התאים מוצגת בשלב 2.2 (איור 5). עם זאת, מכיוון שהתחומים קטנים מאוד ויכולים להיות לא יציבים, פעילויות המתבצעות בשיטות אלה דורשות סבלנות, עדינות ופעולות איטיות.
- שיטת התלייה-טיפה
- השתמש בצפיפות תאים מתאימה כדי להשיג את גודל הכדור הרצוי (צפיפות תאים מומלצת 5 x 105 תאים/מ"ל, טבלה 5).
- פיפטה 20 μL של תרחיף התא על מכסה צלחת פטרי או צלחת מרובת בארות (איור 4A).
- כסו את המנה/צלחת בחלק התחתון והפכו אותה בעדינות (טיפות תלויות ייווצרו אוטומטית על המכסים, איור 4B).
- מלאו את צלחת הפטרי/בארות הצלחת בתמיסת מים סטריליים/PBS כדי למנוע אידוי של התווך מטיפות.
- לדגור על הטיפות במשך 48-72 שעות ב 37 מעלות צלזיוס.
הערה: כוח הכבידה מושך את התאים למטה, והיעדר משטח נגיש מונע את חיבור התאים לכלי הדם ומקדם צבירת תאים. עם זאת, סוגי תאים מסוימים עשויים לדרוש דגירה ארוכה יותר. - לפני ביצוע השלב הבא, מלא את הבארות של הצלחת החדשה (או השתמש בצלחת הישנה עם מים שהוצאו / PBS מהבארות) עם מצע הגידול המלא (100 μL).
הערה: בשלב הבא, יש ליטול 200 קצוות מיקרוליטר, להסיר 1/5 מכל קצה קצה ולעקר לפני השימוש. - מעבירים את כדורי התא לבארות הצלחת מרובת הבארות באמצעות קצוות פיפטה סטריליים עם קצה חתוך. קח 200 קצוות μL, להסיר 1/5 מכל קצה קצה, ולעקר לפני השימוש (איור 4C).
הערה: שלב זה עשוי להיות קשה, מכיוון שזרימת הנוזלים במהלך הפיכת הצלחת/צלחת עלולה לפגוע בכדורים. - דגרו על הכדורים המועברים במשך יום אחד בצלחת מרובת בארות בטמפרטורה של 37°C לפני ביצוע ניסויים נוספים (לדוגמה, הוספת תרכובות, מבחני ציטוטוקסיות, מבוא כדור למקבילות) (איור 4D).
- השיטה להגבלת הידבקות התא
- לפני זריעת התא, כסו את הבארות של הצלחת התחתונה U בתמיסה פעילי שטח (למשל, F-127 פלורוני, פוליאתילן גליקול, אלכוהול פוליוויניל)21. הכינו והוסיפו 100 מיקרוליטר של תמיסת 1% פעילי שטח ב-PBS לכל באר. דגרו על הצלחת עם התמיסה במשך 24 שעות ב-37°C (איור 5A-C). אחסנו את הצלחת זמן רב יותר במידת הצורך, אך שמרו על רמת הנוזלים על ידי הוספת מאגר PBS נוסף.
- הכינו את תרחיף התא בצפיפות התא הרצויה ב-50 מיקרוליטר לבאר (צפיפות תאים מומלצת בעת זריעה 2 x 105/מ"ל, טבלה 5).
- הסירו את תמיסת פעילי השטח מהבארות לפני זריעת התאים כדי למנוע הפרעה לקרום התא על-ידי ליזה (איור 5D).
- הוסיפו את תמיסת התא לצלחת ודגרו במשך 24 שעות בטמפרטורה של 37°C כדי להגיע לצברי תאים (איור 5E). לאחר כ-1-3 ימים, ייווצרו כדורים (איור 5F) והם מוכנים לשימוש לכל ניסוי נוסף.
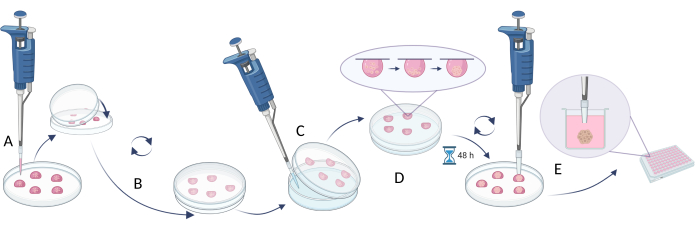
איור 4: שיטת הטיפה התלויה. (A) תרחיף תאים על המכסה וכיסוי המכסה בחלק התחתון של המנה; (ב) סיבוב הכלי ליצירת הטיפות התלויות; (ג) הוספת מים/PBS לחלק התחתון של התבשיל (הגבלת אידוי נוזלים); (ד) דגירה של הכלים בטיפות תלויות ליצירת כדורי תא; (E) איסוף טיפות עם כדורים שנוצרו וייצוב של כדורים מועברים בלוחות מרובי בארות. הדמות נוצרה עם Biorender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
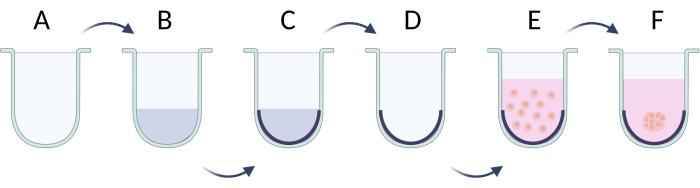
איור 5: הכנה שלב אחר שלב של כדורים בשיטת היצמדות התא המגבילה. (A) באר U-bottom; (B,C) הגבלת התקשרות תאים על ידי תמיסת פעילי שטח; (ד) הוצאת תמיסה מבארות; (ה) תאי זריעה; (F) צבירה של תאים והיווצרות כדור. הדמות נוצרה עם Biorender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. הכנת עור שווה ערך לעובי מלא
הערה: ניתן לחלק את התפתחות העור המקביל בעובי מלא (אפידרמיס ודרמיס) לשלושה שלבים (איור 6): הכנת שכבת הדרמיס המלאכותית עם הופעתם של תאי עור טיפוסיים (כגון פיברובלסטים ותאי פיטום, איור 6A), זריעת תאים הכלולים באפידרמיס המלאכותי (בעיקר קרטינוציטים ומלנוציטים, איור 6B) וצמיחה אנכית של קרטינוציטים עם תהליך קרטיניזציה אפשרי (היווצרות שכבת הקרנית, איור 6C). הכנת עור שווה ערך בעובי מלא מתוארת בשלב 3.1 (3.1.1-3.1.10). אם יש צורך בעור מקביל פחות מתקדם (למשל, רק סוג האפידרמיס), ניתן לזרוע את סוג התא שנבחר (כגון קרטינוציטים) ישירות על קרומי הקולגן או הפוליקרבונט הזמינים מסחרית וגם לגדל עם אפשרות להשראת תהליך הקרטינזציה (לעבור ישירות לשלבים 3.1.9-3.1.10).
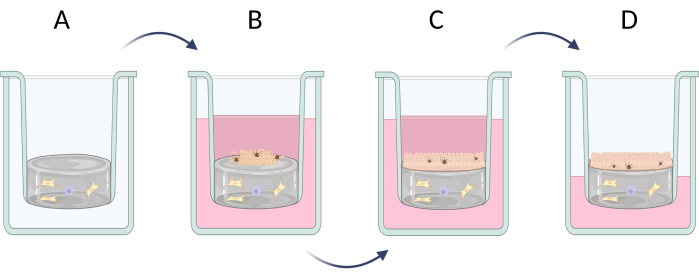
איור 6: הכנה שלב אחר שלב של עור שווה ערך בעובי מלא בתוספות. (A) הכנת שכבת הפסאודו-דרמיס עם תאי עור, (B) זריעה של תאי אפידרמיס, (C) תרבית נוספת של שווה ערך בבינוני, (D) תרבית ממשק אוויר-נוזל מקדמת היווצרות של אפיתל מרובד. הדמות נוצרה עם Biorender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- הכנת עור שווה ערך בעובי מלא בצלחת של 24 בארות
- הניחו את הצינורות עם מים, PBS (10x), 1 M NaOH ותמיסת קולגן מסוג I על קרח.
- לקבוע מספר תקין של תאי עור (למשל, פיברובלסטים ותאי פיטום; ביחס של 10:1) שיש לזרוע בהידרוג'ל. להעביר מספר תקין של תאי עור לצינור של 1.5 מ"ל (500 מיקרוליטר של פיברובלסטים ו-500 מיקרוליטר של תאי פיטום, בהתאם לצפיפויות התאים בטבלה 5) ולצנטריפוגה את התאים (300 x גרם, 3 דקות, RT).
- הסר את supernatant ובעדינות resuspend את התאים בתערובת של 695 μL של מים / 100 μL של PBS (10x) / 5 μL של NaOH.
הערה: אם 1 מ"ל מהפתרון הכולל אינו מספיק, השתמש בטבלה 6 כדי לחשב מחדש את אמצעי האחסון של כל מגיב. - הוסיפו 200 מיקרוליטר של תמיסת קולגן לתערובת וערבבו אותה בעדינות באמצעות פיפטינג.
הערה: היזהר, מכיוון שעקביות התערובת תהיה צפופה. - מוסיפים 200 μL של תערובת מוכנה להוסיף צלחת 24 באר. עבור דגם ללא שכבת הקרנית, הוסף 500 μL לכל באר של צלחת 24 באר.
- דוגרים על הצלחת במשך 10 דקות בטמפרטורת החדר (RT) ולאחר מכן מעבירים אותה לאינקובטור למשך 30 דקות.
הערה: בדוק אם ההידרוג'ל עבר פולימריזציה לפני כל פעולה אחרת. - לפני זריעת התא על פני השטח של ההידרוג'ל, שטפו אותו עם חיץ PBS (500 μL/well).
- קבע את המספר הנכון של תאי אפידרמיס (למשל, קרטינוציטים ומלנוציטים; ביחס של 15:1) שיש לזרוע על גבי ההידרוג'ל. הכינו את תערובת התאים ב-500 מיקרוליטר של מדיום ה-DMEM בתוספת 10% FBS (הוסיפו 250 מיקרוליטר קרטינוציטים ו-250 מיקרוליטר מלנוציטים, צפיפות התאים מוזכרת בטבלה 4) והוסיפו אותה בעדינות לבארות.
הערה: במקרים מסוימים, עדיף תחילה לזרוע מלנוציטים ולאפשר להם להתפשט היטב על הידרוג'ל, ולאחר 24 שעות נוספות, להסיר את המדיום ואת keratinocytes זרע. במקרה זה, להוסיף 250 μL של השעיית התא ו 250 μL של המדיום. - לדגור על הצלחות ב 37 ° C במשך 2-5 ימים, בהתאם למהירות צמיחת התא, עם חילופי בינוני (עם ריכוז יורד של FBS מ 10% עד 1%) כל 48 שעות ניטור התא מבוצע על המיקרוסקופ האופטי.
- אם יש לגרום לתהליך הקרטיניזציה לאחר קבלת שכבה חד-שכבתית של קרטינוציטים על גבי ההידרוג'ל, יש להשתמש בתווך נטול FBS בתוספת יוני סידן וחומצה L-אסקורבית למשך 2-7 שבועות נוספים (בריכוז של 1.5 מיקרומטר CaCl2 ו-50 מיקרוגרם/מ"ל חומצה L-אסקורבית).
הערה: זמן הדגירה תלוי בקרטינוציטים המשומשים ובמהירות ההתמיינות שלהם.
| מגיב | המשוואה לחישוב נפח מגיב | חישובים לדוגמה | |
| (עבור נפח סופי = Vסה"כ של 1 מ"ל) | |||
| תמיסת קולגן מסוג I | 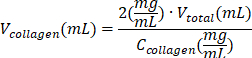 | (קולגן C = 10 מ"ג/מ"ל) | |
| 0.2 מ"ל = 200 מיקרוליטר | |||
| PBS (פי 10) | 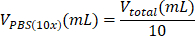 | 0.1 מ"ל = 100 מיקרוליטר | |
| 1 מטר NaOH | 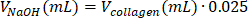 | 0.005 מ"ל = 5 מיקרוליטר | |
| סטרילי H2O | 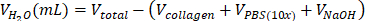 | 0.695 מ"ל = 695 מיקרוליטר | |
טבלה 6: חישוב נפחי ריאגנטים הדרושים להכנת הידרוג'ל מסוג I במינון 2 מ"ג/מ"ל.
4. זיהוי סוגי תאים במודל עור תלת ממדי בשיטות צביעת תאים
הערה: כדי לאשר כי מודל העור המפותח מורכב התאים הצפויים, טוב לבצע צביעת תאים. זהו צעד מכריע לפני שניתן יהיה לבצע ניסויי מטרה כלשהם על מודלנתון 22. במקרה של מודלים תלת-ממדיים של עור, יש צורך להטמיע מודל נתון בפרפין ולהכין שקופיות מיקרוסקופיות עם הרקמה המלאכותית שנחתכה על מיקרוטום (שלב 4.1) לפני צביעת התא (איור 7).
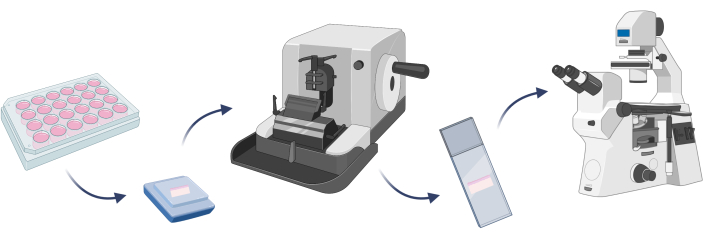
איור 7: שלבים בסיסיים של הטבעה של מודל עור תלת-ממדי, צביעת תאים ותצפיות מיקרוסקופיות. הדמות נוצרה עם Biorender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- הטמעת מודלים תלת ממדיים של עור
- יש לשטוף את העור המקביל עם PBS למשך 5 דקות ב-RT פעמיים ולקבע אותו באמצעות תמיסת פרפורמלדהיד 3.7% ב-PBS (30 דקות, RT). חזור על שלב הכביסה עם PBS.
- לפני ההטבעה, יש לייבש את העור המקביל על ידי דגירה בריכוזים הולכים וגדלים של תמיסות אתנול: 50% (15 דקות), 70% (15 דקות), 96% (2x, 30 דקות) ו-99.8% (2x, 30 דקות).
- שים את העור קבוע מיובש שווה ערך בתבנית מלא פרפין.
הערה: מקם את המקבילה בכיוון המתאים. - מכסים את התבנית בקלטת ומוסיפים עוד פרפין מלמעלה. תן לו להתמצק עד 30 דקות ב- RT.
- יש להקפיא את העור המשובץ בפרפין למשך שעה אחת לפחות בטמפרטורה של -80°C.
- הפעילו את המיקרוטום, הכניסו את העור המשובץ בפרפין וחתכו פרוסות של 5 מיקרומטר. הניחו את פרוסות הרקמה המלאכותית החתוכות על המגלשות המיקרוסקופיות וייבשו אותן למשך 8 שעות לפחות בטמפרטורה של 37°C.
- טבלו את המגלשות בקסילן (2x, 10 דקות), ולאחר מכן הרטיבו מחדש את המגלשות עם ירידה בריכוזי אתנול 99.8% (5 דקות), 96% (5 דקות), 70% (5 דקות) ו-50% (5 דקות).
- הסר את המגלשות מתמיסת האתנול ושטוף אותן פעמיים במים (5 דקות).
הערה: צביעת תאים מסורתית מבוצעת על ידי מריחת צבעים ספציפיים (Hematoxylin, Eosin23) או על ידי שימוש בנוגדנים המכוונים באופן סלקטיבי לסמנים ביולוגיים (כולל קולגן 1A2 עבור פיברובלסטים, ציטוקרטין 14 עבור קרטינוציטים, melan-A או טירוסינאז עבור מלנוציטים24). ניתן לבצע צביעת המטוקסילין ואוזין שגרתית על ידי ביצוע הפרוטוקולים שהוכנו על ידי חברות שונות (שלב 4.2). מצד שני, אם נדרשת צביעה אימונופלואורסצנטית או אימונוהיסטוכימית, ההליך שונה וארוך משמעותית (שלבים 4.3 ו -4.4). כדי להימנע מתגובות לא ספציפיות, השתמש בנוגדנים הראשוניים המיוצרים במינים שונים ולאחר מכן בנוגדנים המשניים הייעודיים.
- צביעת המטוקסילין ואאוזין של דגמי עור תלת ממדיים
- הכתימו את השקופית המיקרוסקופית בתמיסת המטוקסילין למשך 3 דקות ב- RT.
- שטפו את המגלשות בתמיסת אלכוהול חומצי למשך דקה.
הערה: הכינו את תמיסת האלכוהול החומצי על ידי ערבוב 2 מ"ל של 35%-38% חומצה הידרוכלורית עם 98 מ"ל של 99.8% אלכוהול אתילי. - לאחר מכן, לשטוף את השקופית בתמיסת 0.1% סודיום ביקרבונט כדי לקבל צבע כחול-סגול נראה לעין, עדין.
הערה: כדי לקבל תמיסת סודיום ביקרבונט 0.1%, יש להמיס 100 מ"ג נתרן דו-פחמתי ב-100 מ"ל מים טהורים במיוחד. - שטפו את המגלשות באתנול 95% למשך דקה.
- הכתימו את השקופית המיקרוסקופית בתמיסת אאוסין למשך דקה אחת ב-RT.
- שטפו את המגלשות עם 95% אתנול למשך דקה אחת ו-99.8% אתנול למשך 2 דקות.
- שטפו את המגלשות עם קסילן במשך 2 דקות כל אחת פעמיים.
- הר בלסם ולשים כיסוי בחלק העליון של המגלשה. הדגימות מוכנות לתצפיות מיקרוסקופיות.
- צביעה אימונופלואורסצנטית של דגמי עור תלת ממדיים
- שטפו את המגלשה עם PBS (5 דקות).
- הכינו את תמיסת החסימה (אלבומין בסרום בקר 3% [BSA] או חלב דל שומן במאגר PBS בתוספת של 0.1% Triton X-100 ו-0.1% Tween 20) ודגרו על המגלשה בו למשך שעה אחת ב-RT.
- שטפו את המגלשות פעמיים עם מאגר PBS (5 דקות).
- לדלל את הנוגדן הראשוני במאגר PBS (על פי המלצות היצרן, טבלה 7) ולדגור על המגלשות במשך 1-2 שעות ב- RT או לילה ב- 4 מעלות צלזיוס.
- שטפו את המגלשות פעמיים עם מאגר PBS (5 דקות).
- לדלל את הנוגדן המשני במאגר PBS (על פי המלצות היצרן, טבלה 7) ולדגור על השקופיות במשך שעה אחת ב- RT.
- שטפו את המגלשות פעמיים עם PBS (5 דקות).
- הכינו את תמיסת הצבע לצביעת הגרעינים (לדוגמה, Hoechst 33342 או DAPI, טבלה 7) ודגרו על המגלשות עד 15 דקות ב-RT.
- שטפו את המגלשות עם PBS (5 דקות).
- הר בלסם, לכסות את החלק עם כיסוי, לדמיין את ההשפעות של צביעת התא באמצעות מיקרוסקופ פלורסנט.
- צביעה אימונוהיסטוכימית של מודלים תלת ממדיים של עור
- בצע את שלבים 4.3.1-4.3.5.
- בנוסף, בצעו שלב שטיפה עם חיץ המתאים לאנזים איתו מצומד הנוגדן המשני.
- לדלל את הנוגדן המשני בחיץ המתאים לאנזים המצומד (על פי המלצות היצרן) ולדגור על השקפים במשך שעה אחת ב- RT.
- שטפו את המגלשות פעמיים עם PBS (5 דקות).
- הכינו תמיסה של מצע מתאים לאנזים המשומש ודגרו על השקפים בהתאם להמלצות היצרן.
- שטפו את המגלשות עם חיץ (5 דקות) והרכיבו אותן בבלזם.
- דמיינו את ההשפעות של צביעת התא באמצעות מיקרוסקופ שדה בהיר.
| סוג התא/ אורגנואיד התא זוהה | חומר מכתים | דילול / ריכוז | ||
| תאי פיטום | אבידין−סולפורהודאמין 101 | 1 מיקרוגרם/מ"ל | ||
| פיברובלסטים | נוגדן Col1A2 המיוצר בארנב | 1:50 | ||
| נוגדן משני נגד ארנב עז מצומד עם FITC | 1:250 | |||
| קרטינוציטים | נוגדן Cytokeratin 14 המיוצר בעכבר | 1:50 | ||
| נוגדן משני נגד עכבר עז מצומד עם FITC | 1:250 | |||
| מלנוציטים | מלן-נוגדן המיוצר בעכבר | 1:50 | ||
| נוגדן משני נגד עכבר עז מצומד עם FITC | 1:250 | |||
| גרעינים | הוכסט 33342 | 1 מיקרוגרם/מ"ל | ||
| דאפי | 1 מיקרוגרם/מ"ל | |||
טבלה 7: ריכוזים ודילול של ריאגנטים המשמשים לצביעת תאים.
Representative Results
לפני שמתחילים ליצור מודלים של עור במעבדה יש לקבל החלטה על סוג התאים בהם יש להשתמש (קו ראשוני/תא) ובחירת מדיום מתאים לתאים אלה. רוב בנקי התאים ממליצים ויכולים לספק מדיה לכל סוגי תרביות התא. במקרה של מודל רב-תרבותי, יש צורך לבחור מדיום אחד המתאים לכל סוגי התאים הקיימים בתרבית. חלק מאמצעי התא האופייניים המשמשים הן לתרבית תאי עור ראשונית והן לרוב קווי תאי העור הנפוצים נאספו בטבלה 8 18,19,20,25,26,27. מדיה טיפוסית המשמשת לתרביות התאים הראשוניות יקרות למדי, והרכבן מורכב. מצד שני, קווי התא מרוצים בדרך כלל מדיה עם הרכב פשוט. סוגי תאים מסוימים (בעיקר פיברובלסטים ותאי פיטום) יכולים לייצר ולהפריש גורמים המעודדים צמיחה של תאים אחרים (כגון קרטינוציטים ומלנוציטים)28,29. אם נוכחותם במודל מתוכננת, אין צורך בתוספת נוספת של המדיום.
| סוג תא | שם תא | בינוני | הפניה | ||||
| קרטינוציטים | קו HaCaT cel | DMEM, 10% FBS, 100 U/מ"ל פניצילין, 100 מיקרוגרם/מ"ל סטרפטומיצין | לדברי המוכר | ||||
| קרטינוציטים אפידרמיס אנושיים תקינים ראשוניים (NHEK) | קרטינוציטים גידול בינוני 2 (מדיום בסיסי + תערובת תוספים) | לדברי המוכר | |||||
| קרטינוציטים אפידרמיס אנושיים ראשוניים; רגיל, מבוגר (HEKa) | Dermal Cell Basal Medium, תמצית יותרת המוח מפרות 0.4%, 0.5 ננוגרם/מ"ל rh- גורם גדילה-אלפא, 6 מילימ"ר L-גלוטמין, 100 ננוגרם/מ"ל הידרוקורטיזון המיסוקצינאט, 5 מ"ג/מ"ל rh-אינסולין, 1 מ"מ אפינפרין, 5 מ"ג/מ"ל אפו-טרנספרין, 100 U/מ"ל פניצילין (במידת הצורך), סטרפטומיצין 100 מיקרוגרם/מ"ל (במידת הצורך) | לדברי המוכר | |||||
| קרטינוציטים ראשוניים | DMEM/F-12 (3:1), 1% Ultroser G, 1 מיקרומטר הידרוקורטיזון, 1 מיקרומטר איזופרוטרנול, 0.1 מיקרומטר אינסולין, 1 ng/mL גורם גדילה קרטינוציטים, 1% פניצילין-סטרפטומיצין | 18 | |||||
| מלנוציטים | מלנוציטים ראשוניים | בינוני 254, ללא PMA תוסף גדילה של מלנוציטים אנושיים-2, תמיסה אנטיביוטית 1% | 19 | ||||
| מלנוציטים ראשוניים | RPMI-1640, 10% FBS, 14.7 מיקרוגרם/מ"ל פנול אדום תמיסה אדומה, 1% L-גלוטמין, 1% פניצילין/סטרפטומיצין | 27 | |||||
| קו תאי HEMa-LP | בינוני 254, 5 מיקרוגרם/מ"ל rh-אינסולין, 50 מיקרוגרם/מ"ל חומצה אסקורבית, 6 מ"מ L-גלוטמין, 1 מיקרומטר אפינפרין, 1.5 מ"מ סידן כלורי, 100 U/מ"ל פניצילין (במידת הצורך), 100 מיקרוגרם/מ"ל סטרפטומיצין (במידת הצורך) | לדברי המוכר | |||||
| מלנוציטים אפידרמיס אנושיים תקינים ראשוניים (NHEM) | מדיום גידול מלנוציטים (מדיום בסיסי + תערובת תוספים) | לדברי המוכר | |||||
| פיברובלסטים | פיברובלסטים ראשוניים של טנון אנושי (HTFs) | EMEM, 5% FBS, 5 ננוגרם/מ"ל rh-גורם גדילה פיברובלסטי בסיסי, 5 מיקרוגרם/מ"ל rh-אינסולין, 50 מיקרוגרם/מ"ל חומצה אסקורבית, 7 מ"מ L-גלוטמין, 100 U/מ"ל פניצילין, 100 מיקרוגרם/מ"ל סטרפטומיצין, 0.25 מיקרוגרם/מ"ל אמפוטריצין B | 28 | ||||
| HTF ראשיים, וכן | DMEM, 10% FBS, 100 U/מ"ל פניצילין, 100 מיקרוגרם/מ"ל סטרפטומיצין, 0.25 מיקרוגרם/מ"ל אמפוטריצין B | 20.28 | |||||
| פיברובלסטים עוריים אנושיים ראשוניים | |||||||
| קו תאי HFF-1 | DMEM, 15% FBS, 100 U/מ"ל פניצילין, 100 מיקרוגרם/מ"ל סטרפטומיצין | לדברי המוכר | |||||
| קו תאי BJ | EMEM, 10% FBS, 100 U/מ"ל פניצילין, 100 מיקרוגרם/מ"ל סטרפטומיצין | לדברי המוכר | |||||
| תאי פיטום | תאי פיטום עור אנושיים ראשוניים (hsMCs) | IMDM, 10% FBS, 1% חומצות אמינו לא חיוניות, 226 מיקרומטר α-מונותיוגליצרול, 100 U/מ"ל פניצילין, 100 מיקרוגרם/מ"ל סטרפטומיצין | 20 | ||||
| קו תאי LAD2 | StemPro-34, תוסף תזונה 2.5% StemPro-34, 2 מ"מ L-גלוטמין, 100 ננוגרם/מ"ל גורם תאי גזע rh, 100 U/מ"ל פניצילין, 100 מיקרוגרם/מ"ל סטרפטומיצין | 29 | |||||
| קווי תאים HMC-1.1 ו-1.2 | IMDM, FBS 10%, 2 מ"מ ל-גלוטמין, 25 מ"מ HEPES, 100 U/מ"ל פניצילין, 100 מיקרוגרם/מ"ל סטרפטומיצין | 29 | |||||
טבלה 8: סקירה כללית של חומרי ההדפסה הנפוצים ביותר לגידול תאי עור ראשוניים וקווי תאים.
מקרא: המדיום החיוני המינימלי של דולבקו (DMEM), המדיום החיוני המינימלי של הנשר (EMEM), סרום בקר עוברי (FBS), F-12 של תערובת חומרים מזינים Ham-12 (F12), מדיום Dulbecco של Iscove (IMDM), אדם רקומביננטי (rh), מכון הזיכרון רוזוול פארק (RPMI).
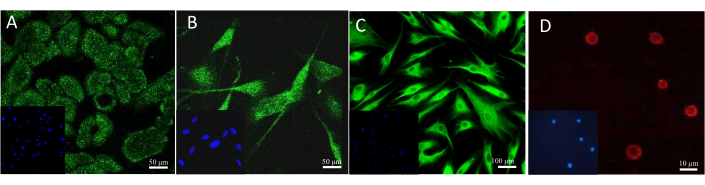
במאמר זה נוצרו מודלים של עור עם התאים העיקריים של קרטינוציטים, מלנוציטים, פיברובלסטים ותאי פיטום. הם מעט תובעניים יותר מקווי התאים, והמדיה המומלצת לתרבית שלהם, ששימשה לתרבית של תא בודד, היא: תוספת קרטינוציטים Growth Medium 2 (לקרטינוציטים), תוספת מדיום 254 (למלנוציטים), תוספת מדיום DMEM (לפיברובלסטים) ותוספת מדיום IMDM (לתאי פיטום). במדיות אלה, תאים מציגים את המורפולוגיה הטיפוסית שלהם שהוקצתה לסוג שלהם (תמונות מייצגות מוצגות באיור 8). במקרה של רב-תרביות של שני סוגי תאים או יותר, היה חשוב לבחור מדיום שבו כל סוגי התאים בתרבית יכולים לגדול. לאחר מספר בדיקות, נבחר מדיום DMEM עם 10% FBS ותערובת אנטיביוטית 1% להכנת מודלים תלת-ממדיים מתקדמים יותר של כדורים ומקבילים.
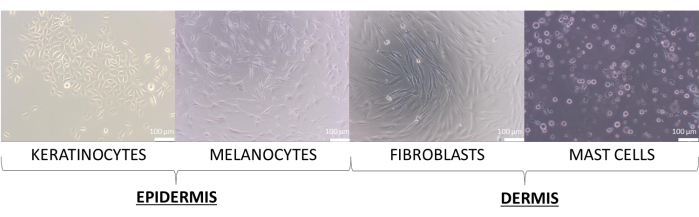
איור 8: תאי עור מציגים מורפולוגיה שונה שנצפתה במהלך המונוקולטורה הדו-ממדית. פסי קנה מידה: 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
ספירות (הנקראות בדרך כלל ספרואידים) הן אחד המודלים התלת-ממדיים הפשוטים ביותר שפותחו על ידי חוקרי הנדסת תאים ורקמות, אם כי כדורים שנוצרו מתאי עור אינם פופולריים כל כך. במסגרת מודל זה, יצירה של תחומים חד-תרבותיים ורב-תרבותיים כאחד אפשרית. שיטות רבות להכנת כדורים (למשל, עם טיפה תלויה, הגבלת הידבקות תאים, ריחוף מגנטי, סיבוב, מיקרופלואידיקה וכו ') תוארו בספרות30. בשל קלות ההכנה, עלות נמוכה, חומרים זמינים כמו גם ציוד, שתי השיטות הראשונות מומלצות למתחילים מודל התא התלת מימדי (3D) ופרוטוקולים לביצועיהם ניתן למצוא לעיל (שלב 2.1 ו -2.2). על פי ספרות31,32, הפרמטרים החשובים ביותר בשיטות אלה הם מספר התא, נפח תרחיף התא וזמן הדגירה.
ניתן ליצור כדורים עם מספר שונה של תאים, אך צפיפות התאים לזריעה צריכה להיות מותאמת לכל סוג תא בנפרד, כמו גם לתרביות משותפות של תאים. תהליך האופטימיזציה שנערך עבור מונוקולטורות של קרטינוציטים ופיברובלסטים גילה כי זריעה של 1 x 104 תאים לכל באר סיפקה את התוצאות הטובות ביותר עבור שני סוגי התאים. הכדורים המוצגים באיור 9 הוכנו בשיטה של הגבלת הידבקות התאים בלוחות U-bottom (שלב 2.2). מומלץ להכין לפחות 4 בארות עם חזרות טכניות (אופטימלי הוא 6 בארות). כדורים המורכבים מ 1 x 104 תאים היו קלים יותר למניפולציה כפי שהם נראו בארות. כתוצאה מכך, ניתן היה אפילו להסיר את המדיום הישן מבארות במהלך בדיקות מבלי לנקז את הכדורים. לאחר הפעולות המתוארות, צורות הכדורים היו ברובן ללא שינוי וניתן היה לחזור עליהן. היציבות של כדורים גדולים יותר הייתה נמוכה במהלך התהליך. ראוי גם להזכיר כי סוגי תאים שונים יכולים ליצור כדורים בצבעים שונים (למשל, קרטינוציטים יוצרים כדורים כהים יותר, בעוד שכדורי פיברובלסטים בהירים משמעותית).
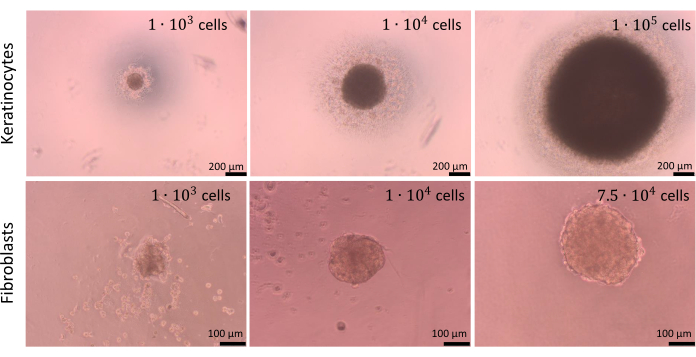
איור 9: יצירת ספירות. כדורים שנוצרו על ידי סוגים ומספרים שונים של תאי עור תוך שימוש בשיטת היצמדות התאים המגבילה. פסי קנה מידה (פנל עליון): 200 מיקרומטר. פסי קנה מידה (פנל תחתון): 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
כאמור בשיטת הטיפה התלויה (שלב 2.1), בשלב מסוים כדורים דורשים העברה מהמכסה לבאר. תהליך זה עלול להזיק לספירות. לכן, עבור שלב זה, דיוק גבוה של העבודה הוא חיוני. הכדורים שנוצרו נוטים לאבד את צורתם הנכונה אם לא מטפלים בהם בזהירות (איור 10). התמונה הראשונה (איור 10A) מציגה כדור טוב המעוגל באופן שווה מכל הצדדים. בתמונה השנייה והשלישית (איור 10B,C) נצפה אובדן עדין של צורה על-ידי הכדור, אך צבר התאים נשאר מעוגל. שלוש התמונות האחרונות (איור 10D-F) מראות שלבים שונים של נזק לכדור. יש צורך בצבירת ניסיון כדי להשיג חזרתיות של צורות ומבני הכדור שנוצרו. עם הניסיונות הראשונים לפתח את הספירות, מומלץ להשתמש בשיטה של הגבלת הידבקות התא עבור חוקרים חסרי ניסיון (שלב 2.2) כפי שהוא מספק תוצאות דומות יותר עם ההשפעה המוגבלת של פעילות החוקר.
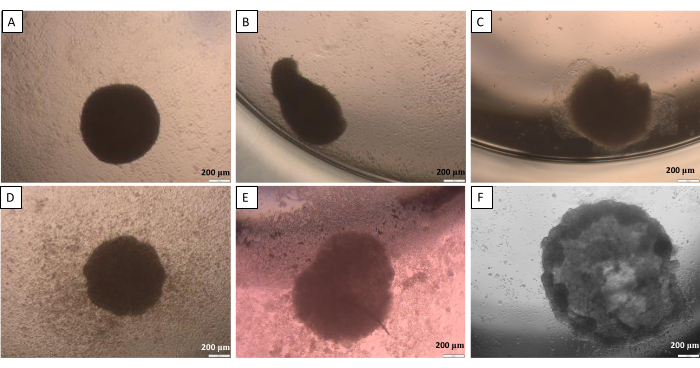
איור 10: קשיים אפשריים במעבר כדור מהמכסה לבאר - שיטת הטיפה התלויה. (A) כדור טוב, (B,C) כדורים פגומים מעט, (D-F) כדורים פגומים מאוד. התמונות צולמו 24 שעות לאחר ההעברה. פסי קנה מידה: 200 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
מקבילים הם מודלים תלת-ממדיים מתקדמים הרבה יותר של עור מלאכותי מאשר כדורים. בתהליך הבנייה של מודל עור, יש לקחת בחשבון היבטים שונים, כולל מספר השכבות במודל (רק אפידרמיס, רק דרמיס, דרמיס עם אפידרמיס ושכבת הקרנית), סוגי תאים משומשים, חומרים יישומיים, גודל עדיף של שווה ערך, סוג המחקר שבו הוא ישמש עוד, וכו '14. ניתן לסדר את המקבילות לעור בתוספות מיוחדות הממוקמות בצלחות מרובות בארות סטנדרטיות בגודל הרצוי (96-, 48-, 24-wells וכו '). למרות שקל יותר להעביר תוספות מבאר אחת לשנייה ובמהלך חילופי המדיום, לא ניתן לפגוע במקבילה; הם די יקרים. אם המודל אינו דורש נוכחות של שכבת הקרנית, פתרון זול יותר הוא להכין את המקבילה בבאר של צלחת רב באר.
שכבת הדרמיס המלאכותית בנויה בדרך כלל כמודל מבוסס פיגומים על ידי שימוש בהידרוג'לים טבעיים (ג'לטין, קולגן, פיברין, חומצה היאלורונית, צ'יטוזן-אלגינט וכו') או סינתטיים (דיאקרילט פוליאתילן גליקול וחומצה פולילקטית)33. כדי להיות דומה לדרמיס העור האמיתי, שכבה זו חייבת להכיל בעיקר מים עם כמה רכיבי מטריצה חוץ-תאיים (ECM) (כולל קולגן או פיברונקטין ), המתווכים את קשירת התא, אינטראקציות תא-תאים ופעולות תאים אחרות34. במחקר זה נבחר קולגן מסוג I מכיוון שקל להכין אותו בצורה של הידרוג'ל, והמבנה הגמיש שלו מבטיח את הקלות של פעילויות מחקר פוטנציאליות נוספות (למשל, העברת שווה ערך מתבשיל אחד למשנהו). תמיסה של קולגן מסוג I המתקבל זנב חולדה מוכן בדרך כלל על ידי המסת אבקה בחומצה אצטית 20 mM. כדי להשיג את שלב פילמור הקולגן, יש צורך לספק תנאי pH מתאימים הנעים בין 6.5-7.5. זה יכול להיות מובטח על ידי תוספת של כמות קפדנית של הידרוקסיד נתרן. לשם הקלות, חברות מסוימות הציגו חישובים ספציפיים, אשר עשויים לסייע לקבוע את הנפחים המדויקים הדרושים להכנת הידרוג'לים כאלה (טבלה 6). למרות שבספרות ניתן למצוא ריכוזים שונים של קולגן בהידרוג'לים (לדוגמה, 0.5-2 מ"ג/מ"ל35; 5-30 מ"ג/מ"ל36; תכולת קולגן נמוכה וגבוהה37), במודל המתואר, תמיסת 2 מ"ג/מ"ל שימשה מכיוון שההידרוג'ל היה עדיין בעל מבנה גמיש, אך היה קומפקטי מספיק כדי שניתן יהיה להוציאו מהבאר במידת הצורך.
כדי להכין עור מציאותי למדי בעובי מלא, תאים מקבילים צריך להיות זרע בפרופורציה אולי קרוב להווה זה בגוף שלנו. במקרה של האפידרמיס, בהתאם לאתר הגוף, הקשר בין מלנוציטים לבין מאגר של קרטינוציטים הקשורים הוא יחס של כ 1:36, המוגדר כיחידת מלנין אפידרמיס (EMU)38. לפיכך, היחס המוחל באפידרמיס המלאכותי היה 1 מלנוציטים ל-15 קרטינוציטים (טבלה 5). כדי ליצור שכבת דרמיס מלאכותית, נעשה שימוש בהידרוג'ל מסוג קולגן 1 שבו שולבו פיברובלסטים ותאי פיטום ביחס של תא פיטום אחד ל -10 פיברובלסטים. כל שכבה של המקבילה הבנויה ניתנת לניטור בזמן אמת במיקרוסקופ אופטי הפוך על ידי שינוי עומק הדגימה הנצפית (תמונות לדוגמה מוצגות באיור 11).
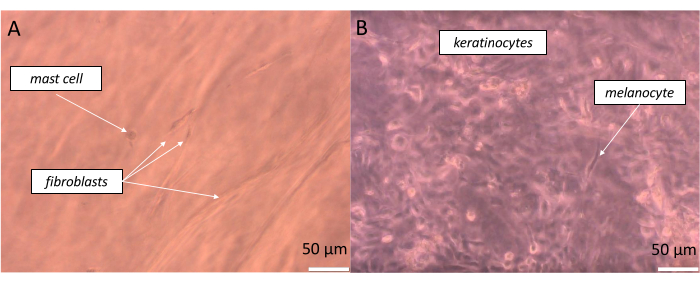
איור 11: תצפית בזמן אמת על תאים שונים בשכבות מסוימות של העור המקביל שנוצר בעובי מלא. (A) פסאודו-דרמיס ו-(B) פסאודו-אפידרמיס) כפי שהודגם במיקרוסקופ שדה בהיר. פסי קנה מידה: 50 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תצפיות מדויקות יותר עם אישור קבלת המבנה המיועד של המודל ניתן לבצע על ידי ביצוע צביעה של שווה ערך. המקבילה הקבועה צריכה להיות מוטמעת תחילה בפרפין ולאחר מכן לחתוך על מיקרוטום. את השקופיות עם רקמה מלאכותית דקה ניתן להכתים מאוחר יותר עם צבעים שונים, כולל hematoxylin ו eosin (צביעה בסיסית המבוצעת במעבדות רפואיות). הודות לפעולה זו, ניתן להבחין בין הדרמיס והאפידרמיס המלאכותיים במקבילים וגם לזהות תאי עור בודדים (איור 12). באיור 12 מוצגים לא רק סוגי התאים הספציפיים, אלא גם אפשר לראות את הקרטינוציטים בשלבים שונים של תהליך חלוקת התא (טלופאזות ומטה-פאזה). במקרה של תאי פיטום, גרגירים ספציפיים ניתנים לזיהוי היטב בתוך התא. תמונות אלה מאשרות בתחילה כי המקבילה העורית שנוצרה חיה (התאים גדלים בה) והם מסוגלים לתפקד כרגיל במודל המפותח. עם זאת, עם האפידרמיס 3D מודלים עובי מלא של העור, חשוב במיוחד לבדוק את האיכות והפונקציונליות של המבנה המתקבל. כדי לבדוק את החדירות של שכבת הקרנית, יש להחיל את מדידות ההתנגדות החשמלית הטרנסאפיתל (TEER) או צביעת לוציפר-צהוב39,40. יתר על כן, בעור מלאכותי המורכב כראוי, סמנים ספציפיים צריכים להיות נוכחים, כולל סמני התמיינות (למשל, Filaggrin, Involucrin, Loricrin, קרטין 10, קרטין 5, מחלקות שומנים הכוללות ceramides), סמני צומת עור-אפידרמיס (למשל, קולגן סוג IV, Laminin V, Alpha6Beta4-integrin, אנטיגן BP)41, סמני צומת הדוק בשכבות האפידרמיס (למשל, claudin-1, occludin, zonula occludens protein (ZO)-1)42 וכן סמני התפשטות שכבת הבסיס (Ki67)41.

איור 12: מורפולוגיה ותפקוד של תאי עור. סקירה כללית של מורפולוגיה ותפקוד תאי העור (תצפית על חלוקות תאים) בעור המקביל בעובי מלא המוכתם בהמטוקסילין ואאוזין. פסי קנה מידה: 100 מיקרומטר (פנל עליון), 50 מיקרומטר (פנל אמצעי, שמאלי), 100 מיקרומטר (פנל אמצעי, מימין), 50 מיקרומטר (פנל תחתון). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
הדרך הנפוצה ביותר לאשר את נוכחותו של סמן ביולוגי היא על ידי ביצוע צביעה ספציפית, כגון immunohistochemical או immunofluorescent. נוגדנים שונים וצבעים פלואורסצנטיים יכולים להיות מיושמים עבור הדמיה מיקרוסקופית של תאים מסוימים במודלים. את התוצאה של צביעה מופתית של תאים בתרבית ניתן לראות באיור 13. כדי לצפות keratinocytes, נוגדן נגד cytokeratin 14 שימש. במקרה של מלנוציטים, זה היה נוגדן ספציפי melan-A. נוגדן קולגן 1A2 שימש להכתמת פיברובלסטים וסולפורהודאמין 101 פלואורסצנטי מצומד עם אבידין זיהה הפרין נוכח בתאי פיטום.
איור 13: תוצאות של צביעת תאים פלואורסצנטיים. (A) ציטוקרטין 14 בקרטינוציטים. סרגל קנה מידה: 50 מיקרומטר. (B) Melan-A במלנוציטים. סרגל קנה מידה: 50 מיקרומטר. (C) קולגן 1A2 בפיברובלסטים. סרגל קנה מידה: 100 מיקרומטר. (D) הפרין בתאי פיטום. סרגל קנה מידה: 10 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
מאמר זה מציג את המתודולוגיה שניתן ליישם כדי להכין מודלים מתקדמים של עור מלאכותי. זהו פתרון טוב בכל פעם שהמחקר המתוכנן זקוק למודלים מחקריים מוגדרים בקפידה שעשויים להתברר כבלתי זמינים בשוק או יקרים מאוד. כפי שהוזכר קודם לכן, מספר מוצרים מקבילים לעור מסחריים זמינים בשוק (למשל, EpiSkin, EpiDerm FT). עם זאת, עלותם (100-400 אירו ליחידה) וזמן האספקה (כמה ימים-שבועות) עשויים לעודד את החוקר לנסות להכין מודל כזה בכוחות עצמו. ההליכים המוצעים קלים לביצוע גם עבור מדענים חסרי ניסיון, ויחד עם זאת, מאפשרים להשיג מודלים מתקדמים מאוד של עור. ראוי להדגיש כי ההחלטה על ההרכב התאי של מודל נתון תלויה לחלוטין בחוקר. מלבד המודל שנוצר, ניתן לפתח ולשפר אותו עוד יותר, מה שפותח פרספקטיבות מחקריות חדשות לחלוטין. במקרה של מודלים מסחריים, יש צורך לקנות שווה ערך אחר.
למרות שתרביות התאים התלת-ממדיות עשויות להיות מתקדמות עם סוגי תאים מרובים, קלות לטיפול ונגישות, הן עדיין רק מודלים מלאכותיים שאינם יכולים לשחזר באופן מלא את המורכבות והפונקציונליות של הרקמה (למשל, תפקודים אימונולוגיים, כלי דם). לכן, ברוב המחקרים, נדרשים מספר מודלים כדי לאשר את התוצאות שהתקבלו. כמה יתרונות וחסרונות של מודלים אלה נאספו בלוח 9, כמו גם מגבלותיהם. מצד שני, מודלים מסחריים מבטיחים סטנדרטים איכותיים גבוהים עם שחזור של ניסויים והשוואה של נתונים בין המעבדות. כדי ליישם את השימוש בתרכובת חדשה למחקר, בהחלט יהיה צורך לרכוש את המקבילה המסחרית המתאימה. אבל בשלב ההכנה, מודל תלת ממדי כזה של העור (כדור מסוג multicell או שווה ערך) יכול לעזור להפחית את מספר הניסויים הדרושים לביצוע על שווה ערך מסחרי. מטרת הייצור והשימוש במודלים המתוארים אינה לעקוף את הצורך ביישום מודלים מחקריים מוסמכים, אלא להקל על המחקר ולהפחית את ההוצאות הנלוות.
| השוואה בין זוג דגמים | יתרונות | חסרונות | ||||
| תרבית תאים לעומת בעלי חיים | סבל מינימלי של בעלי חיים | מידע מוגבל על ההשפעה של גורם נבדק על כל הגוף | ||||
| סטנדרטיזציה גבוהה של הניסוי - יכולת שחזור טובה יותר של התוצאות | מודל יחיד אינו מספיק כדי לשקף את התהליכים המתרחשים בגוף | |||||
| אין תופעות לוואי עבור האורגניזם כולו | - | |||||
| שליטה טובה יותר בתנאי הניסוי | - | |||||
| אפשרות לאוטומציה (למשל, הדפסה ביולוגית) | - | |||||
| עלויות נמוכות יותר | - | |||||
| הגודל הקטן של המדגם הדרוש | - | |||||
| כמות מוגבלת של פסולת שנוצרת | - | |||||
| תרבויות תלת-ממדיות לעומת דו-ממדיות | לשקף טוב יותר את האורגניזם המלא | תרבות גוזלת זמן | ||||
| אפשרות ליצור רקמה תפקודית | עלויות גבוהות יותר | |||||
| אפשרות ליצור מודל המותאם לצרכי המחקר הנישא | היווצרות ספונטנית של מבנה תלת ממדי כמעט אינה אפשרית | |||||
| - | היעדר בדיקות סטנדרטיות לכימות ההשפעות של תרכובות שונות | |||||
| - | גישה מוגבלת לתרבויות תלת-ממד שונות הזמינות בשוק | |||||
| קו תא לעומת תאים ראשיים | דגמים מאושרים ומאושרים | רק מספר מוגבל של שורות תאים זמין | ||||
| סטנדרטיזציה גבוהה של הניסוי - יכולת שחזור טובה יותר של התוצאות | אפשרות מוגבלת להשיג מספר סוגים של תאים מאותו תורם | |||||
| תוחלת חיים ארוכה יותר | עשוי להיות בעל תכונות שהשתנו מהתאים המקוריים | |||||
| קצב התפשטות מהיר למדי | פונקציונליות מופרעת לעתים קרובות של תאים | |||||
| פחות רגיש למספר פעילויות (למשל, הקפאה, צנטריפוגה) | - | |||||
לוח 9: השוואת השימוש במודלים שונים במחקר - יתרונות מול חסרונות
מספר מאמרים מתארים כיצד להכין מודלים תלת-ממדיים של עור (מלבד מאמרי סקירה המסכמים מודלים זמינים מסחרית 14,43,44, הם מתמקדים בדרך כלל במתודולוגיה אחת להשגת כדורים45 או שווה ערך 46).
במאמר זה תוארו שתי מתודולוגיות להיווצרות כדור עם תאי עור. שיטת הטיפה התלויה נמצאת בשימוש נרחב, אך יכולת החזרה והיציבות שלה עשויות להיות לא מספיקות במקרים מסוימים. רוב השלבים דורשים פעולות ספציפיות, כגון עבודה במהירות גבוהה עקב אידוי מים מטיפות במהלך ההעברה. מומלץ גם תנועות עדינות, שכן חוסר מיומנות כזו עלול לגרום נזק מצטבר לתאים31,32. לכן, שיטה קלה יותר להכנת כדור מתמקדת בהגבלת הידבקות התא. היעדר משטח טוב לחיבור תאים מקדם אינטראקציות גבוהות יותר בין תאים. כתוצאה מכך, נוצרים צברי תאים. יכולת החזרה שלו גבוהה בהרבה מכיוון שאין צורך בהעברת כדורים. בשיטות אלה, המספר האופטימלי של תאי עור ליצירת כדור נקבע על 1 x 104 תאים / כדור.
לאחר מכן, הוצגו נהלים המתארים את הכנת המקבילות לעור. המראה והפונקציונליות שלהם במחקר עשויים להיות תלויים מאוד באלמנטים שמהם הם בנויים, כולל תאים (טבלה 2), פיגומים ומדיה. פיגומים 3D המשמשים להכנת עור מלאכותי ניתן לחלק הידרוג'ל סינתטי ואלה שנוצרו ממקורות טבעיים. בהתאם לחומר המשמש ואת המאפיינים שלה כדי להרכיב את הידרוג'ל, הצורך בנוסף להשלים את המדיום עלול להתרחש. הידרוג'לים סינתטיים דורשים שילוב מולקולות ביו-אקטיביות (חלבונים, אנזימים וגורמי גדילה) ברשת ההידרוג'ל הסינתטית כדי לתווך תפקודי תאים ספציפיים47. הגישות העיקריות המוצגות בספרות להשגת העברה מבוקרת של גורמי גדילה להידרוג'לים כוללות העמסה ישירה, אינטראקציה אלקטרוסטטית, קשירה קוולנטית ושימוש בנשאים48. הידרוג'לים שנוצרו ממקורות טבעיים כגון חלבוני ECM ופולימרים יכולים ליצור מסלולי נוזל ברחבי הפיגומים התלת-ממדיים, ולהאיץ את התפלגות החומרים המזינים; לכן, אין צורך בתוספת נוספת של המדיום. מחקרים הראו כי מולקולות קטנות (כמו ציטוקינים וגורמי גדילה) ומקרומולקולות (כולל גליקוזאמינוגליקנים ופרוטאוגליקנים) יכולות להיות מועברות דרך ECM על ידי דיפוזיה47. עם זאת, הדיפוזיה המולקולרית של חמצן, חומרים מזינים ומולקולות ביו-אקטיביות אחרות עלולה להיות מעוכבת על ידי התכונות של הידרוג'ל ECM עצמו. דיפוזיה נמוכה יותר נמצאה בקורלציה עם עובי גבוה יותר של ההידרוג'ל אך גם עם ריכוז גבוה מאוד של קולגן37. במחקר זה, כדי ליצור את המקבילה לעור, נעשה שימוש בריכוז קולגן נמוך השווה ל -2 מ"ג / מ"ל, מה שמצביע על כך שהדיפוזיה המולקולרית דרך ההידרוג'ל צריכה להיות טובה ומהירה. לפיכך, לא סופקה תוספת למדיום בשלב זה וגם לא להידרוג'ל עצמו. כדי לחקות את הדרמיס, תאי פיטום ופיברובלסטים (1:10) הוטמעו בקולגן הידרוג'ל. לאחר מכן, מלנוציטים וקרטינוציטים (1:15) נזרעו על ההידרוג'ל וכל המקבילה תורבתה בתווך. ראוי להזכיר כי המדיום הבסיסי מורכב ממספר חומצות אמינו, חומצות אנאורגניות וויטמינים, ובנוסף הוא משלים סרום (המורכב מרבים: גורמי גדילה והתקשרות לתאים, שומנים, הורמונים, חומרים מזינים ומקורות אנרגיה, נשאים, חלבוני קשירה והעברה וכו '). כדי להשיג את המבנה הנכון של האפידרמיס, תוספי מזון שונים למדיום יש להוסיף בזמן מסוים. הממריץ החשוב ביותר ליזום התמיינות אפידרמיס הוא סידן, שכן הוא מפעיל איתות תוך תאי. חומצה אסקורבית מעוררת מסלול איתות דומה לזה המתווך על ידי סידן, אך השפעתה מלווה גם בהובלה משופרת של אסקורבט ומניעת דלדול נוגד חמצון הידרופילי41. יתר על כן, התמיינות התאים השתפרה כאשר רכיבים אחרים נוספו למדיום (כגון קפאין, הידרוקורטיזון, טריודותירונין, אדנין ורעלן כולרה)41,44. חשוב כי המודלים מוכנים תמיד צריך להיבדק עבור נוכחות של סוג תא נתון בשכבה המתאימה. נוכחותם של כל ארבעת סוגי תאי העור אושרה במבנה של המקבילה שנוצרה על ידי צביעת H&E.
הבעיה הנפוצה ביותר בה נתקלים היא העדינות והאינטואיציה בטיפול במודלים המתקבלים. קשיים מסוימים עשויים להיות קשורים להיווצרות כדור התא, כמו גם עם הכנת הידרוג'ל. במהלך תרבית התא, מספר בעיות אחרות יכולות להתרחש גם; אלה כוללים זיהומים מיקרוביאליים, קצב התרבות נמוך של תאים, הזדקנות של תאים ראשוניים המשמשים במודלים, זמן גידול מרבי של מודלים דו-ממדיים ותלת-ממדיים המשוחזרים מתאים ראשוניים לעומת קווי תאים וכו '. בטבלה 10 נאספו כמה עצות מעשיות מה לעשות כאשר נתקלים באחת מהבעיות הבאות.
| בעיות נפוצות בתרבית תאים | הצעות | |||
| זיהום מיקרוביאלי | אם מתרחש זיהום מיקרוביאלי באחת הצלוחיות / הכלים עם תאים, עדיף להסיר את התרבית הנגועה מהר ככל האפשר (לא לזהם את שאר הצלוחיות / כלים עם תאים). הקפיאו מחדש בקבוקון חדש עם תאים. אם הזיהום חוזר, זה טוב לנסות להרחיב את הספקטרום של אנטיביוטיקה להחיל ולהגדיל את הריכוז שלהם. | |||
| קצב התרבות נמוך של תאים | לחלק מהתאים יש זמן הכפלה ארוך. כדי לעורר את התפשטותם, ניתן להוסיף מספר גורמי גדילה ספציפיים לתאים למדיום הבסיסי. כמו כן, הגדלת הריכוז של FBS או L-גלוטמין בתווך הבסיסי עשויה לעזור לעורר את הצמיחה של התאים. | |||
| הזדקנות תאים ראשוניים המשמשים במודלים | לאחר כמה מעברים, התאים הראשוניים נכנסים להזדקנות ומפסיקים להתחלק. כדי להתגבר על בעיה זו במודלים, מומלץ להשתמש בתאים מהמעבר מוקדם ככל האפשר כדי לבנות את המודל. | |||
| זמן גידול מרבי של מודלים דו-ממדיים ותלת-ממדיים המשוחזרים מתאים ראשוניים לעומת קווי תאים | זמן הטיפוח של מודל תלוי מאוד בסוג התאים המשומשים. עם תאים ראשוניים, זמן הטיפוח יהיה קצר יותר בגלל תוחלת החיים הקצרה שלהם. | |||
| קשיים בהיווצרות כדור התא | תאים מסוימים עשויים לדרוש זמן רב יותר ליצירת כדור. אם לאחר כמה ימים נוספים הכדורים לא נוצרו, לאסוף את התאים מן הדגימה ולבדוק את הכדאיות שלהם עם, למשל, צביעה כחולה trypan. | |||
| בעיות ביציבות הכדור | אם הכדורים אינם יציבים ונהרסים תוך כדי טיפול, נסו ליצור כדורים ממספר תאים נמוך יותר. הקפידו תמיד להעביר בעדינות את הכלים בהם גדלים הספירות. | |||
| קשיים בהכנת הידרוג'ל | בדוק אם שיעור המרכיבים (מים, PBS [10x], NaOH, קולגן סוג 1) היה נכון. תמיסת המלאי של הקולגן היא בדרך כלל צפופה מאוד, ולכן הקפידו לאט לאט לשפך אותו. בועות אוויר מפריעות למורפולוגיה של ההידרוג'ל, ולכן פיפטינג הפוך של הג'ל עשוי לסייע בבעיה זו. | |||
טבלה 10: פתרון בעיות בתרביות תאים
המודלים שנקבעו לאחר הייצור יכולים לשמש בתחומים רבים, החל מ (1) ציטוטוקסיות וניסויי גנוטוקסיות של תרכובות חדשות עם פעילות ביולוגית לשימוש בתרופות וקוסמטיקה49, (2) ניסויים עם גירוי גורמים שונים50, (3) מחקר בסיסי המרחיב את הידע שלנו על תאי העור, תפקודיהם הביולוגיים, אינטראקציות עם תאים אחרים והסביבה51, 52, (4) מחקר על ישויות מחלה נבחרות שבהן ניתן להכניס סוג מסוים של תא למודל שנוצר (תאים סרטניים, תאים עם מוטציה בגן נתון וכו '14,53) ועוד רבים. למותר לציין כי יישום מודלים אלה עולה בקנה אחד עם עקרון 3Rs לשימוש אתי יותר בבעלי חיים בניסויים במוצרים ובמחקר מדעי ואינו מפר את חוק האיסור על ניסויים במוצרים קוסמטיים על בעלי חיים.
Disclosures
המחברים מצהירים כי אין ניגודי עניינים.
Acknowledgements
המחברים אסירי תודה על התמיכה הכספית שניתנה על ידי האוניברסיטה הטכנולוגית של ורשה מהתוכנית 'יוזמת מצוינות - אוניברסיטת מחקר' בצורה של שני מענקים: POB BIB BIOTECHMED-2 להתחיל (מס '1820/2/ZO1/POB4/2021) ומענק הרקטור לקבוצות מחקר סטודנטים (SKIN-ART, מס '1820/116/Z16/2021). יתר על כן, המחברים מבקשים להודות על התמיכה שקיבלו פרופ 'ג'ואנה Cieśla ואת הקתדרה לביוטכנולוגיה תרופות וקוסמטיקה, כמו גם את מועדון המדע ביוטכנולוגיה 'הרביון' בפקולטה לכימיה, האוניברסיטה הטכנולוגית של ורשה. תודה מיוחדת לד"ר מיכאל סטפולק על אספקת התרכובת פלורוניק F-127.
Materials
| Name | Company | Catalog Number | Comments |
| 24-well plate for adherent cell culture | Biologix Europe GmbH | 07-6024 | - |
| 35%–38% HCL | Chempur | 115752837 | - |
| 60 mm cell culture Petri dish | Nest | 705001 | - |
| Avidin−Sulforhodamine 101 | Sigma Aldrich | A2348-5MG | - |
| Bright-field inverted microscope | Olympus | CKX41 | - |
| Calcium chloride | Avantor | 874870116 | - |
| Cell culture flask T75 for adherent cells | Genoplast | G77080033 | - |
| Centrifuge tube 15 mL | GoogLab Scientific | G66010522 | - |
| CO2 Incubator | Heal Force | Galaxy 170R | - |
| Col1A2 antibody produced in rabbit | Novus | NBP2-92790 | - |
| Corning(R) Transwell(R) Polycarbonate | Corning | CLS3422-48EA | - |
| Cytokeratin 14 antibody produced in mouse | Novus | NBP1-79069 | - |
| DPX Mountant for histology | Sigma Aldrich | 06522-100ML | - |
| Dulbecco's Modified Eagle Medium (DMEM) | VWR Chemicals | L0102-500 | - |
| Eosine Y | Kolchem | - | 0.5 % aquatic solution |
| Eppendorf tube 1.5 mL | Sarstedt | 72.690.001 | - |
| Eppendorf tube 2 mL | Sarstedt | 72.691 | - |
| Ethyl alcohol absolute 99.8% | Avantor | 396480111 | diluted in ultrapure water to the needed concentrations |
| Fetal bovine serum | Gibco | 10270106 | - |
| Fluorescent inverted microscope | Olympus | IX71 | - |
| Goat anti-mouse secondary antibody conjugated with FITC | Sigma Aldrich | F0257-1mL | |
| Goat anti-rabbit secondary antibody conjugated with FITC | Novus | NB7159 | - |
| Harris Hematoxylin | Kolchem | - | 1 mg/mL in 95% ethanol |
| Hoechst 33342 | ThermoFisher | H3570 | - |
| Laminar chamber | Heal Force | HFSafe-1200 | - |
| Melan-A antibody produced in mouse | Santa Cruz Biotechnology | sc-20032 | - |
| Microtome | Microm | HM355S | - |
| NaOH | Avantor | 810981997 | - |
| Paraffin pastilles | Sigma Aldrich | 1.07164 | - |
| Paraformaldehyde | Sigma Aldrich | 1581227 | - |
| Penicillin/Streptomycin solution | Sigma Aldrich | P4333 | - |
| Pipette tip, 1000 µL | Sarstedt | 70.305 | - |
| Pipette tip, 20 µL | Sarstedt | 70.3021 | - |
| Pipette tip, 200 µL | Sarstedt | 70.303 | - |
| Pluronic F-127 | BASF | 50401036 | - |
| Serological pipette 10 mL | GoogLab Scientific | G33270011 | - |
| Serological pipette 25 mL | GoogLab Scientific | G33280011 | - |
| Serological pipette 5 mL | GoogLab Scientific | G33260011 | - |
| Sodium bicarbonate | Sigma Aldrich | S5761 | - |
| Sodium bicarbonate | Chempur | 118105307 | |
| Trypsin-EDTA 0.25% solution, phenol red | Sigma Aldrich | 25200072 | - |
| Type 1 collagen | IBIDI | 50201 | - |
| U-bottom 96-well plate | Sarstedt | 83.3925500 | - |
| Xylene | Sigma Aldrich | 534056 | - |
References
- Farage, M. A., Miller, K. W., Elsner, P., Maibach, H. I. Characteristics of the aging skin. Advances in Wound Care. 2 (1), 5-10 (2013).
- Zhu, H., Alikhan, A., Maibach, H. I., Farage, M. A., Miller, K. W., Maibach, H. I. Biology of Stratum Corneum: Tape Stripping and Protein Quantification. Textbook of Aging Skin. , (2015).
- Boer, M., Duchnik, E., Maleszka, R., Marchlewicz, M. Structural and biophysical characteristics of human skin in maintaining proper epidermal barrier function. Postepy Dermatogogii I Alergologii. 33 (1), 1-5 (2016).
- De Falco, M., Pisano, M. M., De Luca, A., Baldi, A., Pasquali, P., Spugnini, E. P. Embryology and Anatomy of the Skin. In Skin Cancer: A Practical Approach. Current Clinical Pathology. , (2014).
- Dehdashtian, A., Stringer, T. P., Warren, A. J., Mu, E. W., Amirlak, B., Shahabi, L., Riker, A. I. Anatomy and Physiology of the Skin. Melanoma: A Modern Multidisciplinary Approach. , 15-26 (2018).
- Graham, H. K., Eckersley, A., Ozols, M., Mellody, K. T., Sherratt, M. J., Limbert, G. Human Skin: Composition, Structure and Visualisation Methods. Skin Biophysics; Studies in Mechanobiology, Tissue Engineering, and Biomaterials. 22, 1-18 (2019).
- Piasek, A. M., Musolf, P., Sobiepanek, A. Aptamer-based advances in skin cancer research. Current Medicinal Chemistry. 30 (8), 953-973 (2023).
- Bergfeld, W. F., Belsito, D. V., Marks, J. G., Andersen, F. A. Safety of ingredients used in cosmetics. Journal of the American Academy of Dermatology. 52 (1), 125-132 (2005).
- Hubrecht, R. C., Carter, E. The 3Rs and humane experimental technique: Implementing change. Animals. 9 (10), 754 (2019).
- Sreedhar, D., Manjula, N., Ajay, P., Shilpa, P., Ligade, V. Ban of cosmetic testing on animals: A brief overview. International Journal of Current Research and Review. 12 (14), 113-116 (2020).
- Silva, R. J., Tamburic, S. A state-of-the-art review on the alternatives to animal testing for the safety assessment of cosmetics. Cosmetics. 9 (5), 90 (2022).
- Xu, Y., Shrestha, N., Préat, V., Beloqui, A. An overview of in vitro, ex vivo and in vivo models for studying the transport of drugs across intestinal barriers. Advanced Drug Delivery Reviews. 175, 113795 (2021).
- Boelsma, E., Ponec, M., Gabard, B., Surber, C., Elsner, P., Treffel, P. Basics (Guidelines) on Cell Culture Testing for Topical/Dermatological Drugs/Products and Cosmetics With Regard to Efficacy and Safety of the Preparations. In Dermatopharmacology of Topical Preparations. , 37-57 (2000).
- Suhail, S., Sardashti, N., Jaiswal, D., Rudraiah, S., Misra, M., Kumbar, S. G. Engineered skin tissue equivalents for product evaluation and therapeutic applications. Biotechnology Journal. 14 (7), 1900022 (2019).
- Sobiepanek, A., et al. Novel diagnostic and prognostic factors for the advanced melanoma based on the glycosylation-related changes studied by biophysical profiling methods. Biosensors and Bioelectronics. 203, 114046 (2022).
- Yang, H., Sun, L., Liu, M., Mao, Y. Patient-derived organoids: A promising model for personalized cancer treatment. Gastroenterology Report. 6 (4), 243-245 (2018).
- Baran, J., et al. Mast cells as a target-A comprehensive review of recent therapeutic approaches. Cells. 12 (8), 1187 (2023).
- Kosten, I. J., Buskermolen, J. K., Spiekstra, S. W., de Gruijl, T. D., Gibbs, S. Gingiva equivalents secrete negligible amounts of key chemokines involved in langerhans cell migration compared to skin equivalents. Journal of Immunology Research. 2015, 627125 (2015).
- cieżyńska, A., et al. A novel and effective method for human primary skin melanocytes and metastatic melanoma cell isolation. Cancers. 13 (24), 6244 (2021).
- Kröger, M., et al. In vivo non-invasive staining-free visualization of dermal mast cells in healthy, allergy and mastocytosis humans using two-photon fluorescence lifetime imaging. Scientific Reports. 10 (1), 14930 (2020).
- Liu, D., Chen, S., Win Naing, M. A review of manufacturing capabilities of cell spheroid generation technologies and future development. Biotechnology and Bioengineering. 118 (2), 542-554 (2021).
- Rossi, A., Appelt-Menzel, A., Kurdyn, S., Walles, H., Groeber, F. Generation of a three-dimensional full thickness skin equivalent and automated wounding. Journal of Visualized Experiments: JoVE. (96), e52576 (2015).
- Kim, K., Kim, J., Kim, H., Sung, G. Y. Effect of α-lipoic acid on the development of human skin equivalents using a pumpless skin-on-a-chip model. International Journal of Molecular Sciences. 22 (4), 2160 (2021).
- Curto, E. V., Lambert, G. W., Davis, R. L., Wilborn, T. W., Dooley, T. P. Biomarkers of human skin cells identified using DermArray DNA arrays and new bioinformatics methods. Biochemical and Biophysical Research Communications. 291 (4), 1052-1064 (2002).
- Godwin, L. S., et al. Isolation, culture, and transfection of melanocytes. Current Protocols in Cell Biology. 63, 1-20 (2014).
- Przekora, A., Zarnowski, T., Ginalska, G. A simple and effective protocol for fast isolation of human tenon's fibroblasts from a single trabeculectomy biopsy - a comparison of cell behaviour in different culture media. Cellular & Molecular Biology Letters. 22, 5 (2017).
- Rådinger, M., Jensen, B. M., Kuehn, H. S., Kirshenbaum, A., Gilfillan, A. M., Coligan, J. E., Bierer, B. E., Margulies, D. H., Shevach, E. M., Strober, W. Generation, Isolation, and Maintenance of Human Mast Cells and Mast Cell Lines Derived from Peripheral Blood or Cord Blood. Current Protocols in Immunology. , (2010).
- Artuc, M., Muscha Steckelings, U., Henz, B. M. Mast cell-fibroblast interactions: Human mast cells as source and inducers of fibroblast and epithelial growth factors. Journal of Investigative Dermatology. 118 (3), 391-395 (2002).
- Panos, R. J., Rubin, J. S., Csaky, K. G., Aaronson, S. A., Mason, R. J. Keratinocyte growth factor and hepatocyte growth factor/scatter factor are heparin-binding growth factors for alveolar type ii cells in fibroblast-conditioned medium. Journal of Clinical Investigation. 92 (2), 969-977 (1993).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Threedimensional cell culture: A powerful tool in tumor research and drug discovery (Review). Oncology Letters. 14 (6), 6999-7010 (2017).
- Amaral, R. L. F., Miranda, M., Marcato, P. D., Swiech, K. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605 (2017).
- Gao, B., Jing, C., Ng, K., Pingguan-Murphy, B., Yang, Q. Fabrication of three-dimensional islet models by the geometry-controlled hanging-drop method. Acta Mechanica Sinica. 35 (2), 329-337 (2019).
- Zhang, C., et al. 3D culture technologies of cancer stem cells: Promising ex vivo tumor models. Journal of Tissue Engineering. 11, (2020).
- Sobiepanek, A., Paone, A., Cutruzzolà, F., Kobiela, T. Biophysical characterization of melanoma cell phenotype markers during metastatic progression. European Biophysics Journal: EBJ. 50 (3-4), 523-542 (2021).
- Jin, G. -. Z., Kim, H. -. W. Effects of Type I collagen concentration in hydrogel on the growth and phenotypic expression of rat chondrocytes. Tissue Engineering and Regenerative. 14 (4), 383-391 (2017).
- Osidak, E. O., et al. Concentrated collagen hydrogels: A new approach for developing artificial tissues. Materialia. 20, 101217 (2021).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: Characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Jimbow, K., Salopek, T. G., Dixon, W. T., Searles, G. E., Yamada, K. The epidermal melanin unit in the pathophysiology of malignant melanoma. The American Journal of Dermatopathology. 13 (2), 179-188 (1991).
- Van Den Bogaard, E., et al. Perspective and consensus opinion: Good practices for using organotypic skin and epidermal equivalents in experimental dermatology research. Journal of Investigative Dermatology. 141 (1), 203-205 (2021).
- Bednarek, R. In vitro methods for measuring the permeability of cell monolayers. Methods and Protocols. 5 (1), 17 (2022).
- Idrees, A., et al. Fundamental in vitro 3D human skin equivalent tool development for assessing biological safety and biocompatibility - towards alternative for animal experiments. 4 Open. 4, (2021).
- Park, H. -. Y., Kweon, D. -. K., Kim, J. -. K. Upregulation of tight junction-related proteins by hyaluronic acid in human HaCaT keratinocytes. Bioactive Carbohydrates and Dietary Fibre. 30, 100374 (2023).
- Choudhury, S., Das, A. Advances in generation of three-dimensional skin equivalents: Pre-clinical studies to clinical therapies. Cytotherapy. 23 (1), 1-9 (2021).
- Zhang, Z., Michniak-Kohn, B. B. Tissue engineered human skin equivalents. Pharmaceutics. 4 (1), 26-41 (2012).
- Woappi, Y., Altomare, D., Creek, K. E., Pirisi, L. Self-assembling 3D spheroid cultures of human neonatal keratinocytes have enhanced regenerative properties. Stem Cell Research. 49, 102048 (2020).
- Ouwehand, K., Spiekstra, S. W., Waaijman, T., Scheper, R. J., de Gruijl, T. D., Gibbs, S. Technical advance: Langerhans cells derived from a human cell line in a full-thickness skin equivalent undergo allergen-induced maturation and migration. Journal of Leukocyte Biology. 90 (5), 1027-1033 (2011).
- Akther, F., Little, P., Li, Z., Nguyen, N. -. T., Ta, H. T. Hydrogels as artificial matrices for cell seeding in microfluidic devices. RSC Advances. 10 (71), 43682-43703 (2020).
- Silva, A. K. A., Richard, C., Bessodes, M., Scherman, D., Merten, O. -. W. Growth factor delivery approaches in hydrogels. Biomacromolecules. 10 (1), 9-18 (2009).
- Lee, H. -. R., et al. Effect of Aronia extract on collagen synthesis in human skin cell and dermal equivalent. Oxidative Medicine and Cellular Longevity. 2022, 4392256 (2022).
- Mulder, P. P. G., Raktoe, R. S., Vlig, M., Elgersma, A., Middelkoop, E., Boekema, B. K. H. L. Full skin equivalent models for simulation of burn wound healing, exploring skin regeneration and cytokine response. Journal of Functional Biomaterials. 14 (1), 29 (2023).
- Goncalves, K., et al. Investigation into the effect of skin tone modulators and exogenous stress on skin pigmentation utilizing a novel bioengineered skin equivalent. Bioengineering & Translational Medicine. 8 (2), 10415 (2023).
- Michel, M., L'Heureux, N., Pouliot, R., Xu, W., Auger, F. A., Germain, L. Characterization of a New Tissue-Engineered Human Skin Equivalent with Hair. In Vitro Cellular & Developmental Biology. Animal. 35 (6), 318-326 (1999).
- Müller, I., Kulms, D. A 3D organotypic melanoma spheroid skin model. Journal of Visualized Experiments: JoVE. (135), e57500 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved