Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Zebra balığı Embriyonik Göz Dokular, Mikrodisseksiyon
Bu Makalede
Özet
Bu makalede, retina pigment epitel birini üç gün postfertilization embriyolar bağlı olan ve olmayan zebrafish retina microdissect bir yaklaşım açıklanmıştır.
Özet
Zebra balığı nedeniyle hızlı göz gelişimi üzerinde bir araştırma için popüler bir hayvan modeli
Protokol
Bölüm 1: mikrodiseksiyon öncesi hazırlıklar
- Çözümler
- E3 orta 4 (5 mM NaCl, 0.17 mM KCl, 0.33 mM CaCl 2 ve 0.33 mM MgSO 4).
- Zil çözümü 1, 5 (116 mM NaCl, 2.9 mM KCl, 1.8 mM CaCl 2, 5 mM HEPES, pH7.2), filtre sterilize edilmelidir.
- 5N NaOH.
- Tungsten iğneler kimyasal aşındırma
- Kil Petri kabı 5N NaOH içeren küçük bir beher sabitleyin.
- NaOH çözeltisi ile temas halinde gelir, böylece beher tarafı bir kağıt klipsi takın.
- Ataş ve kısa bir tungsten tel parçası (~ 2cm) bir ucunu pozitif elektrot için bir DC güç kaynağı negatif elektrot bağlayın.
- Tungsten telin diğer ucunu küçük bir kil topu ile sarın ve NaOH çözeltisi Bu amaçla daldırma.
- Yaklaşık 3V gerilimi artırmak ve iyi bir gravür oranı ulaşılana kadar NaOH çözeltisi tel daldırma ve aşağı. Kaliteli bir iğne genellikle 10 dakika içinde kazınacak.
- Çözüm maruz tungsten tel giderek incelir. Kil topu kapalı düştüğünde, hala pozitif elektrot bağlı olduğu tel diğer tarafı keskin bir iğne şeklinde olacaktır.
- Keskin iğne tuz yatakları kaldırmak için Ringer solüsyonu veya E3 ile durulayın.
- Bantla ahşap bir aplikatör veya kolay kullanım için bir iğne tutucu iğne takın.
- Kültür plakalar
- Falcon 60 x 15 mm polistiren kültür plakaları retina mikrodiseksiyon kullanmak için hazır.
- RPE bağlı retina diseksiyon için Ringer diseksiyonu 30 dakika önce yüzeyin yapışkanlık kurtulmak için çözüm içeren bir kültür plaka tamamen iki embriyo ezmek. Diseksiyonu kısa bir süre önce, plaka yoğun taze Ringer solüsyonu ile yıkayın.
- Embriyolar toplama ve evreleme
- Yetişkin zebrafish 4, 5 açıklandığı gibi korunur.
- Bir bölücü tarafından ıslah gece önce ikili statik üreme tanklarında ana balık ayırın.
- Oda ışığında ertesi sabah açıldıktan sonra bölücü çıkarın. Ebeveynlerin her yarım bir saat 10 dakikalık aralıklarla çapraz izin verin. Her geçtikten sonra balık ayırın.
- 28 ayrı E3 orta her kapısında toplanan embriyolar koruyun ° C
- Sahne embriyolar, 10 ila 12 saat sonra döllenme (hpf) ve restage hemen belirli bir zaman noktalarında diseksiyonu önce, belirlenmiş kriterlere 1, 6 göre .
Bölüm 2: Diseksiyon beyin kaldırma ve göz temasından 1
- Bu bölümde açıklanan prosedürleri (Bölüm 3A) retina ve RPE bağlı retina (3B) diseksiyon için ortak.
- Tüm Dumont forsepsi bir ucu ince diseksiyonları tarafından yapılan ve Dumont forseps doku konumlandırma için başka bir çifti tarafından yardım edilmektedir. Bir kimyasal kazınmış tungsten iğne gerekirse ince manipülasyonlar için kullanılabilir.
- Tüm ince diseksiyonları ~ 5-8x büyütme 1X bir amaç ya da eşdeğeri ile donatılmış bir Olympus SZX16 mikroskop altında yapılmaktadır.
- E3 ortamda embriyolar bakımını bir tezgah üstü inkübatör 28 ° C Diseksiyon sırasında kolay embriyo erişim için mikroskop yanında.
- Bu mikroskop aşamasında, gen ekspresyonu üzerindeki sıcaklık dalgalanmasının etkisini en aza indirmek için bir termo levha ile 28 ° C'ye ısıtılır.
- Part 1 # 3 açıklandığı gibi Ringer Falcon 60 x 15 mm kültür plakasına çözümü için belirli bir gelişim aşamasında embriyo transferi hazırladı.
- Ön gövde parçası ile vücuttan hızlı bir şekilde kafasını kesti.
- Yardımcı forseps ile kültür plaka üzerinde bu doku arka ucunu sabitleyin.
- Dorsal tarafında ön alından başlayan baş açın.
- Beyin gözlerin medial tarafında maruz kalır ve daha fazla manipülasyonlar için yukarı bakacak şekilde kaldırın.
Bölüm 3A: Retina diseksiyon 1
- Bölüm 2 de açıklandığı gibi embriyo hazırlayın.
- Maruz RPE, retinanın küçük bir açılım görülüyor kadar forseps ucu yukarı bakacak şekilde göz topun medial tarafında dikkatlice fırçalayın.
- Fırçalama ve eylem soyma retinanın iç tarafında, hemen hemen tüm maruz kadar devam edin. Çizilme ve maruz retina delme kaçının.
- Şimdi aşağıya doğru bakacak şekilde retina, yaklaşım lateral RPE kaldırmak için olduğunu ve kültür plaka yüzeyinden yaklaşık 45 ° açıyla fırça.
- C RPE müstakil bir kısmı iğneleyerek ora serrata nispeten sağlam bir şekilde bağlı olduğu RPE çıkarınulture diseksiyon için plaka ve retinanın hafifçe kaldırın.
- Kalan RPE temizlemek için kültür çanak alt retina döndürün.
- Biz bir embriyo ezilmiş bir kez bu özel Falcon polistiren kültür plakasına yaklaşık 20 dakika boyunca RPE tercihli bir bağlılık olduğunu fark etmişsinizdir. Bu özellik, RPE kalıntıların çıkarılması için kullanılmaktadır. Ancak, retinal hücreler yüzeye yüksek büyütme altında yakından kontrol edilebilir, daha az bir ölçüde, sopa. Bir RPE kaldırma ve retina bütünlüğünü eksiksiz arasında bir denge vardır.
- Objektif genellikle kültür plakasına bağlıdır ve haddeleme işlemi sırasında retinadan ayrılır. Bazen, lens, lens yüzeyi üzerinde dönen eylem ile kazınmış bir tungsten iğne ile ayırmak için gereklidir.
- Bu prosedürler, doku bütünlüğü ödün vermeden başarıyla retinanın RPE kaldırmak. Bu iyi bir genel morfolojisi (Şekil 1B ve B ') ve histoloji (Şekil 1B ") ile gösterilir, ok fotoreseptör tabaka ve RPE arasında ekstraselüler matriks korunması, özellikle (Şekil 1B son derece iyi." bütün embriyo (Şekil 1A ")) histoloji ile karşılaştırın.
Parça 3B: RPE bağlı retina diseksiyonu 3
- Bölüm 2 de açıklandığı gibi embriyo hazırlayın.
- Kültür plaka baş asistan forseps ile sabitleyin. Gözün arka yan taraftan hafifçe kaldırın ve ön tarafında roll.
- RPE tabakasının dışında olası koroid ve skleral doku cilt nispeten sıkıca bağlı olan ve çoğunlukla ön tarafında dikkatle göz yuvarlayarak sıyrılır olabilir.
- Tungsten iğne ile lens gözün yan tarafında maruz kalır ve göz hala cilde takıldığında sonra çıkarın.
- Bu prosedürler, retina ile tüm RPE başarıyla koruyabilirsiniz. Olası choroids ve skleral doku büyük ölçüde (Şekil 1C, C ve C ") silinebilir.
Bölüm 4: Doku RNA çalışmaları için örnek toplama
- Disseke örnekleri 1 önce açıklandığı gibi downstream RNA karakterizasyonu için bir RNaz ücretsiz mikrofuge'de tüp TRIzol toplanabilir.
Temsilcisi Sonuçlar
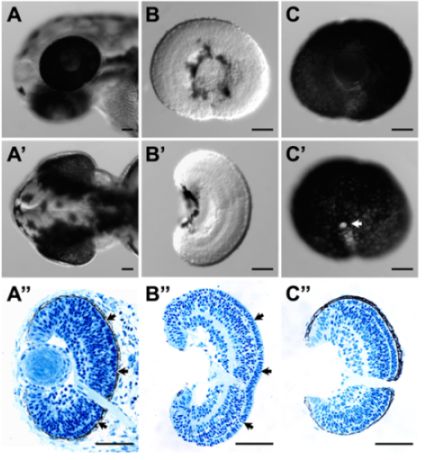
Şekil 1 (A) Yanal ve diseksiyonu önce 52 hpf Zebra balığı larva kafa (A) dorsal. (A) ve (A ') (B) ve (B', 54 hpf disseke retina) dorsal Yanal retina yüzeyinde yatay hem de sağlam olduğu larva baş (A ") karşılık gelen histolojik bölüm ve dorsal kez (B) (B) ve (B ') disseke retina ilgili histolojik bölüm. Retina ve retina laminasyon yapısı bozulmamış oldu. Özellikle, fotoreseptör tabaka ve RPE (A arasındaki ekstraselüler matriks "(oklar, oklar) disseke retina B) korundu". (C) Yanal ve 52 hpf disseke RPE bağlı retina (C ') medial. RPE disseke doku histolojik kesiti (C) ile gösterilir olduğu, sağlam ve sürekli C 'beyaz alan optik sinir (ok). Histoloji, doku örnekleri% 4 toplanır ve fikse edildi 3 açıklandığı gibi paraformaldehid Plastik gömme ve bu örneklerin bir kesit yapıldı. Ölçek çubuğu = 50 mm.
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Zebrafish göz dokularında Mikrodisseksiyon etkin bir şekilde sağlam retina ve RPE bağlı retina elde edebilirsiniz. Bu ifade belirli bir göz doku (yani retina veya RPE) ile ilgili çalışmalar önemli ölçüde yardımcı olur. Aslında, tüm retina 1 ve RPE 3 RNA ekspresyon profillerini elde etmek için bu işlemler başarıyla kullanmış olması. Bu profilleri programı güçlü bir retina farklılaşma mutant 2 tedirgin olan yollar ve gen ailelerinin son kimlik tarafından des...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Teşekkürler
Bu çalışma, Purdue Üniversitesi Biyolojik Bilimler Bölümü'nden mezun bir başlangıç fonu tarafından desteklenmektedir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Cordless pestle motor | VWR international | 47747-370 | |
| DC power supply | Lascar | PSU130 | Any DC supply would work. The specific voltage of a different machine will need further optimization. |
| Disposable pestle & microtube, 1.5 mL (DNase, RNase and pyrogen-free) | VWR international | 47747-366 | These are used for tissue collection in TRIzol for expression analysis. |
| Dumont #5 forceps, Tips: 0.05 x 0.01mm, Inox | World Precision Instruments, Inc. | 500341 | Fine tip dimension is desirable but is not inflexible, as one may need to sharpen the tip from time to time. |
| Dumont #5SF forceps, Tips: 0.025 x 0.005mm, Inox | Fine Science Tools | 11252-00 | Fine tip dimension is desirable but is not inflexible, as one may need to sharpen the tip from time to time. |
| Falcon polystyrene culture plates, 60 X 15 mm | BD Biosciences | 351007 | These plates are used as dissection plates. |
| Olympus SZX16 Stereomicroscope | Olympus Corporation | SZX16 | Any stereomicroscope would work. We used Leica stereomicroscope in previous studies1-3 without any issues. We also use the 1X objective exclusively for the dissection even though we have a 2X objective installed. |
| Sharpening stone | Fine Science Tools | 29008-01 | Use this to sharpen the tip of the forceps if necessary |
| Thermo plate | Tokai Hit | MATS-U55SZX2B | This is used to maintain the temperature of the tissue throughout dissection and minimize the influence of temperature fluctuation on gene expression. We also put the whole microscope in an environmentally controlled room at 28°C during dissection in previous studies1-3 with good success. |
| Trizol, 100 mL | Invitrogen | 15596-026 | |
| tungsten wire, 0.015 inch diameter | World Precision Instruments, Inc. | TGW1510 | |
| Wooden Applicator | Puritan | 807 | This is used for holding the chemically-etched tungsten needle. |
Referanslar
- Leung, Y. F., Dowling, J. E. Gene expression profiling of zebrafish embryonic retina. Zebrafish. 2, 269-283 (2005).
- Leung, Y. F., Ma, P., Link, B. A., Dowling, J. E. Factorial microarray analysis of zebrafish retinal development. Proc Natl Acad Sci U S A. 105, 12909-12914 (2008).
- Leung, Y. F., Ma, P., Dowling, J. E. Gene expression profiling of zebrafish embryonic retinal pigment epithelium in vivo. Invest Ophthalmol Vis Sci. 48, 881-890 (2007).
- Nusslein-Volhard, C., Dahm, R. Zebrafish : a practical approach. , 1st ed, Oxford University Press. Oxford ; New York. (2002).
- Westerfield, M. The zebrafish book : a guide for the laboratory use of zebrafish (Danio rerio). , 4th ed, University of Oregon Press. Eugene, OR. (2000).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203, 253-310 (1995).
- Fadool, J. M., Dowling, J. E. Zebrafish: a model system for the study of eye genetics. Prog Retin Eye Res. 27, 89-110 (2008).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır