È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Microdissezione dei tessuti oculari Zebrafish embrionali
In questo articolo
Riepilogo
Questo articolo descrive un approccio alla microdissect retine zebrafish con e senza epitelio pigmentato retinico collegato, da una a tre embrioni postfertilization giorni.
Abstract
Zebrafish è un modello animale popolare per la ricerca sullo sviluppo degli occhi a causa della sua rapida
Protocollo
Parte 1: Preparativi prima di microdissezione
- Soluzioni
- E3 media 4 (5 mM NaCl, 0,17 mM KCl, 0,33 mM CaCl 2 e 0,33 mM MgSO 4).
- Soluzione di Ringer 1, 5 (116 mM NaCl, 2.9 mM KCl, 1,8 mM CaCl 2, 5 mM HEPES, pH7.2), filtro sterilizzato.
- 5N NaOH.
- Attacco chimico di aghi di tungsteno
- Fissare un piccolo becher contenente NaOH 5N su una piastra di Petri di argilla.
- Fissare una graffetta sul lato del bicchiere, in modo che viene a contatto con la soluzione di NaOH.
- Collegare l'elettrodo negativo di un alimentatore DC per la graffetta e l'elettrodo positivo ad una estremità di un pezzo breve (~ 2 cm) di filo di tungsteno.
- Avvolgere l'altra estremità del filo di tungsteno con una palla di terracotta e tuffo tal fine nella soluzione di NaOH.
- Aumentare la tensione di circa 3V e immergere il filo su e giù per la soluzione di NaOH fino a una velocità di incisione buona è raggiunto. Un ago in buona qualità di solito può essere inciso in 10 minuti.
- Il filo di tungsteno esposti alla soluzione diventerà gradualmente più sottili. Quando la palla cade fuori terra, dall'altra parte del filo che è ancora attaccato l'elettrodo positivo avrà una forma tagliente ago.
- Sciacquare l'ago tagliente con la soluzione di Ringer o E3 per rimuovere i depositi di sale.
- Applicare l'ago di un applicatore di legno con nastro adesivo o un porta aghi per una maggiore maneggevolezza.
- Piastre di coltura
- Il Falcon 60 x 15 mm, piastre di coltura in polistirolo sono pronti da usare per microdissezione della retina.
- Per dissezione RPE-attached retina, schiacciare due embrioni completamente in una piastra di coltura contenente la soluzione di Ringer per sbarazzarsi della adesività della superficie 30 minuti prima dissezione. Poco prima della dissezione, lavare la piastra a lungo con soluzione di Ringer fresco.
- Embrioni di raccolta e messa in scena
- Zebrafish adulti sono mantenuti come descritto 4, 5.
- Separare il pesce padre in vasche di allevamento statico a coppie da un divisore la sera prima di allevamento.
- Rimuovere il divisore dopo la luce della stanza si accende la mattina successiva. Permettere ai genitori di attraversare a intervalli di 10 minuti ogni mezz'ora. Separare il pesce dopo ogni incrocio.
- Mantenere gli embrioni raccolti da ogni incrocio in media E3 separatamente a 28 ° C.
- Embrioni stadio da 10 a 12 Messaggio fecondazione ore (HPF) e restage immediatamente prima della dissezione in corrispondenza dei punti di tempo specifico, secondo i criteri stabiliti 1, 6.
Parte 2: Dissection - rimozione del cervello e l'esposizione agli occhi 1
- Le procedure descritte in questa sezione sono comuni per dissezione retina (3A Parte) e RPE-attached retina (parte 3B).
- Tutte le dissezioni fini sono fatto da un punta della pinza Dumont e assistito da un altro paio di Dumont pinze per il posizionamento del tessuto. Un inciso chimicamente l'ago di tungsteno può essere utilizzato per le manipolazioni più fine, se necessario.
- Tutte le dissezioni fini sono eseguite con ingrandimento ~ 5-8x con un microscopio Olympus SZX16 dotata di un obiettivo 1X o equivalente.
- Mantenere gli embrioni in media E3 in un banco incubatore a 28 ° C vicino al microscopio per un facile accesso embrione durante la dissezione.
- La fase di microscopio viene riscaldato a 28 ° C da una piastra termica per minimizzare l'influenza delle fluttuazioni di temperatura sull'espressione genica.
- Trasferimento di un embrione in uno stadio di sviluppo specifici per la soluzione di Ringer in un Falcon 60 X 15 mm Piastra cultura preparato come descritto nella parte 1 # 3.
- Tagliare la testa con la parte anteriore del tronco velocemente dal corpo.
- Perno la fine posteriore di questo tessuto su piastra di coltura con le pinze assistere.
- Aprire la testa sul lato dorsale a partire dal fronte anteriore.
- Togliere il cervello in modo che il lato mediale degli occhi è esposto ed è rivolto verso l'alto per ulteriori manipolazioni.
Parte 3A: Retinal dissezione 1
- Preparare l'embrione come descritto nella parte 2.
- Spazzolare con cura la RPE esposta sul lato mediale del bulbo oculare che è rivolta verso l'alto dalla punta della pinza fino ad una piccola apertura per la retina è visto.
- Continuare la spazzolatura e peeling azione fino alla parte mediale della retina è quasi tutta a vista. Evitare graffi e pugni la retina esposti.
- Per rimuovere l'RPE laterale sulla retina che ora è rivolto verso il basso, l'approccio che e pennello con un angolo di circa 45 ° dalla superficie piastra di coltura.
- Rimuovere la RPE che è collegato relativamente saldamente al serrata da appuntare la parte staccata del RPE al cPiastra ultura per la dissezione, quindi sollevare delicatamente la retina.
- Stendere la retina sul fondo del piatto cultura per ripulire il RPE residuo.
- Abbiamo notato che questa particolare piastra di polistirolo Falcon cultura ha una aderenza preferenziale di RPE per circa 20 minuti una volta che un embrione è schiacciato. Questa proprietà è utilizzata per la rimozione di residui di RPE. Tuttavia, le cellule della retina si attaccano alla superficie, in misura minore, che può essere ispezionato da vicino in alto ingrandimento. Bisogna trovare un equilibrio tra la completezza di rimozione RPE e l'integrità della retina.
- La lente aderisce spesso alla piastra di coltura e si stacca dalla retina durante il processo di laminazione. Occasionalmente, è necessario staccare l'obiettivo da un ago di tungsteno inciso con una azione vorticosa sulla superficie della lente.
- Queste procedure possono rimuovere con successo RPE dalla retina senza compromettere l'integrità del tessuto. Questo è indicato da una buona morfologia complessiva (Figura 1B e B ') e istologia (Figura 1B "), freccia In particolare, la conservazione della matrice extracellulare tra lo strato dei fotorecettori e la RPE è eccezionalmente buono (Figura 1B."; confrontare con l'istologia dall'embrione suo complesso (Figura 1A ")).
Parte 3B: RPE-attached retina dissezione 3
- Preparare l'embrione come descritto nella parte 2.
- Pin testa alla piastra di coltura per le pinze assistente. Sollevare lo sguardo dolcemente dal lato posteriore laterale e rotolare verso il lato anteriore.
- La coroide presuntiva e il tessuto sclerale sulla parte esterna dello strato di RPE sono collegati strettamente relativamente alla pelle e può essere per lo più staccata tirando l'occhio con attenzione al lato anteriore.
- Rimuovere l'obiettivo con un ago di tungsteno dopo la parte laterale degli occhi è esposto e quando l'occhio è ancora attaccato alla pelle.
- Queste procedure possono preservare con successo l'intero livello RPE con la retina. Coroide presuntiva e il tessuto sclerale può essere in gran parte rimosso (Figura 1C, C 'e C ").
Parte 4: raccolta dei campioni del tessuto per il lavoro dell'RNA
- I campioni sezionato possono essere raccolti in TRIzol in un RNasi-free provetta da microcentrifuga per la caratterizzazione a valle RNA come descritto in precedenza 1.
Rappresentante Risultati
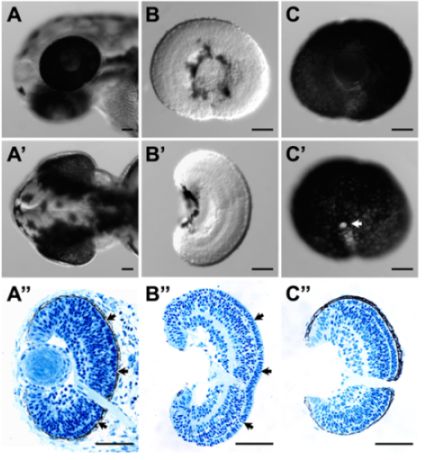
Figura 1. (A) e laterale (A ') vista dorsale di una testa di pesce zebra larvale a 52 hpf prima della dissezione. (A ") la corrispondente sezione istologica della testa larvale in (A) e (A '). (B) e laterale (B') vista dorsale di una retina sezionato a 54 HPF. La superficie della retina era intatto da entrambi i laterali e vista dorsale. (B ") La sezione corrispondente istologica della retina sezionato in (B) e (B '). La struttura della retina e laminazione della retina era intatto. In particolare, la matrice extracellulare tra lo strato dei fotorecettori e RPE (A ", frecce) è stato ben conservato nella retina sezionato (B", frecce). (C) e laterale (C ') vista mediale di un sezionato RPE-attached retina a 52 HPF. RPE strato era intatto e continuo, che è stata indicata anche dalla sezione istologica del tessuto sezionato (C "). L'area bianca in C 'è il nervo ottico (freccia). Per istologia, campioni di tessuto sono stati raccolti e fissati in 4% paraformaldeide. Plastica inclusione e il sezionamento di questi campioni sono state eseguite come descritto 3. barra di scala = 50 micron.
Discussione
Microdissezione dei tessuti dell'occhio zebrafish può effettivamente ottenere retine intatte e RPE-attached retine. Questo aiuta notevolmente studi di espressione relativi a un tessuto oculare specifico (retina o alla RPE). In effetti, abbiamo utilizzato con successo queste procedure per ottenere profili di espressione di RNA della retina tutto RPE 1 e 3. L'utilità di questi profili è fortemente sostenuta dal nostro recente identificazione di percorsi e di famiglie di geni che sono pertu...
Divulgazioni
Riconoscimenti
Questo lavoro è sostenuto da un fondo di avvio del Dipartimento di Scienze Biologiche presso la Purdue University.
Materiali
| Name | Company | Catalog Number | Comments |
| Cordless pestle motor | VWR international | 47747-370 | |
| DC power supply | Lascar | PSU130 | Any DC supply would work. The specific voltage of a different machine will need further optimization. |
| Disposable pestle & microtube, 1.5 mL (DNase, RNase and pyrogen-free) | VWR international | 47747-366 | These are used for tissue collection in TRIzol for expression analysis. |
| Dumont #5 forceps, Tips: 0.05 x 0.01mm, Inox | World Precision Instruments, Inc. | 500341 | Fine tip dimension is desirable but is not inflexible, as one may need to sharpen the tip from time to time. |
| Dumont #5SF forceps, Tips: 0.025 x 0.005mm, Inox | Fine Science Tools | 11252-00 | Fine tip dimension is desirable but is not inflexible, as one may need to sharpen the tip from time to time. |
| Falcon polystyrene culture plates, 60 X 15 mm | BD Biosciences | 351007 | These plates are used as dissection plates. |
| Olympus SZX16 Stereomicroscope | Olympus Corporation | SZX16 | Any stereomicroscope would work. We used Leica stereomicroscope in previous studies1-3 without any issues. We also use the 1X objective exclusively for the dissection even though we have a 2X objective installed. |
| Sharpening stone | Fine Science Tools | 29008-01 | Use this to sharpen the tip of the forceps if necessary |
| Thermo plate | Tokai Hit | MATS-U55SZX2B | This is used to maintain the temperature of the tissue throughout dissection and minimize the influence of temperature fluctuation on gene expression. We also put the whole microscope in an environmentally controlled room at 28°C during dissection in previous studies1-3 with good success. |
| Trizol, 100 mL | Invitrogen | 15596-026 | |
| tungsten wire, 0.015 inch diameter | World Precision Instruments, Inc. | TGW1510 | |
| Wooden Applicator | Puritan | 807 | This is used for holding the chemically-etched tungsten needle. |
Riferimenti
- Leung, Y. F., Dowling, J. E. Gene expression profiling of zebrafish embryonic retina. Zebrafish. 2, 269-283 (2005).
- Leung, Y. F., Ma, P., Link, B. A., Dowling, J. E. Factorial microarray analysis of zebrafish retinal development. Proc Natl Acad Sci U S A. 105, 12909-12914 (2008).
- Leung, Y. F., Ma, P., Dowling, J. E. Gene expression profiling of zebrafish embryonic retinal pigment epithelium in vivo. Invest Ophthalmol Vis Sci. 48, 881-890 (2007).
- Nusslein-Volhard, C., Dahm, R. . Zebrafish : a practical approach. , (2002).
- Westerfield, M. The zebrafish book : a guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203, 253-310 (1995).
- Fadool, J. M., Dowling, J. E. Zebrafish: a model system for the study of eye genetics. Prog Retin Eye Res. 27, 89-110 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon