Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mikrodissektion von Zebrafisch Embryonale Augentücher
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt einen Ansatz zur Zebrafisch Retina mit und ohne Pigmentepithel angebracht, von einem bis drei Tagen der Befruchtung Embryonen microdissect.
Zusammenfassung
Zebrafisch ist ein beliebter Tiermodell zur Erforschung der Entwicklung des Auges wegen seiner schnellen
Protokoll
Teil 1: Vorbereitungen vor Mikrodissektion
- Lösungen
- E3 Medium 4 (5 mM NaCl, 0,17 mM KCl, 0,33 mM CaCl 2 und 0,33 mM MgSO 4).
- Ringer-Lösung 1, 5 (116 mM NaCl, 2,9 mM KCl, 1,8 mM CaCl 2, 5 mM HEPES, pH 7,2), sterilfiltriert.
- 5N NaOH.
- Chemisches Ätzen von Wolfram Nadeln
- Sichern Sie sich einen kleinen Becher mit 5N NaOH auf einer Petrischale mit Ton.
- Bringen Sie eine Büroklammer auf der Seite des Bechers, so dass es in Kontakt mit der NaOH-Lösung kommt.
- Verbinden Sie die negative Elektrode aus einer DC-Stromversorgung, die Büroklammer und die positive Elektrode an einem Ende ein kurzes Stück (~ 2cm) aus Wolframdraht.
- Wickeln Sie das andere Ende des Wolfram-Draht mit einem kleinen Ton-Ball und dip diesem Zweck in die NaOH-Lösung.
- Erhöhen Sie die Spannung auf ca. 3V und tauchen den Draht nach oben und unten in der NaOH-Lösung, bis eine gute Ätzrate erreicht ist. Eine Nadel in guter Qualität können in der Regel in 10 Minuten geätzt werden.
- Der Wolframdraht der Lösung ausgesetzt wird allmählich dünner. Wenn der Ton Kugel abfällt, wird die andere Seite der Leitung, die noch auf der positiven Elektrode angebracht haben eine spitze Nadel Form.
- Spülen Sie die spitze Nadel mit Ringer-Lösung oder E3 zu Salzablagerungen zu entfernen.
- Befestigen Sie die Nadel zu einem Holzstab durch Band oder einen Nadelhalter für eine einfache Handhabung.
- Kultur-Platten
- Die Falcon 60 x 15 mm Polystyrol Kultur Platten sind bereit, für Netzhaut-Mikrodissektion verwendet werden.
- Für Sezieren RPE-attached Netzhaut, crush zwei Embryonen völlig in einer Kultur Platte mit Ringer-Lösung, um loszuwerden, die Haftfähigkeit der Oberfläche 30 Minuten vor dem Sezieren. Kurz vor ihrer Zerlegung, waschen Sie die Platte intensiv mit frischer Ringerlösung.
- Embryonen Sammlung und Inszenierung
- Adult Zebrafisch erhalten bleiben, wie beschrieben 4, 5.
- Trennen Sie die Eltern Fisch in statischen Zuchtbecken durch einen Teiler paarweise in der Nacht zuvor Zucht.
- Entfernen Sie die Trennlinie nach dem Raumlicht eingeschaltet ist am nächsten Morgen geworden. Lassen Sie die Eltern, um im 10-Minuten-Takt Cross jede halbe Stunde. Trennen Sie die Fische nach jeder Kreuzung.
- Pflegen Sie die Embryonen aus jeder Kreuzung in E3 Medium getrennt gesammelt bei 28 ° C.
- Embryonen bei 10 bis 12 Stunden nach der Befruchtung (HPF) und reinszenieren unmittelbar vor Dissektion an der bestimmten Zeitpunkten, nach festgelegten Kriterien 1, 6.
Teil 2: Dissection - Gehirn entfernt und Auge Belichtung 1
- Die Verfahren in diesem Abschnitt beschrieben sind häufig zum Präparieren Netzhaut (Teil 3A) und RPE-attached Netzhaut (3b).
- Alle feinen Sektionen werden von einer Spitze des Dumont Pinzetten getan und unterstützt durch ein anderes Paar von Dumont Pinzetten zur Positionierung des Gewebes. Ein chemisch geätzten Wolframnadel kann für eine feinere Manipulationen bei Bedarf verwendet werden.
- Alle feinen Dissektionen sind bei ~ 5-8fache Vergrößerung unter einem SZX16 Mikroskop mit einem 1X Ziel oder gleichwertig ausgestattet war.
- Pflegen Sie die Embryonen in E3-Medium in einem Tischgerät Brutschrank bei 28 ° C neben dem Mikroskop leicht Embryo Zugang beim Präparieren.
- Der Mikroskoptisch ist bis 28 ° C durch eine thermo Platte erwärmt, um den Einfluss von Temperaturschwankungen auf die Genexpression zu minimieren.
- Transfer eines Embryos zu einem bestimmten Entwicklungsstadium an Ringer-Lösung in einem Falcon 60 X 15 mm Kulturplatte hergestellt, wie in Teil 1 # 3 beschrieben.
- Schneiden Sie den Kopf mit einem Teil der vorderen Kofferraum schnell aus dem Körper.
- Pin das hintere Ende dieses Gewebes auf die Kultur Platte mit der Unterstützung der Pinzette.
- Öffnen Sie den Kopf auf der Rückenseite ab der vorderen Stirn.
- Entfernen Sie das Gehirn, so dass die mediale Seite der Augen ausgesetzt ist und nach oben gerichtet ist für weitere Manipulationen.
Teil 3a: Retinal Dissektion 1
- Bereiten Sie den Embryo als in Teil 2 beschrieben.
- Gründlich abbürsten der exponierten RPE auf der medialen Seite des Augapfels, die nach oben durch die Spitze der Zange, bis eine kleine Öffnung auf der Netzhaut zu sehen ist.
- Setzen Sie die Bürsten und Peeling Aktion bis der medialen Seite der Netzhaut fast alle ausgesetzt sind. Vermeiden Sie Kratzer und Stanzen der exponierten Netzhaut.
- Um die seitliche RPE auf der Netzhaut, die nun vor nach unten, Ansatz entfernen, und Bürste in einem Winkel von ca. 45 ° von der Kultur Plattenoberfläche.
- Entfernen Sie das RPE, die relativ fest an der ora serrata befestigt durch Pinning der abgelösten Teil des RPE, die culture Platte für die Präparation und heben Sie dann die Netzhaut sanft.
- Rolle der Netzhaut auf dem Boden der Kulturschale zu bereinigen die restliche RPE.
- Wir haben bemerkt, dass diese besondere Falcon Polystyrol Kulturplatte Vorzugspreis Einhaltung der RPE für ca. 20 Minuten einmal ein Embryo ist gebrochen. Diese Eigenschaft ist für die Entfernung von RPE Reste eingesetzt. Allerdings sind die Zellen der Netzhaut-Stick an die Oberfläche zu einem geringeren Teil, die eng unter hoher Vergrößerung untersucht werden. Man muss ein Gleichgewicht zwischen der Vollständigkeit der RPE Entfernung und Retina Integrität zu schlagen.
- Das Objektiv oft hält sich an die Kultur Platte und löst sich von der Netzhaut beim Walzen. Gelegentlich ist es notwendig, die Linse durch eine geätzte Wolframnadel lösen mit einem wirbelnden Wirkung auf die Oberfläche der Linse.
- Diese Verfahren können erfolgreich beseitigt RPE von der Netzhaut, ohne dabei die Integrität des Gewebes. Dies wird durch eine insgesamt gute Morphologie (Abbildung 1B und B ') und Histologie (Abbildung 1B ") angegeben, Pfeil Insbesondere die Erhaltung der extrazellulären Matrix zwischen den Photorezeptor-Schicht und der RPE außergewöhnlich gut ist (Abbildung 1B." Vergleich mit der Histologie aus der ganzen Embryo (Abbildung 1A ")).
Teil 3b: RPE-attached Netzhaut Dissektion 3
- Bereiten Sie den Embryo als in Teil 2 beschrieben.
- Pin den Kopf, um die Kultur Platte vom Assistenten Pinzette. Heben Sie das Auge vorsichtig aus dem hinteren lateralen Seite und rollen auf der Vorderseite.
- Die mutmaßlichen Aderhaut und Skleralgewebe auf der Außenseite des RPE Schicht relativ dicht an der Haut befestigt und kann meist abgezogen werden durch Rollen der Augen sorgfältig auf die Vorderseite.
- Nehmen Sie das Objektiv mit einer Wolfram-Nadel nach der lateralen Seite des Auges ausgesetzt ist, und wenn das Auge ist immer noch auf der Haut angebracht.
- Diese Verfahren können mit Erfolg in der ganzen RPE-Schicht mit der Netzhaut. Mutmaßlich Choroidea und Skleralgewebe weitgehend entfernt werden (Abbildung 1C, C 'und C ").
Teil 4: Tissue Probenentnahme für die RNA-Arbeiten
- Die seziert Proben können in TRIzol in ein RNase-freies Mikrozentrifugenröhrchen für nachgeschaltete RNA Charakterisierung als vor 1 beschrieben gesammelt werden.
Repräsentative Ergebnisse
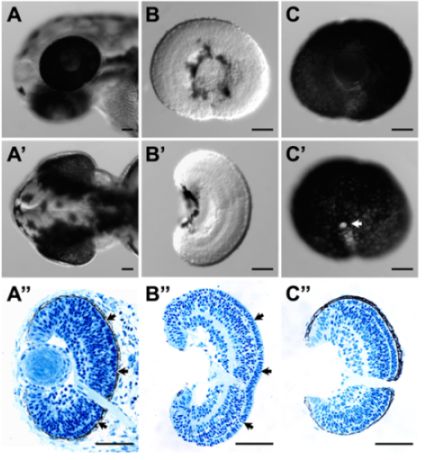
Abbildung 1. (A) Laterale und (A ') Dorsalansicht eines Zebrafisch-Larven Kopf bei 52 hpf vor ihrer Zerlegung. (A ") die entsprechenden histologischen Schnitt der larvalen Kopf in (A) & (A '). (B) Laterale und (B') Dorsalansicht eines seziert Netzhaut bei 54 hpf. Die Oberfläche der Netzhaut intakt war von beiden seitlichen und dorsalen Aussicht. (B ") die entsprechenden histologischen Schnitt des seziert Netzhaut in (B) und (B '). Die Struktur der Netzhaut und des retinalen Laminierung war intakt. Insbesondere die extrazelluläre Matrix zwischen den Photorezeptorschicht und RPE (A "(, Pfeile war, Pfeile) sowie in den sezierten Netzhaut B) erhalten." (C) Quer-und (C ') medialen Darstellung eines seziert RPE-attached Netzhaut bei 52 hpf. RPE-Schicht intakt war und kontinuierliche, was auch durch die histologischen Schnitt des sezierten Gewebes (C ") angegeben. Der weiße Bereich in C 'ist der Sehnerv (Pfeil). Für Histologie, Gewebeproben gesammelt und in 4% Paraformaldehyd. Plastic Einbettung und Schneiden dieser Proben wurden wie 3 beschrieben. Scale-bar = 50 pm.
Diskussion
Mikrodissektion von Zebrafisch Augengewebe effektiv erhalten intakte Netzhaut und RPE-attached Netzhaut. Diese im Wesentlichen unterstützt Ausdruck Studien in Bezug auf ein bestimmtes Augengewebes (dh Netzhaut oder RPE). In der Tat haben wir erfolgreich diese Verfahren genutzt werden, um RNA Expressionsprofile der ganze Netzhaut 1 und RPE 3 zu erhalten. Der Nutzen dieser Profile ist stark von unserer letzten Identifizierung von Wegen und Gen-Familien, die in einem Retina-Differenzierung mutierten ...
Offenlegungen
Danksagungen
Diese Arbeit wird durch ein Start-up Fund aus dem Department of Biological Sciences an der Purdue University unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Cordless pestle motor | VWR international | 47747-370 | |
| DC power supply | Lascar | PSU130 | Any DC supply would work. The specific voltage of a different machine will need further optimization. |
| Disposable pestle & microtube, 1.5 mL (DNase, RNase and pyrogen-free) | VWR international | 47747-366 | These are used for tissue collection in TRIzol for expression analysis. |
| Dumont #5 forceps, Tips: 0.05 x 0.01mm, Inox | World Precision Instruments, Inc. | 500341 | Fine tip dimension is desirable but is not inflexible, as one may need to sharpen the tip from time to time. |
| Dumont #5SF forceps, Tips: 0.025 x 0.005mm, Inox | Fine Science Tools | 11252-00 | Fine tip dimension is desirable but is not inflexible, as one may need to sharpen the tip from time to time. |
| Falcon polystyrene culture plates, 60 X 15 mm | BD Biosciences | 351007 | These plates are used as dissection plates. |
| Olympus SZX16 Stereomicroscope | Olympus Corporation | SZX16 | Any stereomicroscope would work. We used Leica stereomicroscope in previous studies1-3 without any issues. We also use the 1X objective exclusively for the dissection even though we have a 2X objective installed. |
| Sharpening stone | Fine Science Tools | 29008-01 | Use this to sharpen the tip of the forceps if necessary |
| Thermo plate | Tokai Hit | MATS-U55SZX2B | This is used to maintain the temperature of the tissue throughout dissection and minimize the influence of temperature fluctuation on gene expression. We also put the whole microscope in an environmentally controlled room at 28°C during dissection in previous studies1-3 with good success. |
| Trizol, 100 mL | Invitrogen | 15596-026 | |
| tungsten wire, 0.015 inch diameter | World Precision Instruments, Inc. | TGW1510 | |
| Wooden Applicator | Puritan | 807 | This is used for holding the chemically-etched tungsten needle. |
Referenzen
- Leung, Y. F., Dowling, J. E. Gene expression profiling of zebrafish embryonic retina. Zebrafish. 2, 269-283 (2005).
- Leung, Y. F., Ma, P., Link, B. A., Dowling, J. E. Factorial microarray analysis of zebrafish retinal development. Proc Natl Acad Sci U S A. 105, 12909-12914 (2008).
- Leung, Y. F., Ma, P., Dowling, J. E. Gene expression profiling of zebrafish embryonic retinal pigment epithelium in vivo. Invest Ophthalmol Vis Sci. 48, 881-890 (2007).
- Nusslein-Volhard, C., Dahm, R. . Zebrafish : a practical approach. , (2002).
- Westerfield, M. The zebrafish book : a guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203, 253-310 (1995).
- Fadool, J. M., Dowling, J. E. Zebrafish: a model system for the study of eye genetics. Prog Retin Eye Res. 27, 89-110 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten