Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kordon Kanı adlı Sitotoksik T lenfositler genişletilmesi olduğunu Hedef Sitomegalovirüs, Epstein-Barr Virus ve Adenovirüs
Bu Makalede
Özet
Burada ilk iyi üretim uygulamaları (GMP) uyumlu göbek kordon kanı, ağırlıklı naif T hücrelerinin kaynağı virüs-spesifik sitotoksik T lenfositler (CTL) üretme yöntemi açıklar.
Özet
Kök hücre nakli sonrası Virüs enfeksiyonları, özellikle kordon kanı sonra, ölümün en sık nedenleri arasındadır (CB) transplantasyonu (TCMB) burada CB enfeksiyondan alıcı koruyabilirsiniz virüs deneyimli T hücreleri 1 sezilebilir numaraları içermez. - Biz ve diğerleri, virüs spesifik CTL seropozitif vericilerden elde edilen ve alıcı için infüze olduğunu göstermiştir 4 güvenli ve koruyucu. 5-8 Bununla birlikte, yakın zamana kadar, virüs spesifik T hücreleri dolayı muhtemelen, kordon kan elde edilememiştir virüs özel bellek T hücrelerinin yokluğunda.
Daha naif T hücrelerinin in vivo emişli koşullarda taklit çabasıyla, biz böylece T hücre spesifitesi sürüş, CB-türevli dendritik hücreler (DC) immünodominant CMV antijeni pp65 içeren bir adenoviral vektör (Ad5f35pp65) ile transdük kullanılan bir yöntem kurdu inisiyasyon az CMV ve adenovirüs. 9 doğru, biz bu ma kullanınyakalandığı DC'ler gibi her ikisi de ifade IL-7, IL-12 ve IL-15. ikinci biz EBV-dönüştürülmüş B hücreleri uyarımı kullanılmış, ya da EBV-LCL, az 10 sitokinler varlığında CB-alınan T-hücrelerinde latent ve litik EBV antijenleri. Ad5f35pp65-transdük EBV-LCL ikinci stimülasyon da IL-15 varlığında T hücrelerinin uyarmak için kullanılır. Müteakip uyarımlar EBV-LCL ve IL-2 Ad5f35pp65-transduced kullanın.
50x10 6 CB mononükleer hücreler itibaren biz antijenik uyarılara yanıt olarak antijen ile doldurulan hedefleri ve serbest sitokinler lyse 150 x 10 6 virüs-spesifik T hücreleri yukarı oluşturmak edebiliyoruz. 11. Bu hücreler kullanılarak GMP uyumlu şekilde imal edilmiştir yalnızca % 20 bir fraksiyone kordon kanı ünitesi fraksiyonu ve klinik kullanım için tercüme edilmiştir.
Protokol
1. Mononükleer Hücre İzolasyonu (gün 0)
- Kordon kanı ünitesi% 20 fraksiyonu çıkış portuna dişi luer adaptör başak takın, şırınga takın ve kan çıkarın. 50 ml santrifüj tüpüne ısıtılmış RPMI içinde 20 mL çözülmüş kan aktarın. RPMI 5 mL kordon kan torbası Durulama ve aynı santrifüj tüpüne aktarılır.
- 400 x g hızında 10 dakika için hücreler santrifüjleyin. Süpernatant aspire.
- Sıcak RPMI 20 mL hücreler yeniden süspanse edin. 50 mL santrifüj tüpüne Lymphoprep 15 mL üzerine tabaka hücreleri. 40 dakika @ 400 x g santrifüjleyin.
- Mononükleer hücreler içeren arayüz Harvest ve RPMI 20 mL yıkayın. 10 dakika @ 450 x g santrifüjleyin.
- Süpernatant aspire ve RPMI 20 mL yıkayın. Hücreleri hesaplama ve 5 dakika @ 400 x g dönerler.
- 5 at süpernatant ve tekrar süspansiyon hücreleri aspire x 10 6 mononükleer hücre / Cellgenix DC medya (serum serbest) mL. EBV-LCL nesil için 1 ml çıkarın ve 15 ml ce koymaktüp ntrifuge.
2. Dendritik Hücre Üretimi (Günlük tarihinden itibaren 0)
- Hücrelerin Levha 2 mL başına iyi bir 6-plaka içine (5 x 10 6 hücre / DC medya mL zaten). 1-2 saat için kuvöz bırakın.
- 1-2 saat sonra PBS ile 3-4 kez yıkanarak olmayan yapışık hücrelere yıkayın. Yapışmayan hücreler ve donma toplayın. 2 mL / çukur 1000 U / ml IL-4 ve 800 U / mL GM-CSF içeren DC ortam ekleyin.
- 3-4 gün DC başlandıktan sonra, 100 mcL ekleme / iyi 1000U/mL, IL-4 ve 800 U / mL GM-CSF bir nihai konsantrasyon içeren bir ortam ile, IL-4 ve GM-CSF ile doldurmak.
- Günde 5-6, hasat bir transfer pipet ile iyice kazıma DC üzerinde. 5 dakika @ 400 x g için büyük hücreleri ve santrifüj sayın. 2x10 6 hücre / DC medya mL Aspiratif medya ve tekrar süspansiyon DC. / Iyi bir 24 oyuklu plaka 0.5 mL ekleyin.
- 10 bulaşıcı birimlerinin bir İB başına hücre de Ad5f35pp65 vektörü kullanılarak DC transdüksiyonu. Vecto eklebir 24 oyuklu plaka her bir kuyucuğa r. 1.5 saat boyunca hücreler inkübe edin. 1.5 saat sonra, / kuyu DC ortam ihtiva eden 1.5 mL eklemek: 1000 U / ml IL-4, 800 U / mL GM-CSF, 10 ng / ml TNF-alfa, 1 ug / mL PGE-1, 100 ng / mL ' IL-6, ve 10 ng / ml IL-1beta. Bu sitokinler DC'ler olgunlaşır.
3. EBV-LCL Üretimi (Günlük tarihinden itibaren 0)
- 5 x 10 6 mononükleer hücreleri içeren tüp santrifüjleyin. Konsantre süpernatan EBV B95.8 200 mcL ve tam kültür ortamı 1,8 ml (RPMI +% 10 FBS + 2mM L-glutamin) ihtiva eden siklosporin (1 ug / mL) ekleyin.
- 96-kuyulu plakanın kuyularının 10 ve 5 kuyu içine 200 ul hücre içine kısım 100 mcL. Hücrelerinin sadece 100 mcL içeren kuyulara tam medya + siklosporin 100 mcL ekleyin. Steril su ile kalan kuyuları doldurun.
- LCL haftalık besleme ve yaklaşık 2 hafta sonra, 24-kuyulu plakanın bir 96-kuyucuklu levha uzanır. Bir hafta sonra, T25 şişeye aktarın ve sonraki hafta transfer etmekbir T75 şişesi. Bu aşamada size LCL hacimde dondurmak tavsiye edilir. Genellikle LCL yeterli sayıda üretmek için 1 ay sürer.
4. CTL Initiation - 7 gün DC'lerin başlatılması sonra
- 30 Gy de Hasat DC'ler ve saçmak. 4 x ve sayımı yıkayın. Insan serumu (% 45 RPMI, 45% TIKLAYINIZ sitesi,% 10 insan serumu, 2mM L-glutamin) @ 1 x 10 5 DC'ler / mL. Içeren T hücre medya süspanse DC
- Adım 2.2 yapışmayan hücreler çözülme. Hücreleri yıkayın ve saymak. 2 x 10 6 yapışmayan hücreler / insan serumu içeren T hücre medyada mL süspanse edin. 10 ng / ml IL-7 ve IL-12 ve 5 ng / ml IL-15 ekleyin. 1 hücreleri mL'si başına iyi bir 24 oyuklu plaka ekleyin. Başına iyi DC 1 ml ekleyin. Steril su ile 24-kuyulu plakanın kuyularının boş doldurun.
- 7 gün T hücre başlandıktan sonra, yem ve / veya insan serumu içeren T hücre medya ile hücreleri bölme.
- LCL hazır olana kadar 9-12 gün T hücre başlandıktan sonra, T hücreleri dondurmak.
- OLCL genişletilmiş ve T75 şişeler içinde pasajlanmağa devam edilir nce, 5 dakika @ 400 x g santrifüj için LCL transdüksiyonu. Bir MOI hücre başına 100 enfeksiyöz birim de hücre pelet vektör ekleyin. 1.5 saat boyunca inkübe edin. Sonra 5 x 10 5 LCL / mL tam medyada tekrar süspansiyon ve 24-kuyu plaka başına iyi 2 mL 1.5 saat. 12
- 2 gün sonra, 40 Gy de LCL ve ışın tedavisi hasat. 4 x ve sayımı yıkayın. 2.5 x 10 5 hücre / ml insan serumu içeren T hücre medyada LCL süspanse edin. 1 LCL mL'si başına iyi bir 24 oyuklu plaka ekleyin. Ayrıca, bir Grex40 kültür cihazı için ve aynı zamanda 5 ng / ml IL-15, 5 x 10 6 LCL ekleyin. 13
- T hücreleri Harvest. @ 400 x g'da 5 dakika boyunca santrifüj, süpernatan aspire, ve 1 x 10 6 T hücre / ml insan serumu içeren T-hücresi ortamı içinde tekrar süspansiyon haline getirin. 5 ng / ml IL-15 ilave edin ve 24 oyuklu plaka halinde olan LCL için 1 mL / kuyu T hücreleri (1 x 10 6 T-hücrelerinin toplam) ekleyin. Grex40 olarak getirmek, 30 mL ortam toplam hacmi.
- Hücreler confluent ise günde 3-4 sonrası uyarım üzerine, daha sonra (plaka) 1:1 bunları ayırmak ve 50 U / ml IL-2 ihtiva eden taze ortam ilave edin. Onlar konfluent değilse o zaman sadece ½ medya aspire ve 50 U / ml IL-2 içeren ortam ile değiştirin. Grex40 olarak, yarım ortamı aspire taze bir ortam ile değiştirin ve 50 U / ml IL-2 ilave edin.
- 7. gün, adım 4.6 olarak tekrarlayın ancak IL-15, stimülasyon günü IL-2 kullanılması uygun değildir.
5. Temsilcisi Sonuçlar
GMP uyumlu FDA onaylı imalat protokolü şematik Şekil 1'de gösterilmiştir. Süreci yaklaşık 50 gün sürer. Bununla birlikte, kordon kan virüs-tecrübeli T hücreleri sahip değildir ve bu nedenle birincil saf T hücrelerinin ex vivo gerekir, virüs özel T hücrelerinin önceden mevcut olan bellek T hücrelerinin genişletmek üretme tipik yöntemleri. Bunu yapmak için, IL-12, IL-15, dendritik hücrelerin yanı sıra sitokinler, IL-7 kullanmakViral özgüllük üretmek için gereklidir.
3 uyarımlar sonra, verim 100x10 6 hücreleri üzerinde olmalıdır. Yeterli hücreleri mevcut değil ise CTL'lerin istenilen sayıda mevcut olana kadar ilave uyarımlar gerçekleştirilebilir. Bu hücrelerin çoğu, CD4 karışımı + ve CD8 + T hücreleri ile CD3 + olmalıdır. % 15'den az NK hücreleri (CD3-/CD56 +) ve% 1'den az CD19 + B hücreleri (Şekil 2) olmalıdır.
Genişletilmiş CTL, CMV, adenovirüs, Hexon ve Penton gelen antijen pp65 tanımak yanı sıra, EBV-LCL üzerinde ifade edilir çok sayıda EBV antijen gerekir. Bir ELISPOT deneyi olarak test edildiğinde, bir CTL salgılayan gereken daha fazla IFN-y! Alakasız antijenleri (Şekil 3) daha bu antijenlere yanıt olarak.
CTL de viral peptit ile doldurulan hedefleri gibi PHA patlamaların lyse gerekir. 51 Cr salınım testi olarak, CTL CMVpp65-darbeli ve Adenovirüs, LCL lyse gerekir Hexon-ve /veya hedefler Penton-darbeli ama alakasız peptid (Şekil 4) ile doldurulan hedefleri.
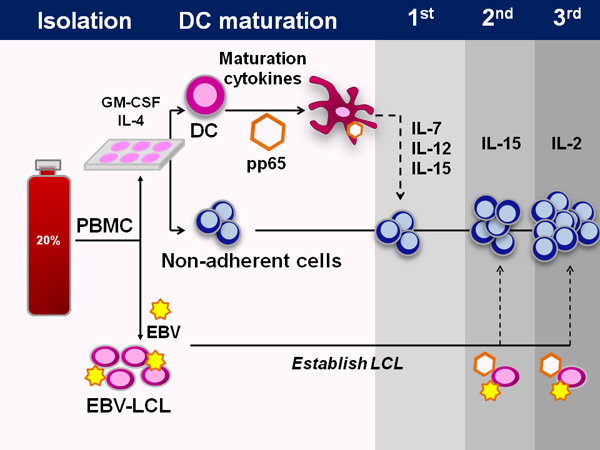
Şekil 1. Kordon kanı çoklu-virüs-spesifik CTL oluşturulması. Kordon kanı CTL üretim tüm süreci gösteren şematik. İlk kordon kanı mononükleer hücrelerinin fraksiyone göbek kordon kanı ünitesi% 20 fraksiyonu izole edilmiştir. LCL üretim için kaydedilmiş 5x10 6 hücre dışında, bütün hücreleri daha sonra yapışmayan hücreler hasat edilir ve dondurulur, bu noktada, 1-2 saat için dendritik hücre ortamı içinde kaplanır. DC DC sonra ortam, IL-4 ve GM-CSF içeren beslenir. Kültürün 5 gün sonra, DC olgunlaşmaya bırakılır ve immünodominant CMV pp65 antijen ihtiva eden bir adenoviral vektör ile transdük. Başlatma anda, bu DC yapışmayan hücreler hem de sitokinler, IL-7, IL-12 ile birleştirilirve IL-15. Daha sonraki uyarımlar anda, aynı adenovirüs vektörü antijen sunan hücreler olarak kullanılır EBV-LCL, transdüksiyonu için kullanılmıştır. IL-15, ikinci uyarma ve IL-2 sonra kullanılır.
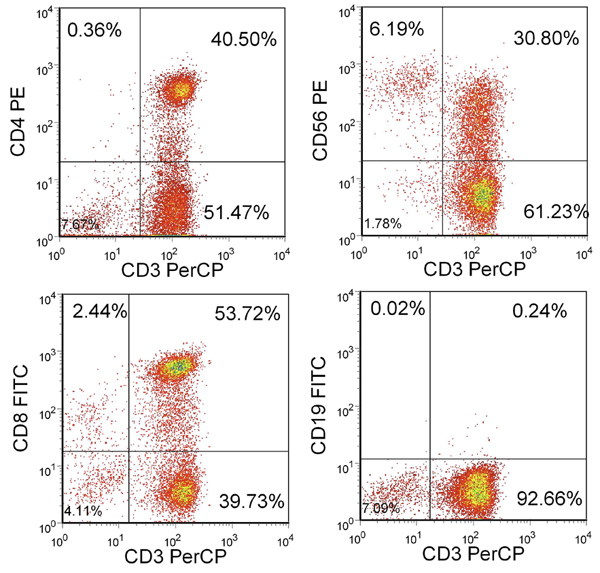
Şekil 2.. T hücrelerinin ve sonuçta oluşan Fenotip. Gösterilen lenfosit kapısı dahil canlı hücrelerin yüzdesi. CTL CD3 + ve CD4 + veya CD8 + ama büyük ölçüde CD3-/CD56- ve olan CD19-.
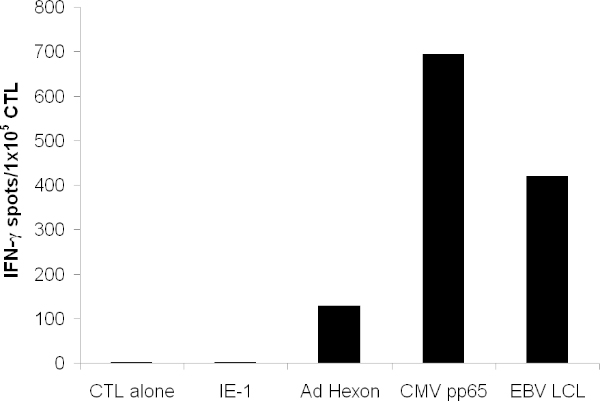
Şekil 3. T hücre işlevselliği. T-hücresi özgüllük IFN-γELISPOT ile test edildi. T-hücreleri çakışan peptitler Hexon, Penton, pp65, tüm protein kapsayan ile doldurulan ve ilgisiz antijen IE-1 edildi. Yalnız CTL başına ortam gösterir. Otolog LCL ışınlanmış ve 1x10 5 / kuyu da eklendi. Gösterilen hücresi c oluşturan ortalama noktanüsha kuyu ount.
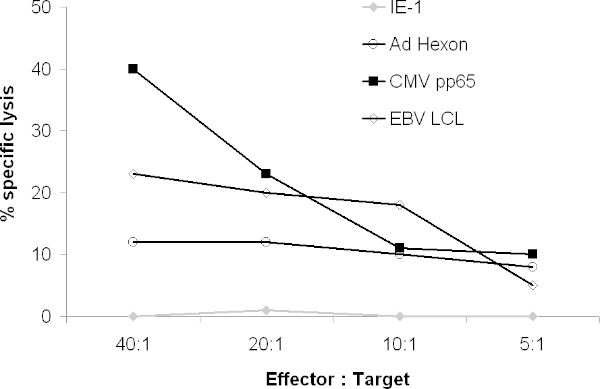
Şekil 4. KVK sitotoksik aktivitesini. Viral antijenleri eksprese eden hedef lyse çıkan CTL bir yeteneklerini 51 Cr analizi ile test edildi. 51 Cr-etiketli otolog PHA blast çakışan peptitler tüm antijen ya da 51 LCL CTL ile kültüre edildi otolog Krom-etiketli kapsayan ile doldurulmuşlardır. 4 saat sonra, gama serbest bir gama sayacı üzerinde sayılmıştır.
Tartışmalar
TCMB sonra viral enfeksiyonlar kontrol altına almayı amaçlayan güncel yaklaşımlar etkili olabilir, ancak önemli toksisiteleri ile ilişkili, pahalıdır ve daha sonra enfeksiyona karşı uzun süreli koruma kazandırmaz. Aslında, bazı antiviral ilaçların kullanımı başka koruyucu olacağı virüs-spesifik T hücrelerin genişlemesini sınırlayan olabilir. 14. Başka bir seçenek donör kaynaklı virüs özel T-hücrelerinin bir infüzyon. Biz ve diğerleri gibi T hücreleri İşte, güvenl...
Açıklamalar
Yazarlar ifşa etmek başka bir şey var.
Teşekkürler
Bu çalışma Dan L. Duncan işbirlikçi araştırma bursu (SPK ve EJS), Ulusal Kalp, Akciğer ve Kan Enstitüsü (US4HL081007), bir Lösemi ve Lenfoma Derneği Klinik Araştırmacı Ödülü (SPK) ve Ulusal Kanser Enstitüsü tarafından desteklenen (RO1 CA06150816; EJS).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | |
| RPMI 1640 | Invitrogen | 21870-076 | |
| DC medya | CellGenix | 20801-0500 | |
| EHAA (tıklayın kullanıcısının Orta) | Irvine Scientific | 9195 | |
| İnsan Serum | İkizler Bio Ürünler | 100-110 | |
| Gaz geçirgen Cultureware 18 | Wilson-Wolf | 80040S | |
| IL-2 | Chiron (TCH Eczane) | ||
| IL-12 | NCI / CTEP | ||
| IL-15 | CellGenix | 1013-050 | |
| IL-7, | Ar-Ge | AFL207 | |
| IL-1beta | Ar-Ge | AFL201 | |
| IL-6, | HücreGenix | 1004-050 | |
| GM-CSF | TCH Eczane | ||
| IL-4, | Ar-Ge | AFL204 | |
| TNF-alfa | Ar-Ge | AFL210 | |
| Ad5f35pp65 | BCM CAGT Vektör Üretim Tesisi | ||
| Plazma transferi dişi luer adaptör seti | Charter Tıp | 89-550-66j | |
| Lymphoprep | Nycomed | 1114550 |
Referanslar
- Kennedy-Nasser, A. A. Comparable outcome of alternative donor and matched sibling donor hematopoietic stem cell transplant for children with acute lymphoblastic leukemia in first or second remission using alemtuzumab in a myeloablative conditioning regimen. Biol. Blood Marrow Transplant. 14, 1245-1245 (2008).
- Hanley, P. J. Improving clinical outcomes using adoptively transferred immune cells from umbilical cord blood. Cytotherapy. 12, 713 (2010).
- Szabolcs, P., Cairo, M. S. Unrelated umbilical cord blood transplantation and immune reconstitution. Semin. Hematol. 47, 22 (2010).
- Canto, E., Rodriguez-Sanchez, J. L., Vidal, S. Distinctive response of naive lymphocytes from cord blood to primary activation via TCR. J. Leukoc. Biol. 74, 998-998 (2003).
- Leen, A. M. Monoculture-derived T lymphocytes specific for multiple viruses expand and produce clinically relevant effects in immunocompromised individuals. Nat. Med. 12, 1160-1160 (2006).
- Riddell, S. R. Restoration of viral immunity in immunodeficient humans by the adoptive transfer of T cell clones. Science. 257, 238 (1992).
- O'Reilly, R. J. Adoptive transfer of antigen-specific T-cells of donor type for immunotherapy of viral infections following allogeneic hematopoietic cell transplants. Immunol. Res. 38, 237-237 (2007).
- Peggs, K. S. Adoptive cellular therapy for early cytomegalovirus infection after allogeneic stem-cell transplantation with virus-specific T-cell lines. Lancet. 362, 1375-1375 (2003).
- Sili, U. Large-scale expansion of dendritic cell-primed polyclonal human cytotoxic T-lymphocyte lines using lymphoblastoid cell lines for adoptive immunotherapy. J. Immunother. 26, 241 (2003).
- Bollard, C. M. Good manufacturing practice-grade cytotoxic T lymphocytes specific for latent membrane proteins (LMP)-1 and LMP2 for patients with Epstein-Barr virus-associated lymphoma. Cytotherapy. 13, 518 (2011).
- Hanley, P. J. Functionally active virus-specific T cells that target CMV, adenovirus, and EBV can be expanded from naive T-cell populations in cord blood and will target a range of viral epitopes. Blood. 114, 1958 (1958).
- Hanley, P. J. Expansion of T cells targeting multiple antigens of cytomegalovirus, Epstein-Barr virus and adenovirus to provide broad antiviral specificity after stem cell transplantation. Cytotherapy. , (2011).
- Gerdemann, U. Generation of Multivirus-specific T Cells to Prevent/treat Viral Infections after Allogeneic Hematopoietic Stem Cell Transplant. J. Vis. Exp. (51), e2736 (2011).
- Mori, T., Kato, J. Cytomegalovirus infection/disease after hematopoietic stem cell transplantation. Int. J. Hematol. 91, 588 (2010).
- Einsele, H. Infusion of cytomegalovirus (CMV)-specific T cells for the treatment of CMV infection not responding to antiviral chemotherapy. Blood. 99, 3916 (2002).
- Bao, L. Expansion of cytomegalovirus pp65 and IE-1 specific cytotoxic T lymphocytes for cytomegalovirus-specific immunotherapy following allogeneic stem cell transplantation. Biol. Blood Marrow Transplant. 14, 1156 (2008).
- Shpall, E. J., Bollard, C. M., Brunstein, C. Novel cord blood transplant therapies. Biol. Blood Marrow Transplant. 17, S39-S45 (2011).
- Vera, J. F. Accelerated production of antigen-specific T cells for preclinical and clinical applications using gas-permeable rapid expansion cultureware (G-Rex. J. Immunother. 33, 305 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır