È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Espansione linfociti T citotossici da sangue del cordone ombelicale che Target Citomegalovirus, virus di Epstein-Barr virus, e Adenovirus
In questo articolo
Riepilogo
Qui si descrive la prima pratica di fabbricazione (GMP) conforme metodo per produrre virus-specifici linfociti T citotossici (CTL) da sangue del cordone ombelicale, fonte di cellule T prevalentemente ingenuo.
Abstract
Infezione da virus dopo il trapianto di cellule staminali sono tra le cause più comuni di morte, specialmente dopo sangue cordonale (CB) trapianto (CBT) in cui l'organismo di certificazione non contiene numeri notevoli di virus-esperti cellule T in grado di proteggere il destinatario dalle infezioni 1. - 4 Noi e altri hanno dimostrato che virus specifica CTL generati da donatori sieropositivi e infuso al destinatario sono sicuri e protettivi. 5-8 Tuttavia, fino a poco tempo, virus-specifiche cellule T non può essere generato dal sangue del cordone ombelicale, probabilmente a causa del assenza di celle di memoria virus-T specifiche.
Nel tentativo di imitare il meglio in condizioni di innesco in vivo di cellule T naive, abbiamo stabilito un metodo utilizzato CB derivate da cellule dendritiche (DC) trasdotte con un vettore adenovirale (Ad5f35pp65) contenente l'antigene immunodominante CMV pp65, quindi guidare specificità delle cellule T verso CMV e adenovirus. 9 Alla iniziazione, usiamo queste macchineDCs strutturati come anche cellule T CB-derivato in presenza delle citochine IL-7, IL-12 e IL-15. 10 Alla stimolazione secondo abbiamo usato EBV-trasformate cellule B, o EBV-LCL, che esprimono sia latente e litiche antigeni EBV. Ad5f35pp65-trasdotte EBV-LCL sono usati per stimolare le cellule T in presenza di IL-15 alla seconda stimolazione. Stimoli successivi utilizzano Ad5f35pp65-trasdotte EBV-LCL e IL-2.
Da 50x10 6 cellule mononucleate CB siamo in grado di generare l'alto di 150 x 10 6 cellule T virus-specifici che lisare antigene-pulsate obiettivi e citochine rilascio in risposta alla stimolazione antigenica. 11 Queste cellule sono state prodotte in un modo conforme GMP utilizzando solo la frazione al 20% di una unità di sangue del cordone frazionato e tradotti per l'uso clinico.
Protocollo
1. Cella di isolamento mononucleare (giorno 0)
- Inserire spike di luer femmina nella porta di uscita della frazione 20% della unità di sangue cordonale, collegare la siringa e rimuovere il sangue. Trasferimento sangue scongelati a 20 ml di RPMI riscaldato in tubo da 50 ml per centrifuga. Risciacquare sangue borsa dei cavi con 5 ml di RPMI e trasferire al tubo da centrifuga stessa.
- Centrifugare le cellule per 10 minuti a 400 x g. Aspirare il surnatante.
- Risospendere le cellule in 20 ml di RPMI caldo. Cellule strato su 15 ml di Lymphoprep in tubo da 50 ml per centrifuga. Centrifugare 40 minuti a 400 x g.
- Raccogliere l'interfaccia contenente le cellule mononucleari e lavare in 20 ml di RPMI. Centrifugare per 10 minuti a 450 x g.
- Aspirare il surnatante e lavare in 20 ml di RPMI. Contare le celle e girare per 5 minuti a 400 x g.
- Aspirare il surnatante e risospendere le cellule a 5 x 10 6 cellule mononucleate / mL di Cellgenix DC media (privo di siero). Togliere 1 mL per EBV-LCL generazione e mettere in 15 mL centrifuge tubo.
2. Cellule dendritiche Generation (a partire dal giorno 0)
- Piastra 2 ml di cellule (sono già a 5 x 10 6 cellule / ml di DC media) per pozzetto in una piastra da 6 pozzetti. Lasciare in incubatore per 1-2 ore.
- Dopo 1-2 ore, lavare le cellule non aderenti mediante lavaggio 3-4 volte con PBS. Raccogliere le cellule non aderenti e congelare. Aggiungere 2 mL / pozzetto di supporti contenenti CC 1000 U / ml di IL-4 e 800 U / ml di GM-CSF.
- 3-4 giorni dopo DC iniziazione, rifornire di IL-4 e GM-CSF aggiungendo 100 pl / pozzetto di supporti contenenti una concentrazione finale di 1000U/mL IL-4 e 800 U / ml di GM-CSF.
- Il giorno 5-6, raccolto la DC raschiando il bene con una pipetta di trasferimento. Contare le cellule grandi e centrifugare per 5 minuti a 400 x g. Aspirare media e risospendere CC a 2x10 6 cellule / ml di DC media. Aggiungere 0,5 ml / pozzetto di una piastra a 24 pozzetti.
- Trasdurre la DC con il Ad5f35pp65 vettore in una cella per MOI di 10 unità infettive. Aggiungi vector a ciascun pozzetto in una piastra da 24 pozzetti. Incubare le cellule per 1,5 ore. Dopo 1,5 ore, aggiungere 1,5 mL / pozzetto di DC supporto contenente: 1000 U / ml di IL-4, 800 U / ml di GM-CSF, 10 ng / mL TNF-alfa, 1 pg / mL PGE-1, 100 ng / mL IL-6, e 10 ng / ml di IL-1beta. Queste citochine maturare i controller di dominio.
3. Generazione di EBV-LCL (a partire dal giorno 0)
- Centrifugare la provetta contenente le x 5 10 6 cellule mononucleate. Aggiungere 200 ml di concentrato EBV B95.8 surnatante e 1,8 ml di mezzo completo (RPMI + 10% FBS + 2 mM L-glutammina) contenente ciclosporina (1 pg / mL).
- Aliquotare 100 ml di cellule in 10 pozzetti di una piastra a 96 pozzetti e 200 pl in 5 pozzetti. Aggiungere 100 ml di mezzi completi ciclosporina + ai pozzetti contenenti solo 100 ml di cellule. Riempire i pozzetti rimanenti con acqua sterile.
- Alimentare il settimanale LCL ed espandere da una piastra a 96 pozzetti a un 24-pozzetti dopo ~ 2 settimane. Dopo un'altra settimana, trasferire in un matraccio T25 ed il trasferimento settimana successivauna beuta T75. In questa fase si consiglia di congelare aliquote di LCL. Si richiede in genere 1 mese a generare un numero sufficiente di LCL.
4. CTL Initiation - 7 giorni dopo l'inizio delle DC
- DC Harvest e irradiano a 30 Gy. Lavare 4 x e il conteggio. Risospendere DC in mezzi cellule T contenenti siero umano (45% RPMI, 45% CLICK, il 10% di siero umano, 2 mM L-glutammina) @ 1 x 10 5 cellule dendritiche / mL.
- Scongelare le cellule non aderenti a partire dal punto 2.2. Lavare le cellule, e contare. Risospendere a 2 x 10 6 cellule non aderenti / ml in mezzi cellule T contenenti siero umano. Aggiungere 10 ng / ml di IL-7 e IL-12, e 5 ng / ml di IL-15. Aggiungere 1 ml di cellule per pozzetto in una piastra da 24 pozzetti. Aggiungere 1 ml di DC per pozzetto. Riempire i pozzetti vuoti di 24 pozzetti con acqua sterile.
- 7 giorni dopo l'inizio delle cellule T, mangimi e / o dividere le celle con i media delle cellule T contenenti siero umano.
- 9-12 giorni dopo l'inizio delle cellule T, congelare le cellule T fino a quando il LCL sono pronti.
- Once LCL si sono ampliati e sono diversi passaggi in fiasche T75, trasdurre l'LCL mediante centrifugazione per 5 minuti a 400 x g. Aggiungere il vettore al pellet cellulare ad una MOI di 100 unità infettive per cellula. Incubare per 1,5 ore. Dopo 1,5 ore, risospendere in mezzi completi a 5 x 10 5 LCL / ml e aggiungere 2 ml per pozzetto in una piastra a 24 pozzetti 12.
- Dopo 2 giorni, raccogliere il LCL e irradiano a 40 Gy. Lavare 4 x e il conteggio. Risospendere il LCL in mezzi cellule T contenenti siero umano a 2,5 x 10 5 cellule / ml. Aggiungere 1 ml di LCL per pozzetto di una piastra a 24 pozzetti. Inoltre, aggiungere 5 x 10 6 LCL ad un dispositivo di coltura Grex40 e 5 ng / ml di IL-15. 13
- Raccogliere le cellule T. Centrifugare per 5 minuti a 400 xg, aspirare il surnatante, risospendere in mezzi e cellule T contenenti siero umano a 1 x 10 6 cellule T / mL. Aggiungere 5 ng / ml di IL-15 e di aggiungere 1 ml / pozzetto di cellule T (totale di 1 x 10 6 cellule T) al LCL che sono già in 24-pozzetti. Nel Grex40, portareil volume totale del supporto fino a 30 mL.
- Il giorno 3-4 post-stimolazione, se le cellule confluenti sono poi divisi (nel piatto) 1:1 e aggiungere mezzo fresco contenente 50 U / ml IL-2. Se non sono confluenti poi semplicemente aspirare ½ media e sostituirlo con supporti contenenti 50 U / mL di IL-2. Nel Grex40, aspirare la metà dei mezzi di comunicazione, sostituire con mezzi freschi, e aggiungere 50 U / mL di IL-2.
- Il giorno 7, ripetere come nel passo 4,6 ma utilizzare IL-2 nel giorno della stimolazione non, IL-15.
5. Risultati rappresentativi
Uno schema del GMP approvato dalla FDA protocollo di fabbricazione è rappresentato in figura 1. Il processo dura circa 50 giorni. Metodi tipici di generazione di virus-specifiche cellule T espandere preesistenti cellule T di memoria, tuttavia, il sangue del cordone non ha virus esperti cellule T, e quindi abbiamo bisogno di prime ingenuo T cellule ex vivo. Per fare ciò, usiamo cellule dendritiche e le citochine IL-7, IL-12 e IL-15,necessaria per generare specificità virale.
Dopo 3 stimolazioni, il rendimento deve essere superiore a 100x10 6 celle. Se le cellule non siano disponibili sufficienti, stimolazioni supplementari possono essere eseguite fino a quando il numero desiderato di CTL sono disponibili. La maggior parte di queste cellule dovrebbe essere CD3 + con una miscela di CD4 + e CD8 + T cellule. Ci dovrebbe essere inferiore a 15% delle cellule NK (CD3-/CD56 +) e meno di 1% di cellule B CD19 + (Figura 2).
Il CTL estesa dovrebbe riconoscere l'antigene pp65 da CMV, hexon e Penton da adenovirus, nonché numerosi antigeni EBV che sono espressi sulla EBV-LCL. Quando la prova è in un saggio ELISPOT, CTL dovrebbe secernere più IFN-? in risposta a questi antigeni di antigeni irrilevanti (Figura 3).
Il CTL dovrebbe anche lisare virali peptide-pulsati tali obiettivi blasti PHA. In un saggio di rilascio Cr 51, CTL dovrebbe lisare LCL, CMVpp65-pulsato e Adenovirus esone-e /o Penton-pulsato obiettivi, ma non obiettivi pulsate con peptidi irrilevanti (Figura 4).
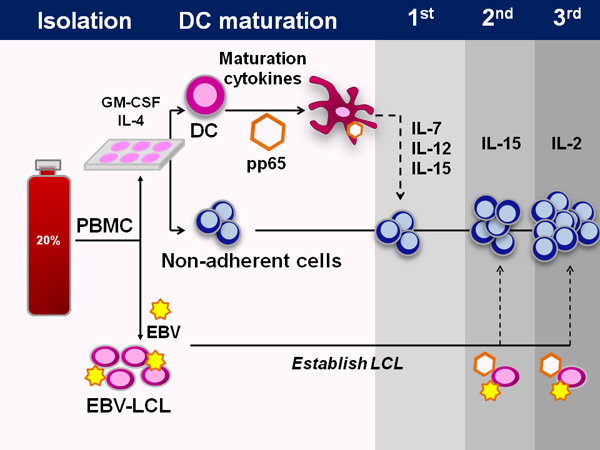
Figura 1. Generazione di multi-virus CTL specifici dal cordone ombelicale. Schematico che mostra l'intero processo di fabbricazione CTL da cordone ombelicale. Prima le cellule mononucleate del sangue del cordone sono isolati dalla frazione 20% della frazionato unità di sangue del cordone ombelicale. Con l'eccezione di 5x10 6 cellule salvate per generazione LCL, tutte le cellule vengono quindi piastrate in mezzi cellule dendritiche per 1-2 ore, a questo punto le cellule non aderenti sono raccolte e congelate. La DC vengono poi alimentati DC supporti contenenti IL-4 e GM-CSF. Dopo 5 giorni di coltura, la DC sono maturato e trasdotte con un vettore adenovirale contenente l'antigene immunodominante CMV pp65. All'iniziazione DC questi sono combinati con le cellule non aderenti e le citochine IL-7, IL-12,e IL-15. A stimolazioni successive, lo stesso vettore adenovirale viene utilizzato per trasdurre EBV-LCL, che sono utilizzati come le cellule presentanti l'antigene. IL-15 viene utilizzato al secondo stimolazione e IL-2 in seguito.
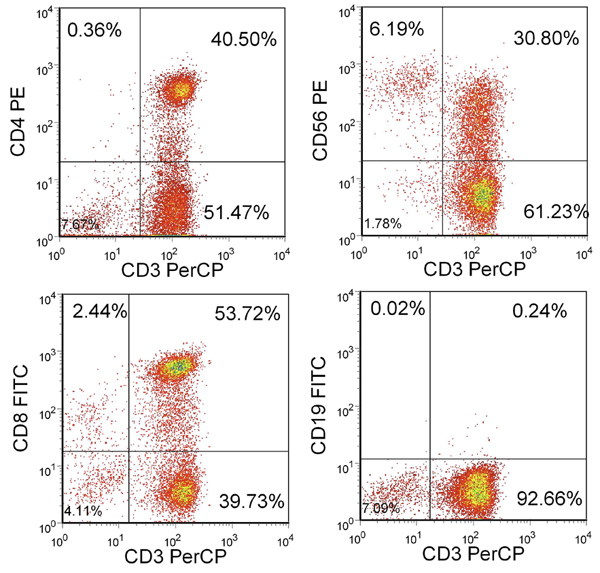
Figura 2. Fenotipo delle cellule T risultante. Mostrata è la percentuale di cellule vive inclusi nel gate linfocitario. CTL sono CD3 + e CD4 + e CD8 +, ma in gran parte CD3-/CD56- e CD19-.
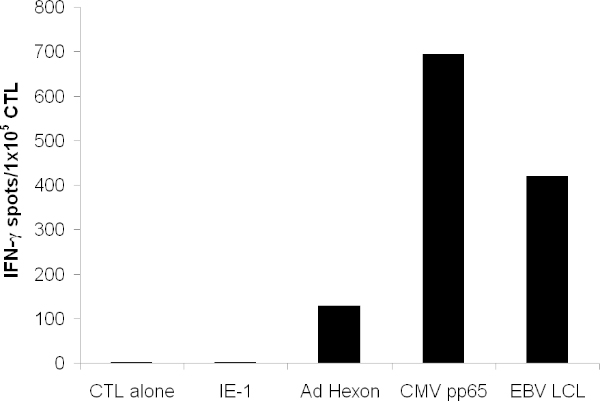
Figura 3. Funzionalità delle cellule T. Specificità delle cellule T è stato testato da IFN-γELISPOT. Le cellule T sono state pulsate con peptidi sovrapposti copre l'intera proteina di hexon, Penton, pp65, e l'antigene irrilevante IE-1. CTL da solo indica un mezzo solo. Autologo LCL sono stati irradiati e ha aggiunto a 1x10 5 / bene. Viene mostrato il punto medio di formazione delle cellule cim porto di pozzetti in triplicato.
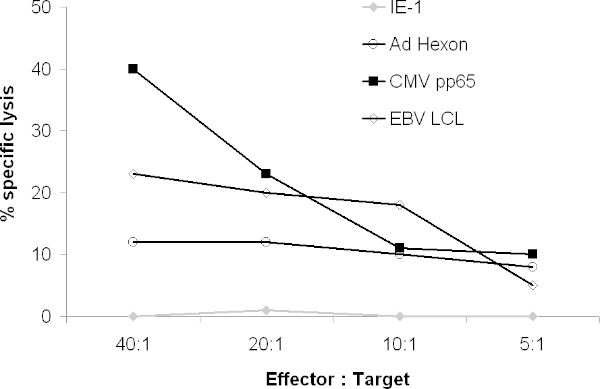
Figura 4. Attività citolitica dei CTL. La capacità del CTL risultante per lisare bersagli esprimenti antigeni virali è stato testato in un saggio di 51 Cr. 51 Cr-etichettati blasti autologhe PHA sono state pulsate con peptidi sovrapposti copre l'intera o antigene marcato con 51 Cr LCL autologhe sono stati co-coltivate con CTL. Dopo 4 ore, gamma di rilascio è stato contato in un contatore gamma.
Discussione
Attuali strategie volte a controllare le infezioni virali dopo CBT può essere efficace, ma sono associati a tossicità significative, sono costosi, e non conferiscono protezione a lungo termine contro l'infezione in seguito. In effetti, l'uso di alcuni farmaci antivirali possono limitare l'espansione del virus-specifiche cellule T che altrimenti sarebbero protettivo. 14 Un'altra opzione è l'infusione di donatore-derivati virus-cellule T specifiche. Noi e altri hanno dimostrat...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da un L. Dan Duncan collaborativa assegno di ricerca (CMB e EJS), il National Heart, Lung, and Blood Institute (US4HL081007), un Leukemia and Lymphoma Society Clinical Research Scholar premio (CMB), e il National Cancer Institute (RO1 CA06150816; EJS).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | |
| RPMI 1640 | Invitrogen | 21870-076 | |
| DC supporti | CellGenix | 20801-0500 | |
| EHAA (Medium Click di) | Irvine Scientific | 9195 | |
| Siero umano | Gemini Bio Prodotti | 100-110 | |
| Gas Permeabile Cultureware 18 | Wilson-Wolf | 80040S | |
| IL-2 | Chirone (TCH Farmacia) | ||
| IL-12 | NCI / CTEP | ||
| IL-15 | CellGenix | 1013-050 | |
| IL-7 | R & S | AFL207 | |
| IL-1beta | R & S | AFL201 | |
| IL-6 | CellaGenix | 1004-050 | |
| GM-CSF | TCH Farmacia | ||
| IL-4 | R & S | AFL204 | |
| TNF-alfa | R & S | AFL210 | |
| Ad5f35pp65 | BCM CAGT Vector Production Facility | ||
| Trasferimento al plasma con adattatore femmina luer | Carta Medical | 89-550-66J | |
| Lymphoprep | Nycomed | 1114550 |
Riferimenti
- Kennedy-Nasser, A. A. Comparable outcome of alternative donor and matched sibling donor hematopoietic stem cell transplant for children with acute lymphoblastic leukemia in first or second remission using alemtuzumab in a myeloablative conditioning regimen. Biol. Blood Marrow Transplant. 14, 1245-1245 (2008).
- Hanley, P. J. Improving clinical outcomes using adoptively transferred immune cells from umbilical cord blood. Cytotherapy. 12, 713 (2010).
- Szabolcs, P., Cairo, M. S. Unrelated umbilical cord blood transplantation and immune reconstitution. Semin. Hematol. 47, 22 (2010).
- Canto, E., Rodriguez-Sanchez, J. L., Vidal, S. Distinctive response of naive lymphocytes from cord blood to primary activation via TCR. J. Leukoc. Biol. 74, 998-998 (2003).
- Leen, A. M. Monoculture-derived T lymphocytes specific for multiple viruses expand and produce clinically relevant effects in immunocompromised individuals. Nat. Med. 12, 1160-1160 (2006).
- Riddell, S. R. Restoration of viral immunity in immunodeficient humans by the adoptive transfer of T cell clones. Science. 257, 238 (1992).
- O'Reilly, R. J. Adoptive transfer of antigen-specific T-cells of donor type for immunotherapy of viral infections following allogeneic hematopoietic cell transplants. Immunol. Res. 38, 237-237 (2007).
- Peggs, K. S. Adoptive cellular therapy for early cytomegalovirus infection after allogeneic stem-cell transplantation with virus-specific T-cell lines. Lancet. 362, 1375-1375 (2003).
- Sili, U. Large-scale expansion of dendritic cell-primed polyclonal human cytotoxic T-lymphocyte lines using lymphoblastoid cell lines for adoptive immunotherapy. J. Immunother. 26, 241 (2003).
- Bollard, C. M. Good manufacturing practice-grade cytotoxic T lymphocytes specific for latent membrane proteins (LMP)-1 and LMP2 for patients with Epstein-Barr virus-associated lymphoma. Cytotherapy. 13, 518 (2011).
- Hanley, P. J. Functionally active virus-specific T cells that target CMV, adenovirus, and EBV can be expanded from naive T-cell populations in cord blood and will target a range of viral epitopes. Blood. 114, 1958 (1958).
- Hanley, P. J. Expansion of T cells targeting multiple antigens of cytomegalovirus, Epstein-Barr virus and adenovirus to provide broad antiviral specificity after stem cell transplantation. Cytotherapy. , (2011).
- Gerdemann, U. Generation of Multivirus-specific T Cells to Prevent/treat Viral Infections after Allogeneic Hematopoietic Stem Cell Transplant. J. Vis. Exp. (51), e2736 (2011).
- Mori, T., Kato, J. Cytomegalovirus infection/disease after hematopoietic stem cell transplantation. Int. J. Hematol. 91, 588 (2010).
- Einsele, H. Infusion of cytomegalovirus (CMV)-specific T cells for the treatment of CMV infection not responding to antiviral chemotherapy. Blood. 99, 3916 (2002).
- Bao, L. Expansion of cytomegalovirus pp65 and IE-1 specific cytotoxic T lymphocytes for cytomegalovirus-specific immunotherapy following allogeneic stem cell transplantation. Biol. Blood Marrow Transplant. 14, 1156 (2008).
- Shpall, E. J., Bollard, C. M., Brunstein, C. Novel cord blood transplant therapies. Biol. Blood Marrow Transplant. 17, S39-S45 (2011).
- Vera, J. F. Accelerated production of antigen-specific T cells for preclinical and clinical applications using gas-permeable rapid expansion cultureware (G-Rex. J. Immunother. 33, 305 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon