Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Sıçan Karaciğer Hücreleri İzolasyon ve İlköğretim Kültür
Özet
İlköğretim hepatositler bir fizyolojik ilgili deneysel sistem biyokimyasal, moleküler ve metabolik fonksiyonlarını değerlendirmek için değerli bir araç sağlar. Biz sürekli to1.0 × 10 kadar yaşayabilir hepatositler üretir yerinde karaciğer perfüzyon, sıçan için güvenilir bir protokol tarif 8 hücreler.
Özet
İlköğretim hepatosit kültürü yaygın karaciğer fonksiyonu, hastalık, patofizyolojisi, farmakoloji ve diğer ilgili konularda temel araştırmalarda kullanılan bir araçtır. Sağlam hepatosit izolasyonu için iki adım kollajenaz perfüzyon dayanan yöntemi ilk kez 1969 1 Berry ve Friend tarafından tanıtıldı ve o zamandan beri birçok değişiklikler geçirmiştir. En sık kullanılan teknik Seglenin 1976 2 tarafından tanımlanmıştır. Esasen, hepatositlerde portal ven yoluyla olmayan bir recirculating kollajenaz perfüzyon ile anestezi yetişkin sıçan ayrışmış bulunmaktadır. İzole hücreleri daha sonra, bir 100 mikron gözenek boyutu örgü naylon filtre aracılığıyla süzülmüş ve plakalar üzerinde kültürlenmiştir. 4-saatlik kültür sonra, orta kültürüne ek süre için serum içeren ya da serum içermeyen aracı madde, örneğin HepatoZYME-SFM ile değiştirilir. Bu prosedürler iyi metin ile daha çok video gösterdiği edilebilir cerrahi ve steril kültür adımları gerektirir. Here, biz çok sayıda canlı hepatositlerin nesil sürekli izin video ve yazılı bir protokol, her iki tarafından bu işlemler için ayrıntılı adımlar belgelemek.
Protokol
1. Hazırlık
Tüm tamponları taze steril teknik kullanılarak hazırlanmıştır ve bir Corning 0.22 mikron filtre kullanılarak sterilize filtresi.
- Hank Dengeli Tuz Çözeltisi için aşağıdaki ekleyerek Ben tampon Perfüzyon hazırlayın (HBSS, Ca 2 olmadan + ve Mg 2 +, bkz. Tablo 1): 25 0.5 mM ve HEPES 0,9 mM EDTA için Mg 2 + (MgCl2) mM.
- (HBSS için aşağıdaki ekleyerek Perfüzyon tampon II hazırlayın Ca 2 + ve Mg 2 +, 25 mM HEPES: Tablo 1) bakın.
- Perfüzyon tampon II artı collagenaseII hazırlayın: kollajenaz II (1000 U) 300 ml Perfüzyon tampon II ile çözülür ve perfüzyon önce su banyosunda çözüm sıcak tutun. Kollajenaz II aktivite süresi olan azalma nedeniyle, bu çözelti 30 dakika içinde kullanılmalıdır.
- William komple Orta hazırlayın: Aşağıdaki ekle; insülin ile 100 nM, dekzametazon, 100 nM, penisilin 100 IU / ml streptomisin ve ila 100 mg / ml 'ye L-glutamin 2 mM, fetal bovin serumu (FBS)% 5 ila için: Williams' Orta E.
- Bunlar, tamponlar 42 az su banyosunda 30 dakika boyunca ısıtılmış edilmelidir ° C, 37 kanülün bir çıkış sıcaklığı tekabül eden en uygun ° C.
2. Karaciğer İzolasyon için Rat Perfüzyon
- Perfüzyon sistemi pompa, otoklavlanabilir silastik tüp ve su banyosu (bkz. Şekil 1) oluşur. 10 ml / dak perfüzyon peristaltik pompa önceden ayarlanabilir debi.
- Intraperitoneal (ip) ketamin (87 mg / kg vücut ağırlığı) artı Xylazine (13 mg / kg) ile bir yetişkin sıçan (300 g vücut ağırlığı) uyuşturmak. Anestezi derinliği ayak tutam tarafından takip edilmelidir. Rat artık zararlı uyaran tepki verdiğinde, karın saç ve hazırlık betadin ve etanol ile karın tıraş. Ensizyon yoluyla girin.
- Ortaya çıkarmakdikkatli karın boşluğunun sağ dış organları hareket ve hepatik portal ven (bkz. Şekil 1) içine 18-gauge angiocath eklemek tarafından hepatik portal ven.
- Iğne perfüzat boru bağlayın ve önceden ısıtılmış (37 ° C) Perfüzyon Tampon ben düşük bir akış hızı (10 ml / dak) in situ olarak infüzyon başlatabilir.
- Düzgün bir şekilde gerçekleştirildiği takdirde, karaciğer anında mazur başlamalıdır. Başarılı kateterizasyonu onaylandıktan sonra, inferior vena kava (IVC) bir kesim efflux (Şekil 1) izin olun. Başarılı kateterizasyonu için bir başka test IVC üzerine steril bez ile hafif bir basınç uygulayarak yapılabilir; karaciğerin tüm loblar hızla şişmeye başlaması gerekir.
- 25 ml / dak akış hızını artırmak. Karaciğer rengi soluk haline gelmelidir.
- Ek bir 6 dakika için akış kesinti olmaksızın Perfüzyon tampon II artı kollajenaz II perfüzyon çözüm açın.
- Periyodik (sindirim sırasında 5-10 kez) 5 saniye aralıklarla için IVC için bez ile basınç uygulayın. Karaciğer da toplam sindirim süresini azaltmak, ve nihai verimi artırarak, gelişmiş karaciğer hücre ayrışma yol şişer.
- Kollajenaz perfüzyon sonra, karaciğer Duygusal aramaya başlamalıdır. 20 ml William tam medyum ile bir pre-soğutulmuş steril bir behere karaciğer içermeyen, yerinde incelemek ve sonra da doku kültürü hücre ardına al.
3. Hepatosit Hücre İzolasyon
- Hücre kültürü kaput içinde, nazikçe steril bir petri içinde William komple Orta içine hücreleri dağıtmak için bir hücre kazıyıcı kullanın.
- Bağ dokusu ve sindirilmemiş doku parçaları ortadan kaldırmak için bir 50 ml Konik tüpü içine, bir 100 mikron gözenek büyüklüğü hücre süzgecinden hücre dispersiyon filtre.
- 4 ° C'de 3 dakika süreyle 50 x g'de 40 ml William tam medyum ve santrifüj hücreleri askıya
- Süpernatant aspire, veyavaşça hücreleri yıkamak için 40 ml soğuk William'ın tam Orta hücrelerin yeniden askıya. Santrifüj tekrarlayın.
- Süpernatant aspire ve yavaşça 25 ml William'ın tam Orta ile tekrar askıya hücreler. Tüpe PBS içinde 25 ml% 90 Percoll çözüm ekleyin ve hafifçe karıştırın.
- 4 ° C'de 10 dakika süreyle 200 x g'de santrifüje Canlı hücreler Percoll degrade altında kalacaktır, çünkü degrade üstünden ölü hücreleri aspire.
- 30 ml ılık William'ın tam Orta hücre pelet Askıya ve sonra santrifüj tekrarlayın ve 20 ml sıcak William'ın tam Ortamda hücre pelletini yeniden askıya.
- Bir hemasitometre kullanarak hücre süspansiyonu içindeki hücreleri saymak ve Tripan mavisi ile hücre canlılığı belirler.
4. Hepatosit Kültür
- Tercih edilen konsantrasyon sıcak William komple Orta hücreleri seyreltilir, örneğin 2.5 x 10 5 hücre / ml. Hücre kültürü plakalar üzerinde istenilen hacimde Tabak hücreler, örneğin. 5 x 10 5 hücre / 2 ml / kuyu, 6 kuyu / plaka; veya 2.5 iyi x 10 5 hücre / 1,5 ml /, 12 kuyu / plakası. Un kaplı plaka karaciğer hücre kültürleri için uygundur.
- Hepatositler tam hücre boyutu büyüyecek ve son bir izdiham elde etmek için yeterli alan sağlarken>% 85 canlı hücreler ile tipik bir hazırlık olarak, hücre yoğunluğu hücre-hücre teması sağlayan yaklaşık% 60-70 izdiham, ulaşmalıdır % 90-95.
- İyi bir merkezi bölgeye toplamak için hücreler için eğilimi en aza indirmek için, başka bir deyişle, hepatositlerin eşit bir tek tabaka oluşturmak üzere (hücre inkübatöründe bir hava akımı içinde nedeniyle büyük olasılıkla), plakaları içinde kalmasına izin Bir kuluçka koymadan önce 30 dakika boyunca hücre kültürü kaput.
- Kültür 37 hücreleri% 95 hava ve% 5 CO2 ile nemlendirilmiş bir atmosferinde ° C. 4-h kültürden sonra, hücreler ya aynı serumu içeren ortam içinde kalır olabilir ya da serum-f ile orta yerineree ortam, örneğin HepatoZYME-SFM (bkz. Tablo 1). Serum içermeyen aracı madde, serum içermeyen aracı madde kullanılır hormonlar hiçbir yan etki ile hücre morfolojisi temin edilmesine yardımcı olur.
- Hücreleri deney önce kurtarmak ve en az bir gece büyümeye olanak sağlar. Bu kritik enzimler (örneğin, P450) fonksiyonu korumaya yardımcı olabilir, çünkü 24 saat içinde test için hücreleri kullanmanızı öneririz.
- Gerekirse, 2 gün aralıklarla büyüme medyumu yerini alır.
5.. Temsilcisi Sonuçlar
Koşulları düzenli olarak bir sıçan karaciğer hazırlık başına 1.0 x 10 8 hücrelerinin hücre hasat oluşturmak nitelendirdi. Tripan mavisiyle çıkarma ile ölçülen hepatositlerin yaşayabilirliği 88 ~% 96 aralığında olduğu, sürekli.
Şekil 2, 4 saat tohumlama sonrası hepatositlerin agrega ve form küme tasvir. En çok izole hücreler tipik monolayer büyüme düzleşir ve yaymak. 24 saat olarak, hücre kenarları tanımlandığı gibidir, hücre yüzeyinde oldukça düz ve lipid damlacıkları görülebilir. Hücreler 1-3 hücrelerinin merkezinde bulunan yuvarlak nükleol, ve hücreler arasında çekirdekler görüntü tutarlıdır boyutu (Şekil 2) sahiptir.
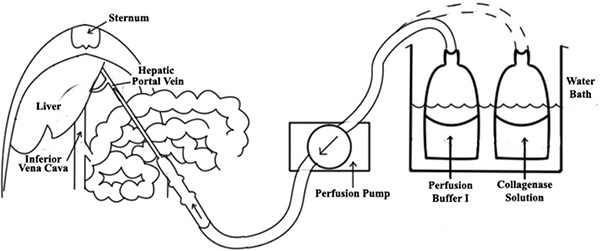
Şekil 1. Karaciğer perfüzyon şeması. Bir 18-gauge angiocath karaciğer portal damar içine yerleştirilir, daha sonra bir perfüzat boru iğne bağlanır. Başarılı kateterizasyonu onaylandıktan sonra, inferior vena kava (IVC) bir kesim efflux izin olun.
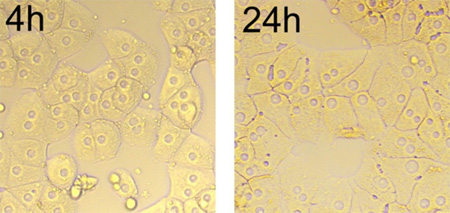
Şekil 2. Zamanla kültür hepatosit (4 saat ile 24 saat), büyütme x 200 morfolojisi. 24 saat kültüre sonra, hücreler tipik monolayer büyüme yayılır ve hücreler arasındaki kavşaklar doğrusaldır.
| Reaktif Adı | Şirket | Katalog numarası |
| HBSS (Ca 2 olmadan + ve Mg 2 +) | Invitrogen | 14174 |
| HBSS (Ca2 + ve Mg ile birlikte 2 +) | Invitrogen | 14025 |
| Williams'ın Orta D | Invitrogen | 12551-032 |
| Collegenase II | Worthington | LS004176 |
| Hücre süzgeç (100 mikron) | BD | 352360 |
| HepatoZYME-SFM | Invitrogen | 17705 |
| Percoll | Sigma | P4937 |
| Angiocath (18 gauge) | BD | 381705 |
Tablo 1.
Tartışmalar
Karaciğer primer kültürü yaygın karaciğer fizyolojisi ve patolojisi çeşitli yönlerini incelemek için kullanılan in vitro model olduğunu. Örneğin, primer kültür P450 sitokromlar, ilaç metabolizması, ilaç-ilaç etkileşimleri ve sitotoksisite ve genotoksisite 3-7 mekanizmaları da dahil olmak üzere ilaç metabolize eden enzimlerin ifade ve fonksiyonunu değerlendirmek için kullanılır. Sıçan karaciğer hücrelerinin izolasyonu ve kültür tarif protokolü 8. Aiken
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Yazarlar, teknik yardım için Sayın Josh Basford ve Dr Xiao-min Li teşekkür etmek istiyorum. Bu çalışma NIH hibe (DK70992 ve ML DK92779) tarafından kısmen desteklenmiştir.
Referanslar
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J. Cell Biol. 43, 506-520 (1969).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods Cell Biol. 13, 29-83 (1976).
- Saito, K., Kobayashi, K., Mizuno, Y., Fukuchi, Y., Furihata, T., Chiba, K., Schmidt, M., Schmitz, H. J., Baumgart, A., Guedon, D. Peroxisome proliferator-activated receptor alpha (PPARalpha) agonists induce constitutive androstane receptor (CAR) and cytochrome P450 2B in rat primary hepatocytes. Drug Metab. Pharmacokinet. 25, 108-111 (2010).
- Gomez-Lechon, M. J., Donato, M. T., Castell, J. V., Jover, R. Human hepatocytes in primary culture: the choice to investigate drug metabolism in man. Curr. Drug Metab. 5, 443-462 (2004).
- Goncalves, L. A., Vigario, A. M., Penha-Goncalves, C. Improved isolation of murine hepatocytes for in vitro malaria liver stage studies. Malar. J. 6, 169 (2007).
- Bu, S. Y., Mashek, D. G. Hepatic long-chain acyl-CoA synthetase 5 mediates fatty acid channeling between anabolic and catabolic pathways. J. Lipid Res. 51, 3270-3280 (2010).
- Aiken, J., Cima, L., Schloo, B., Mooney, D., Johnson, L., Langer, R., Vacanti, J. P. Studies in rat liver perfusion for optimal harvest of hepatocytes. J. Pediatr. Surg. 25, 140-144 (1990).
- Jauregui, H. O., McMillan, P. N., Hevey, K., Naik, S. A quantitative analysis of lectin binding to adult rat hepatocyte cell surfaces. In Vitro Cell. 24, 401-412 (1988).
- Klaunig, J. E., Goldblatt, P. J., Hinton, D. E., Lipsky, M. M., Trump, B. F. Mouse liver cell culture. II. Primary culture. In Vitro. 17, 926-934 (1981).
- Hay, R. J. Operator-induced contamination in cell culture systems. Dev. Biol. Stand. 75, 193-204 (1991).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır