Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Isolierung und Primärkultur von Ratten Leberzellen
In diesem Artikel
Zusammenfassung
Primäre Hepatozyten ein wertvolles Instrument, um biochemische, molekulare und metabolische Funktionen in einem physiologisch relevanten experimentellen Systems zu evaluieren. Wir beschreiben ein zuverlässiges Protokoll für Ratte in situ Leberperfusion, die konsequent erzeugt lebensfähigen Hepatozyten bis bis 1,0 × 10 8 Zellen pro Präparat mit der Lebensfähigkeit der Zellen zwischen 88 ~ 96%.
Zusammenfassung
Primäre Hepatozyten-Kultur ist ein wertvolles Werkzeug, die ausgiebig in der Grundlagenforschung der Leberfunktion, Krankheiten, Pathophysiologie, Pharmakologie und anderer verwandter Fächer eingesetzt. Das Verfahren auf Zwei-Schritt-Kollagenase-Perfusion für die Isolation von intakten Hepatozyten Basis wurde erstmals von Berry und Freund in 1969 1 eingeführt und seit damals hat viele Veränderungen durchgemacht. Das am häufigsten verwendete Technik wurde von Seglenin 1976 2 beschrieben. Im Wesentlichen sind Hepatozyten getrennt von erwachsenen Ratten betäubt durch eine nicht rezirkulierenden Kollagenase Perfusion durch die Pfortader. Die isolierten Zellen werden dann durch ein 100 um Porengröße Mesh Nylonfilter filtriert und auf Platten kultiviert. Nach 4-Stunden-Kultur wird das Medium mit serumhaltigem oder serumfreiem Medium, z. B. HepatoZYME-SFM, für eine längere Kultur ersetzt. Diese Verfahren erfordern chirurgische und sterile Kultur Schritte, die besser von Video werden als durch Text kann unter Beweis gestellt. Here, dokumentieren wir die detaillierten Schritte für diese Verfahren sowohl von Video-und schriftlichen Protokoll, das konsequent erlauben bei der Erzeugung von lebensfähigen Hepatozyten in großen Stückzahlen.
Protokoll
1. Vorbereitung
Alle Puffer werden frisch zubereitet und mit steriler Technik und sterilisiert mit einem Corning 0,22 um Filter zu filtern.
- Bereiten Perfusionspuffer ich, indem Sie folgende an Hanks Balanced Salt Solution (HBSS ohne Ca 2 + und Mg 2 +, siehe Tabelle 1): Mg 2 + (MgCl 2) bis 0,9 mm, EDTA bis 0,5 mm, und HEPES bis 25 mM.
- Bereiten Perfusionspuffer II, indem Sie folgende an HBSS (mit Ca 2 + und Mg 2 +, siehe Tabelle 1): 25 mM HEPES zu.
- Bereiten Perfusionspuffer II plus collagenaseII: Lösen Sie Kollagenase II (1000 U) mit 300 ml Perfusionspuffer II und hält die Lösung in warmen Wasserbad vor Perfusion. Diese Lösung sollte innerhalb von 30 Minuten verwendet werden, da die Aktivität der Kollagenase II nahm mit der Zeit.
- Bereiten Williams komplette Medium: Fügen Sie die folgendeWilliams 'Medium E: L-Glutamin zu 2 mM, fötales Rinderserum (FBS) bis 5%, Insulin bis 100 nM bis 100 nM Dexamethason, Penicillin und 100 IU / ml und Streptomycin bis 100 mg / ml.
- Diese Puffer sind für 30 Minuten im Wasserbad bei 42 ° C erwärmt werden, eine optimale Temperatur entsprechend einer Austrittstemperatur an der Kanüle von 37 ° C
2. Ratten-Leber-Perfusion für Isolation
- Die Perfusion System besteht aus der Pumpe, autoklavierbar Silasticschlauch und einem Wasserbad (siehe Abbildung 1). Voreinstellung der Durchflussmenge der peristaltischen Perfusionspumpe bis 10 ml / min.
- Anesthetize einer erwachsenen Ratte (300 g Körpergewicht) mit intraperitoneale (ip) Ketamin (87 mg / kg Körpergewicht) plus Xylazin (13 mg / kg). Narkosetiefe sollte von Zeh Prise überwacht werden. Wenn die Ratte reagiert nicht mehr auf schädliche Reize, rasieren, Haare und Bauch-prep der Bauch mit Betadine und Ethanol. Geben Sie durch einen Einschnitt an der Mittellinie.
- Aussetzendie Pfortader durch vorsichtiges Bewegen der Eingeweide nach rechts außerhalb der Bauchhöhle, und fügen Sie eine 18-Gauge-Angiocath in die Pfortader (siehe Abbildung 1).
- Schließen Sie das Perfusat Schlauch an der Nadel und starten Sie die Infusion in situ bei einer niedrigen Flussrate (10 ml / min) mit vorgewärmten (37 ° C) Perfusionspuffer ich.
- Wenn richtig ausgeführt, sollte die Leber sofort beginnen zu blanchieren. Nach erfolgreicher Kanülierung bestätigt wird, machen einen Schnitt am unteren Hohlvene (IVC) zu Efflux (Abbildung 1) zu ermöglichen. Ein weiterer Test für die erfolgreiche Kanülierung kann durch leichten Druck mit einem sterilen Tupfer auf die IVC durchgeführt werden, alle Leberlappen sollten schnell anfangen zu schwellen.
- Erhöhen der Strömungsgeschwindigkeit auf 25 ml / min. Die Leber sollte blass in der Farbe.
- Schalten Sie die Perfusionslösung zu Perfusionspuffer II plus Kollagenase II ohne Unterbrechung der Strom für weitere 6 Minuten.
- In regelmäßigen Abständen (5-10 mal während der Verdauung) Druck ausüben mit Tupfer auf die IVC für die 5-Sekunden-Intervallen. Die Leber wird anschwellen, was zu erhöhten Leber-Zell-Dissoziation, die wiederum reduziert gesamte Dauer der Verdauung und die Erhöhung Endausbeute.
- Nach Kollagenase Perfusion, sollte Leber beginnen, sich matschig. Sezieren die Leber frei, in eine vorgekühlte sterile Becher mit 20 ml Vollmedium Williams, und dann bringen Sie es zum Gewebezellkultur Kapuze.
3. Hepatocyte Zellisolation
- Innerhalb der Zellkultur Haube, mit einem Zellschaber vorsichtig dispergieren die Zellen in vollständigem Medium Williams in einer sterilen Petrischale.
- Filtern Zelldispersion durch ein 100 um Porengröße Zelle Sieb in eine 50 ml konisches Rohr, um das Bindegewebe und unverdauten Gewebe-Fragmente zu entfernen.
- Suspend-Zellen in 40 ml Vollmedium Williams und bei 50 Zentrifuge × g für 3 min bei 4 ° C
- Den Überstand aspirieren undvorsichtig resuspendieren Zellen in Vollmedium 40 ml kaltem Williams, um Zellen zu waschen. Wiederholen Sie die Zentrifugation.
- Saugen Sie den Überstand und resuspendieren sanft Zellen mit 25 ml Vollmedium Williams. 25 ml 90% Percoll-Lösung in PBS in die Röhre und vorsichtig mischen.
- Zentrifugieren bei 200 xg für 10 min bei 4 ° C Absaugen toten Zellen aus dem oberen Ende des Gradienten, da die lebensfähigen Zellen am Boden der Percoll-Gradienten bleiben.
- Hängen Sie das Zellpellet in 30 ml warmem Vollmedium Williams, und wiederholen Sie dann Zentrifugation und Resuspendieren des Zellpellets in 20 ml warmem Vollmedium Williams.
- Zählen der Zellen in der Zellsuspension unter Verwendung eines Hämozytometers und bestimmen die Lebensfähigkeit der Zellen durch Trypan-Blau-Färbung.
4. Hepatozytenkultur
- Verdünnte Zellen mit Vollmedium warmen Williams auf bevorzugte Konzentration, z. B. 2,5 × 10 5 Zellen / ml. Tafel Zellen bei einer gewünschten Volumen auf Zellkulturplatten, zB. 5 x 10 5 Zellen / 2 ml / Well, 6 Vertiefungen / Platte, oder 2,5 x 10 5 Zellen / 1,5 ml / gut, 12 Vertiefungen / Platte. Un-beschichtete Platte ist für Leber-Zellkulturen in Ordnung.
- In einem typischen Prep mit> 85% lebensfähige Zellen, sollte die Zelldichte erreichen etwa 60-70% Konfluenz, die für die Zell-Zell-Kontakt ermöglicht und gleichzeitig genügend Raum für die Hepatozyten bis zu ihrer vollen Größe der Zellen wachsen, und eine endgültige Zusammenfluss von 90-95%.
- Um eine gleichmäßige Monoschicht von Hepatozyten zu bilden, mit anderen Worten, die Tendenz zu aggregieren Zellen zu minimieren im zentralen Bereich der Wanne (wahrscheinlich aufgrund der Luft-Strömung innerhalb des Zellinkubator), dass die Platten im Inneren bleiben die Zellkultur Haube für 30 Minuten, bevor Sie sie in einem Brutkasten.
- Kultur wurden die Zellen bei 37 ° C in einer befeuchteten Atmosphäre von 95% Luft und 5% CO 2. Nach 4-stündiger Kultur konnte die Zellen entweder in dem gleichen Serum enthaltenden Medium bleiben oder zu ersetzen mit Serum-free Medium, zB HepatoZYME-SFM (siehe Tabelle 1). Das serumfreie Medium können die Zellmorphologie ohne negative Auswirkungen von Hormonen, wenn ein Serum-freies Medium verwendet wird, aufrechtzuerhalten.
- Erlauben Zellen zu erholen und wachsen mindestens über Nacht vor dem Experiment. Wir empfehlen, um die Zellen für den Test innerhalb von 24 Stunden zu verwenden, da dies zur Erhaltung der Funktion des kritischen Enzyme (z. B. P450).
- Ersetzen des Wachstumsmediums Zeitabständen von 2 Tagen, wenn nötig.
5. Repräsentative Ergebnisse
Die beschriebenen Bedingungen regelmäßig zu generieren Zelle Ernten von 1,0 x 10 8 Zellen pro Präparat aus einer Rattenleber. Die Lebensfähigkeit der Hepatozyten durch Trypanblau-Ausschluss gemessen war durchweg im Bereich von 88 ~ 96%.
Wie in 2, die Hepatozyten zusammen und bilden Cluster nach 4 Stunden Seeder dargestellt. Die meisten isolierten Zellen abflachen und in typischen Monolage Wachstum verteilt. Von 24 Stunden, die Kanten der Zellen definiert werden, die Oberfläche von Zellen ziemlich glatt, und Lipidtröpfchen sind. Die Zellen haben ein bis drei Nucleoli, die rund sind, in der Mitte der Zellen befindet, und die Kerne Anzeige einheitliche Größe zwischen den Zellen (2).
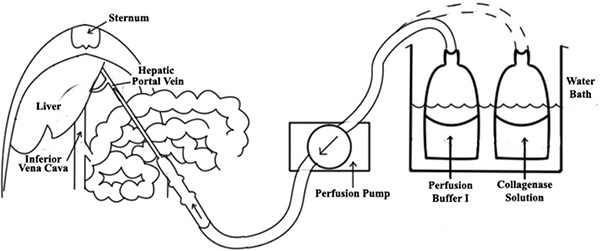
Abbildung 1. Ein Diagramm der Leberperfusion. Eine 18-Gauge-Angiocath in die Pfortader der Leber eingeführt wird, so wird ein Perfusat Schlauch mit der Nadel verbunden. Nach erfolgreicher Kanülierung bestätigt wird, machen einen Schnitt am unteren Hohlvene (IVC), damit Efflux.
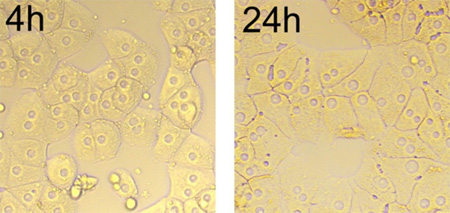
2. Morphologie der kultivierten Hepatocyten im Laufe der Zeit (4 Stunde bis 24 Stunden), Vergrößerung 200. Nach 24 Stunden lang kultiviert, die Zellen in typischen Monoschicht Wachstum verbreitet, und die Verbindungen zwischen den Zellen linear sind.
| Name des Reagenzes | Firma | Katalog-Nummer |
| HBSS (ohne Ca 2 + und Mg 2 +) | Invitrogen | 14174 |
| HBSS (mit Ca 2 + und Mg 2 +) | Invitrogen | 14025 |
| Williams 'Medium E | Invitrogen | 12551-032 |
| Collegenase II | Worthington | LS004176 |
| Zellsieb (100 um) | BD | 352360 |
| HepatoZYME-SFM | Invitrogen | 17705 |
| Percoll | Sigma | P4937 |
| Angiocath (18-Gauge) | BD | 381705 |
Tabelle 1.
Diskussion
Primärkultur von Hepatozyten ist ein in vitro Modell in großem Maße verwendet, um verschiedene Aspekte der Leber Physiologie und Pathologie zu studieren. Zum Beispiel wird Primärkultur verwendet, um die Expression und Funktion der Wirkstoff-Enzyme einschließlich Cytochrom P450, Arzneimittel-Metabolismus, Wechselwirkungen zwischen Medikamenten, und die Mechanismen der Zytotoxizität und Genotoxizität 3-7 zu bewerten. Das Protokoll beschreibt die Isolierung und Kultur von Ratten-Leberzellen ausge...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren danken Herrn Dr. Josh Basford und Xiao-Min Li, um technische Unterstützung zu danken. Diese Arbeit wurde zum Teil durch Zuschüsse NIH (DK70992 DK92779 und zu ML) unterstützt.
Referenzen
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J. Cell Biol. 43, 506-520 (1969).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods Cell Biol. 13, 29-83 (1976).
- Saito, K., Kobayashi, K., Mizuno, Y., Fukuchi, Y., Furihata, T., Chiba, K., Schmidt, M., Schmitz, H. J., Baumgart, A., Guedon, D. Peroxisome proliferator-activated receptor alpha (PPARalpha) agonists induce constitutive androstane receptor (CAR) and cytochrome P450 2B in rat primary hepatocytes. Drug Metab. Pharmacokinet. 25, 108-111 (2010).
- Gomez-Lechon, M. J., Donato, M. T., Castell, J. V., Jover, R. Human hepatocytes in primary culture: the choice to investigate drug metabolism in man. Curr. Drug Metab. 5, 443-462 (2004).
- Goncalves, L. A., Vigario, A. M., Penha-Goncalves, C. Improved isolation of murine hepatocytes for in vitro malaria liver stage studies. Malar. J. 6, 169 (2007).
- Bu, S. Y., Mashek, D. G. Hepatic long-chain acyl-CoA synthetase 5 mediates fatty acid channeling between anabolic and catabolic pathways. J. Lipid Res. 51, 3270-3280 (2010).
- Aiken, J., Cima, L., Schloo, B., Mooney, D., Johnson, L., Langer, R., Vacanti, J. P. Studies in rat liver perfusion for optimal harvest of hepatocytes. J. Pediatr. Surg. 25, 140-144 (1990).
- Jauregui, H. O., McMillan, P. N., Hevey, K., Naik, S. A quantitative analysis of lectin binding to adult rat hepatocyte cell surfaces. In Vitro Cell. 24, 401-412 (1988).
- Klaunig, J. E., Goldblatt, P. J., Hinton, D. E., Lipsky, M. M., Trump, B. F. Mouse liver cell culture. II. Primary culture. In Vitro. 17, 926-934 (1981).
- Hay, R. J. Operator-induced contamination in cell culture systems. Dev. Biol. Stand. 75, 193-204 (1991).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten