Method Article
Doğal Müsin Dağıtım Eğitim için sabitlenmemiş, Dondurulmuş Dokular kullanma
Bu Makalede
Özet
Optimal Kesme Sıcaklık orta (OCT) gömülü sabitlenmemiş dondurulmuş doku örneklerinin salgılanan mukus doğal dağıtım ve glikozilasyon incelemek için kullanılabilir. Bu yaklaşım, doku işleme minimal ve glikolipitler, müsin ve glukanıdır-epitopların doğal sunumu korunur. Doku kesitleri floresan veya kromojenik algılama kullanılarak immünohistokimyasal olarak analiz edilebilir.
Özet
Mukinler ağırlığı 1-3% 70'den fazla karbonhidrat içeren karmaşık ve ağır glikosilatlıdır O-bağlı glikoproteinler, vardır. Salgılanan müsin, goblet hücresi ve mide mukozası tarafından üretilen, bir mikrometre kalınlığında mukus tabakası için iskele sağladığı hatları bağırsak ve solunum yolu 3,4 epithelia. Müsin ek olarak, mukus tabakalar da antimikrobiyal peptitler, sitokinler ve immünoglobulinler 5-9 içerir. Mukus tabakası konak bağışıklık önemli bir parçası olduğunu ve mikroorganizmaların 8,10-12 istila karşı ilk savunma hattı oluşturur. Bunun gibi, mukus mikropların çok sayıda etkileşimleri tabidir, hem patojenler ve simbiont ve salgılanan müsin bu etkileşimler için önemli bir arayüz oluştururlar. Böyle biyolojik etkileşimin çalışma genellikle doku toplama ve boyama için histolojik yöntemler içerir. Doku toplama ve preserv için iki en yaygın olarak kullanılan yöntemler histolojikklinik ve araştırma laboratuvarlarında ation şunlardır: formalin fiksasyonu kriyo-koruyan medya gömerek ardından, parafine gömme takip ve doku dondurma.
Parafine gömülü doku örneklerinde berraklık ve iyi tanımlanmış morfolojisi gibi histolojik görselleştirme için optimal nitelikler ile bölümleri üretmek. Bununla birlikte, parafin gömme işlemi sırasında epitopunun çok sayıda değiştirilmiş ve bu epitoplara incelemek için, doku kesitleri daha fazla sayıda epitop yöntemlerine de 13 biri ile işlenmesi gereken hale gelir. Salgılanan müsin ve lipitler organik çözücü maddeler (ya da ksilen Citrisolv) ile inkübasyon uzun sürmesi parafin gömme temizleme adımı sırasında doku ayıklanır. Bu nedenle bu yaklaşım müsin ve in vivo mukus niteliği ve dağıtım odaklanan çalışmalar için optimal olduğunu.
Buna karşılık, Optimal Kesme Sıcaklık donma dokuların (OCT) orta bir katıştırmaboşluklar örnek dehidratasyon ve takas ve örnek hidrasyon korur. Bu mukus sulu tabaka daha iyi koruma sağlar, ve böylece epitel biyoloji Müsinlerin çok sayıda rolleri çalışma sağlar. Bu yöntem, doku en az işleme gerektirdiği gibi, doku daha doğal bir durumda muhafaza edilir. Dolayısıyla dondurulmuş doku bölümleri boyamadan önce herhangi bir ek işlem gerektirmez ve kolayca immünohistokimyasal yöntemler kullanılarak analiz edilebilir.
Biz dondurulmuş kolon örneklerinde mikrometre kalınlığında salgılanan mukus tabakasının korunması göstermektedir. Aynı dokularda parafin içine gömülmüş, bu katman büyük ölçüde azaltılmış olur. Ayrıca bitki lektinler kullanarak müsin sunulan glukanıdır epitopların immünofloresan boyama göstermektedir. Bu yaklaşımın avantajı, özel fiksatif kullanımını gerektirir ve zaten laboratuvarda muhafaza edilebilir dondurulmuş doku kullanan veriyor olmamasıdır.
Protokol
1. OCT Doku Gömme
- Sığ bir strafor kutuda 2-metil bütan için kuru buz ekleyerek dondurma banyo hazırlayın.
- Doku Harvest, yavaşça aşırı sıvı kurulamak için kağıt mendil üzerine nemli. Ek dondurulmuş doku (sıvı nitrojen içinde dondurulmuş doku) kullanıyorsanız, doku kriyo-mikrotom odasında yerleştirerek -20 ° C'ye kadar ısınmasını bekleyin.
- Yeterli kalıbın alt kapağı, Peel-A-Way donma kalıp eki küçük bir miktar ekleyin.
- Kalıp içinde doku yerleştirin, doku istenen yönde de kalıbın tabanındaki üzerinde duran olduğundan emin olun. Bir kez dondurulmuş doku blok veya alt taraftan ya da kesit olacaktır.
- OCT doku kapağı, ve dondurma banyo içinde kalıp yerleştirin. Doku dondurur OCT bileşiği beyaz dönecek.
- Sonra belirgin bir dondurma torba içinde dondurulmuş blok ve kapalı yerde kalıp soyma, dondurulmuş.
- Dondurulmuş bloklar tutulabilir-80 ° C'ye kadar.
2. Kesit Doku
- Sıra doku kriyo-mikrotom odasında blokları ve bunların -20 ° C (yaklaşık 30 dk) ulaşmanızı sağlar.
- Bir 3-5 mikron kalınlığında kesit Kes ve bölümün üstünde bir pozitif yüklü cam slayt yerleştirin. Doku slayt uyacaktır.
- Hava 30-60 dakika süreyle doku kurulayın.
- Slaytlar, bu aşamada kullanılabilir, ya da -80 ° C 'de gelecekte kullanılmak üzere muhafaza edilebilir.
3. Boyama Doku
- -80 Bekletildi Slaytlar ° C: slaytlar 30 dakika boyunca oda sıcaklığında kuru bir çözülme ve hava sağlar.
- % 10 oranında, oda sıcaklığında 30 dakika boyunca tamponlu formalin ile slaytlar düzeltildi.
- 250 ml tampon içinde slaytlar 10 kez daldırma her bir yıkama için, PBS veya TBST tamponu içinde üç kez yıkanır. PBS tamponu fosfataz, kromojenik conjug Alkalin ile tespiti için, ancak, immunofloresans boyaması için kullanılabilirlerantikor ated, TBST PBS içinde fosfat beri kullanılması gerektiğini Alkalin fosfataz aktivitesini inhibe eder.
- Doku kesitleri slaytlar artık lekeli hazırdır.
4. Mukus Algılama böyle Alsiyan Mavi ve Periyodik Asit Schiff gibi Histokimyasal Boyaları Kullanımı
- Alsiyan Mavi lekesi:
- Su içinde slaytlar durulama, oda sıcaklığında 3 dakika için% 3 asetik asit içinde inkübe edilir.
- Oda sıcaklığında 30 dakika için Alsiyan Blue pH 2.5 çözeltisi ile Leke.
- 10 dakika süreyle akan su içinde yıkayın slaytlar, DI su ile durulayın.
- Oda sıcaklığında 5 dakika boyunca Nükleer Hızlı Kırmızı Counterstain.
- Yıkama distile su içinde üç kez kayar.
- Periyodik Asit Schiff boyası:
- Su içinde slaytlar durulayın, 5 dakika için taze hazırlanmış% 1 periyodik asit içinde inkübe edilir.
- DI suyla üç kez yıkayın, bir kez miliQ suya batırın.
- Oda sıcaklığında, 15 dakika süre ile Schiff reaktif Lekee.
- 10 dakika süreyle akan su içinde yıkayın slaytlar, DI su ile durulayın.
- Oda sıcaklığında 30 sn için Surgipath hematoksilin Counterstain.
- Yıkama distile su içinde üç kez kayar.
- İnkübasyon oda sıcaklığında Scott musluk suyu içinde 30 saniye kayar.
- DI suyla üç kez yıkayın.
- Kurutmak ve% 100 etanol içinde üç hızlı değişiklikler ve Citrisolv üç değişiklikler, 2 dakika her biri, ardından% 95 etanol içinde 1 dakika inkübe edilerek slaytlar temizleyin. Oda sıcaklığında tüm.
- Reçineli orta (Cytoseal 60) lamelleri üzerine slaytlar monte edin.
5. Histokimyasal Yöntemlerle glukanıdır epitoplar Algılama Lektinlerle ve Antikorlar (Tablo 1) kullanarak
- Lektin kullanarak üç glikan epitopunun floresans saptama için, oda sıcaklığında, 10-30 dakika boyunca PBS içinde% 1 BSA ile bloke slaytlar.
- Bir biyotinile lektin kullanıldığı için,% 0.1 ile 15 dakika inkübe edilerek endojen biyotin engellemekAvidin, oda sıcaklığında% 0.01 biotin ile 15 dakika inkübe edildi.
- Her engelleme adımdan sonra PBS slaytlar yıkayınız.
- Taze 1 ug / ml Rodamin-konjuge succinylated buğday tohumu aglutinin (sWGA), 1.3 ug / ml biyotinile Sambucus nigra agglutinin (SNA) ve 5 mg / HEPES / ml NaCl tampon içinde floresein-konjuge Jacalin (10 mM HEPES, bir karışım hazırlamak 150 mM NaCl, pH 7.5).
- Düz bir yüzeye veya bir boyama kutusu ve katman üstüne lektin karışımı koyun slaytlar. Karışım yavaşça hacim sıvı üzerinde parafilm yerleştirilerek azaltılabilir, parafilm sıvı düzleştirir ve buharlaşmasını önler.
- Karanlıkta, oda sıcaklığında 1 saat inkübe edin.
- Yıkama üç kere PBS ile kayar.
- 0.7 mg / ml streptavidin-konjuge CY5 (biyotinile-SNA tespit etmek için), ve karanlıkta oda sıcaklığında 30 dakika inkübe edilir ve tabaka ile kayar.
- Yıkama üç kere PBS ile kayar.
- 0.1 & m çekirdekler Counterstainu, g / ml DAPI.
- VectaMount montaj ortam (veya herhangi bir sulu ortam) olarak, örneğin sulu ortam ile lameller üzerine monte slaytlar.
6. Lektin Boyama Özgünlük için denetleme
- Lektin boyama özgüllük boyamadan önce hedef glikan epitopun belirli enzimsel bölünme ile ya da küçük moleküller ile rekabet tarafından kontrol edilir.
- Sambucus nigra aglutinin (SNA) bağlama özgünlüğü için Enzimatik dilinim
- 250 50 mM sodyum asetat pH 5.5 mU / ml Arthrobacter ureafaciens siyalidaz (AUS) seyreltin.
- Öneri kutusu boş altına su ekleyin, bu inkübasyon sırasında nemli odasına oluşturacaktır.
- Sıra kaydıraklı bir lamel ile slayt ve kapak üzerinde ucu kutusu, katman 150-200 ul AUS çözüm üst tabla üzerine yerleştirin. Hava kabarcığı oluşumunu önleyiniz.
- 2.5 saat için 37 ° C sıcaklıkta inkübe kutusu kapağı ve kapatın.
- Yıkama odasında temper de PBS içinde üç kez slaytlartüm ücretsiz sialik asit kaldırmak için düs ük. Bu slaytları SNA boyanması için negatif olması gerekir.
- Jacalin ve succinylated buğday tohumu aglutinin (sWGA) özgüllük için Rekabetçi inhibitörler
- Lektin karışımın tablet 200 ul 5.4 adım için iki Eppendorf tüpleri içinde hazırlanır.
- Diğer şişeye 1:10 seyreltme de şişeleri ve Chitin-hidrolisat (sWGA inhibitörü) biri 200 mM melibiyoz (Jacalin inhibitörü) ekleyin.
- Bindirme negatif kontrol slaytlar inhibitörleri içeren slaytların geri kalanı ile aynı zamanda oda sıcaklığında inkübe edin ve karışımı 1 saat. Bu slaytları sırasıyla, Jacalin veya sWGA boyama için negatif olması gerekir.
7. Temsilcisi Sonuçlar
Kriyo-koruyan medya (OCT) gömülü dondurulmuş dokulara parafine gömülü doku örnekleri arasında bir karşılaştırma Muci için boyama korunması ve kalitesi çarpıcı farkı ortayan glikoproteinler. Böyle Alsiyan Mavi ve Periyodik Asit Schiff gibi histokimyasal boyalar ile Doku boyama dondurulmuş ya da parafine gömülü örnekleri (Şekil 1) karşılaştırılabilir doku kesitlerinde çok farklı sonuçlar üretebilir. Görünüşe göre organik çözücü parafin gömme işlemi sırasında kullanılır ki (ksilen veya Citrisolv) epithelia üzerinde salgılanan müsin dağılımı de çok numuneleri (Şekil 2) glikolipitlerin kaldırma olarak etkiler. Sonuç olarak, mukus tabaka mukoza hücreleri üzerinde daraltılmış ve çoğunlukla goblet hücrelerinde bulunan görünür. Kriyo-koruyan medya dokuların Flaş dondurma (OCT) örnek hidrasyon muhafaza ve salgılanan müsin tabakasının boyutları korunmuştur. Parafin gömme işlem benzer bir şekilde diğer mukus ile ilişkili glukanlardır ve glikolipidler etkilemiştir. Glukanıdır dağılımı bulunan epitoplara rutin glukanıdır tespiti için kullanılır lektinler, (Şekil 3) ve antikorlar kullanılarak incelendimüsin ve glikolipitler (Şekil 6). Lektin bağlayıcı iyi tanımlanmamış ve glukanlardır hem de glikan yapı 14,15 arasında uzaysal dağılımının tarafından etkilendiği için, bu lektin boyanması için uygun kontrol uygulamak için önemlidir. Enzimatik parçalanma ve yarışmalı inhibisyonu: Burada test dokulara lektin boyama kontrol etmek için iki yöntem gösterilmektedir. Glikan epitopunun Yarılma glikan-spesifik enzimler ile doku bölüm sindirilmesi ile yapılabilir, örneğin bakteri siyalidaz için SNA (Şekil 4) bağlayıcı sialik asit için kontrol olarak. Edildi Spesifik enzim (örneğin glycosidase) okudu glukanıdır epitop kaldırılması için mevcut olmadığı durumlarda, lektin özgünlüğü, sWGA boyama Jacalin boyama veya Chitin-hidrolizat için melibiyoz (Şekil 5) olarak rekabetçi bir inhibitörü ekleyerek teyit edilebilir.
Biz ek dondurulmuş doku örnekleri, hangi rou olduğunu burada göstermektinely klinik ve araştırma laboratuvarlarında elde edilen, daha OCT gömülü ve müsin glikoproteinler ve onları mevcut birçok glukanlardır incelemek için kullanılabilir.
| Lektin / Ab | Kaynak | Binbaşı özgüllük |
| LFA | Limax flavus (Sarı slug) | Terminal Sia |
| MAA * | Maackia amurensis (Amur Maackia) | Galβ1-R Siaα2-3Galβ1-R / 3-O-sülfat |
| SNA | Sambucus nigra (Mürver) | Siaα2-6Gal / Siaα2-6GalNAc |
| WGA | Triticum vulgaris (Buğday) | GlcNAcβ1-4GlcNAcβ1-4GlcNAc / Sia |
| sWGA | Succinylated Triticum vulgaris (Buğday) | GlcNAc & beta, 1-4GlcNAcβ1-4GlcNAc |
| PNA | Arachis (Yerfıstığı) | Galβ1-3GalNAc (değiştirilmemiş T-antijen) |
| Jacalin | Artocarpus integrifolia (Jacalin) | Galβ1 3GalNAc-O-bağlı glukanlardır bulunabilir |
| ECA | Erythrina cristagalli (Mercan ağacı) | Galβ1-4GlcNAc |
| TKH2 | Antikor | O-bağlı glukanlardır üzerine Siaa2-6GalNAc (STN) |
| CA19-9 | Antikor | Siaa2-3Galβ1-4 (Fuca1-3) GlcNAc (SLE) |
| SNH3 | Antikor | Siaa2-3Galβ1-3 (Fuca1-4) GlcNAc (SLE x) |
Kısaltmalar: Ab, antikor; Sia, Sialik asit; Gal, Galaktoz; GalNAc, N-acetylgalactosamine, GlcNAc, N-asetilglukozamin; fuc, fucose; STN, Sialyl Tn, SLE, sialyl Lewisa, SLE, x, sialyl Lewis x. MAA için * Ticari kaynaklardan Mali, MALII ve MAH içerir.
Tablo 1. Glukanıdır epitopları için lektinler ve antikorların kısmi listesi.

Şekil 1. Alsiyan Mavi ve dondurulmuş ve parafine gömülü kolon dokularında Periyodik Asit Schiff boyası. Insan, fare veya tavuk kolon örneklerinin doku kesitleri OCT (üst panel) dondurulmuş veya parafin (alt panel) gömülü Periyodik Asit Schiff (PAS) ile boyandı ya Alsiyan Mavi (AB). Bu reaktifler sırasıyla, pembe ya da mavi mukus leke. Üst panel: dondurulmuş doku olarak, goblet hücrelerinde müsin ek olarak, mukus salgılanması ayrıca kuvvet idiible (oklar). Alt panel: parafine gömülmüş doku, mukus boyama goblet hücreleri ile sınırlı idi. Çekirdekler Surgipath (PAS) veya Mayer'in (AB) Hematoksilen ile zıt edildi. Ölçek çubuğu 100 mikron gösterir. büyük bir rakam görmek için buraya tıklayın .
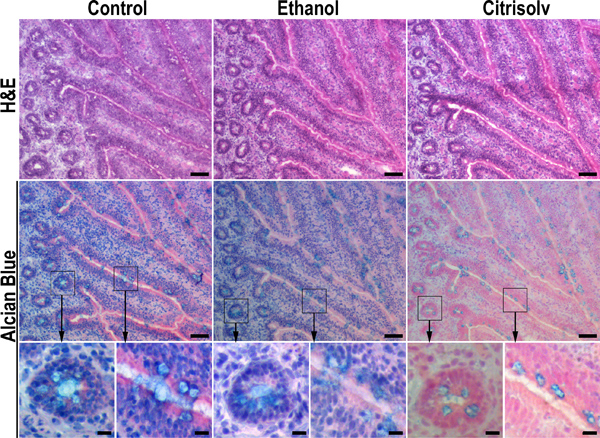
Şekil 2. % 10 tamponlu formalin ve sulu (sol panel) muhafaza içinde müsin önemli kaybına Citrisolv kuluçka sonuçlar. Dondurulmuş tavuk ileum örnekleri Seri kesitler sıralı% 70 inkübasyon,% 90 ve% 100 etanol ile etanol içinde suyu 20 dakika süreyle, fikse edildi Her (orta panel) veya etanol içinde susuz ve 1 saat (sağ panel) Citrisolv ile temizlenir. Dehydrated örnekleri Hematoksilen-Eozin (H & E) veya Alsiyan Blue boyaması önce PBS geri rehidrate edildi. Etanol dehidratasyon ve Citrisolv takas gelişmiş doku morphology (örneğin, üst satır, orta ve sağ görüntüleri veya sol resim). Etanol dehidratasyon Alsiyan Blue boyaması (orta sıra, sol ve orta görüntüleri karşılaştırın) üzerinde anlamlı bir etkisi vardı. Buna karşılık, Citrisolv inkübasyon Alsiyan Blue boyaması azalır ve parafine gömülü dokularda (Şekil 1) görülene benzer bir desen goblet hücreleri (orta sıra, sağ resim) için sınırlı. Bu veriler parafine gömülü örneklerinde mukus granülleri kuvvetli boyanma takas adımı sırasında küçülen ve goblet hücrelerinde mukus yoğuşmalı bağlı olduğunu göstermektedir. Dondurulmuş OCT-gömülü dokularda mukus sönük ve az yoğun boyama doku mukus daha doğal dağılımını yansıtmaktadır. Kutulu alanlardan yüksek büyütme oklarla işaretlenmiştir. Ölçek çubukları 50 mikron (üst ve orta satırlar) ve 10 mikron (alt satır) gösterir.

Şekil 3,. Bağlanmadondurulmuş ve parafine gömülü dokularda glukanıdır epitoplara lektinler. Tavuk ince bağırsak (ileum) örneklerinde OCT (üst panel) dondurulmuş veya Jacalin (mavi), sWGA (yeşil) ve SNA ile probed (alt panel) parafine gömüldü (kırmızı ). Kutulu alanlardan yüksek büyütme oklarla işaretlenmiştir. Dondurulmuş dokularda O-bağlı glukanlardır bağlama Jacalin lümen (Jacalin, üst panel, oklar) içine goblet hücrelerinden sızıntı ortaya çıktı yapıları ortaya çıkarmıştır. Buna karşılık, parafine gömülü dokularda bağlama Jacalin goblet hücreleri (Jacalin, alt panel, oklar) ve villus fırça sınır (sol alt resim, ok) ile sınırlı idi. β1-4GlcNAc arasında sWGA boyama kısmen de dondurulmuş dokularda Jacalin lektin bağlayıcı (üst panel, oklar) ile birlikte lokalize ve dokuların (alt panel, oklar) parafine gömülü. Buna karşılık, α2-6 bağlantılı sialik asit bağlayıcı SNA lektin (SNA, ok uçları) hücre içi ve Jacalin (renk ile birlikte lokalize etmezkırmızı görüntü, SNA ok ucu, noktalı ok işaretli mavi Jacalin) ile işaretlenmiş. Ölçek çubukları 100 mikron (sol resim) ve 20 mikron (büyütülmüş kutulu alanlar) gösterir.

Şekil 4. SNA ile sialik asit boyama için enzimatik bölünme kontrolü. Tavuk ince bağırsak numuneler 37 ° C sıcaklıkta 250 mU / ml Arthrobacter ureafaciens siyalidaz (Avustralya) ile 2.5 saat boyunca ya da 50 mM sodyum asetat pH 5.5 tamponu ile inkübe edildi AUS tedavi sialik asidin SNA bağlama özgünlüğü teyit biotinlenmiş SNA ile boyanarak ortadan kaldırmaktadır. Ölçek çubuğu 100 mikron gösterir.
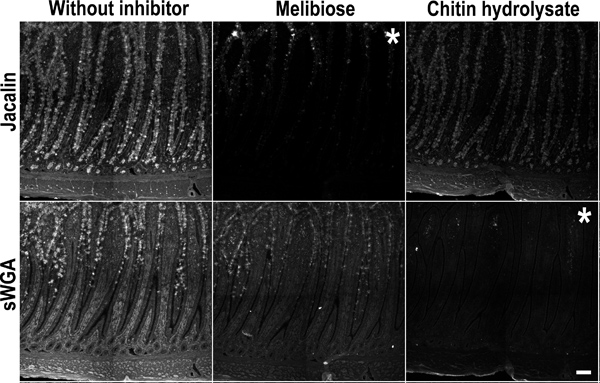
Şekil 5,. Jacalin ve sWGA glikan ile boyanması için Rekabetçi inhibisyon kontrolü. Tavuk ince bağırsak (kıvrımbağırsak) örnek spesifik LEC varlığında bir Jacalin ve sWGA karışım ile inkübe edildikalay inhibitörleri: melibiyoz (orta sütun), Chitin-hidrolizat (sağ sütun) veya inhibitör olmadan (A ve D). Üst panel: (solda) inhibitörleri olmadan Jacalin boyama. (Merkezi) Jacalin boyama melibiyoz tarafından inhibe edilmiştir. (Sağda) Chitin-hidrolizat Jacalin boyama inhibe etmemiştir. Alt panel: (solda) inhibitör olmadan sWGA boyama. (Merkezi) melibiyoz sWGA boyama inhibe etmemiştir. (Sağda) sWGA boyama Chitin-hidrolizat tarafından inhibe edilmiştir. Bu inhibisyon dokuları ile lektinlerinin spesifik etkileşimi teyit etmektedir. Boyama inhibisyon Asteriskler imajının. Ölçek çubuğu 100 mikron gösterir.

Şekil 6. Sekretuar müsin, glikolipid ve donmuş insan kolorektal kanser dokularında glukanıdır epitopların tespiti. Villöz karsinom ve mukoza karsinom Kolorektal kanser biyopsi sıvı azot içinde ek dondurulmuş ve OCT gömülü. Doku kesitleri 1 saat süreyle inkübe edildisalgılanan musin karşı antikorlar ile MUC5AC sialyl Lewis - glukanıdır epitop gangliosides (kolorektal kanser belirteci CA 19-9) üzerinde bulunan ve sialyl-Tn - müsin üzerinde bol glukanıdır epitopu (TKH2 antikor ile tespit) ile 30 dakika inkübasyon izledi biyotinile eşek anti-fare IgG ikincil antikor, ve peroksidaz-konjuge streptavidin ile 30 dakika inkübasyon. İlave doku peroksidaz-konjuge streptavidin ile 30 dakika inkübasyon, ardından biyotinile lektinler SNA ve sWGA ile 1 saat boyunca inkübe edildi. Peroksidaz boyama AEC kiti kullanılarak geliştirilmiştir. Siyah ölçek çubuğu 200 mikron gösterir.
Tartışmalar
Dondurulmuş dokularda mukus ve glukanıdır epitoplarının korunması parafine gömüldü dokuların üstündür. Bu mukus salgılanması katman (Şekil 1 ve 3) ve parafine gömülmüş dokulara göre dondurulmuş dokuda üç glukanlardır yapılarının dağılımı (Şekil 3) arasında muhafaza göstermiştir. Bu tür Carnoy çözeltisi gibi özel fiksatifler, (% 60 etanol,% 30 kloroform,% 10 asetik asit) 17 doku numuneleri içinde mukus tabakasının en uygun şekilde korunması için geliştirilmiştir. Optimal, bu çözüm mukus çalışmalar için varız doku örnekleri toplamak için kullanılması gerektiğini ve mukus tabakası 16-17 pürüzsüz bir görünüm korumak için gösterilmiştir. OCT gömülü sabitlenmemiş donmuş örnekleri mukus tabakası sağlam görünür ve bazı alanlarda doku ayırmak olabilir, ancak genel tabakası kalınlığı Carnoy solüsyonu ve embedd ile tespit edilen dokularda gözlenen ile uyum içindedirParafin 16-17 ed. 16 - Örneğin, dondurulmuş insan kolon dokusunda bölümünde mukus tabakası Carnoy's sabit insan kolon Örnek 55.4 ± 2.5 mikron (204.8 mikron aralığında 7.7) için bildirilen aralığında ~ 100 mikron (Şekil 1) 'dir.
Bu, on yıllardır bilinmektedir ki biyolojik numune, 18 ~% 30 büzülme ve dokular 13 ksilen gibi organik çözücüler, Citrisolv ve bir dereceye kadar kloroform ekstresi lipidler, glikolipidler ve, proteinler de etanol dehidrasyon ile sonuçlanır. Fiksasyon (% 10 tamponlu formalin), dehidratasyon (artan etanol konsantrasyonu) ve takas (Citrisolv veya ksilen): parafine gömme için Doku işlem aşağıdaki adımları içerir. Sabitlenmemiş dondurulmuş doku kesitlerinde şu adımları taklit ederek, biz Citrisolv (Figür parafine gömülü dokuların buna benzer doku morfolojisi sonuçlanan dondurulmuş doku bölümlerden mukus ayıklar göstermiştire 2, sağ panel). Buna karşılık, mukus katman (Şekil 2, sol ve orta panel) ya da formalin etanol ile inkübasyon yoluyla değişmemiştir. Bu da gösteriyor ki Citrisolv / ksilen uzamış inkübasyon gerektirir standart parafine gömme prosedürün açıklığa adım, mukus tabakasının çöküşle sonuçlanır. Formalin fiksasyonu kolayca glikan, lipid glikolipitler ve proteinler (Şekil 2, 3 ve 6) karşı lektinler ve antikorlar ile boyanarak edilebilir formalin ile tespit edildi mukus tabakası ve dondurulmuş doku bölümleri zarar vermez. Bu etkiler membrana bağlı proteinler ve doku patolojisinin çalışma için önemsiz olabilir, ama bu tür salgılanan mukus tabakası gibi yüksek nemli yapılar için yıkıcı vardır. Müsinlerin Ancak histolojik çalışmalar hala mukus tabakası korunması suboptimal olduğu parafine gömülü örnekleri, çoğunlukla yapılır. Böyle se kesin kimlik olarak mukus tabakası kompozisyon derinliği analizlerindecreted ya da zar bağlı glikoproteindir MUC kombinasyonları spesifik antikorlar ve protein omurgaları belirlenmesi için kütle spektrometrisi gerektirir. Mukus tabakasının korunması gibi çalışmaları için ancak ilk gerekliliktir.
Birçok laboratuar farklı projeler için geçmişte toplanmıştır OCT dondurulmuş doku örneklerinin, bu dokular kolayca müsin, glikolipid ve mukus korunması için benzersiz tasarlanmış özel fiksatif içine dokuları toplamak için ihtiyacı ortadan kaldırarak glukanıdır dağılımını kullanılabilir olması. Donmuş dokular en az işleme geçmesi ve bu yüzden doğal olarak sulu glikan, lipid doğal dağılımı muhafaza edilir. Bu mikrobiyal-konak ilişkileri aleminde özellikle önemlidir. Bu "bariyer" molekülleri dekorasyon salgılanan müsin ve birçok glukanıdır yapıların natüralist dağılımı ve bolluğu Bilgi konak savunma, mikrobiyal sömürü ve patojenler anlamada anahtar olacakolduğunu.
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Yazarlar Tavuk dokuları yardım ettikleri için Nicole M. Nemeth (University of Georgia) ve Jeanne M. Fuarı (LANL) teşekkür ve çekimler sırasında, onun yardım için Steven A. Springer olurdu. Bu çalışmada tüm kuşların bakım Los Alamos Ulusal Güvenlik, LLC, Los Alamos operatörün Kurumsal Hayvan Bakım ve Kullanım Komitesi tarafından onaylanmış laboratuvar hayvanları ve tüm protokolleri insani kullanımı için Sağlık kuralları National Institutes uygun oldu Sözleşme kapsamında Ulusal Laboratuvarı ABD Enerji Bakanlığı ile No DE-AC52-06NA25396. Bu çalışmada farelerde bakımı UCSD hayvan onaylanan protokole uygun olduğunu. İnsan doku UCSD onaylı protokol IRB bir parçası olarak elde edildi. Bu çalışma California Lab Ücret Başkan Programı Üniversitesi (PG) ve hibe NS047101 Nörolojik Bozukluklar Ulusal Enstitüsü ve İnme (Nörobilim Mikroskopi Paylaşılan Tesisi, UC San Diego) hibe 118645 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif ve ekipman Adı | Şirket | Katalog numarası | |
| 2-metil bütan | Fisher Scientific | 03551-4 | |
| AEC peroksidaz substrat kiti | Vektör Labs | SK-4200 | |
| Alsiyan Mavi | Sigma-Aldrich | A3157 | |
| Anti-CA 19-9 monoklonal antikor | Calbiochem | CA1003 | |
| Anti-MUC5AC monoklonal antikor | Millipore | MAB2011 | |
| Avidin-Biotin engelleme kiti | Vektör Labs | SP-2001 | |
| Biyotinile eşek anti-fare antikoru | Jackson Immunoresearch | 90863 | |
| Biotinlenmiş SNA | Vektör Labs | B-1305 | |
| Sığır sedk | Sigma-Aldrich | A4503 | |
| Chitin-hidrolizat | Vektör Labs | SP-0090 | |
| Kriyostat mikrotom | Leica Microsystems | Leica CM 1800 | |
| Hematoksilen | Surgipath Medikal Sanayi | 3801570 | |
| Hidrojen peroksit% 30 | Fisher Scientific | H325-100 | |
| Jacalin-FITC | Vektör Labs | FL-1151 | |
| Mayer Hematoksilen | Sigma-Aldrich | MHS32 | |
| Melibiyoz | Sigma-Aldrich | M5500 | |
| Nükleer Hızlı Kırmızı | Vektör Labs | H-3403 | |
| Ekim bileşik | VWR International | 25608-930 | |
| Peroksidaz bağlı streptavidin | Jackson Immunoresearch | 94638 | |
| Schiff reaktifi | Elektron mikroskobu bilimler | 26052 | |
| sWGA-Rodamin | Vektör Labs | RL1022S | |
| TKH2 monoklonal antikor | ATCC | HB-9654 | |
| VectaMount sulu montaj medya | Vektör Labs | H-5501 | |
| Cytoseal 60 | Thermo Scientific | 8310-4 | |
| Peel-A Way kalıpları | Polysciences A.Ş. | 18646A-1 |
Referanslar
- Slayter, H. S., Wold, J. K., Midtvedt, T. Intestinal mucin of germ-free rats. Biochemical and electron-microscopic characterization. Carbohydr. Res. 222, 1-9 (1991).
- Lamblin, G. The carbohydrate diversity of human respiratory mucins: a protection of the underlying mucosa. Am. Rev. Respir. Dis. 144, S19-S24 (1991).
- Corfield, A. P., Carroll, D., Myerscough, N., Probert, C. S. Mucins in the gastrointestinal tract in health and disease. Front. Biosci. 6, D1321-D1357 (2001).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nat. Rev. Immunol. 9, 799-809 (2009).
- Lievin-Le Moal, V., Servin, A. L. The front line of enteric host defense against unwelcome intrusion of harmful microorganisms: mucins, antimicrobial peptides, and microbiota. Clin. Microbiol. Rev. 19, 315-337 (2006).
- Kim, Y. S., Ho, S. B. Intestinal goblet cells and mucins in health and disease: recent insights and progress. Curr. Gastroenterol. Rep. 12, 319-330 (2010).
- Nochi, T., Kiyono, H. Innate immunity in the mucosal immune system. Curr. Pharm. Des. 12, 4203-4213 (2006).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: soldier in the fight against respiratory viruses. Clin. Microbiol. Rev. 24, 210-229 (2011).
- McGuckin, M. A., Linden, S. K., Sutton, P., Florin, T. H. Mucin dynamics and enteric pathogens. Nat. Rev. Microbiol. 9, 265-278 (2011).
- Knowles, M. R., Boucher, R. C. Mucus clearance as a primary innate defense mechanism for mammalian airways. J. Clin. Invest. 109, 571-577 (2002).
- Johansson, M. E. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria. Proc. Natl. Acad. Sci. U.S.A. 105, 15064-15069 (2008).
- Hooper, L. V., Macpherson, A. J. Immune adaptations that maintain homeostasis with the intestinal microbiota. Nat. Rev. Immunol. 10, 159-169 (2010).
- Hayat, M. A. Microscopy, Immunohistochemistry, and Antigen Retrieval Methods: For Light and Electron Microscopy. Hayat, M. A. , Kluwer Academic/Plenum Publishers. New York, NY. 53-70 (2002).
- Cohen, M., Hurtado-Ziola, N., Varki, A. ABO blood group glycans modulate sialic acid recognition on erythrocytes. Blood. 114, 3668-3676 (2009).
- Cohen, M., Varki, A. The sialome--far more than the sum of its parts. OMICS. 14, 455-464 (2010).
- Ota, H., Katsuyama, T. Alternating laminated array of two types of mucin in the human gastric surface mucous later. Histochemical J. 24, 86-92 (1992).
- Matsuo, K., Ota, H., Akamatsu, T., Sugiyama, A., Katsuyama, T. Histochemistry of the surface mucous gel layer of the human colon. Gut. 40, 782-789 (1997).
- Boyde, A., Maconnachie, E. Treatment with lithium salts reduces ethanol dehydration shrinkage of glutaraldehyde fixed tissue. Histochemistry. 66, 181-187 (1980).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır