Method Article
Использование незаписанные, замороженные ткани для изучения природных распространения Муцин
В этой статье
Резюме
Незаписанные замороженных образцов тканей, встроенные в оптимальной температуры среды резки (ОКТ) могут быть использованы для изучения распределения природного и гликозилирования выделяется слизь. В этой обработке тканей подход является минимальным и природных презентация гликолипиды, муцина и гликана-эпитопы сохраняется. Срезы тканей могут быть проанализированы с помощью иммуногистохимии с помощью флуоресцентной или хромогенных обнаружения.
Аннотация
Mucins are complex and heavily glycosylated O-linked glycoproteins, which contain more than 70% carbohydrate by weight1-3. Secreted mucins, produced by goblet cells and the gastric mucosa, provide the scaffold for a micrometers-thick mucus layer that lines the epithelia of the gut and respiratory tract3,4. In addition to mucins, mucus layers also contain antimicrobial peptides, cytokines, and immunoglobulins5-9. The mucus layer is an important part of host innate immunity, and forms the first line of defense against invading microorganisms8,10-12. As such, the mucus is subject to numerous interactions with microbes, both pathogens and symbionts, and secreted mucins form an important interface for these interactions. The study of such biological interactions usually involves histological methods for tissue collection and staining. The two most commonly used histological methods for tissue collection and preservation in the clinic and in research laboratories are: formalin fixation followed by paraffin embedding, and tissue freezing, followed by embedding in cryo-protectant media.
Paraffin-embedded tissue samples produce sections with optimal qualities for histological visualization including clarity and well-defined morphology. However, during the paraffin embedding process a number of epitopes become altered and in order to study these epitopes, tissue sections have to be further processed with one of many epitope retrieval methods13. Secreted mucins and lipids are extracted from the tissue during the paraffin-embedding clearing step, which requires prolong incubation with organic solvents (xylene or Citrisolv). Therefore this approach is sub-optimal for studies focusing on the nature and distribution of mucins and mucus in vivo.
In contrast, freezing tissues in Optimal Cutting Temperature (OCT) embedding medium avoids dehydration and clearing of the sample, and maintains the sample hydration. This allows for better preservation of the hydrated mucus layer, and thus permits the study of the numerous roles of mucins in epithelial biology. As this method requires minimal processing of the tissue, the tissue is preserved in a more natural state. Therefore frozen tissues sections do not require any additional processing prior to staining and can be readily analyzed using immunohistochemistry methods.
We demonstrate the preservation of micrometers-thick secreted mucus layer in frozen colon samples. This layer is drastically reduced when the same tissues are embedded in paraffin. We also demonstrate immunofluorescence staining of glycan epitopes presented on mucins using plant lectins. The advantage of this approach is that it does not require the use of special fixatives and allows utilizing frozen tissues that may already be preserved in the laboratory.
протокол
1. Ткань вложение в октябре
- Подготовка замораживания ванну, добавив сухого льда 2-метил-бутана в неглубокую коробку из пенопласта.
- Урожай ткань и осторожно влажной на папиросной бумаге, чтобы высушить избыток жидкости. При использовании оснастки замороженной ткани (ткань, которая была заморожена в жидком азоте), позволяют ткани нагреться до -20 ° C, поместив его в крио-микротома камеры.
- Добавить небольшое количество октября в Peel-A-Way замораживания формы, достаточно, чтобы покрыть дно формы.
- Поместите ткань в форме, убедитесь, что ткань опиралась на дно формы в нужной ориентации. После заморожены, ткани блок будет секционного либо снизу или с боков.
- Накройте тканью с октября, и поместить форму в морозильной ванны. Соединение октября станет белым, как ткань замерзает.
- После заморожены, очистить плесень с замороженными блок и место в заметное замораживания сумку.
- Замороженные блоки могут быть сохраненыпри -80 ° С до использования.
2. Ткань Секционирование
- Место ткани блоков в крио-микротома камеры, и позволяет им достигать -20 ° C (примерно 30 минут).
- Вырезать 3-5 мкм раздел, и поместить положительно заряженные стекло в верхней части раздела. Ткань будет придерживаться слайд.
- Воздух сухой ткани в течение 30-60 мин.
- Слайды могут быть использованы на данном этапе, или же они могут храниться при -80 ° C для дальнейшего использования.
3. Окрашивание тканей
- Слайды, которые хранились при -80 ° C: позволяет слайды таять и сухой воздух при комнатной температуре в течение 30 мин.
- Исправить слайды с 10% буферном растворе формалина в течение 30 мин при комнатной температуре.
- Вымойте три раза в PBS или TBST буфера, для каждой стирки окунуть слайды в 10 раз по 250 мл буфера. PBS буфера может быть использован для иммунофлуоресцентного окрашивания, однако, для обнаружения хромогенных с щелочной фосфатазы Conjugated антитела, TBST должны быть использованы с фосфатом в PBS ингибирует активность щелочной фосфатазы.
- Срезы тканей слайды теперь готовы быть окрашены.
4. Использование Гистохимические пятен, таких как Alcian синий и периодических Шифф кислота обнаружить слизь
- Alcian синевы:
- Промыть слайдов в воде, инкубировать в 3% уксусной кислоты в течение 3 мин при комнатной температуре.
- Пятно с Alcian синий рН 2,5 раствор в течение 30 мин при комнатной температуре.
- Вымойте слайды в проточной воде в течение 10 мин, промыть в воде DI.
- Контрастирующая в ядерной Fast Red течение 5 мин при комнатной температуре.
- Wash скользит в три раза дистиллированной водой.
- Периодические Шифф кислота пятна:
- Промыть слайдов в воде, инкубировать в свежеприготовленного 1% периодического кислоты в течение 5 мин.
- Вымойте три раза дистиллированной водой, опустите сразу в воду miliQ.
- Пятно с Шифф реагента в течение 15 мин при комнатной температуре.
- Вымойте слайды в проточной воде в течение 10 мин, промыть в воде DI.
- Контрастирующая в Surgipath Hematoxylin в течение 30 сек при комнатной температуре.
- Wash скользит в три раза дистиллированной водой.
- Инкубируйте слайды 30 секунд в водопроводной воде Скотта при комнатной температуре.
- Вымойте три раза дистиллированной водой.
- Высушить и очистить слайдов путем инкубации 1 мин в 95% этаноле, а затем три быстрых изменений в 100% этаноле, и три изменений в Citrisolv, 2 мин каждый. Все при комнатной температуре.
- Установите слайды на покровные со смолистыми среды (Cytoseal 60).
5. Использование лектинов и антител (табл. 1) для обнаружения Glycan Эпитопы по гистохимических методов
- Для флуоресцентной детекции эпитопов из трех гликана использованием лектинов, блокировать слайды с 1% BSA в PBS в течение 10-30 мин при комнатной температуре.
- С биотинилированного лектина используется, блокировать эндогенного биотина путем инкубации 15 мин с 0,1%Авидин, а затем 15 мин инкубации с 0,01% биотина при комнатной температуре.
- Вымойте слайдов в PBS после каждой блокировки шаг.
- Свежий приготовить смесь из 1 мкг / мл родамина-сопряженных сукцинилированный зародышей пшеницы агглютининов (sWGA), 1,3 мкг / мл биотинилированного Бузина черная агглютининов (СНС) и 5 мкг / мл Fluorescein конъюгированных джакалин в HEPES / NaCl буфере (10 мМ HEPES, 150 мМ NaCl, рН 7,5).
- Место слайды на плоской поверхности или в окрашивании поле, а слой лектина смеси на вершине. Смесь объем может быть уменьшен, осторожно размещения парафильмом на жидкость, парафильмом объединяет жидкость и предотвращает испарение.
- Инкубировать 1 час при комнатной температуре в темноте.
- Wash скользит в три раза с PBS.
- Слой слайды с 0,7 мкг / мл стрептавидин-сопряженных Cy5 (для выявления биотинилированного-SNA), и инкубировать в течение 30 мин при комнатной температуре в темноте.
- Wash скользит в три раза с PBS.
- Контрастирующая ядер с 0,1 м иU, г / мл DAPI.
- Установите слайды на покровные водной среде, такой как VectaMount монтаж средств массовой информации (или любой водной среде).
6. Контроль за лектина Специфика Окрашивание
- Лектина специфику окрашивания контролируется либо по конкретным ферментативного расщепления целевой гликана эпитопа перед окрашиванием или конкуренции с малыми молекулами.
- Ферментативное расщепление для Бузина черная агглютининов (СНС) специфичность связывания
- Развести Arthrobacter ureafaciens сиалидазы (AUS) до 250 МЕ / мл в 50 мМ ацетата натрия рН 5,5.
- Добавить воду на дно пустого Tip-Box, это будет являться влажной камере во время инкубации.
- Место слайды лицевой стороной вверх на верхний лоток из Tip-Box, слой 150-200 мкл раствора AUS на слайд и накройте покровным стеклом. Избегайте образования пузырьков воздуха.
- Закройте крышку коробки и инкубировать при 37 ° C в течение 2,5 часов.
- Wash скользит три раза в PBS при комнатной температуреры, чтобы удалить все бесплатно сиаловых кислот. Эти слайды должны быть отрицательными для окрашивания СНС.
- Конкурентные ингибиторы джакалин и сукцинилированный зародышей пшеницы агглютининов (sWGA) специфичность
- Алиготе 200 мкл лектина смеси, приготовленной в шаге 5,4 до двух Eppendorf флаконах.
- Добавить 200 мМ мелибиозы (джакалин ингибитор) в один из флаконов и хитин-гидролизатом при разбавлении 1:10 (sWGA ингибитор) в другой флакон.
- Наложение негативные слайды управления с ингибиторами смесей, содержащих и инкубировать 1 час при комнатной температуре, в то же время, как остальные слайды. Эти слайды должны быть отрицательными для джакалин или sWGA окрашивания, соответственно.
7. Представитель Результаты
Сравнение образцов ткани в парафин замороженных тканей, встроенные в крио-защитного средства массовой информации (ОКТ) выявили поразительную разницу в сохранении и качество окрашивания для muciп гликопротеинов. Ткань окрашивания гистохимических красителей, таких как Alcian синий и периодических Шифф кислота, дают очень разные результаты в сопоставимых срезов тканей из замороженного или парафином образцов (рис. 1). Похоже, что органический растворитель (ксилол или Citrisolv), который используется в процессе вложения парафина влияет на распределение муцина на эпителии секретируемых а также удаление большей части гликолипидов из образцов (рис. 2). В результате, слой слизи появляется рухнул на клетки слизистой оболочки и встречается в основном у бокаловидных клеток. Вспышка замораживания тканей в крио-защитного средства массовой информации (ОКТ) поддерживается образца гидратации и сохранил секретируемых размеры муцинов слоя. Процесс парафин вложения сказывается на других слизи, связанных гликанов и гликолипидов аналогичным образом. Glycan распределению был исследован с помощью лектинов, которые обычно используются для обнаружения гликана (рис. 3) и антитела против эпитопов найти намуцина и гликолипидов (рис. 6). Из-за связывания лектинов не определена и зависит от пространственного распределения гликанов, а также структуры гликанов 14,15, важно, чтобы применить соответствующие меры контроля для лектина окрашивания. Здесь мы показываем два метода для управления лектина пятна на испытания тканей: ферментативного расщепления и конкурентного ингибирования. Расщепление эпитопов гликана было сделано путем переваривания срез ткани с гликана-специфических ферментов, например бактериального сиалидазы, как контроль за сиаловой кислоты связывания SNA (рис. 4). В случаях, когда специфический фермент (например, гликозидазой) не доступен для удаления гликана эпитопа изучены, специфичность лектина может быть подтверждена путем добавления конкурентным ингибитором, таких как мелибиозы для джакалин окрашивание или хитин-гидролизатом для окрашивания sWGA (рис. 5).
Мы демонстрируем здесь, что оснастка замороженных образцов тканей, которые ROUtinely, полученные в клинике и в научно-исследовательских лабораториях, могут быть дополнительно встроены в октябре и использоваться для изучения муцина гликопротеинов и многие гликанов присутствовать на них.
| Лектина / Ab | Источник | Основная специфика |
| LFA | Limax Флава (желтая пуля) | Терминал Sia |
| MAA * | Maackia амурская (Амурская Maackia) | Siaα2-3Galβ1-R / 3-O-сульфата на Galβ1-R |
| SNA | Бузина черная (бузины) | Siaα2-6Gal / Siaα2-6GalNAc |
| WGA | Triticum угри (зародышей пшеницы) | GlcNAcβ1-4GlcNAcβ1-4GlcNAc / Sia |
| sWGA | Сукцинилированный угри Triticum (зародышей пшеницы) | GlcNAc & BОП; 1-4GlcNAcβ1-4GlcNAc |
| PNA | Арахисовое hypogaea (арахис) | Galβ1-3GalNAc (немодифицированного T-антиген) |
| Джакалин | Artocarpus integrifolia, (джакалин) | Galβ1-3GalNAc найти на O-связанных гликанов |
| ECA | Erythrina cristagalli (Coral дерево) | Galβ1-4GlcNAc |
| TKH2 | Антитело | Siaa2-6GalNAc (STN) на O-связанных гликанов |
| CA19-9 | Антитело | Siaa2-3Galβ1-4 (Fuca1-3) GlcNAc (СКВ) |
| SNH3 | Антитело | Siaa2-3Galβ1-3 (Fuca1-4) GlcNAc (СКВ х) |
Сокращения: Ab, антитела, Sia, сиаловой кислоты; Гал, галактоза; GalNAc, N-ацетилгалактозамина; GlcNAc, N-ацетилглюкозамина; Fuc, Fucose, STN, сиалил Tn; SLe, сиалил Lewisa; SLe х, сиалил-Льюис х. * Коммерческие источники MAA включает Мали, MALII и MAH.
Таблица 1. Неполный список лектинов и антител к эпитопам гликана.

Рисунок 1. Alcian синий и периодического окрашивания Шифф кислота замороженных и парафиновых срезах тканей толстой кишки. Срезы тканей человека, мыши или образцах куриного толстой кишки заморожены в октябре (верхняя панель) или в парафин (нижняя панель) окрашивали с периодическими кислота Schiff (PAS) или Alcian Blue (AB). Эти реагенты пятна слизи, розовый или голубой, соответственно. Верхняя панель: в замороженных тканях, в дополнение к муцина в бокаловидных клеток, слизи, секретируемые также по отношениюible (стрелки). Нижняя панель: в парафин тканей, слизи окрашивания был прикован к бокаловидных клеток. Ядра контрастно Surgipath (PAS) или Майера (AB) Hematoxylin. Масштаб полоса указывает на 100 мкм. Нажмите, чтобы увеличить показатель .
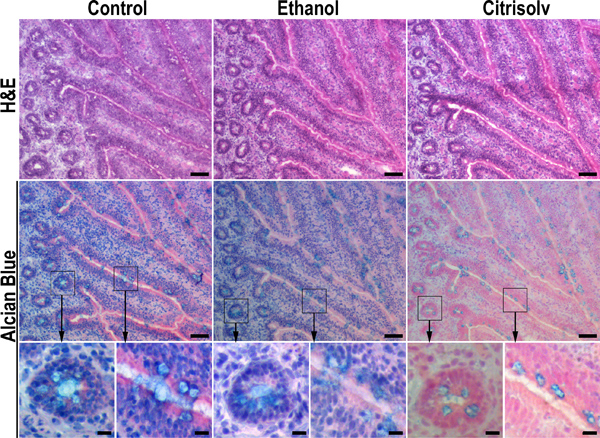
Рисунок 2. Citrisolv инкубации приводит к существенной потере муцинов. Серийные срезы замороженных образцах куриного подвздошной кишки были зафиксированы в 10% буферном растворе формалина и хранится гидратированный (слева), обезвоживали в этаноле последовательной инкубации в 70%, 90% и 100% этанола в течение 20 мин каждый (средняя панель), или обезвоженной в этаноле и согласованы с Citrisolv в течение 1 часа (правая панель). Высушенные образцы регидратации обратно в PBS до гематоксилином и эозином (H & E) или Alcian синего окрашивания. Обезвоживанию этанола и Citrisolv очистки тканей улучшенного морphology (например, верхнего ряда, среднего и правого изображений по сравнению с левым изображением). Этанол обезвоживания не оказали существенного влияния на Alcian синего окрашивания (средний ряд, сравнить левую и среднюю изображений). В отличие от Citrisolv инкубации уменьшено Alcian синего окрашивания и ограничивается его бокаловидных клеток (средний ряд, справа) в шаблон, который был похож на таковой в парафин ткани (рис. 1). Эти данные свидетельствуют о том, что сильное окрашивание слизистой гранул в парафин образцов связано с сокращением и конденсации слизи в бокаловидных клеток во время очистки шаг. Слабее и менее плотной окрашивания слизи в замороженном октября срезах тканей отражает более естественным распределением слизи в тканях. Высшее увеличениях в коробках области отмечены стрелками. Масштаб полоски показывают 50 мкм (верхний и средний ряды) и 10 мкм (нижний ряд).

Рисунок 3. Связываниелектинов в гликана эпитопов на замороженные и парафин тканей. Куриные тонкой кишки (подвздошной кишки) образцов замороженных в октябре (верхняя панель) или в парафин (нижняя панель) были исследованы с джакалин (синий), sWGA (зеленый) и SNA (красный ). Высшее увеличениях в коробках области отмечены стрелками. В замороженных тканей джакалин привязки к O-связанных гликанов показали структуры, которые, казалось, сочилась из бокаловидных клеток в просвет (джакалин, верхняя панель, стрелки). В отличие от джакалин привязки к парафин тканей был прикован к бокаловидных клеток (джакалин, нижняя панель, стрелки) и на границе ворсинки щетки (внизу слева изображение, стрелка). sWGA окрашивания β1-4GlcNAc частично совместно с локализованными связывания лектина джакалин в обоих замороженных тканей (верхняя панель, стрелки), а в парафин тканей (нижняя панель, стрелки). В отличие от СНС лектина привязки к α2-6 связан сиаловых кислот является внутриклеточным (SNA, наконечники стрел), а не ко-локализуются с джакалин (цветИзображение, SNA в красной стрелкой отмечен, джакалин в синий, отмеченные пунктирная стрелка). Масштаб полоски указывают на 100 мкм (слева изображения) и 20 мкм (увеличенный коробках районы).

Рисунок 4. Ферментативный контроль расщепления для окрашивания сиаловой кислоты с СНС. Куриные небольшие образцы кишечника инкубировали с 250 МЕ / мл Arthrobacter ureafaciens сиалидазы (AUS) или 50 мМ ацетата натрия, рН 5,5 буфере в течение 2,5 ч при температуре 37 ° C. AUS лечение отменяет окрашивание с биотинилированным SNA, подтверждающие СНС специфичность связывания с сиаловой кислоты. Масштаб полоса указывает на 100 мкм.
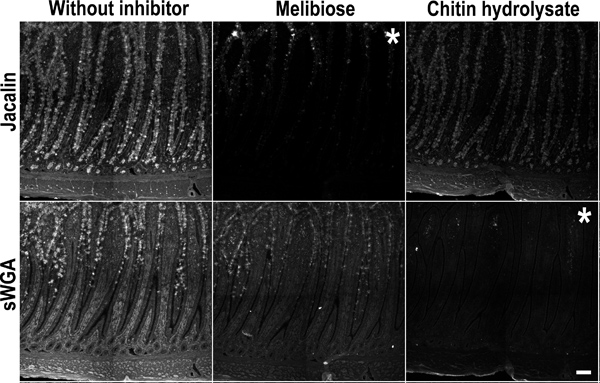
Рисунок 5. Конкурентное управление торможением для гликана окрашивания джакалин и sWGA. Куриные тонкой кишки (подвздошной кишки) образцы инкубировали со смесью джакалин и sWGA в присутствии конкретного лекцииолово ингибиторы: мелибиозы (средняя колонка), хитин-гидролизат (правая колонка) или без ингибитора (А и D). Верхняя панель: (слева) джакалин окрашивание без ингибиторов. (В центре) джакалин окрашивание подавляется мелибиозы. (Справа) хитин-гидролизатом не ингибирует джакалин окрашивания. Нижняя панель: (слева) sWGA окрашивание без ингибитора. (В центре) мелибиозы не ингибирует sWGA окрашивания. (Справа) sWGA окрашивание подавляется хитин-гидролизатом. Это торможение подтверждает специфическое взаимодействие лектинов с тканями. Звездочки знаком образ окрашивания торможения. Масштаб полоса указывает на 100 мкм.

Рисунок 6. Обнаружение секреторных муцин, гликолипиды и гликана эпитопов в замороженных тканях человека колоректального рака. Колоректального рака биопсия ворсинок от рака и рака слизистой были оснастку замороженной в жидком азоте и встроенные в октябре Срезы тканей инкубировали в течение 1 чс антителами против выделяется муцина MUC5AC, сиалил-Льюис - гликана эпитопа найти на ганглиозидов (колоректальный рак маркера СА 19-9), и сиалил-Tn - обильные эпитопа гликана на муцин (обнаружен с TKH2 антитела), а затем 30 мин инкубации с биотинилированного осла анти-мышиных IgG вторичные антитела, и через 30 мин инкубации с пероксидазой сопряженных стрептавидином. Дополнительная тканей инкубировали в течение 1 часа с биотинилированным лектинов СНС и sWGA, а затем 30 мин инкубации с пероксидазой сопряженных стрептавидином. Пероксидазы окрашивания был разработан с использованием AEC комплект. Черные шкалы указывает 200 мкм.
Обсуждение
Сохранение слизи и гликана эпитопов в замороженных тканях выше, чем в тканях, которые были внедрены в парафин. Мы продемонстрировали сохранение секретируемых слой слизи (рис. 1 и 3) и распределения из трех гликанов структуры (рис. 3) в замороженных тканях по сравнению с парафином тканях. Специализированная фиксаторы, такие, как решение Карнуа (60% этанола, 30% хлороформа, 10% уксусной кислоты) 17 были разработаны для оптимального сохранения слизистого слоя в образцах тканей. Оптимально, это решение должно быть использован для сбора образцов ткани, которые предназначены для исследования слизи и был показан сохранить гладкую появление слизи слоем 16-17. Слой слизи в незаписанных замороженные образцы встроенные в октябре появляется прочная и в некоторых районах может отделяться от тканей, однако общая толщина слоя находится в согласии с этим наблюдается в тканях, которые были зафиксированы с решением Карнуа и embeddред в парафин 16-17. Например, слой слизи в замороженных тканях человека разделе толстой кишки составляет ~ 100 мкм (рис. 1), которая находится в пределах сообщалось Carnoy's фиксированной человека образца толстой кишки 55,4 ± 2,5 мкм (в диапазоне 7,7 - 204,8 мкм) 16.
Она была известна на протяжении десятилетий, что этанол приводит к обезвоживанию ~ 30% сокращение биологических образцов 18, и что органические растворители, такие как ксилол, хлороформ и Citrisolv экстракт липидов, гликолипидов и, в некоторой степени, белков из тканей 13. Ткань для обработки парафин вложения включает в себя следующие действия: фиксация (10% буферном растворе формалина), обезвоживание (увеличение концентрации этанола) и очистки (Citrisolv или ксилол). По имитируя эти действия на нефиксированные замороженных срезов ткани, мы показали, что Citrisolv извлекает слизи из замороженных срезов ткани в результате чего ткани морфологии, который похож на парафин тканей (FigurE 2, справа). В отличие от слизистого слоя не была изменена путем инкубации с формалином или этанола (рис. 2, слева и в центре панели). Это говорит о том, что на поляне шаг стандартная процедура вложения парафин, который требует длительной инкубации в Citrisolv / ксилол, приводит к краху слой слизи. Формалин фиксации не повредить слой слизи и замороженных срезов тканей, которые были зафиксированы с формалином может быть легко окрашивается с лектинов и антител против гликанов, гликолипиды и белки (рис. 2, 3 и 6). Эти эффекты могут быть незначительными для изучения мембран-связанных белков и тканей патологии, но они являются разрушительными для высоко гидратированных структур, таких как выделяемый слой слизи. Однако гистологические исследования муцина по-прежнему осуществляются преимущественно с парафином образцов, в которых сохранение слой слизи является оптимальным решением. В углубленный анализ слой слизи композиции, такие как точная идентичность себеcreted или мембраносвязанных MUC комбинации гликопротеин требуют специфических антител и масс-спектрометрии для идентификации белков магистралей. Сохранение слой слизи является лишь начальным требованиям для таких исследований.
Многие лаборатории образцы тканей замораживали в октябре, что было собрано в прошлом для различных проектов, эти ткани могут быть легко использованы для изучения муцин, гликолипиды и гликана распределения избавляя пользователя от необходимости собирать тканей в специальных фиксаторов, которые предназначены исключительно для сохранения слизи. Замороженные ткани подвергаются минимальной обработке, и поэтому естественное распределение гликанов, которые являются гидратированные в природе, сохраняется. Это особенно важно в области микробных-хозяин взаимодействий. Знание натуралистического распределение и численность муцинов секретируемых и многие структуры гликанов украшении этих "барьеров" молекул будет ключевым в понимании иммунной защиты, микробные эксплуатации и возбудителиесть.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы хотели бы поблагодарить Николь М. Немет (Университет штата Джорджия) и Жанна М. Fair (LANL) за помощь в уборке куриные тканей, и Steven A. Springer за его помощь во время съемок. Обо всех птиц в этом исследовании был в соответствии с Национальными Институтами Здоровья руководящие принципы для гуманного использования лабораторных животных, а все протоколы были одобрены Институциональные уходу и использованию животных комитета в Лос-Аламосской национальной безопасности, LLC, оператор в Лос-Аламосе Национальная лаборатория по контракту № DE-AC52-06NA25396 с министерством энергетики США. Уход за мышами в данном исследовании, в соответствии с UCSD животных утвержденным протоколом. Ткани человека были получены в рамках UCSD протокол IRB утвержден. Эта работа была поддержана грантом 118645 из Университета Калифорнии Лаборатории стоимость программы Президента (PG) и гранта NS047101 из Национального института неврологических расстройств и инсульта (Neuroscience микроскопии общего фонда, UC San Diego).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагентов и оборудования | Компания | Номер в каталоге | |
| 2-метил-бутана | Fisher Scientific | 03551-4 | |
| AEC пероксидазы подложки комплект | Vector Labs | SK-4200 | |
| Alcian синий | Sigma-Aldrich | A3157 | |
| Anti-CA 19-9 моноклональных антител | Calbiochem | CA1003 | |
| Anti-MUC5AC моноклональных антител | Millipore | MAB2011 | |
| Авидин-биотин блокировка комплект | Vector Labs | SP-2001 | |
| Биотинилированные осла анти-мышиных антител | Джексон Immunoresearch | 90863 | |
| Биотинилированные SNA | Vector Labs | B-1305 | |
| Бычий сывороточный Албумин | Sigma-Aldrich | A4503 | |
| Хитин-гидролизатом | Vector Labs | SP-0090 | |
| Криостат микротома | Leica Microsystems | Leica CM 1800 | |
| Гематоксилин | Surgipath медицинский штат Индиана | 3801570 | |
| Перекись водорода 30% | Fisher Scientific | H325-100 | |
| Джакалин-FITC | Vector Labs | FL-1151 | |
| Майер Hematoxylin | Sigma-Aldrich | MHS32 | |
| Мелибиозы | Sigma-Aldrich | M5500 | |
| Ядерная Fast Red | Vector Labs | H-3403 | |
| Октябрь соединение | VWR International | 25608-930 | |
| Пероксидазой стрептавидин | Джексон Immunoresearch | 94638 | |
| Шифф реагентов | Электрон науки микроскопии | 26052 | |
| sWGA-родамина | Vector Labs | RL1022S | |
| TKH2 моноклональных антител | ATCC | HB-9654 | |
| VectaMount водного монтаж СМИ | Vector Labs | H-5501 | |
| Cytoseal 60 | Thermo Scientific | 8310-4 | |
| Peel-A Way формы | Polysciences Инк | 18646A-1 |
Ссылки
- Slayter, H. S., Wold, J. K., Midtvedt, T. Intestinal mucin of germ-free rats. Biochemical and electron-microscopic characterization. Carbohydr. Res. 222, 1-9 (1991).
- Lamblin, G. The carbohydrate diversity of human respiratory mucins: a protection of the underlying mucosa. Am. Rev. Respir. Dis. 144, S19-S24 (1991).
- Corfield, A. P., Carroll, D., Myerscough, N., Probert, C. S. Mucins in the gastrointestinal tract in health and disease. Front. Biosci. 6, D1321-D1357 (2001).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nat. Rev. Immunol. 9, 799-809 (2009).
- Lievin-Le Moal, V., Servin, A. L. The front line of enteric host defense against unwelcome intrusion of harmful microorganisms: mucins, antimicrobial peptides, and microbiota. Clin. Microbiol. Rev. 19, 315-337 (2006).
- Kim, Y. S., Ho, S. B. Intestinal goblet cells and mucins in health and disease: recent insights and progress. Curr. Gastroenterol. Rep. 12, 319-330 (2010).
- Nochi, T., Kiyono, H. Innate immunity in the mucosal immune system. Curr. Pharm. Des. 12, 4203-4213 (2006).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: soldier in the fight against respiratory viruses. Clin. Microbiol. Rev. 24, 210-229 (2011).
- McGuckin, M. A., Linden, S. K., Sutton, P., Florin, T. H. Mucin dynamics and enteric pathogens. Nat. Rev. Microbiol. 9, 265-278 (2011).
- Knowles, M. R., Boucher, R. C. Mucus clearance as a primary innate defense mechanism for mammalian airways. J. Clin. Invest. 109, 571-577 (2002).
- Johansson, M. E. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria. Proc. Natl. Acad. Sci. U.S.A. 105, 15064-15069 (2008).
- Hooper, L. V., Macpherson, A. J. Immune adaptations that maintain homeostasis with the intestinal microbiota. Nat. Rev. Immunol. 10, 159-169 (2010).
- Hayat, M. A., Hayat, M. A. . Microscopy, Immunohistochemistry, and Antigen Retrieval Methods: For Light and Electron Microscopy. , 53-70 (2002).
- Cohen, M., Hurtado-Ziola, N., Varki, A. ABO blood group glycans modulate sialic acid recognition on erythrocytes. Blood. 114, 3668-3676 (2009).
- Cohen, M., Varki, A. The sialome--far more than the sum of its parts. OMICS. 14, 455-464 (2010).
- Ota, H., Katsuyama, T. Alternating laminated array of two types of mucin in the human gastric surface mucous later. Histochemical J. 24, 86-92 (1992).
- Matsuo, K., Ota, H., Akamatsu, T., Sugiyama, A., Katsuyama, T. Histochemistry of the surface mucous gel layer of the human colon. Gut. 40, 782-789 (1997).
- Boyde, A., Maconnachie, E. Treatment with lithium salts reduces ethanol dehydration shrinkage of glutaraldehyde fixed tissue. Histochemistry. 66, 181-187 (1980).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены