Method Article
Utilizzo non fissati, tessuti congelati allo Studio di distribuzione naturale Mucina
In questo articolo
Riepilogo
Non fissati campioni di tessuto congelato incorporati nel terreno ottimale temperatura di taglio (OCT) possono essere utilizzati per studiare la distribuzione naturale e glicosilazione di muco secreto. In questa elaborazione tessuto approccio è minimo e la presentazione naturale di glicolipidi, mucine e glicano-epitopi è conservato. Le sezioni di tessuto possono essere analizzati mediante immunoistochimica con rivelatore a fluorescenza o cromogenico.
Abstract
Mucine sono complesse e fortemente glicosilata O-linked glicoproteine, che contengono più del 70% in peso di carboidrati 1-3. Mucine secrete, prodotto dalle cellule caliciformi e della mucosa gastrica, forniscono l'impalcatura per un micrometri di spessore strato di muco che le linee epiteliali dell'intestino e del tratto respiratorio 3,4. Oltre a mucine, strati di muco contengono anche peptidi antimicrobici, citochine, e immunoglobuline 5-9. Lo strato di muco è una parte importante di immunità innata accoglienza, e costituisce la prima linea di difesa contro l'invasione dei microrganismi 8,10-12. Come tale, il muco è soggetto a numerose interazioni con microbi, entrambi i patogeni e simbiotici, e mucine secrete costituiscono un'importante interfaccia per queste interazioni. Lo studio di tali interazioni biologiche di solito comporta metodi istologici per la raccolta dei tessuti e colorazione. I due metodi più comunemente utilizzati per la raccolta dei tessuti istologici e Preservzione nella clinica e nei laboratori di ricerca sono: la fissazione in formalina seguita da paraffina, e il congelamento dei tessuti, seguita da incorporamento nel crio-protectant media.
Incluso in paraffina di campioni di tessuto produrre sezioni con caratteristiche ottimali per la visualizzazione istologica tra cui la chiarezza e ben definita morfologia. Tuttavia, durante il processo di paraffina incorporare un numero di epitopi si alterano e per studiare questi epitopi, sezioni di tessuto devono essere ulteriormente trasformati con uno dei molti metodi smascheramento 13. Mucine secrete e lipidi vengono estratti dal tessuto durante la paraffina-embedding passo di compensazione, che richiede prolungare l'incubazione con solventi organici (xilene o Citrisolv). Pertanto questo approccio è sub-ottimale per studi focalizzati sulla natura e la distribuzione di mucine e muco in vivo.
Al contrario, i tessuti di congelamento a temperature di taglio ottimale (OCT) incorporando un supportovuoti disidratazione e di compensazione del campione, e mantiene l'idratazione del campione. Questo permette una migliore conservazione del muco strato idratato, e consente quindi lo studio dei ruoli numerose mucine in biologia epiteliale. Poiché questo metodo richiede un trattamento minimo del tessuto, il tessuto viene mantenuto in uno stato più naturale. Pertanto sezioni congelate tessuti non richiedono alcuna ulteriore elaborazione prima della colorazione e può essere facilmente analizzati utilizzando metodi di immunoistochimica.
Dimostriamo la conservazione di micrometri di spessore strato di muco secreto in campioni congelati colon. Questo strato viene drasticamente ridotta quando i tessuti stessi sono inclusi in paraffina. Abbiamo anche mostrare una colorazione immunofluorescenza di epitopi glycan presenti in mucine con lectine vegetali. Il vantaggio di questo approccio è che non richiede l'uso di fissativi speciali e permette con tessuti congelati che possono già essere conservati in laboratorio.
Protocollo
1. Embedding Tissue in OCT
- Preparare un bagno di congelamento con l'aggiunta di ghiaccio secco a 2-metil butano in una scatola di polistirolo poco profonda.
- Raccogliere il tessuto, e delicatamente umido su un fazzoletto di carta per asciugare il liquido in eccesso. Se si utilizza lo snap-frozen tessuto (tessuto che è stato congelato in azoto liquido), consentono il tessuto riscaldare fino a -20 ° C, collocandolo in un microtomo crio-camera.
- Aggiungere una piccola quantità di Office per il Peel-A-Way stampo congelamento, quanto basta per coprire il fondo dello stampo.
- Posizionare il tessuto nello stampo, assicurarsi che il tessuto viene appoggiato sul fondo dello stampo l'orientamento desiderato. Una volta congelato, il blocco di tessuto sarà sezionato o dal basso o dai lati.
- Coprire il tessuto con OCT, e mettere lo stampo nel bagno di congelamento. Il composto ottobre diventa bianca come il tessuto si blocca.
- Una volta congelato, sbucciare lo stampo fuori dal blocco congelato e mettere in un sacco marcata congelamento.
- I blocchi possono essere conservati congelatia -80 ° C fino all'utilizzo.
2. Tissue Sezionamento
- Tessuto Collocare dei blocchi nella crio-microtomo camera, e consentire loro di raggiungere -20 ° C (circa 30 min).
- Tagliare una sezione 3-5 um di spessore, e posizionare un vetrino caricato positivamente sulla sommità della sezione. Il tessuto si atterrà alla diapositiva.
- Far asciugare i tessuti per 30-60 min.
- Le slitte possono essere utilizzati in questa fase, oppure possono essere conservati a -80 ° C per utilizzo futuro.
3. Colorazione dei tessuti
- Vetrini che sono stati conservati a -80 ° C: lasciare che i vetrini di scongelare e asciugare a temperatura ambiente per 30 min.
- Fissare i vetrini con il 10% formalina per 30 min a temperatura ambiente.
- Lavare tre volte in PBS o tampone TBST, per ogni lavaggio immergere i vetrini per 10 volte in 250 ml di tampone. Tampone PBS può essere utilizzato per la colorazione di immunofluorescenza, tuttavia, per la rilevazione cromogenica con fosfatasi alcalina conjugated anticorpo, TBST deve essere utilizzato in quanto il fosfato in PBS inibisce l'attività della fosfatasi alcalina.
- Le sezioni di tessuto vetrini sono ora pronti per essere colorati.
4. Utilizzando Macchie istochimici come Alcian Blu e Schiff acido periodico per rilevare Muco
- Alcian Blu macchia:
- Sciacquarli con acqua, incubare in acido acetico al 3% per 3 minuti a temperatura ambiente.
- Macchia con Alcian blu pH 2,5 soluzione per 30 minuti a temperatura ambiente.
- Lavare i vetrini in acqua corrente per 10 minuti, sciacquare in acqua deionizzata.
- Di contrasto in Nuclear Fast Red per 5 minuti a temperatura ambiente.
- Lavare i vetrini tre volte in acqua deionizzata.
- Schiff acido periodico macchia:
- Sciacquarli con acqua, incubare in appena preparato acido periodico 1% per 5 min.
- Lavare tre volte in acqua deionizzata, immergere in acqua una volta miliQ.
- Colorare con il reagente di Schiff per 15 minuti a Temperatura ambientee.
- Lavare i vetrini in acqua corrente per 10 minuti, sciacquare in acqua deionizzata.
- Di contrasto in ematossilina Surgipath per 30 secondi a temperatura ambiente.
- Lavare i vetrini tre volte in acqua deionizzata.
- Incubare i vetrini 30 sec in acqua di rubinetto Scott a temperatura ambiente.
- Lavare tre volte in acqua deionizzata.
- Disidratare e cancellare diapositive incubando 1 min in etanolo al 95%, seguita da tre rapidi cambi di etanolo al 100%, e tre variazioni Citrisolv, 2 minuti ciascuno. Il tutto a temperatura ambiente.
- Montare i vetrini coprioggetto con il supporto resinoso (Cytoseal 60).
5. Utilizzo di lectine e anticorpi (Tabella 1) per rilevare epitopi glicano con i metodi istochimici
- Per la rivelazione della fluorescenza di tre epitopi glycan utilizzando lectine, bloccare i vetrini con 1% BSA in PBS per 10-30 min a temperatura ambiente.
- Poiché una lectina biotinilato viene utilizzato, bloccare biotina endogena mediante incubazione 15 min con 0,1%Avidina, seguito da 15 minuti di incubazione con biotina 0,01% a temperatura ambiente.
- Lavare i vetrini in PBS dopo ogni passaggio di blocco.
- Appena preparare una miscela di 1 ug / ml rodamina coniugata agglutinina di germe di grano succinilata (sWGA), 1,3 mg / ml biotinilato Sambucus nigra agglutinina (SNA) e 5 pg / ml di fluoresceina coniugato Jacalin in HEPES / NaCl tampone (10 mM HEPES, 150 mM NaCl pH 7,5).
- Collocare i vetrini su una superficie piana o in una scatola di colorazione, e la miscela di lectina strato sulla parte superiore. Il volume di miscela può essere ridotto leggermente posizionando parafilm sul liquido, il parafilm appiattisce il liquido e previene l'evaporazione.
- Incubare 1 ora a temperatura ambiente al buio.
- Lavare i vetrini tre volte con PBS.
- Vetrini strato con 0,7 ug / ml coniugato streptavidina-Cy5 (per rilevare la biotinilato-SNA), e incubare per 30 min a temperatura ambiente al buio.
- Lavare i vetrini tre volte con PBS.
- Controcolorare nuclei con 0.1 & mu, g / ml DAPI.
- Montare i vetrini coprioggetto con il mezzo acquoso come VectaMount mezzo di montaggio (o qualsiasi altro supporto acquosi).
6. Controllando per Specificità colorazione lectina
- Specificità colorazione lectina è controllato mediante clivaggio enzimatico specifico di bersaglio glicano epitopo prima della colorazione o da competizione con piccole molecole.
- Clivaggio enzimatico per Sambucus nigra agglutinina (SNA) specificità di legame
- Diluire Arthrobacter ureafaciens sialidasi (AUS) a 250 mU / ml in 50 mM acetato di sodio pH 5.5.
- Aggiungere acqua al fondo di un vuoto tip-box, questo formerà una camera umida durante l'incubazione.
- Collocare i vetrini a faccia in su nel vassoio superiore della punta-box, strato 150-200 ul di soluzione AUS sul vetrino e coprire con un vetrino coprioggetti. Evitare la formazione di bolle d'aria.
- Chiudere il coperchio della scatola e incubare a 37 ° C per 2,5 h.
- Lavare i vetrini tre volte in PBS a temperare cameraratura per rimuovere tutti gli acidi liberi sialico. Queste diapositive dovrebbe essere negativo per la colorazione SNA.
- Inibitori competitivi per Jacalin succinilata e germe di grano agglutinina (sWGA) specificità
- Aliquotare 200 pl della miscela lectina preparato nella fase 5,4 a due flaconcini Eppendorf.
- Aggiungere 200 mM melibiosio (inibitore Jacalin) ad una delle fiale e Chitin-idrolizzato a diluizione 1:10 (sWGA inibitore) alla fiala.
- Vetrini di controllo negativi con l'overlay contenente inibitori miscela e incubare 1 ora a temperatura ambiente al tempo stesso come il resto delle diapositive. Queste diapositive dovrebbe essere negativo per Jacalin o colorazione sWGA, rispettivamente.
7. Risultati rappresentativi
Un confronto tra i campioni di tessuto inclusi in paraffina di tessuti congelati incorporati in crio-protectant media (OCT) ha rivelato notevole differenza nella conservazione e la qualità della colorazione per Mucin glicoproteine. Colorazione dei tessuti con coloranti istochimiche, come Alcian Blu e acido periodico Schiff, producono risultati molto diversi in sezioni di tessuto comparabili da campioni congelati o incorporati paraffina (Figura 1). Sembra che il solvente organico (xilene o Citrisolv) che viene utilizzata durante il processo di paraffina influenza la distribuzione di mucine secrete sulla epiteli nonché eliminando gran parte dei glicolipidi dai campioni (Figura 2). Come risultato, lo strato di muco appare collassata sulle cellule della mucosa e si trova soprattutto nelle cellule caliciformi. Flash congelamento dei tessuti in crio-protectant supporti (OCT) ha mantenuto l'idratazione del campione e conservato le dimensioni mucine strato secrete. Il processo di paraffina influenzata altre muco-glicani e glicolipidi associati in un modo simile. Distribuzione glicano stata esaminata usando lectine, che vengono abitualmente utilizzati per il rilevamento glicano (Figura 3) e anticorpi contro epitopi presenti sullamucine e glicolipidi (Figura 6). Perché lectina legante non è ben definito ed è influenzata dalla distribuzione spaziale dei glicani nonché la struttura glicano 14,15, è importante applicare gli opportuni controlli per la colorazione lectina. Qui mostriamo due metodi per controllare la colorazione lectina sui tessuti esaminati: scissione enzimatica e inibizione competitiva. Clivaggio degli epitopi glycan è stato fatto digerire con la sezione di tessuto glicano-specifici enzimi, per esempio sialidasi batteriche come controllo per l'acido sialico vincolante SNA (Figura 4). Nei casi in cui l'enzima specifico (ad esempio glicosidasi) non è disponibile per la rimozione del epitopo glicano studiato, lectina specificità può essere confermato con l'aggiunta di un inibitore competitivo come melibiosio per colorazione Jacalin o Chitin-idrolizzato per la colorazione sWGA (Figura 5).
Dimostriamo qui che snap-congelati campioni di tessuto, che sono routinely ottenuti in clinica e in laboratori di ricerca, può essere ulteriormente integrato in ottobre e utilizzati per studiare le glicoproteine mucina e molti glicani presenti su di essi.
| Lectina / Ab | Fonte | Maggiore specificità |
| LFA | Limax flavus (slug Giallo) | Sia Terminal |
| MAA * | Maackia amurensis (Amur Maackia) | Siaα2-3Galβ1-R / 3-O-solfato sulle Galβ1-R |
| SNA | Sambucus nigra (Sambuco) | Siaα2-6Gal / Siaα2-6GalNAc |
| WGA | Triticum vulgaris (germe di grano) | GlcNAcβ1-4GlcNAcβ1-4GlcNAc / Sia |
| sWGA | Triticum vulgaris succinilata (germe di grano) | GlcNAc & beta, 1-4GlcNAcβ1-4GlcNAc |
| PNA | Arachis hypogaea (arachidi) | Galβ1-3GalNAc (non modificato T-antigene) |
| Jacalin | Artocarpus integrifolia (Jacalin) | Galβ1-3GalNAc trovato su O-linked glicani |
| Corte dei conti | Erythrina cristagalli (albero corallo) | Galβ1-4GlcNAc |
| TKH2 | Anticorpo | Siaa2-6GalNAc (STN) su O-linked glicani |
| CA19-9 | Anticorpo | Siaa2-3Galβ1-4 (Fuca1-3) GlcNAc (SLE a) |
| SNH3 | Anticorpo | Siaa2-3Galβ1-3 (Fuca1-4) GlcNAc (SLE x) |
Abbreviazioni: Ab, anticorpi, Sia, acido sialico, Gal, galattosio, GalNAc, N-acetilgalattosammina; GlcNAc, N-acetilglucosamina, Fuc, Fucose, STN, sialil Tn, un SLE, sialil Lewisa, SLE x, x sialil Lewis. * Fonti commerciali per MAA sono MALI, MALII & MAH.
Tabella 1. Una lista parziale di lectine e anticorpi per epitopi glycan.

Figura 1. Alcian Blu e Periodic Acid Schiff colorazione dei tessuti del colon congelati e inclusi in paraffina. Sezioni di tessuto di origine umana, mouse o campioni del colon pollo congelati in OCT (pannello superiore) o inclusi in paraffina (pannello inferiore) sono state colorate con acido periodico di Schiff (PAS) o Alcian blu (AB). Questi reagenti macchia di muco rosa o blu, rispettivamente. Pannello superiore: Nei tessuti congelati, oltre alle mucine in cellule caliciformi, muco secreto è stato anche neibile (frecce). Pannello inferiore: In tessuti inclusi in paraffina, colorazione muco si limitava a cellule caliciformi. I nuclei sono stati di contrasto con Surgipath (PAS) o di Mayer (AB) ematossilina. Bar Scala indichi 100 micron. Clicca qui per ingrandire la figura .
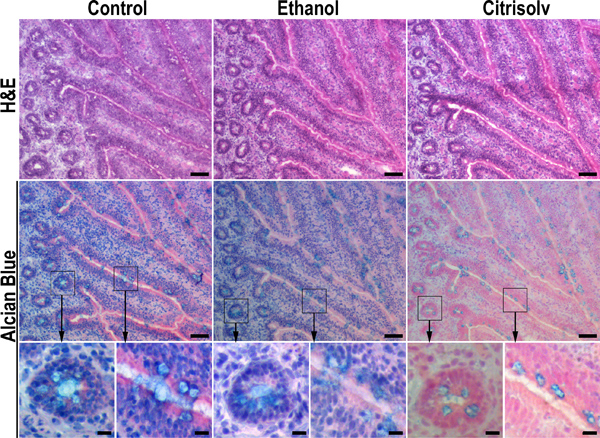
Figura 2. Risultati incubazione Citrisolv in perdita sostanziale di mucine. Sezioni seriali di campioni congelati ileo pollo sono state fissate in formalina tamponata al 10% e mantenuto idratato (pannello sinistro), disidratati in etanolo mediante incubazione sequenziale nel 70%, 90% e 100% etanolo per 20 min ciascuna (pannello centrale), o disidratati in etanolo ed eliminato con Citrisolv per 1 ora (pannello destro). Campioni disidratati sono stati reidratati torna alla PBS prima di ematossilina e eosina (H & E) o Alcian colorazione blu. Etanolo disidratazione e Citrisolv compensazione migliore tessuto mormorfologia (ad esempio, riga superiore, le immagini al centro ea destra rispetto a immagine a sinistra). Disidratazione etanolo ha avuto alcun effetto significativo sulla colorazione Alcian blu (riga di mezzo, confrontare le immagini sinistra e al centro). In contrasto, l'incubazione Citrisolv ridotto Alcian colorazione blu e confinato a cellule caliciformi (fila centrale, destro) in un modello che era simile a quella osservata nei tessuti inclusi in paraffina (Figura 1). Questi dati implicano che la colorazione forte di granuli di muco in inclusi in paraffina di campioni è dovuta alla contrazione e condensazione di muco nelle cellule calice durante la fase di compensazione. La colorazione più debole e meno denso di muco nelle congelati OTT-incorporati tessuti riflette una distribuzione più naturale di muco nel tessuto. Più elevati ingrandimenti delle aree in scatola sono contrassegnati con le frecce. Barre di scala indicano 50 pm (righe superiore e medio) e 10 micron (riga in basso).

Figura 3. Il legame dilectine per epitopi glycan sui tessuti congelati e inclusi in paraffina. pollo piccolo intestino (ileo) campioni congelati in OCT (pannelli superiori) o inclusi in paraffina (pannelli inferiori) sono stati sondati con Jacalin (blu), sWGA (verde) e SNA (rosso ). Più elevati ingrandimenti delle aree in scatola sono contrassegnati con le frecce. Nei tessuti congelati legame O-linked glicani Jacalin rivelato strutture che sembravano essere trasudano dalle cellule calice nel lume (Jacalin, pannello superiore, frecce). Al contrario, vincolante per i tessuti inclusi in paraffina Jacalin si limitava a cellule caliciformi (Jacalin, pannello inferiore, frecce) e al confine pennello villi (in basso a sinistra dell'immagine, freccia). colorazione sWGA di β1-4GlcNAc parzialmente co-localizzato con il legame della lectina Jacalin in entrambi i tessuti congelati (pannello superiore, frecce), e inclusi in paraffina tessuti (pannello inferiore, frecce). In contrasto, lectina SNA legame α2-6 acidi sialici collegati è intracellulare (SNA, frecce), e non co-localizza con Jacalin (coloreimmagine, SNA in rosso contrassegnato con punta di freccia, Jacalin in blu contrassegnata con la freccia tratteggiata). Barre di scala indicano 100 micron (immagini a sinistra) e 20 micron (ingrandite aree in scatola).

Figura 4. Controllo clivaggio enzimatico per colorazione acido sialico con SNA. Campioni intestino piccolo pollo sono state incubate con 250 mU / ml Arthrobacter ureafaciens sialidasi (AUS) o con 50 mM sodio acetato pH 5,5 tampone per 2,5 ore a 37 ° C. AUS trattamento abolisce colorazione con biotinilato SNA, confermando specificità di legame SNA agli acidi sialico. Bar Scala indica 100 micron.
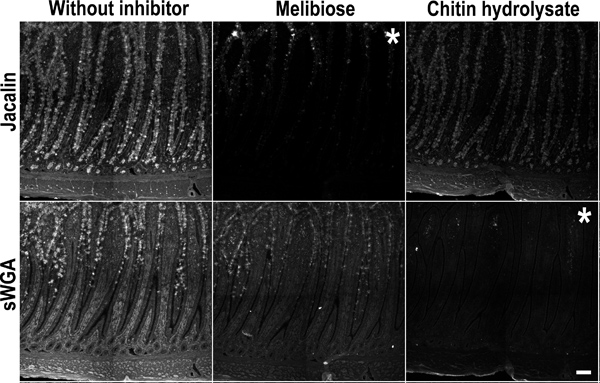
Figura 5. Controllo di inibizione competitiva per la colorazione glicano con Jacalin e sWGA. Pollo piccolo intestino (ileo) campioni sono stati incubati con una miscela Jacalin e sWGA in presenza di specifici lecInibitori stagno: melibiosio (colonna centrale), chitina-idrolizzato (colonna di destra) o senza inibitore (A e D). Pannello superiore: (a sinistra) colorazione Jacalin senza inibitori. (Al centro) colorazione Jacalin è stato inibito da melibiosio. (A destra) La chitina-idrolizzato non ha inibito la colorazione Jacalin. Pannello inferiore: (a sinistra) colorazione sWGA senza inibitore. (Al centro) melibiosio non ha inibito la colorazione sWGA. (A destra) colorazione sWGA è stato inibito da chitina-idrolizzato. Questo conferma l'inibizione specifica interazione delle lectine con i tessuti. Asterischi immagine segno di inibizione colorazione. Bar Scala indica 100 micron.

Figura 6. Rilevamento di mucine secretori, glicolipidi e epitopi glycan congelati in tessuti umani di cancro del colon-retto. Biopsie di cancro del colon-retto da carcinoma dei villi e carcinoma muco erano snap-congelati in azoto liquido e integrato in ottobre Sezioni di tessuto sono state incubate per 1 hcon anticorpi contro la mucina secreta MUC5AC, sialil Lewis a - glicano epitopo trovato il gangliosidi (tumore colorettale marcatore CA 19-9), e sialil-Tn - abbondante epitopo glicano sulla mucine (rilevato con TKH2 anticorpo), seguito da 30 minuti di incubazione con asino biotinilato anti-IgG di topo anticorpo secondario, e 30 minuti di incubazione con streptavidina coniugata a perossidasi. Altri tessuti sono state incubate per 1 ora con l'biotinilato lectine SNA e sWGA, seguiti da 30 minuti di incubazione con streptavidina coniugata a perossidasi. Colorazione con perossidasi è stato sviluppato utilizzando AEC kit. Barra della scala nera indica 200 micron.
Discussione
Conservazione di epitopi muco e glicano in tessuti congelati è superiore a quella dei tessuti che sono stati incorporati in paraffina. Abbiamo dimostrato la conservazione di strato di muco secreto (figure 1 e 3) e la distribuzione di tre strutture glicani (Figura 3) in tessuti congelati rispetto paraffinati tessuti. Fissativi specializzati, come soluzione di Carnoy (60% etanolo, 30% cloroformio, acido acetico 10%) 17 sono stati sviluppati per la conservazione ottimale dello strato di muco in campioni di tessuto. In modo ottimale, la soluzione dovrebbe essere utilizzato per raccogliere campioni di tessuto che sono dedicati per studi muco e ha dimostrato di mantenere l'aspetto liscio strato di muco 16-17. Lo strato di muco non fissate in campioni congelati in OCT incorporato appare robusto e in alcune zone possono staccarsi dal tessuto, tuttavia lo spessore complessivo è in accordo con quello osservato nei tessuti che sono stati risolti con la soluzione di Carnoy e embedded in paraffina 16-17. Ad esempio, lo strato di muco congelate in sezione di tessuto umano del colon è ~ 100 um (Figura 1), che è all'interno dell'intervallo riportato per Carnoy's-campionamento fissa colon umano 55,4 ± 2,5 micron (range 7,7-204,8 micron) 16.
E 'noto da decenni che risultati disidratazione in etanolo ~ restringimento 30% dei campioni biologici 18, e che i solventi organici come xilene, Citrisolv e cloroformio lipidi, glicolipidi e, in qualche misura, proteine dai tessuti 13. Trasformazione dei tessuti per la paraffina comprende le seguenti fasi: fissazione (formalina tamponata al 10%), disidratazione (concentrazione di etanolo in aumento), e di compensazione (Citrisolv o xilene). Imitando questi passaggi non fissata sul sezioni di tessuto congelato, abbiamo dimostrato che Citrisolv estrae muco sezioni di tessuto congelato conseguente morfologia tissutale che è simile a quella di tessuti inclusi in paraffina (Figure 2, pannello di destra). Al contrario, lo strato di muco non è stato alterato mediante incubazione con formalina o etanolo (Figura 2, sinistra e pannelli centrali). Questo suggerisce che la fase di compensazione procedura standard paraffina, che richiede incubazione prolungata in Citrisolv / xilene, porta a collasso dello strato di muco. Fissazione in formalina non danneggia lo strato di muco e congelati sezioni tessuti che sono stati fissati in formalina può essere facilmente trattata con lectine e anticorpi contro glicani, glicolipidi e proteine (figure 2, 3 e 6). Questi effetti possono essere trascurabile per lo studio delle proteine di membrana e patologia dei tessuti, ma sono devastanti per strutture altamente idratati come lo strato di muco secreto. Tuttavia studi istologici di mucine sono ancora condotte principalmente con campioni inclusi in paraffina, in cui la conservazione strato di muco è subottimale. Nelle analisi approfondite di composizione dello strato di muco, come la precisa identità di sécreted o membrana combinazioni legate glicoproteina MUC richiedono anticorpi specifici e la spettrometria di massa per l'identificazione delle proteine dorsali. Preservazione dello strato di muco, ma è il requisito iniziale per tali studi.
Molti laboratori hanno campioni di tessuti congelati in OCT che sono stati raccolti in passato per progetti diversi, questi tessuti possono essere facilmente utilizzato per studiare mucine, glicolipidi e distribuzione glicano eliminando la necessità di raccogliere tessuti in fissativi speciali che sono progettati unicamente per la conservazione muco. I tessuti congelati sottoposti a trattamento minimo e quindi la distribuzione naturale dei glicani, che sono idratati in natura, è conservata. Questo è particolarmente importante nel regno di interazioni ospite-microbica. La conoscenza della distribuzione naturalistica e l'abbondanza di mucine secrete e le strutture glycan molti decorare questi "barriera" molecole sarà la chiave per comprendere difesa ospite, lo sfruttamento microbica e patogeniè.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Gli autori desiderano ringraziare Nicole M. Nemeth (Università della Georgia) e Jeanne M. Fair (LANL) per il loro aiuto nella raccolta tessuti di pollo, e Steven A. Springer per il suo aiuto durante le riprese. La cura di tutti gli uccelli in questo studio era in conformità con le linee guida del National Institutes of Salute per l'uso umano degli animali da laboratorio e tutti i protocolli sono stati approvati dalla cura degli animali e del Comitato Istituzionale Usa presso il Los Alamos National Security LLC, operatore del Los Alamos Laboratorio Nazionale nell'ambito del contratto n ° DE-AC52-06NA25396 con il Dipartimento dell'Energia degli Stati Uniti. La cura dei topi in questo studio è conforme al protocollo UCSD animale approvato. I tessuti umani sono stati ottenuti come parte del protocollo UCSD IRB approvato. Questo lavoro è stato sostenuto dalla concessione 118645 presso la University of California Programma Fee Lab Presidente (PG) e la concessione NS047101 dal National Institute of Neurological Disorder and Stroke (Fondo Microscopia Neuroscienze in comune, UC San Diego).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente e | Azienda | Numero di catalogo | |
| 2-metil butano | Fisher Scientific | 03551-4 | |
| AEC perossidasi kit substrato | Vector Labs | SK-4200 | |
| Alcian Blu | Sigma-Aldrich | A3157 | |
| Anti-CA 19-9 anticorpo monoclonale | Calbiochem | CA1003 | |
| Anti-MUC5AC anticorpo monoclonale | Millipore | MAB2011 | |
| Avidina-biotina blocco kit | Vector Labs | SP-2001 | |
| Biotinilato asino anti-topo | Jackson ImmunoResearch | 90863 | |
| Biotinilato SNA | Vector Labs | B-1305 | |
| Albumina di siero bovinomin | Sigma-Aldrich | A4503 | |
| Chitina-idrolizzato | Vector Labs | SP-0090 | |
| Criostato microtomo | Leica Microsystems | Leica CM 1800 | |
| Ematossilina | Surgipath Medical Ind. | 3801570 | |
| Il perossido di idrogeno 30% | Fisher Scientific | H325-100 | |
| Jacalin-FITC | Vector Labs | FL-1151 | |
| Ematossilina di Mayer | Sigma-Aldrich | MHS32 | |
| Melibiosio | Sigma-Aldrich | M5500 | |
| Nuclear Fast Red | Vector Labs | H-3403 | |
| Ottobre composto | VWR International | 25608-930 | |
| Perossidasi streptavidina coniugata | Jackson ImmunoResearch | 94638 | |
| Schiff reagente | Scienze di microscopia elettronica | 26052 | |
| sWGA-Rhodamine | Vector Labs | RL1022S | |
| TKH2 anticorpo monoclonale | ATCC | HB-9654 | |
| VectaMount mezzo di montaggio acquoso | Vector Labs | H-5501 | |
| Cytoseal 60 | Thermo Scientific | 8310-4 | |
| Peel-A Way stampi | Polysciences Inc. | 18646A-1 |
Riferimenti
- Slayter, H. S., Wold, J. K., Midtvedt, T. Intestinal mucin of germ-free rats. Biochemical and electron-microscopic characterization. Carbohydr. Res. 222, 1-9 (1991).
- Lamblin, G. The carbohydrate diversity of human respiratory mucins: a protection of the underlying mucosa. Am. Rev. Respir. Dis. 144, S19-S24 (1991).
- Corfield, A. P., Carroll, D., Myerscough, N., Probert, C. S. Mucins in the gastrointestinal tract in health and disease. Front. Biosci. 6, D1321-D1357 (2001).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nat. Rev. Immunol. 9, 799-809 (2009).
- Lievin-Le Moal, V., Servin, A. L. The front line of enteric host defense against unwelcome intrusion of harmful microorganisms: mucins, antimicrobial peptides, and microbiota. Clin. Microbiol. Rev. 19, 315-337 (2006).
- Kim, Y. S., Ho, S. B. Intestinal goblet cells and mucins in health and disease: recent insights and progress. Curr. Gastroenterol. Rep. 12, 319-330 (2010).
- Nochi, T., Kiyono, H. Innate immunity in the mucosal immune system. Curr. Pharm. Des. 12, 4203-4213 (2006).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: soldier in the fight against respiratory viruses. Clin. Microbiol. Rev. 24, 210-229 (2011).
- McGuckin, M. A., Linden, S. K., Sutton, P., Florin, T. H. Mucin dynamics and enteric pathogens. Nat. Rev. Microbiol. 9, 265-278 (2011).
- Knowles, M. R., Boucher, R. C. Mucus clearance as a primary innate defense mechanism for mammalian airways. J. Clin. Invest. 109, 571-577 (2002).
- Johansson, M. E. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria. Proc. Natl. Acad. Sci. U.S.A. 105, 15064-15069 (2008).
- Hooper, L. V., Macpherson, A. J. Immune adaptations that maintain homeostasis with the intestinal microbiota. Nat. Rev. Immunol. 10, 159-169 (2010).
- Hayat, M. A. Microscopy, Immunohistochemistry, and Antigen Retrieval Methods: For Light and Electron Microscopy. Hayat, M. A. , Kluwer Academic/Plenum Publishers. New York, NY. 53-70 (2002).
- Cohen, M., Hurtado-Ziola, N., Varki, A. ABO blood group glycans modulate sialic acid recognition on erythrocytes. Blood. 114, 3668-3676 (2009).
- Cohen, M., Varki, A. The sialome--far more than the sum of its parts. OMICS. 14, 455-464 (2010).
- Ota, H., Katsuyama, T. Alternating laminated array of two types of mucin in the human gastric surface mucous later. Histochemical J. 24, 86-92 (1992).
- Matsuo, K., Ota, H., Akamatsu, T., Sugiyama, A., Katsuyama, T. Histochemistry of the surface mucous gel layer of the human colon. Gut. 40, 782-789 (1997).
- Boyde, A., Maconnachie, E. Treatment with lithium salts reduces ethanol dehydration shrinkage of glutaraldehyde fixed tissue. Histochemistry. 66, 181-187 (1980).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon