Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Chef-tdTomato kullanarak Zebrafish Somatosensoriyel Nöron Optogenetic Etkinleştirme
Bu Makalede
Özet
Optogenetic teknikleri mümkün davranışına özgü nöronların katkısı çalışma yaptık. Biz bir diyot pompalı katı hal (DPSS) lazer ile channelrhodopsin varyant (şef) ifade ve yüksek hızlı video kamera ile ortaya çıkardı davranışların kaydedilmesi tek somatosensoriyel nöronlar aktive larva zebrafish bir yöntem açıklanmaktadır.
Özet
Larva zebrafish basit nöral devrelerin gelişimi ve işlevi açıklayan bir model olarak ortaya çıkmaktadır. Dış döllenme, hızlı bir gelişme ve translucency nedeniyle, zebrafish özellikle nöral devre fonksiyonu araştırmak optogenetic yaklaşımlar için uygundur. Bu yaklaşımda, ışığa duyarlı iyon kanallarının açılıp inhibe bunları iradesi ve böylece belirli davranışları katkılarını değerlendirmek için deneyci sağlayan, belirli nöronlar olarak ifade edilmiştir. Larva zebrafish bu yöntemlerin uygulanması kavramsal olarak basit ama teknik detay optimizasyon gerektirir. Burada larva zebrafish somatosensoryel nöronlar, foto-aktive tek hücreler, bir channelrhodopsin varyantı ifade ve ortaya çıkan davranışları kaydetmek için bir yordam göstermek. Önceden kurulmuş yöntemleri için birkaç değişiklik tanıştırarak, bu yaklaşım kadar aktif tek nöronların davranışsal tepkiler için kullanılan olabiliren az 4 gün sonrası dölleme (dpf). Özellikle, biz tagged channelrhodopsin varyant, Chef-tdTomato ifade sürmek için bir somatosensoryel nöron artırıcı, CREST3, kullanarak bir transgen yarattı. Konfokal mikroskopi ile görüntülenebilir somatosensoriyel nöronlarda mozaik ifade, 1-hücreli dönem embriyoların sonuçları içine bu transgen enjekte. Aydınlatıcı, bir 473 nm DPSS lazer ışığı ile bu hayvanların hücreleri tanımlanan bir fiber optik kablo aracılığıyla rehberlik, yüksek hızlı bir video kamera ile kaydedilmiş ve kantitatif analiz edilebilir davranışları ortaya çıkarır. Bu teknik, herhangi zebrafish nöron aktive tarafından ortaya çıkarılan çalışma davranışlarına adapte olabilir. Genetik ya da farmakolojik tedirginlikler bu yaklaşımı birleştiren devre oluşumu ve işlevi araştırmak için güçlü bir yol olacaktır.
Giriş
Işık tanımlanmış dalga boyları ile nöronal uyarılabilirliği teşvik etmek ya da engellemek için optogenetic yöntemlerinin geliştirilmesi mümkün davranışı 1, 19, 21 kontrol nöral devrelerin nöronların farklı toplumlarda fonksiyonu çalışma yapmıştır. Bu teknikten sıklıkla nöron grupları aktive etmek için kullanılır, fakat aynı zamanda tek tek nöron aktive etmek için de kullanılabilir. Yarı saydam olduğundan Zebra balığı larvaları bu yöntemleri için özellikle uygundurlar, onların sinir sistemi hızla gelişir ve transgenik hayvanlar oluşturmak hızlı ve rutin. Ancak, önemli teknik engeller güvenilir tek bir nöron aktivasyon ulaşmak için aşılması gereken.
Tek zebrafish nöronların optogenetic aktivasyonu için bir prosedür optimize etmek için, biz somatosensoriyel nöronlar üzerinde duruldu. Kafa innerve trigeminal nöronlar ve Rohon-Sakal (: Zebra balığı larvaları iki nöron popülasyonları kullanarak somato çeşitli uyaranlara algılamakVücudun geri kalan innerve RB) nöronları,. Her trigeminal ve RB nöron deride yaygın şube uyaranlara ve downstream nöral devreleri bağlanır merkezi bir akson algılamak için bir periferik akson hedefleniyor. Hayvanlar bu tutarlı somatosensoryel devreleri, 18 5 oluşturdular gösteren, erken saat sonrası fertilizasyon (HPF) 21 olarak dokunmaya tepki. Larval gelişim süresince en az MAUTHNER hücrenin üzerine bazı trigeminal ve RB nöronlar sinaps, klasik kaçış yanıtı aktive ama delil biriken kaçış davranışının 2, 4 varyasyonlarını aydınlatır bağlantı farklı desenleri ile somato nöronların birden fazla sınıflar olduğunu göstermektedir etmek 10, 12, 14, 15, 16, 17. Bu yöntem geliştirilmesine Bizim motivasyon somato nöronların farklı sınıfların davranış işlevini karakterize etmek için, ama bu yaklaşım ilke lar nöronların hemen her nöron veya nüfus fonksiyonunu incelemek için kullanılabilirval zebrafish.
Douglass ve ark. Önceden aktive etmek için bir yöntem tarif Channelrhodopsin-2-eksprese eden, mavi ışık ile somatosensoriel nöronların kaçış davranışının 3 ortaya çıkarmak. Onların yaklaşımı somatosensoriyel nöronlarda ChR2-EYFP ifade sürücü isl1 geni bir artırıcı elemanı kullanılmalıdır. Bu, transgen, ancak, bir ikinci haberci bir birlikte-enjeksiyon gerektiren, nispeten zayıf floresan göstermek için rapor edildi, UAS :: GFP, ChR2-EYFP salgılayan hücrelerin görüntülenmesine izin verir. Bu yaklaşım 24-48 hpf arasındaki davranış tepkiler için kullanılan, ancak 72 hpf geçmişte bir yanıt ortaya çıkarmak asla. Bu yöntem çok erken larva dönemleri (24-48 hpf) de sinir devresi eğitim için çalışıyor iken Böylece, daha farklı davranışsal tepkiler görülür ve nöral devrelerin daha olgun yaşlı larvaları, nöral devreleri ve davranışsal tepkileri tanımlamak için yetersizdir.
Biz çalıştılarva RB nöronların alt popülasyonlarının işlevini karakterize etmek amacıyla bu tekniğin duyarlılık geliştirmek. Ifadesi iyileştirmek için bir floresan etiketli ışık aktif kanal ifadesi yükseltmek için lexA-VP16 ifade ve lexA operatör dizileri (4xLexAop) 11 bir streç sürmek için bir somatosensoriyel özgü artırıcı (CREST3) 20 kullanılır. Bu yapılandırma, ikinci bir muhabir co-ifade ve bize doğrudan her nöronda kanalın göreceli bolluk belirlemek için izin için ihtiyacı ortadan kaldırarak, kanalı ifade güçlendirilmiş. Lexa / LexAop dizisi kullanarak bize Gal4/UAS sistemi kullanmak zebrafish muhabiri satırlara transgen tanıtmak için izin ek avantajı vardı. Bu transgen Geçici ifade ifade düzeylerde sonuçlandı, ancak genellikle birkaç gün içinde hücre gövdesi ve bireysel nöronların akson projeksiyonları görselleştirmek için yeterince güçlüydü. Duyarl optimize etmekışığa Sığ biz kanal Chef, sarmal döngü EF 13 yaşında bir crossover site ile channelopsin-1 (Chop1) ve channelopsin-2 (Chop2) bir chimera oluşan channelrhodopsin türevi aktive ışık kullanılır. Bu kanal ChR2 gibi aynı dalga boyunda aktive, fakat ChR2 de dahil olmak üzere diğer yaygın olarak kullanılan kanal, daha daha duyarlı hale aktivasyonu için düşük bir ışık yoğunluğu gerektirir. Chef proteini bize kanal aktive olmadan protein ekspresyonu için ekran sağlayan kırmızı floresan proteini, tdTomato erimiş oldu. Bir ışık kaynağı olarak, bir diyot larvaları belirli bir bölgeye mavi bir ışık hassas, yüksek-enerjili darbe sunmak için bir fiber optik kablo birleştiğinde katı-hal (DPSS) lazer pompalanır kullanılır. Bu bize tek bir nöron kanalı ifade nadir transgenik hayvanlar bulmak için ihtiyacı ortadan kaldırarak, bireysel nöronların üzerine lazer ışığı odaklamak için izin verdi. Bu yaklaşımı kullanarak, biz, tek RB nöronlar aktive davranışsal tepkisi kaydetmek başardıkyüksek hızlı video kamera ve resim konfokal mikroskopi ile yüksek çözünürlükte aktive nöron s.
Protokol
Vaktinden önce aşağıdaki hazırlayın.
1. Optik Kablo hazırlayın
- Bir ~ 150 ° açı oluşturmak için bir Bunsen beki üzerine cam Pasteur pipeti ve konik boyun eriterek optik kablo için bir depolama birimi oluşturun.
- Bir tel kesici veya jilet kullanarak, dikkatle iki parçaya optik kabloyu kesti. Her bir parça, bir FC / PC adaptörü ve bir açık uçlu bir ucunu olmalıdır. Bir rezerv kablosu olarak tek parça depolayın.
- Kablosunun kesik ucuna 5.0 cm lif ceket ve güçlendirilmesi lifler (Şekil 1A) kaldırarak kaplama, optik kablo sıyırın.
- Hazırlanan Pasteur pipeti içine optik kablo takın. Kablosunu kolayca pipet içinde ve dışında hareket edebildiğinden emin olun.
- Optik kablo dikkatle cam elyaf yerinden fiber kaplama kesip çıkarın, Pasteur pipet ucu çıkıntı ile kesme ucundan ~ 2 mm.
- Nick o kırmak ve bir elmas kalem / cam kesici cam elyaf kullanmaff uç lif (Şekil 1B) sonunda temiz bir kesme / yüzey oluşturmak için kullanılır.
- Depolama için Pasteur pipeti içine optik kablo çekin. Optik fiber ucu dengesiz yontma veya tatili alırsa adımı (1.6) tekrarlayın.
- Pasteur pipeti pozisyon optik kablo mikromanipülatör (Şekil 1C) kullanarak.
Prosedürler 2-8 birçok zebrafish deneyleri için genel olarak uygulanabilir embriyolar transgenlerin enjekte için bir yöntem açıklanmaktadır. Diğer Jüpiter video 6, 7, 8, 9 içinde tarif edilenler gibi bu yöntem üzerinde değişimler, 22 eşit ölçüde etkilidir.
2. Enjeksiyon İğneleri çekin
- Bir iğne çektirmenin kullanarak, yavaş yavaş konik ucu ile iki enjeksiyon iğneleri içine borosilikat cam tüp çekin. Çektirme ayarları değişecektir. (Bir Sutter Aletleri iğne çektirmenin biz ayarları kullanın: P = 500, Isı = 720, = 50, Hız çekin = 70 ve Zaman = 150). Her iğne çektirme farklıdır, bu nedenle çektirme ayarları em optimizepirically. Daha konik iğne için, Isı artırmak ve / veya çekin. Az konik iğne için, Zaman ve / veya azalma Pull artırmak.
- Güvenli bir kapta saklayın iğneler (yani haddelenmiş bant ile bir Petri kabı, yapışkan tarafı dışarı).
3. Enjeksiyon Kalıpları dökün
- Agaroz tamamen çözülene kadar, 30 ml embriyo / mavi su 0,5 gr agaroz eritin.
- Bir Petri kabı alt yarısı içine dökün.
- , Agaroz içine kuyu (Şekil 2) montaj kuyuları etrafında kabarcık oluşumunu engellemek için dikkatli olmak dikdörtgen kalıp yerleştirin.
- Agaroz katılaşmasını bekleyin.
- Kalıp çıkarın ve mavi / embriyo su ile Petri kabı dolduracak.
- Dikey olarak saklanması, aynı günlük kullanım için oda sıcaklığında ya da 4 ° C de gelecekte kullanılmak üzere, temiz su ile doldurulur.
4. Enjeksiyonlar için Plazmid DNA Mix Yap
- GKD 2 O. 1:10 fenol kırmızısı ile 50 ng / ml 'lik bir konsantrasyon ile plazmid DNA seyreltilir Içinörnek:
1.0 mi plazmid DNA (250 ng / ml) 0.5 ml fenol kırmızısı 3.5 mL GKD 2 O - Birkaç gün için hemen kullanılarak ya da 4 ° C 'de depolandığı takdirde, DNA karışımı, oda sıcaklığında saklanabilir.
5. Çiftleşme Çiftleri ayarlama
Eğer enjeksiyonları yapmak için plan önce bu akşam yapılmalıdır.
- Birlikte sistem su ve yer erkek ve dişi balık yetiştirme tankları doldurun. Işıkları bir bölücü ile, tesiste ayrı erkek ve dişi balık açmak gibi enjeksiyonlar kısa sürede yapılabilir yapamıyorsanız.
6. Enjeksiyonlar için hazırlayın (embriyo için beklerken yapılabilir)
- Basınçlı enjektör kulesi açın. Sistem pulse ayarlanmış olduğundan emin olun. 1 PULSE SÜRESİ seti ile başlayın.
- HAVA valfi açın ve~ 20 psi enjektör basıncını ayarlayın.
- Yüksek büyütmede bir diseksiyon kapsamı kullanarak, forseps veya bir ~ 2 mikron açma (Şekil 3, Film 1) oluşturmak için bir poker ile iğnenin ucu bölünürler.
- DNA karışımı ile iğne doldurun: 1. DNA karışımı içine, iğne, ucu tarafı yukarı yerleştirilmesi ve iğne kapiller eylem veya 2 ile doldurmak icar. DNA 1-2 ul Pipeti uzun ulaşılması ucu kullanarak iğne doğrudan karıştırın.
- Sıra enjekte hazır olana kadar güvenli bir yerde iğne doldurulur.
7. Embriyolar toplayın
- Tesisin ışıkları açık sonra, bölücüler (varsa) çıkarın. Bir süzgeç / küçük elek ile embriyolar toplayın ve taze mavi / embriyo su ile bir Petri aktarabilirsiniz.
8. 1-2 Cep Sahnesi'nde embriyolar enjekte
- Plastik bir pipet kullanarak enjeksiyon kalıpları için hasat embriyolar transfer.
- Bir diseksiyon mikroskobu kullanarak, yavaşça içine embriyolar itinforseps veya künt bir poker ile kuyu (Şekil 4, Movie 2).
- Embriyolar üzerinde mikromanipülatör ve pozisyon içine yüklenen iğne yerleştirin.
- İstediğiniz ses seviyesini (~ 1 nl) elde edene kadar 1 adım artışlarla PULSE SÜRESİ ayarlayarak enjeksiyon hacmi kalibre. Bu, bir daha önceki Jüpiter video 8, 22 de tarif edildiği gibi, bir mikrometre slaydı ile kalibre edilmiş, ancak enjeksiyon hacmi geniş bir uygun ifade neden olacaktır çünkü bu deney hassasiyet için, gerekli değildir olabilir.
- ~ Enjekte 1 nl DNA tüm embriyolar için hücre ve tekrar doğrudan karıştırın. DNA ayrıca, yumurta sarısı içine enjekte, ancak bu (Şekil 5, Film 3) daha az etkin olma eğilimindedir.
- Mavi / embriyo su hafif bir akış kullanarak kalıp enjekte embriyolar çıkarın.
- Mağaza karanlıkta 28.5 ° C'de embriyolar enjekte.
- Periyodik olarak döllenmemiş, hasarlı veya ölü embriyolar çıkarın.
- Embriyolar wi Treatpigmentasyon önlemek için 18-24 hpf arasındaki inci PTU.
9. Transgen İfade Ekranı
- Elle dechorionate 24-48 hpf embriyoları forseps kullanarak.
- Tricaine 0.02% kullanarak larva uyuştur.
- Bir floresan mikroskop kullanılarak, RB veya trigeminal nöron ifadesi ile larva tespit ve taze PTU mavi / embriyo su ile yeni bir yemek için bu transfer. Kolaylıkla tanımlanabilir hücrelerinde ifade seyrek olan embriyolar uygun olan, fakat ifade yoğunluk geniş kabul edilebilir, böylece bireysel nöronların bir fiber optik kablo ile aktivasyonu için hedeflenir.
- Mağaza embriyolar 28.5 karanlıkta ° C istenen deney aşamasına kadar.
10. Davranış deneyler için Larva Dağı
- GKD 2 O ve katılaştırma önlemek için 42 ° C ısıtma bloğu deposunda% 1.5 düşük erime agaroz olun.
- Bir küvet içine, bir cam Pasteur pipeti, transfer önceden elenmiş larvaları birini kullanarakmümkün olduğunca küçük mavi / embriyo su ile% 1.5 düşük erime agaroz e.
- Küçük bir Petri kabı üzerine agaroz bir damla larva aktarın.
- Diseksiyon mikroskobu altında, pozisyon larva dorsal kadar.
- Agaroz katılaşmış erdiğinde, tüm larva etrafında agar bir kama bırakarak, ince bir jilet (# 11 bistüri) ile agaroz kesip.
- Sarısı iki tarafında iki çapraz kesim olun; nick larva bakımı alamayız.
- Embriyo / mavi su ile agaroz çevreleyen alanı doldurun.
- Larva gövde ve kuyruk (Şekil 6) uzak agaroz çekin.
11. Yüksek hızlı Kamera ve Görüntüleme Yazılımı hazırlayın
- Kapsamı diseksiyon üzerine yüksek hızlı kamera monte edin.
- Bilgisayara bağlayın.
- Bilgisayarı açın.
- Yüksek hızlı fotoğraf makinesini açın.
- Open Video / görüntüleme yazılımı (Biz AOS görüntüleme yazılımı kullanın ve burada kullanmak için prosedürleri anlatacağım, ancak diğer görüntülemeyazılım) eşit kabul edilebilir.
- Buna göre kamera ayarlarını (saniyede yani 1.000 kare (fps),% 50 tetik tampon veya diğer tercih edilen ayarları) ayarlayın.
- Kayda başlayın.
12. Bir 473 nm Lazer Kullanarak Tek Nöronlar etkinleştirin
- Uyarıcı, lazer ve optik kablo takın.
- Stimülatör açın.
- 5 Volt, maksimum ve 5 msn bir darbe süresi uyarıcı ayarlayın.
- Üreticinin talimatlarına göre lazer açın.
- Chef-tdTomato ekspresyonu (Şekil 6) ile bir nöronun hücre gövdesi yakınındaki optik kablonun ucuna yerleştirmek için bir diseksiyon mikroskobu kullanın.
- Duyusal nöron etkinleştirmek için mavi ışık nabız sunun.
- Yüksek hızlı bir kamera kullanarak Tutanak davranış saniyede 500 veya 1,000 kare ayarlayın.
- Habitüasyon önlemek için her aktivasyon arasında 1 dakika bekleme, istediğiniz gibi deney tekrarlayın. (Biz her nöron için üç yanıtların minimum kayıt).
- Karşıserbest larva, hayvan kesmemeye özen forseps ile agaroz dışında gözetlemek. Bu hayvan daha da geliştirmek için izin verilebilir ve prosedürü davranış gelişimi karakterize etmek için eski bir aşamada tekrar edilebilir. Embriyo ayrıca aşağıda tarif edildiği gibi, hücresel yapı ile ilişkili davranış için aktive hücrenin yüksek çözünürlüklü konfokal görüntüleme için yeniden monte edilebilir.
- Taze mavi / embriyo su ile kültürü plaka larva aktarın. Biz bireysel larva izlemek için bir 24-plaka kullanın.
13. Bir Konfokal Mikroskop ile Görüntü Nöron (ler)
- 0.02% tricaine ile larva uyuştur.
- % 1.2 düşük erime agaroz veya dorsal kalıp Mount larva, yukarı sırt tarafı.
- Bir 543 nm lazer ve uygun filtre ve objektif Image chef-tdTomato nöronlar. Biz 20x objektif kullanın.
- Agaroz gelen larva çıkarın ve mavi / embriyo su ile iyice bireysel dönün.
- 28.5 Mağaza fu için karanlıkta ° Crther analizi.
Sonuçlar

Şekil 1. Optik kablo kurmak. Fiber optik kablo (A) Katmanlar. Pasteur pipeti (B) Stripped fiber optik kablo. (C) Pasteur pipeti Fiber optik kablo mikromanipülatör kullanılarak yerleştirilir.
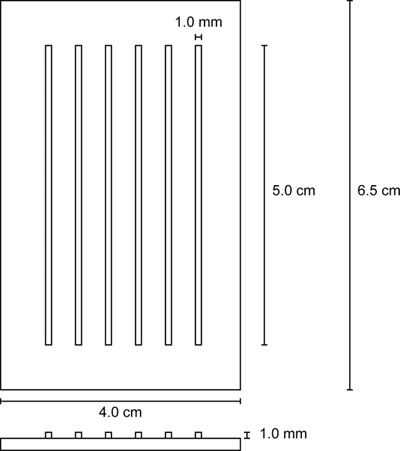
Şekil 2. Enjeksiyon kalıp şablonu.
Tartışmalar
Biz canlı zebrafish tek RB nöronların optogenetic aktivasyonu için bir yaklaşım tarif var. Bizim yöntemi belirli somatosensoriyel nöronların bir floresan etiketli channelrhodopsin varyantı, şef-tdTomato 13, ifade geçici transgenesis kullanır. Bu yaklaşım, kolaylıkla diğer larva zebrafish hücre popülasyonu içinde kullanım için uyarlanabilir.
Bu yaklaşımı kullanarak biz sürekli şef-tdTomato ifade 34-48 hpf larva davranışsal tepkilere yol açtı. 5 V mavi...
Açıklamalar
Yazarlar hiçbir rakip mali menfaati olduğunu beyan ederim.
Teşekkürler
Biz lazer kurmak davranış deneyleri ve DPSS tavsiye için Fumi Kubo, Tod Thiele ve HerwigBaier (UCSF / Max Planck Enstitüsü) thank; şef-tdTomato deneylerinde yardım için MBL Nörobiyoloji Sahası'na Heesoo Kim ve Chiara Cerri; PetronellaKettunen (Göteborg Üniversitesi ) İlk optogenetic deneyler üzerinde işbirliği için; BaljitKhakh, Eric Hudson, Mike Baca ve teknik danışmanlık için John Milligan (UCLA) ve şef-tdTomato için Roger Tsien (UCSD) yaparız. AS: Bu çalışma NSF AMSP ve bir hibe için NRSA (5F31NS064817) ödülü (0.819.010 RIG) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif / Malzeme Adı | Şirket | Katalog Numarası | Yorumlar |
| Malzemeler | |||
| Cam Pasteur pipeti | Balıkçı | 1367820B | veya eşdeğeri (10-15 mm çap) |
| 200 mikron fiber optik | ThorLabs | AFS200/220Y-CUSTOM | Patch Cord, Uzunluk: 3 m, End A: FC / PC, End B: FC / PC, Ceket: FT030 |
| 50 mikron fiber optik | ThorLabs | AFS50/125Y-CUSTOM | Patch Cord, Uzunluk: 3 m, End A: FC / PC, End B: FC / PC, Ceket: FT030 |
| Ayarlanabilir sıyırma aleti | ThorLabs | AFS900 | veya Üç Delik sıyırma aleti (FTS4) |
| Diamond Wedge kâtip | ThorLabs | S90W | |
| / Brown Mikropipet Çektirme Flaming | Sutter Aletleri | P-97 | ya da denk |
| Filament ile borosilikat cam tüp | Sutter Aletleri | BF-100-78-10 | |
| Enjeksiyon kalıp | n / a | n / a | Şekil 5, |
| 1.5 ml santrifüj tüplerine | Herhangi | Herhangi | |
| Petri kabı (100x15 mm) | Herhangi | Herhangi | |
| Petri kabı (60X15 mm) | Herhangi | Herhangi | |
| Basınç enjektör | ASI | MPPI-3 | ya da denk |
| Mikromanipülatör ve metal stand | Narashige | M152 | ya da denk |
| Tek kullanımlık plastik pipetler | Fisherbrand | 13-711-7 | ya da denk |
| Poker (Pin tutucu ve Böcek pin) | Güzel Bilim Araçları, Inc | 26018-17 ve 26000-70 | ya da denk |
| Forseps | Güzel Bilim Araçları, Inc | 11255-20 | ya da denk |
| Microloader pipet uçları | Eppendorf | 9300001007 | |
| 28.5 ° C inkübatör | herhangi | herhangi | |
| 42 ° C ısı bloğu | Herhangi | Herhangi | |
| Non-Steril neşter bıçakları # 11 | Güzel Bilimsel Araçları, Inc | 10011-00 | ya da denk |
| S Diseksiyonbaşa çıkmak | Zeiss | Stemi | ya da denk |
| Standart filtre ile Floresan diseksiyon kapsamı | Herhangi | herhangi | ya da denk |
| Konfokal mikroskop | Zeiss | LSM 510 veya 710 | veya GFP ve RFP için lazerler ile eşdeğer ve 10x, 20x ve 40x hedefleri |
| Yüksek hızlı kamera | AOS Technologies, Inc | X-PRI (130025-10) | ya da denk |
| 473 nm taşınabilir lazer | Kristal lazerler | CL-473-050 | TTL seçeneği ile ya da yüksek güç, |
| S48 Stimülatör | Astro-Med, Inc Çim Enstrüman bölümü | S48K | ya da denk |
| FC / PC çiftleşme kol FC / PC | ThorLabs | ADAFC1 | Mayıs neoptik kablo bağlantısı için ed |
| Lazer Güvenlik Gözlükleri | ThorLabs | LG10 | ya da denk |
| 24 kültür plakaları | Genesee | 25-102 | ya da denk |
| Tek depresyon slaytlar | Balıkçı | S175201 | Veya eşdeğeri |
| Reaktif | |||
| Anında okyanus | Sucul Ekosistemler | IS50 | |
| Metilen mavisi | Balıkçı | S71325 | |
| Fenol kırmızı | Sigma | P4758 | |
| Agaroz | EMD | 2125 | ya da denk |
| Düşük Erime agaroz | Sigma | A9045 | veya eşdeğeri |
| PTU | Sigma | P7629 | |
| Tricaine | Sigma | A5040 | |
| mavi / embriyo su | 10 L GKD 2 O 0.6 gr Instant Ocean 6 damla metilen mavisi | ||
| fenol kırmızısı | (0.2 M KCl içinde 5 mg / ml) | ||
| 100x PTU | 0.150 g PTU 50 ml GKD 2 O 70 ° C'de erime, sık sık sallamak -20 ° C de tablet ve mağaza | ||
| 1x PTU | 1 ml 100x PTU 99 ml mavi / balık suyu | ||
| Tricaine stok solüsyonu | 400 mg tricaine 97.9 GKD 2 O | ||
| ~ 2.1 ml 1M Tris pH9.0 | ~ 7.0 pH ayarı Uzun süreli depolama için 4 ° C veya -20 ° C'de saklayın |
Referanslar
- Arrenberg, A. B., Del Bene, F., Baier, H. Optical control of zebrafish behavior with halorhodopsin. Proc. Natl. Acad. Sci. U.S.A. 106 (42), 17968-17973 (2009).
- Burgess, H. A., Johnson, S. L., Granato, M. Unidirectional startle responses and disrupted left-right co-ordination of motor behaviors in robo3 mutant zebrafish. Genes Brain Behav. 8 (5), 500-511 (2009).
- Douglass, A. D., Kraves, S., Deisseroth, K., Schier, A. F., Engert, F. Escape behavior elicited by single, channelrhodopsin-2-evoked spikes in zebrafish somatosensory neurons. Curr. Biol. 18 (15), 1133-1137 (2008).
- Downes, G. B., Granato, M. Supraspinal input is dispensable to generate glycine-mediated locomotive behaviors in the zebrafish embryo. J. Neurobiol. 66 (5), 437-451 (2006).
- Drapeau, P., Saint-Amant, L., Buss, R. R., Chong, M., McDearmid, J. R., Brustein, E. Development of the locomotor network in zebrafish. Prog. Neurobiol. 68 (2), 85-111 (2002).
- Eisenhoffer, G. T., Rosenblatt, J. Live Imaging of Cell Extrusion from the Epidermis of Developing Zebrafish. J. Vis. Exp. (52), e2689 (2011).
- Graeden, E., Sive, H. Live Imaging of the Zebrafish Embryonic Brain by Confocal Microscopy. J. Vis. Exp. (26), e1217 (2009).
- Kague, E., Weber, C., Fisher, S. Mosaic Zebrafish Transgenesis for Evaluating Enhancer Sequences. J. Vis. Exp. (41), e1722 (2010).
- Kemp, H. A., Carmany-Rampey, A., Moens, C. Generating Chimeric Zebrafish Embryos by Transplantation. J. Vis. Exp. (29), e1394 (2009).
- Kohashi, T., Oda, Y. Initiation of Mauthner- or non-Mauthner-mediated fast escape evoked by different modes of sensory input. J. Neurosci. 28 (42), 10641-10653 (2008).
- Lai, S. L., Lee, T. Genetic mosaic with dual binary transcriptional systems in Drosophila. Nat. Neurosci. 9 (5), 703-709 (2006).
- Liao, J. C., Haehnel, M. Physiology of afferent neurons in larval zebrafish provides a functional framework for lateral line somatotopy. J. Neurophysiol. 107 (10), 2615-2623 (2012).
- Lin, J. Y., Lin, M. Z., Steinbach, P., Tsien, R. Y. Characterization of engineered channelrhodopsin variants with improved properties and kinetics. Biophys J. 96 (5), 1803-1814 (2009).
- Liu, K. S., Fetcho, J. R. Laser ablations reveal functional relationships of segmental hindbrain neurons in zebrafish. Neuron. 23 (2), 325-335 (1999).
- Liu, Y. C., Bailey, I., Hale, M. E. Alternative startle motor patterns and behaviors in the larval zebrafish (Danio rerio). J. Comp. Physiol. A. Neuroethol. Sens Neural. Behav. Physiol. 198 (1), 11-24 (2012).
- Palanca, A. M., Lee, S. L., Yee, L. E., Joe-Wong, C., Trinh, L. A., Hiroyasu, E., Husain, M., Fraser, S. E., Pellegrini, M., Sagasti, A. New transgenic reporters identify somatosensory neuron subtypes in larval zebrafish. Dev. Neurobiol. , (2012).
- Pujol-Martí, J., Zecca, A., Baudoin, J. P., Faucherre, A., Asakawa, K., Kawakami, K., López-Schier, H. Neuronal birth order identifies a dimorphic sensorineural map. J. Neurosci. 32 (9), 2976-2987 (2012).
- Saint-Amant, L., Drapeau, P. Time course of the development of motor behaviors in the zebrafish embryo. J. Neurobiol. 37 (4), 622-632 (1998).
- Szobota, S., et al. Remote control of neuronal activity with a light-gated glutamate receptor. Neuron. 54 (4), 535-545 (2007).
- Uemura, O., et al. Comparative functional genomics revealed conservation and diversification of three enhancers of the isl1 gene for motor and sensory neuron-specific expression. Dev. Biol. 278 (2), 587-606 (2005).
- Wyart, C., Del Bene, F., Warp, E., Scott, E. K., Trauner, D., Baier, H., Isacoff, E. Y. Optogenetic dissection of a behavioural module in the vertebrate spinal cord. Nature. 461 (7262), 407-410 (2009).
- Yuan, S., Sun, Z. Microinjection of mRNA and Morpholino Antisense Oligonucleotides in Zebrafish Embryos. J. Vis. Exp. (27), e1113 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır