Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hidrojen Değişim Kütle Spektrometre Kullanarak Protein Dinamiği Analizi
Bu Makalede
Özet
Protein yapı ve dinamikleri protein yapı ve fonksiyon arasındaki ilişkiyi anlamak için anahtardır. Yüksek çözünürlüklü kütle spektrometrisi ile birlikte hidrojen alış veriş proteinlerin konformasyonel dinamiklerini incelemek ve temas arayüzler ve allosterik etkileri de dahil olmak üzere protein-ligand ve protein-protein etkileşimleri, karakterize için çok yönlü bir yöntemdir.
Özet
Bütün hücresel süreçleri proteinlerin işlevselliğine bağlıdır. Verilen bir proteinin işlevselliğini eşsiz amino asit dizisinin doğrudan bir sonucu olmasına rağmen, bu sadece bir tek tanımlanmış üç boyutlu bir düzenleme ya da daha yaygın da birbirine konformasyonlarının bir topluluk olarak içine polipeptid zincirinin katlanması ile gerçekleştirilir. Protein yapısında ve fonksiyonunda arasındaki bağlantıyı araştıran proteinlerin görevleri onların büyük çeşitliliği yerine edebiliyoruz nasıl anlaşılması için elzemdir. Fonksiyonel döngüsü boyunca ilerlerken, bir protein maruz yapısal değişiklikleri incelemek için bir olanak, hidrojen-1 yüksek çözünürlüklü kütle spektrometrisi (HX-MS) ile kombinasyon halinde H / 2, H-değişimidir. HX-MS örneğin kristalografisiyle elde edilen yapısal bilgilere yeni bir boyut ekler çok yönlü ve sağlam bir yöntemdir. Bu küçük mol bağlayıcı, katlama ve açılımı proteini incelemek için kullanılırecule ligandlar, protein-protein etkileşimleri, enzim katalizi ile bağlantılı konformasyonel değişiklikleri ve allostery. Protein miktarı çok sınırlıdır ya da proteinin kristalizasyon mümkün değildir Buna ek olarak, HX-MS sıklıkla kullanılmaktadır. Burada HX-MS ile protein dinamiğini çalışmak için genel bir protokol sağlar ve nasıl bir kompleks içinde iki proteinin etkileşim arayüz ortaya çıkarmak için bir örnek olarak tarif eder.
Giriş
Proteinler ve protein komplekslerinin kristal yapılarının sayısı son yıllarda hızla artmıştır. Bunlar, bu proteinlerin yapısal organizasyon çok değerli anlık mevcut ve yapı-fonksiyon analizi için bir temel sağlar. Ancak, proteinlerin ve bunların fonksiyonları için gerekli olan yapısal değişiklikler, dinamikleri, nadiren X-ışını kristalografisi ile ortaya çıkar. Cryo-elektronmikroskop, diğer taraftan, farklı yapıda protein ve protein kompleksleri yakalamak mümkün ama genellikle ikincil yapı seviye 1 şekilsel değişiklikleri aşağı çözemez. Atomik ayrıntıları, çözelti içinde proteinlerin konformasyonel dinamiği sadece NMR ile çözülebilir, ancak bu yöntem halen göreceli olarak küçük boyutlarda (genellikle ≤ 30 kDa) proteinlere sınırlı ile deneyler engellemektedir proteinlerin yüksek konsantrasyonlarda (≥ 100 uM), ihtiyacı var oligomerizasyon ya da toplama eğilimli proteinler 2. Bir yöntem, kiyüksek çözünürlüklü X-ışını kristalografisi ve kriyo-elektronmikroskop arasında olan ve köprü edebilmektedir protein boyut veya konsantrasyonu ile sınırlı değildir amid hidrojen-1 kütle spektrometrisi (MS) ile bir arada H / 2 H-değişim (HX) 'dir. Son yıllarda bu yöntem, protein dinamiği, protein katlanmasına, protein stabilitesi ve bu şekilsel değişikliklere 3-5 analizi için değerli bir analitik araç geliştirmiştir. Bu yöntemin moleküler temeli protein D 2 O çözeltisi yerleştirildiği zaman, döteryum atomları ile yer değiştirmeye doyurmaya proteinlerde omurga amid hidrojenlerin arasında kararsız doğasıdır. , Zaman içinde protein kütlesindeki artış, daha sonra yüksek çözünürlüklü MS ile ölçülür.
Kısa peptitler yapısal olmayan sadece sıcaklık, katalizör konsantrasyonuna bağlı HX (OH - Şekil 3, 3 H + O, yani pH) ve endüktif, kedi nedeniyle komşu artıkların amino asit yan zincirlerialytic ve sterik etkiler. Iç kimyasal kuru k kanal üzerindeki bu etkiler zarif Bai et al. 6 ile nicelleştirilmiştir edilmiş ve bir program pH ve sıcaklığa bağlı olarak bir polipeptid içinde her bir amino asit için k kanal hesaplar (izniyle Z. Zhang) mevcuttur. Nötr pH ve ortam sıcaklıklarında k ch 10 1 -10 saniye 3 -1 sırasına göre olan. Sıkı bir şekilde katlanmış proteinin iç iyonları kapandı - proteinlerinde HX temel olarak ikincil yapı içinde hidrojen bağı ve OH sulu sınırlı erişimi nedeniyle düşük derecede daha düşük büyüklükte 2-9 emir olabilir. Doğal protein HX bu nedenle kısmen ya da küresel açılımı, kimyasal değişimi ve denkleme göre yerel durumuna yeniden katlama etkisi altına (1) ve k obs açılış hızı k op, kapatma hızı k cl ve içsel kimyasal değişimi bağlıdır gözlenen kur rate k ch denkleme göre (2).
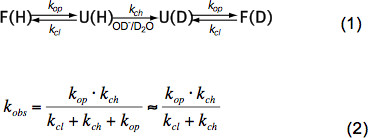
Yerli hal koşullarında k op k ch çok daha küçüktür ve paydada ihmal edilebilir. EX1 ve EX2 denilen iki uç döviz rejimleri vardır. K cl k kanal (EX1) daha küçük ise, gözlenen oranı açma hızına hemen hemen eşit olduğunu ve HX, bir yapı elemanının açılımı hemen gözlem sağlar. , Yapısal elemanın açılması üzerine bir kerede amid proton değişimi, izotop tepe 7 bir bimodal dağılım ile MS kolayca gözlemlenebilir böyle bir değişim rejimi,. K cl k ch çok daha büyük olduğu takdirde orantı sabit katlama açılımı dengesinin eşittir burada, (EX2) gözlenen oranı k ch ile orantılıdır sabiti K u = k op / K cl. Izotopik dağılımı yaklaşık olarak aynı kalırken, bu koşullar altında, bir çok açılış ve kapanış etkinlik ortalama kütlesi tedrici bir artışa yol açan, döteronların seyahati amid proton değişim önce gereklidir. EX2 rejimi ΔG u açılımı serbest enerji belirlenmesini ve bir yapı elemanının bu nedenle stabilitesini sağlar. Yerli devlet koşul altında EX2 rejimi en yaygın olanıdır. PH ve kaotropik ajanların eklenmesi artış EX1 için değişim mekanizmasını değiştirebilir. Bu nedenle, HX-MS termodinamiği keşfetmek hem de protein katlanma ve yapısal değişikliklerin kinetik parametreler için kullanılabilir.
HX yukarıda belirtildiği gibi doğal olarak pH ve sıcaklığa bağlıdır ve omurga amid grubu bir solvent tamamen açık proton değişim yarılanma ömrü> fizyolojik pH'da 5-400 ms (pH 7.6) ve 30 ° C, fakat 10 dakika arasında olduğu bir pH 2,9> 2 saat ortalama ve 0 ° ile 15 saat(Ca bir yarı ömür. 1-2 dakika ile alışverişi bir polipeptidin, ilk omurga amid bağının proton hariç) C. Bu tür değiş tokuş koşulları altında, yavaş dışarı dahil döteronların içerdiği tüm bilgileri kaybetme ile, bu koşullar altında aktif olan proteazlar (örneğin, pepsin) kullanılarak örnek sindirimi mümkündür. Yavaş alışverişi koşullar altında peptik sindirim tanıtılmasından bu yana, tam uzunlukta proteinlerin genel HX kinetik değil, sadece analiz edilebilir ama HX belirli bölgelerde 8,9 lokalize olabilir. Uzamsal çözünme anda 10-30 kalıntıları arasındaki genel olarak üretilen peptik parçalarının, büyüklüğü ile sınırlıdır. Bununla birlikte, pepsin ile bölünmesi nedeniyle spesifik olmayan doğası oluşturulan üst üste binen parçaları, uzamsal çözünürlük bir artışa neden olabilir. Buna ek olarak, çeşitli başka proteazlar, söndürme koşullar altında, ancak, daha az verimli 10 pepsin daha aktif olduğu bulunmuştur. Dahası increauzamsal çözünürlük se gibi elektron yakalama ayrışma (ECD), elektron transfer ayrılma (ETD) ve kızıl ötesi multiphoton ayrılma (IRMPD) 11-13 gibi döteryumlanma desen korunmuş yöntemler ile, gaz fazında peptitlerin parçalanması ile ulaşılabilir. Bu teknikler nedeniyle çarpışma kaynaklı ayrılma (CID) tarafından görülmektedir intramoleküler proton göçü ("karıştırma"), en yaygın olarak kullanılan parçalama tekniği bir uzamsal çözünürlük kaybını önler. Ancak, bu yöntemler her bir peptit için optimizasyon ve yine bu nedenle oldukça zordur.
HX-MS viral kapsid montaj 14-17 dahil olmak üzere protein-ligand ve protein-protein etkileşimlerini analiz etmek için kullanılmıştır. Protein açılımı ve sıcaklık kaynaklı konformasyonel değişiklikler 7,18,19 incelenmiştir hem de yeniden katlama. Fosforilasyonu ve tek bir amino asit mutasyon-ilişkili şekilsel değişiklikleri 16,20 ve nükleotidlerinide kaynaklı değişimler 21,22 analiz edilmiştir. Bu nedenle, bu yöntem derleme ve moleküler makineleri dinamiklerini analiz etmek için ideal uygun görünüyor. Kimin mekanizması büyük genel ilgi çekici biri aday, Hsp90 şaperon karmaşıktır.
Access restricted. Please log in or start a trial to view this content.
Protokol
1.. Tamponlar hazırlanması ve Protein Örnekleri
- H 2 O tampon hazırlayın. Kullanım Hsp90 standart tampon (40 mM HEPES / KOH, pH 7.5, 50 mM KCI, 5 mM MgCl2,% 10 gliserol) H 2 olarak O tamponu.
Not: Numune analizinden önce diyaliz edilmiştir ise H, 2 O tampon olarak diyaliz tampon kullanın. Bu, D 2 O tampon, sadece hidrojen izotop H 2 O tampon farklıdır esastır. NH4 gibi uçucu tampon CO 3 ya da NH 4-asetat ya da tampon bileşenleri uygun değildir! - Bir vakum konsantratör kullanılarak Hsp90 standart tampon maddesi liyofilizasyon ile D 2 O tamponu hazırlayın. H 2 O tam buharlaştırılmasından sonra, başlangıç toplam hacmi (örneğin 1 850 ul D 2 O eklenmesini gerektiren% 15 gliserol ile tampon ml) ulaşmak için tüp saf D 2 O ekleyin. Tamponun tam buharlaşma tekrar ve tampon / tuz com yeniden çözünmesineD 2 O 2x batıklar.
- (0.4 M KH 2 PO 4 / H 3 PO 4 pH 2,2) söndürme tampon hazırlayın.
Not: 4 M guanidin hidroklorür ve 0.5 M Tris (2-karboksietil) fosfin (TCEP-HCI) ilave edilebilir çok kararlı proteinlerin peptik sindiriminin verimliliğini artırmak için. - % 100 kontrol numunesi (6 M guanidin hidroklorid, D 2 O) hazırlayın. Tamamen örnek H 2 O buharlaşır ve% 10 gliserol ile ilk toplam hacmi (örneğin, 100 ul numune ulaşmak için tüp D 2 O ilave edilmesini gerektirebilir eklemek 6 M. bir son konsantrasyon elde etmek üzere bir Hsp90 kana guanidin hidroklorid ekleyin 90 ul D 2 O). Tamponun tam buharlaşma tekrar edin ve D 2 O'da tampon / tuz bileşenleri yeniden çözünmesine
Not: Örnek 20-100 pmol her bir enjeksiyon için gereklidir. HX-MS deneyleri her gün için% 100 kontrol için yeterli örnek hazırlayın. - 5 ul Hsp90 standart tampon içinde 50 pmol Hsp90 hazırlayın.
Not: Örnek 20-100 pmol bir miktarı ham her veri noktası için gereklidir. Reaksiyonda numunenin hacmi ideal olarak 1-5 ul. Bu gereksinimleri uygun konsantrasyonu ayarlayın. Herhangi bir tampon, sürece deterjan ya da uçucu bileşenler içermez olarak kullanılabilir.
2. Aldehite üzerinde Hareketsizlestirilmis Pepsin hazırlanması Boncuk Aktif
- 2 ml 50 mM sodyum sitrat (pH 5) içinde 80 mg taze pepsin çözülür.
- , Sodyum siyanoborohidrit, 20 mg çözülür 1 ml 2 M Na 2 SO 4 bakım (çok toksik!) Ile ele almak ve pepsin çözeltisine ekleyin.
- Yavaşça (örneğin, tavan çalkalayıcı) çalkalanarak oda sıcaklığında 10 dakika boyunca inkübe edin karışımı.
- Karışıma hareketsiz aldehid grupları ile 600 mg boncuk ilave edin ve oda sıcaklığında 5-10 dakika boyunca inkübe edin.
- 2 M Na 2 2.2 ml ekleyin SO100 ul alikolar içinde 4 (pH 5) bir saat boyunca her 3 dakika yavaşça pepsin dışarı tuzuna. Yavaşça oda sıcaklığında bir havai çalkalayıcıda eklemeler arasındaki örnek karıştırın.
- Bir üst bir çalkalayıcı içinde 14-16 saat / gece boyunca 4 ° C'de inkübe edin pepsin boncuklar.
- 2 saat boyunca oda sıcaklığında 1 ml 1 M etanolamin ve inkübasyon ekleyerek reaksiyonu söndürün.
- , 500 rpm'de bir 50 ml Falcon tüpüne boncuk aşağı Spin süpernatantı atmak ve% 0.1 formik asit içinde yeniden süspanse boncuklar. Bu adım 2x tekrarlayın. Son santrifüj aşamasından sonra, süpernatan ve boncuk tahmini ses atın. % 0.1 'lik formik asidin eşdeğer bir hacim ilave edin ve 4 ° C'de saklayın
3. Amid Hidrojen-değişimi için Kolonların hazırlanması
- Sütun bindirme için 1 mm'lik bir iç çapa sahip ve pepsin sütunlar için 2 mm sütun kullanarak koruma.
- Bekçi kolonunun bir tarafını sökün ve filtreyi kaldırmak. Sıkıca funn ambalaj vidaSütunun açık ucu üzerine el. Sütunun alt çıkış için boş bir şırınga (5 mi) takmak için bir 1/16 inç ve boru adaptörü kullanarak. Bekçi sütun gaz geçirmez bunu düzeltmek için emin olun.
- Huni üstünde boncuk harç madde bir kaç damla uygulanır. Koruma sütuna huniden bulamacı emmek için şırınga pistonu çekin. Huni üzerine daha bulamaç boncuk malzemesi uygulayın ve koruma sütunu tamamen boncuk malzeme ile dolana kadar işlemi devam edin. Huni çıkarın ve açık ucuna filtre ve filtre halkası yerleştirin. Sıkıca koruma kolonu üzerine sütun kapağı vida ve diğer taraftan şırınga çıkarın. Sütun malzeme kurumasını önlemek için fişler ile koruma sütunların iki ucunu kapatın.
4. Hidrojen Borsası Kütle Spektrometre (HX-MS) için Sistemini Kurmak
- HPLC sistemi ile tuzak kolonu (Şekil 1) takın. Akış hızını ayarlayarak sütun dengelenmesiçözücü madde olarak% 0.1 formik asit ile 0.4 ml / dk bir pompa. Henüz pepsin sütunu ne analitik kolon bağlamayın.
- Kütle spektrometresi kalibre ve kütle spektrometresi kaynağına HPLC çıkış takılabilir.
5. Exchange Dynamic Range Belirlenmesi
- Aşırı saf Çözücü A (su içinde% 0.1 formik asit) ve ultra saf solvent B (asetonitril içinde% 0.1 formik asit) hazırlanması; hazır karışık solventler ticari olarak mevcuttur. HPLC pompaları temizleyin. Kısa bir tuz giderme adımından sonra oluşan basamaklı bir derece ile bir program seçerek kromatografisi ile kontrol yazılımı kütle spektrometresi yöntemleri ayarlayın. Tam boy için Hsp90% 5 solvent A/95% çözücüye% 90 solvent A/10% çözücü B'den elüt edilmesi için desalt / yükten 6-yollu vana ve oluşan basamaklı bir derece geçiş, ardından 1-2 dakika bir tuzunu giderme basamağını kullanımı B. Enjeksiyon öncesinde / YÜKLENİYOR pozisyon desalt YÜKLEMEY için enjeksiyon valfi ve 6-yollu vana ayarlayın.
Not: Bu deney sırasında pepsin veya analitik kolon etmeyin. - 1-10 ul H2O tamponu içinde Hsp90 100-200 pmol hazırlayın ve 30 ° C'de 10 dakika boyunca inkübe 100 ul kadar örnek hacmini getirmek ve zaman tanımlanmış bir süre (örneğin 10 sn, 100 sn, 1.000 sn) için tam olarak kuluçkaya sıcaklık ayarlanır D 2 O tampon ekleyin. 100 ul söndürme tamponunu ekleyin ve aşağı yukarı pipetleme karıştırın. Bir Hamilton şırınga ile enjeksiyon valfının enjeksiyon portuna 200 ul numune enjekte edilir. Kromatografi programını başlatın ve INJECT pozisyona enjeksiyon valfi açın. 2 dk eluteye Desalt / YÜKLEMENİN den 6-yollu vana açıldıktan sonra. En az üç zaman noktaları için bu işlemi tekrarlayın.
- Adımı tekrar 5.2 ama önceden 30 ° C de 10 dakika boyunca kuluçka için Hsp90 örnek Sti1 2-3x aşırı eklemek
- Kütle spektrometrisi yazılım spektrumlarının deconvolution ile tam boyda bir protein kütleleri belirler. Incorporat sayısını hesaplamakHer bir çalışma (örneğin 10 saniye, 100 saniye, 1000 saniye sonra) gözlenen kütle ile tam uzunlukta HSP90'ın molekül ağırlığı karşılaştırarak döteronlar ed.
- Ve yokluğunda bir süre (x-ekseni) karşı Sti1 (y-ekseni) varlığında Hsp90 için dahil döteronlar çizilir. Her iki eğri arasındaki farkın maksimum olan bir dinamik aralık zaman noktasını belirler. Hsp90-Sti1 arayüzü ve peptid düzeyinde dinamiklerini tanımlamak zaman D 2 O inkübasyon süresi için bu değeri kullanın.
6. MS / MS spektra kullanarak Peptik Peptitlerin Belirlenmesi
- Sisteme pepsin sütun ve analitik sütun bağlayın.
- Degrade türü ve kütle spektrometresi yöntemi seçerek kontrol yazılımı kromatografisi ve kütle spektrometresi için parametrelerini ayarlamak. Iyi kromatografik çözünürlük sağlamak için uzun degrade (örneğin fazla 90 dk) seçin. Kütle spektrometresi üzerinde MS / MS spektrumları etkinleştirir.
Not: İyi çözüHPLC ve yüksek kitle doğruluğu tion bu aşamada en yüksek önceliğe sahiptir. - 100 ul H 2 O tampon Hsp90 100-200 pmol hazırlayın. 100 ul söndürme tamponunu ekleyin ve aşağı yukarı pipetleme karıştırın. Bir Hamilton şırınga ile enjeksiyon valfının enjeksiyon portuna 200 ul numune enjekte edilir. Kromatografi programını başlatın ve INJECT pozisyona enjeksiyon valfi açın. 2 dk konumunu eluteye Desalt / YÜKLEMENİN den 6-yollu vana açıldıktan sonra.
Not: Birden fazla protein HX-MS (örneğin protein-protein etkileşimi arayüzler) analiz edilecek olması halinde, her bir protein için, peptidler ayrı ayrı belirlenmelidir. - Çıkan peptidler için bir veritabanı (yani Maskot) arayarak Hsp90 peptik peptidler belirlemek.
Not: amacı mümkün olduğu kadar çok peptik peptidleri belirlemek ve analiz saflaştırılmış protein ile yapılır gibi özel bir veritabanı kullanmak mümkündür. Örnek saflık olacak hdikkate alınması için ave. - MS / MS olmadan ve fiili HX deney için kullanılacak degrade ile bu adımı tekrarlayın. Hsp90 ve Sti1% 45 solvent A/55% çözücü B. 90% çözücü A/10% solvent B 10 dk degrade kullanmak için
Not: Gradients 5-15 dakika arasında son derece örnek karmaşıklığı ve HX sistem özelliklerine bağlıdır normalde. - 6.5 'de kullanılan gradyanı içinde 6.4 tanımlanan peptik peptidlerin tutma süreleri belirlemek 1 içeren bir liste oluşturmak.) Peptid dizisi, 2). Peptid şarj durumu ve 3). Tutma süresi. Bu deneyler HX sonra her bir peptid tanımlamak için kullanılacaktır.
Not: küçük m / z farklılıklar, aynı şarj durumuna ve aynı tutma süresi ile peptitler belirsizlik kaynağı olabilir farkında olun.
7. Protein-protein etkileşim Arayüz Tanıtımı
- Kontrol softwar de degrade ve kütle spektrometresi yöntemi kurmake. , 300-1,500 m / z arasında kitlelerin tespiti için optimize edilmiş bir kütle spektrometresi yöntemi yükleyin% 45 çözücü A/55% çözücü B'ye% 90 solvent A/10% solvent B 10 dk doğrusal bir degrade kullanmak rağmen çoğu peptidler 1,000 m / z altında olacaktır. YÜK pozisyonda, YÜKLEME / tuzsuzlaştırma Pozisyonu 6 yollu vana içine enjeksiyon vanasını ayarlayın. 0.4 ml / dk için yükleme pompasının akış hızını ayarlayın.
Not: Uzunluk ve degrade türü örnek bağımlı olan ve optimize edilmesi gerekebilir. Daha uzun geçişlerini kromatografisi çözünürlüğü artırmak ama arka değişimi nedeniyle proteinlerin içine döteronların birleşme azaltmak. Seçilen yöntem, tüm deneyler için karşılaştırılabilir aynı olması gerekir. - Değişime uğramamış bir referans için 100 ul H2O tamponu içinde HSP90'ın 20-100 pmol hazırlar. Aşağı iki kez 100 ul buz söndürme tampon, pipet yukarı ve ekleme ve HPLC enjeksiyon valfi içine numune enjekte. Hemen kromatografi program ve sw başlangıçINJECT pozisyona enjeksiyon valfi kaşıntı. 2 dk konumunu eluteye Desalt / YÜKLEMENİN den 6-yollu vana açıldıktan sonra. Hsp90 ve Sti1 bireysel ve proteinlerin karışımı için için bunu yapın.
- 1-5 ul bir hacimde HSP90'ın 20-100 pmol hazırlayın. (; Yapısal dinamikleri Not görmek için örneğin 30 saniye) 100 ul kadar örnek ses getirmek ve zaman belirli bir süre için tam olarak kuluçkaya sıcaklık ayarlanır D 2 O tampon ekleyin. Iki aşağı buz gibi soğuk tampon maddesi söndürme, pipet yukarı ve 100 ul eklenir ve hızlı bir şekilde HPLC enjeksiyon valfı içine 200 ul enjekte edilir. Hemen kromatografi programını başlatmak ve INJECT pozisyona enjeksiyon valfi açın. 2 dk konumunu eluteye Desalt / YÜKLEMENİN den 6-yollu vana açıldıktan sonra. Etkileşen protein yokluğunda her bir peptidin içine dahil edilmesini deuteron belirlemek için, her bir protein için yapın.
Not: confor dinamiklerini inceleyerek zamanDeğişiklikleri mational D 2 O tamponu içinde Hsp90 farklı inkübasyon süreleri ile deney tekrar. (Örneğin 10 sn, 30 sn, 100 sn, 300 sn, 1.000 sn, vb) logaritmik inkübasyon sürelerini seçerek geniş bir zaman ölçeği örtbas etmeye çalışın. D 2 O tampon ve örnek tampon hidrojen izotopu hariç tam olarak aynı olmalıdır. - % 100 kontrol örneğinde (20-100 pmol) eşit miktarda hazırlayın ve 100 ul kadar örnek hacmi getirmek için D 2 O tampon ekleyin. Iki aşağı buz gibi soğuk tampon maddesi söndürme, pipet yukarı ve 100 ul eklenir ve hızlı bir şekilde HPLC enjeksiyon valfı içine 200 ul enjekte edilir. Hemen kromatografi programını başlatmak ve INJECT pozisyona enjeksiyon valfi açın. 2 dk konumunu eluteye Desalt / YÜKLEMENİN den 6-yollu vana açıldıktan sonra.
- Etkileşim yüzeyi belirlemek için (Not) bağlı devlet dengeyi ve kuluçkaya Sti1 bir en az 2 kat fazla Hsp90 mixİstenen sıcaklıkta bir kompleks oluşumuna kadar dengededir. 100 ul kadar örnek ses getirmek ve bir süre (örneğin 30 saniye) belirli bir süre için tam olarak kuluçkaya sıcaklık ayarlanır D 2 O tampon ekleyin. Iki ve hızlı HPLC enjeksiyon valfi enjekte aşağı buz gibi soğuk söndürme tampon, pipet yukarı ve 100 ul ekleyin. 2 dk konumunu eluteye Desalt / YÜKLEMENİN den 6-yollu vana açıldıktan sonra. 20-100 Sti1 ve pmol ve Hsp90 aşan bu deneyi tekrarlayın.
Not: mutlak konsantrasyonları etkileşiminin ayrılma sabitine denge bağlıdır. İdeal olarak, D 2 O içine seyreltildikten sonra protein konsantrasyonu (ilişkili alt konsantre edilmiş proteinin>% 85 tekabül etmektedir), en az 10x K D olmalıdır aşan ilave edildi. - Uygun yazılım ile edinilen verileri analiz ve analiz her peptid bulmak için adım 6.5 belirlenen tutma kez kullanın. Hesaplamate değişime uğramamış proteinin (adım 7.2) ve HX deneyler (adım 7.3) için izotop dağılımının ağırlık merkezi.
Not: alışverişinde peptitler izotop desenleri peptid şarj durumu hakkında bilgi ve centroids kolay belirlenmesini sağlayan kütle spektrometresi, yüksek kütle doğruluğu, onların unexchanged benzerlerinden farklı görünseler de. - Hedef proteinin tek başına döteronların bağlanma partneri fazla olan bir birleşme karşılaştır. Bu bir elektronik tablo programı ile el ticari yazılım veya otomatik olarak yapılabilir. % 100 kontrol numunesi değerleri, her bir peptit için maksimum değişimini temsil ettiği ve O etiket nedeniyle geri değişimi için, deney esnasında kaybedilen D 2 miktarını belirlemek için kullanılabilir.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Hsp90 maya ve Hsp90 hastabakıcı ailesinin üyesi bir moleküler şaperonudur. Karmaşık bir ATPaz döngüsü geçerek birçok protein müşterilerin geç katlanan adımları yardımcı olur. Verimli katlanır Hsp70 gelen müşterilerin transferi ve ortak hastabakıcı Sti1/Hop etkileşimi gerektirir. Hsp90 Sti1 doğrudan bağlanan ve HSP90'ın ATPaz en aktivitesinin inhibisyonu bağlama istemci kolaylaştırır. Sti1 ile Hsp90 etkileşimi son zamanlarda HX-MS 23 kullanılarak incelenmiştir. Burada, yu...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bir protein için bir bağlanma ortağının etkileşim kaçınılmaz olarak bağlanma sitesinde solvent erişilebilirlik değişikliklere neden olur. Buna ek olarak, pek çok protein, gerçek bağlama arayüzü başka bölgeleri etkileyen bağlanması üzerine dinamik bir konformasyonal değişiklik geçirmektedir. HX-MS bu değişiklikleri izlemek için sağlam bir yöntem ve diğer yöntemler örtemez o zaman ölçekleri proteinlerin yapısal değişimleri ortaya bile yeteneğine sahiptir.
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Biz ifşa hiçbir şey yok.
Teşekkürler
Biz yazının yorumları için M. Boysen teşekkür ederim. Bu proje (: CellNetworks EXC 81/1 Mükemmellik SFB638 ve MA MPM 1278/4-1 ve Kümede) Deutsche Forschungsgemeinschaft tarafından finanse edildi. MPM Mükemmeliyet Kümesi araştırmacı: CellNetworks.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| maXis QTOF | Bruker | ||
| nanoAcquity UPLC | Waters Corp. | ||
| Shimadzu 10AD-VP | Shimadzu | ||
| 6-port Valve EPC6W with microelectric actuator | Valco | #EPC6W | |
| Injection valve (manual) | Rheodyne | #7725 | |
| Poros AL20 media | Applied Biosystems | #1-6029-06 | |
| Poros R2 | Applied Biosystems | #1-1118-02 | |
| Pepsin | Sigma | #P6887 | use fresh pepsin |
| Microbore (1 mm) | IDEX | #C-128 | |
| Microbore (2 mm) | IDEX | #C-130B | |
| Acquity UPLC BEH C8 Column | Waters Corp. | #186002876 | |
| Thermomixer | Eppendorf | #5355000.011 | |
| Tubing (various diameters) | IDEX | ||
| Fittings | IDEX | #PK-110 with PK-100 |
Referanslar
- Saibil, H. R. Conformational changes studied by cryo-electron microscopy. Nat. Struct. Biol. 7 (9), 711-714 (2000).
- Mittermaier, A., Kay, L. E. New tools provide new insights in NMR studies of protein dynamics. Science. 312 (5771), 224-228 (2006).
- Hoofnagle, A. N., Resing, K. A., Ahn, N. G. Protein analysis by hydrogen exchange mass spectrometry. Annu. Rev. Biophys. Biomol. Struct. 32, 1-25 (2003).
- Wales, T. E., Engen, J. R. Hydrogen exchange mass spectrometry for the analysis of protein dynamics. Mass. Spectrom. Rev. 25 (1), 158-170 (2006).
- Konermann, L., Pan, J., Liu, Y. -H. Hydrogen exchange mass spectrometry for studying protein structure and dynamics. Chem Soc. Rev. 40 (3), 1224-1210 (2011).
- Bai, Y., Milne, J. S., Mayne, L., Englander, S. W. Primary structure effects on peptide group hydrogen exchange. Proteins. 17 (1), 75-86 (1993).
- Rist, W., Jørgensen, T. J. D., Roepstorff, P., Bukau, B., Mayer, M. P. Mapping temperature-induced conformational changes in the Escherichia coli heat shock transcription factor sigma 32 by amide hydrogen exchange. The Journal of biological chemistry. 278 (51), 51415-51421 (1074).
- Englander, J. J., Rogero, J. R., Englander, S. W. Protein hydrogen exchange studied by the fragment separation method. Anal Biochem. 147 (1), 234-244 (1985).
- Zhang, Z., Smith, D. L. Determination of amide hydrogen exchange by mass spectrometry: a new tool for protein structure elucidation. Protein Sci. 2 (4), 522-531 (1993).
- Cravello, L., Lascoux, D., Forest, E. Use of different proteases working in acidic conditions to improve sequence coverage and resolution in hydrogen/deuterium exchange of large proteins. Rapid Commun. Mass Spectrom. : RCM. 17 (21), 2387-2393 (2003).
- Rand, K. D., Zehl, M., Jensen, O. N., Jørgensen, T. J. D. Protein hydrogen exchange measured at single-residue resolution by electron transfer dissociation mass spectrometry. Anal chem. 81 (14), 5577-5584 (2009).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Electron capture dissociation of electrosprayed protein ions for spatially resolved hydrogen exchange measurements. J. Am. Chem. Soc. 130 (35), 11574-11575 (2008).
- Yamada, N., Suzuki, E. -I., Hirayama, K. Identification of the interface of a large protein-protein complex using H/D exchange and Fourier transform ion cyclotron resonance mass spectrometry. Rapid Commun. Mass Spectrom. 16 (4), 293-299 (2002).
- Lee, T., Hoofnagle, A. N., et al. Docking motif interactions in MAP kinases revealed by hydrogen exchange mass spectrometry. Mol. Cell. 14 (1), 43-55 (2004).
- Hasan, A., Smith, D. L., Smith, J. B. Alpha-crystallin regions affected by adenosine 5'-triphosphate identified by hydrogen-deuterium exchange. Biochem. 41 (52), 15876-15882 (2002).
- Lanman, J., Lam, T. T., Emmett, M. R., Marshall, A. G., Sakalian, M., Prevelige, P. E. Key interactions in HIV-1 maturation identified by hydrogen-deuterium exchange. Nat. Struct. Mol. Biol. 11 (7), 676-677 (2004).
- Wang, L., Lane, L. C., Smith, D. L. Detecting structural changes in viral capsids by hydrogen exchange and mass spectrometry. Protein Sci. 10 (6), 1234-1243 (2001).
- Pan, H., Raza, A. S., Smith, D. L. Equilibrium and kinetic folding of rabbit muscle triosephosphate isomerase by hydrogen exchange mass spectrometry. J. Mol. Biol. 336 (5), 1251-1263 (2004).
- Mazon, H., Marcillat, O., Forest, E., Smith, D. L., Vial, C. Conformational dynamics of the GdmHCl-induced molten globule state of creatine kinase monitored by hydrogen exchange and mass spectrometry. Biochem. 43 (17), 5045-5054 (2004).
- Lanman, J., Lam, T. T., et al. Identification of novel interactions in HIV-1 capsid protein assembly by high-resolution mass spectrometry. J. Mol. Biol. 325 (4), 759-772 (2003).
- Rist, W., Graf, C., Bukau, B., Mayer, M. P. Amide hydrogen exchange reveals conformational changes in hsp70 chaperones important for allosteric regulation. J. Biol. chem. 281 (24), 16493-16501 (2006).
- Graf, C., Stankiewicz, M., Kramer, G., Mayer, M. P. Spatially and kinetically resolved changes in the conformational dynamics of the Hsp90 chaperone machine. EMBO J. 28 (5), 602-613 (2009).
- Lee, C. -T., Graf, C., Mayer, F. J., Richter, S. M., Mayer, M. P. Dynamics of the regulation of Hsp90 by the co-chaperone Sti1. EMBO J. 31 (6), 1518-1528 (2012).
- Lou, X., Kirchner, M., et al. Deuteration distribution estimation with improved sequence coverage for HX/MS experiments. Bioinformatics. 26 (12), 1535-1541 (2010).
- Kreshuk, A., Stankiewicz, M., Lou, X., Kirchner, M., Hamprecht, F. A., Mayer, M. P. Automated detection and analysis of bimodal isotope peak distributions in H/D exchange mass spectrometry using HeXicon. Intl. J. mass spectrom. 302 (1-3), 125-131 (2011).
- Walters, B. T., Ricciuti, A., Mayne, L., Englander, S. W. Minimizing back exchange in the hydrogen exchange-mass spectrometry experiment. J. Am. Soc. Mass Spectrom. 23 (12), 2132-2139 (2012).
- Weis, D. D., Wales, T. E., Engen, J. R., Hotchko, M., Ten Eyck, L. F. Identification and characterization of EX1 kinetics in H/D exchange mass spectrometry by peak width analysis. J. Am. Soc. Mass Spectrom. 17 (11), 1498-1509 (2006).
- Fang, J., Rand, K. D., Beuning, P. J., Engen, J. R. False EX1 signatures caused by sample carryover during HX MS analyses. Intl. J. Mass Spectrom. 302 (1-3), 19-25 (2011).
- Deng, Y., Smith, D. L. Identification of unfolding domains in large proteins by their unfolding rates. Biochem. 37 (18), 6256-6262 (1998).
- Wales, T. E., Engen, J. R. Partial unfolding of diverse SH3 domains on a wide timescale. J. Mol. Biol. 357 (5), 1592-1604 (2006).
- Pan, Y., Piyadasa, H., O'Neil, J. D., Konermann, L. Conformational dynamics of a membrane transport protein probed by h/d exchange and covalent labeling: the glycerol facilitator. J. Mol. Biol. 416 (3), 400-413 (2012).
- Hebling, C. M., Morgan, C. R., Stafford, D. W., Jorgenson, J. W., Rand, K. D., Engen, J. R. Conformational analysis of membrane proteins in phospholipid bilayer nanodiscs by hydrogen exchange mass spectrometry. Anal chem. 82 (13), 5415-5419 (2010).
- Abzalimov, R. R., Kaplan, D. A., Easterling, M. L., Kaltashov, I. A. Protein conformations can be probed in top-down HDX MS experiments utilizing electron transfer dissociation of protein ions without hydrogen scrambling. J. Am. Soc. Mass Spectrom. 20 (8), 1514-1517 (2009).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır