Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Görüntüleme Patogenez ve Cording Deşifre ve
Bu Makalede
Özet
Optically transparent zebrafish embryos are widely used to study and visualize in real time the interactions between pathogenic microorganisms and the innate immune cells. Micro-injection of Mycobacterium abscessus, combined with fluorescence imaging, is used to scrutinize essential pathogenic features such as cord formation in zebrafish embryos.
Özet
Zebrafish (Danio rerio) embryos are increasingly used as an infection model to study the function of the vertebrate innate immune system in host-pathogen interactions. The ease of obtaining large numbers of embryos, their accessibility due to external development, their optical transparency as well as the availability of a wide panoply of genetic/immunological tools and transgenic reporter line collections, contribute to the versatility of this model. In this respect, the present manuscript describes the use of zebrafish as an in vivo model system to investigate the chronology of Mycobacterium abscessus infection. This human pathogen can exist either as smooth (S) or rough (R) variants, depending on cell wall composition, and their respective virulence can be imaged and compared in zebrafish embryos and larvae. Micro-injection of either S or R fluorescent variants directly in the blood circulation via the caudal vein, leads to chronic or acute/lethal infections, respectively. This biological system allows high resolution visualization and analysis of the role of mycobacterial cording in promoting abscess formation. In addition, the use of fluorescent bacteria along with transgenic zebrafish lines harbouring fluorescent macrophages produces a unique opportunity for multi-color imaging of the host-pathogen interactions. This article describes detailed protocols for the preparation of homogenous M. abscessus inoculum and for intravenous injection of zebrafish embryos for subsequent fluorescence imaging of the interaction with macrophages. These techniques open the avenue to future investigations involving mutants defective in cord formation and are dedicated to understand how this impacts on M. abscessus pathogenicity in a whole vertebrate.
Giriş
Mycobacterium abscessus insanlarda klinik sendromların çok geniş bir yelpaze neden olan bir yükselen bir patojendir. Bunlar deri enfeksiyonları gibi ciddi kronik akciğer enfeksiyonları, çoğunlukla bağışıklık sistemi baskılanmış ve kistik fibroz hastalarında 1,2,3,4 karşılaşılan sayılabilir. M. abscessus insanlarda da, hastane ve iatrojenik enfeksiyonlara yol açan önemli bir hızla büyüyen bir mikrobakteriyel tür olarak kabul edilir. Dahası, birçok yeni raporlar imkanı vurgulanan M. abscessus, kan-beyin bariyerini geçer ve merkezi sinir sistemi (MSS) 5,6 önemli lezyonlar tetikleyebilir. Hızlı bir yetiştiriciye, M. olmasına rağmen Ayrıca abscessus sergiler granülomatöz yapılar içinde yıllarca sessiz kalmayı ve akciğerlerde 7 kazeöz lezyonlar oluşturmak için kapasitesi de dahil olmak Mycobacterium tuberculosis olanlar ilişkili birkaç patojenik özellikleri. Daha endişe verici düşük sen olduğunuM. duyarlılık antibiyotiklere abscessus, önemli terapötik başarısızlık oranı 8,9 giden tedavisi son derece zordur bu enfeksiyonların render. Bu türün önemli bir tehdit esas önemli bir halk sağlığı kurumlarına 10 kaygı ve akciğer nakli 11 kontrendike biridir antibiyotik olan içsel direnç olduğunu.
M. abscessus görüntüler farklı klinik sonuçlara yol düz (S) veya pürüzlü (R) koloni morfotipler. S suşu aksine, R bakteriler bir ip ya da kordon benzeri yapı 12,13 giden, uçtan uca büyümesi için bir eğilim vardır. Hücresel veya hayvan ya modellere dayalı birkaç bağımsız çalışmalar R hiper-virülans fenotip 14,15 Morfotip saptandı. Epidemiyolojik çalışmaların, M. en şiddetli vakalarından abscessus akciğer enfeksiyonları R ile ilişkili olduğu görünen tek varyant olan 16 varyantları olduğunuenfekte olmuş bir konukçu 3 yıl için kalıcı olduğu görülmüştür. Morfotip farkı yüzeyi ile ilişkili glycopeptidolipids (GPL) 12 (S) varlığında veya (R) zarara dayanır. Ancak, mevcut hücresel / hayvan modellerinin doğal sınırlamalar nedeniyle M. incelemek için kullanılan abscessus enfeksiyon, R veya S varyantları patofizyolojik olaylarla ilgili bilgimiz belirsiz kalır. Intravenöz veya aerosol yollardan bağışıklık yetkili farelerin Enfeksiyon kalıcı enfeksiyonları ve in vivo ilaç duyarlılık testi 17 için çalışma farelerin kullanımını engelleyen, geçici kolonizasyon yol açar. Bu nedenle, konak yanıtının manipülasyon için uygun hayvan modelleri geliştirmek önemli bir sorundur. Bu bağlamda, enfeksiyonun memeli olmayan model, bu gibi maliyet, hız ve etik kabul edilebilirliği o gibi birçok avantaj sunar 18 melanogaster Drosophila da dahil olmak üzere, son zamanlarda geliştirilmiştirfare modelini VER. Enfeksiyon Zebra balığı (Danio rerio) modeli aynı zamanda non-invaziv görüntüleme, M. ilerlemesi ve kronolojisi tarafından, görselleştirmek için araştırılmaktadır Canlı bir hayvanda 19 abscessus enfeksiyon. Önemlisi, kavramın bir kanıtı da M. karşı in vivo antibiyotik değerlendirmeleri için uygunluğu göstermek için kurulmuştur 17,20 abscessus.
Zebra balığı çok çeşitli patojenler ve konak bağışıklık sistemi 21 arasındaki etkileşimleri incelemek için son yirmi yılda kullanılmaktadır. Bu alternatif omurgalı modelin artan başarısı motive ve çok sayıda viral ve bakteriyel enfeksiyonlar 19,22,23,24,25,26,27,28,29 daha iyi anlaşılması için kullanılmasını valide büyük ve eşsiz fırsatlar dayanır. Diğer birçok hayvan modellerinde farklı olarak, zebra balığı embriyolar invazif olmayan flüoresan görüntüleme 30. Bu ha sağlayan optik olarak saydamdır,M. çalışmaya yol açtı s abscessus bakteriyel morfolojik plastisite bir örnek temsil dışı Cording açıklaması ile sonuçlanan, görülmemiş detaylarla zebrafish embriyolar bulaşmış. Cording bağışıklık sisteminin devirmenin yeni bir mekanizma ve akut M. patogenezi teşvik eden bir kilit mekanizmasını temsil eder abscessus enfeksiyon 19.
Bu rapor M. patofizyolojik özellikleri deşifre Zebra balığı embriyo kullanarak yeni araçlar ve yöntemleri açıklar enfeksiyon abscessus ve basil ve doğuştan gelen bağışıklık sistemi arasında yakın etkileşimleri çalışmak için. İlk olarak, haddi zatında bakteriyel inokulum, embriyo hazırlanması ve enfeksiyon işlenmesini içeren detaylı mikroenjeksiyon protokolü sunulmaktadır. Yöntem özellikle M. değerlendirmek üzere uyarlanmış Böyle ev sahibi hayatta kalma ve bakteriyel yükü gibi çeşitli parametreler, ölçerek abscessus virulans sunulmuştur. Özel odak nasıl verilirBir zamanmekansal düzeyde, kader ve ilerlemesini enfeksiyon ve M. konak immün yanıtı izlemek için Video mikroskopi kullanılarak abscessus. Dahası, M. sırasında katkı ve makrofajlar rolünü araştırmak için enfeksiyon abscessus, yöntem (Genetik olarak ya da kimyasal olarak tabanlı ya da yaklaşımlar kullanılarak) makrofajlar tükenmiş embriyolar açıklanmıştır üretir. Son olarak, protokoller sabit veya canlı embriyolar kullanarak makrofajlar veya nötrofiller belgelenmiştir belirli etkileşimleri görselleştirmek için.
Bu raporun amacı, M. yeni ışık tutacak ileri çalışmalar teşvik etmektir abscessus virülans mekanizmaları ve akut ve kontrolsüz enfeksiyon sürecinin kuruluşunda Cording özellikle rolü.
Protokol
Zebra balığı deneysel esaslar ilgili kurum ve devlet düzenlemelere uymak zorundadır. Mevcut çalışmada, zebrabalıkları deneyler laboratuar hayvanlarının kullanımı için, Avrupa Birliği kurallarına göre, Üniversite Montpellier (http://ec.europa.eu/environment/chemicals/lab_animals/home_en.htm) yapıldı ve referansı kapsamında onaylanan CEEA-LR-13007.
Reaktifler ve Mikroenjeksiyon Ekipman 1. Hazırlık
- Sonra yukarı 1 ay 28.5 ° C ve mağaza (20 dakika boyunca 120 ° C) sterilize otoklav, 1 L distile su 31 0.06 g Instant Ocean Deniz tuzu çözerek balık suyu hazırlayın.
- 1 L damıtılmış su içinde metilen mavisi 1 g çözülmesiyle metilen mavisi çözeltisi hazırlayın. Sonra yukarı 1 ay 28.5 ° C'de sterilize ve saklamak için otoklav, mavi balık suyu elde etmek için 1 L balık su içinde metilen mavisi çözeltisi 300 ul ekleyin.
NOT: additiBalık suda metilen mavisi kalıp büyümesini engeller. - Fosfat Tamponlu Salin hazırlanması (PBS)
- 5,696 g Na 2 HPO 4, 680 mg KH 2 PO 4, 969 mg KCl ve 78,894 g NaCI, 1 L damıtılmış suda eritilmesi ile 10 x PBS stok çözelti hazırlayın ve HCI ile 7.0'a pH ayarlamak. , 1 X PBS elde sterilize etmek için 120 ° C de 20 dakika boyunca su ve otoklav damıtılmış 900 ml 10 x PBS çözeltisi 100 ml seyreltik için.
- Kadar 1 yıl süreyle oda sıcaklığında 1 X PBST elde etmek için% 0.05 Tween 80 ekleyin ve saklayın.
- Daha sonra solüsyon sterilize filtre sığır karaciğer ve 1 L damıtılmış su içinde oleik asit, 0.5 g 8.5 g NaCl, 50 g sığır serum albumini, 20 g D-glikoz, 40 mg Katalaz çözülmesiyle oleik asit Dekstroz Katalaz (OADC) zenginleştirme hazırlanması ve en fazla 6 ay süreyle 4 ° C'de saklayın.
- 400 mg tricai çözülmesiyle etil 3-aminobenzoat metansülfonik asit (tricaine) stok çözeltisi, 100 ml hazırlayın97.9 ml ne toz distile su. 7.0 pH değerini ayarlamak ve -20 ° C'de çözelti depolamak için 1 M Tris (pH 9) ve 2,1 ml ilave edilir.
- Aşağıdaki ayarlarla bir mikropipet çektirmenin cihazı kullanılarak borosilikat cam kılcal (1mm OD x 0.78 mm ID) çekerek microcapillary enjeksiyon iğneleri hazırlayın: Hava basıncı 650; 999 Isı; 50 çekin; Hız 80; Saat 200.
- Mavi balık su içinde% 1.5 agar çözeltisi hazırlayın ve 100 mm petri kaplarına eridi ağar 25 ml dökün. Erimiş agar üstünde, belirli kanallar diziye için ev yapımı kalıpları yerleştirin. "V" şeklinde kanal pozisyonu embriyolar için kullanılan yumurta (Şekil 1) 31 için kullanılan biçimli "U" ise. Katılaşmış sonra, dikkatlice damgasını çıkarın.
NOT: en fazla 2 ay süreyle 4 ° C'de dehidratasyon ve mağaza önlemek için mavi balık su ile agar örtün.
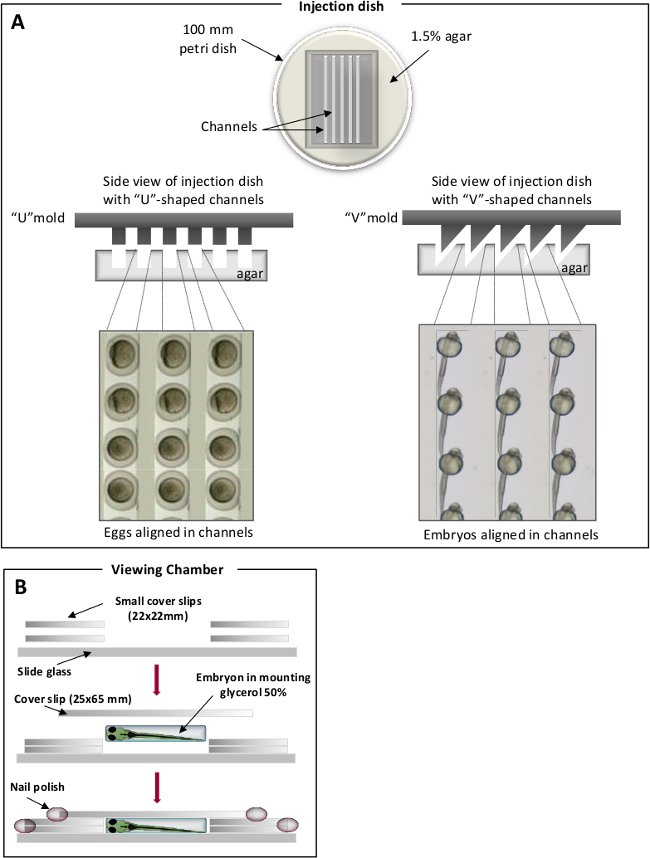
Zebra balığı enjeksiyonlar için Şekil 1. Yerleştirme odaları. (A) yumurta (sol panel) ve embriyolar için V-şekilli kanalların (sağ panel), U-şekilli kanallar. Zebra balığı yumurta / embriyo kanallarında koydu ve aynı eksen boyunca hizalanır. (B) görüntüleme odaları mikroskobik gözlem için. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
2. Hazırlık ve M. Depolama abscessus Aşı
- M. abscessus büyüme koşulları
- M. dışarı Plakalı OADC% 10 ve% 0.5 gliserol (7H10 OADC) ve uygun antibiyotik floresan proteini kodlayan vektör tarafından taşınan direnç markörünün bağlı olarak takviye ihtiva eden bir Middlebrook 7H10 ağarı üzerine -80 ° C gliserol stokundan abscessus. Inkübe4-5 gün boyunca 30 ° C'de kanştınn.
- Bir floresan pozitif mikobakteriyel koloni al ve 15 ml'lik steril bir plastik tüp gerekli bir antibiyotik ile OADC ile desteklenmiş 1 mi Middlebrook 7H9 suyu,% 0.2 gliserol,% 0.05 Tween 80 (7H9 OADC / T) inoküle. Çalkalamadan 1 hafta boyunca 30 ° C'de inkübe edin.
Not: Tween 80 topaklanma ve bakteriyel agregasyonunu kısıtlar. - (Yaklaşık 5,10 7 bakteri / ml karşılık gelen) son 0,1 OD 600, 150 cm 2 doku kültürü şişelerinde 50 ml Middlebrook 7H9 OADC / T 2.1.2 'de elde edilen ön-kültür yeniden süspanse edin ve 4 için 30 ° C de inkübe günde bir katlanarak büyüyen kültürün (OD 600 = 0,6 0,8) elde edilmiştir.
NOT: topaklanma en aza indirmek için, özellikle de kaba varyant, inkübasyon 5 gün geçmemelidir. Hem pürüzsüz ve sert varyantları benzer büyüme gösterir.
- M. hazırlanması abscessus inokulumlar60;
NOT: nedeniyle kaba M. yüksek eğilimine abscessus büyük topaklar oluşturmak ve radyaller için, belirli bir tedavi öncesi embriyolar microinjections homojen ve nicel olarak kontrol inokulum üretmek için gereklidir. Bu tedavi aynı zamanda sert ırkına göre daha az ölçüde olsa da, agrega üreten bakterilere düz uygulanır.- Hasat 4 ° C'de santrifüj ile 150 cm2 doku kültürü şişeleri kültürleri katlanarak büyüyen 000 50 ml'lik steril bir plastik tüp, oda sıcaklığında 15 dakika boyunca xg ve 1 ml 7H9 OADC / T bakteriyel pelletini. Kısım 1.5 ml mikrosantrifüj tüpleri içine bakteriyel süspansiyonlar 200 ul.
NOT: 1 ml şırınga içinde, küçük hacim ile çalışma oldukça homojen bir süspansiyon elde etmek için gereklidir. - Her Sonication se arasında 10 sn sonları ile (10 sn, (15 yukarı ve aşağı dizileri) sonikasyon üç kez 26-G iğne ile bakteriyel süspansiyonlar homojenizeBir su banyosu sonikatör kullanılarak sekans). Kısaca 7H9 OADC / T ve vorteks 1 ml ekleyin. 100 x g'de santrifüjleyin 3 dakika.
- Dikkatle kümeleri önlemek ve 50 ml'lik steril bir plastik tüp homojen süspansiyonların havuza mikobakteriler içeren süpernatantlar toplamak.
- Nihai kalan bakteriyel agregaların varlığı için görsel olarak kontrol edin.
NOT: agregalar hala mevcutsa, 2 dakika boyunca 100 xg'de Ek bir santrifüj işleminin devam ve supernatant toplanır. - Santrifüj Süspansiyon 5 dakika boyunca 4000 x g'de, 200 ul 7H9 OADC / T pelet tekrar süspansiyon ve enjeksiyon için devam edin.
- 7H10 OADC agar üzerinde (1 x PBST içinde) seri dilüsyonları kaplama ve 30 ° C de 4 gün inkübe edildikten sonra, koloni oluşturan birim (CFU) sayımı ile son bakteriyel konsantrasyon değerlendirin. CFU her yeni partisi için belirlenmelidir.
- -80 & # Az 5 ul alikotları saklayarak dondurulmuş inokulumlar stoklarını hazırlayın176 ° C.
NOT: -80 ° C donmuş tümbölenini CFU değerlendirme dondurma / çözme inokulum bakteri canlılığını etkileyebilir olarak canlı bakteri kesin sayısını belirlemek için bir ön koşuldur. Bunlar donmuş inokulumlar sonraki enjeksiyonlar için kullanılmak üzere hazırdır. Tüm alikotları CFU aynı sayıda yana, başka bir deneyden elde edilen tekrarlanabilir bir şekilde bakteri enjekte sağlar.
- Hasat 4 ° C'de santrifüj ile 150 cm2 doku kültürü şişeleri kültürleri katlanarak büyüyen 000 50 ml'lik steril bir plastik tüp, oda sıcaklığında 15 dakika boyunca xg ve 1 ml 7H9 OADC / T bakteriyel pelletini. Kısım 1.5 ml mikrosantrifüj tüpleri içine bakteriyel süspansiyonlar 200 ul.
- Aşı kalite kontrolü
Not: (mikobakteriler özgü) Ziehl-fast boyama öncesi ve 2.2 tarif edilen homojenleştirme işlemlerinden sonra bakteriyel süspansiyonlar kalitesini karşılaştırmak için kullanılabilir.- Nokta ve bir cam slayt homojenize bakteri süspansiyonu bir damlacık yaymak ve bu tamamen kurumasını 65-70 o C ve leke bir Ziehl-Neelsen boyama protokolü kullanılarak ayarlanmış bir sıcak plaka üzerinde en az 30 dakika süreyle smear düzeltmek için izin .
- Bir mikroskop, bir 100 kullanarak bakteriyel smear gözlemleyinX objektif ve olmayan işlenmiş bakteriyel süspansiyon bir karalama ile karşılaştırmak (Şekil 2).
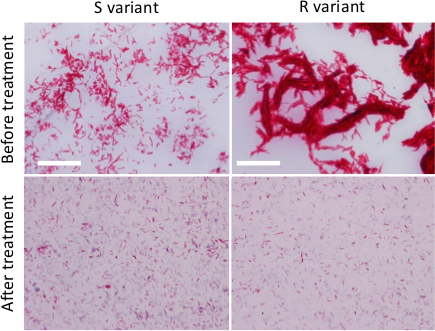
Dağınık M. Şekil 2. Hazırlanması abscessus inokulumlar. R veya S Ziehl-fast boyama (üst paneller) Herhangi bir tedavi öncesinde sıvı ortamında yetiştirilen varyantları ya da tedavisi için (alt paneller) sonrasında, mikobakteriyel agrega büyüklüğü ve sayısı (şırınga, sonifikasyon ve dekantasyon ardışık aşama) azaltmak için . Bakteri 100 x APO yağı 1,4 NA objektif) bir mikroskop kullanılarak tespit edilmiştir. Ölçek çubukları:. 20 mikron bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
3. Zebra balığı Embriyolar hazırlanması
- Zebra balığı yumurtaları yumurtlama ve toplama
- S gün öncepawning, 2 erkek ve 1 kadın koyarak cins yetişkin zebrabalıkları: bir yumurta toplama sepeti 31 ayrı akvaryum oluşan bir üreme odasına (genellikle 2 1 oranında optimum fertilizasyon oranını sağlar).
NOT: Yumurta toplama sepetleri veliler tarafından yenen yumurta korumak ve yumurta hasat kolaylaştırmak için kullanılır. - 28.5 ° C, 25 ml mavi balık su (maksimum 100 tabak başına embriyolar) ve onları tutmak ile dolu bir 100 mm Petri kabındaki 1 hpf, hasat yumurta ve sadece düzgün geliştirilen embriyoların at. Sigara döllenmiş yumurta atılır.
- S gün öncepawning, 2 erkek ve 1 kadın koyarak cins yetişkin zebrabalıkları: bir yumurta toplama sepeti 31 ayrı akvaryum oluşan bir üreme odasına (genellikle 2 1 oranında optimum fertilizasyon oranını sağlar).
- Enjeksiyonlar için zebra balığı embriyo Hazırlık
- Yaklaşık 24 saat sonrası fertilizasyon (hpf), 100 mm Petri kabındaki ince cımbız ile embriyo dechorionate ve 28.5 ° C'de saklayın.
- Bir pipet kullanılarak 30-48 HPF embriyolar toplayın ve balık 25 ml su 270 mg / L ihtiva eden tricaine ile dolu bir "V" şeklinde yerleştirme bölmesine transfer edin.Daha kolay bir mikro-manipülasyonu için optimize edilmiş bir ev yapımı Microloader ucu aracını (ev yapımı kısaltıldı mikro yükleyici ucu) kullanarak kanallar düzgün embriyoların yatırın.
NOT: kaudal ven veya kuyruk kas enjeksiyonları için yukarı sırt tarafında intravenöz enjeksiyon için aşağıya dorsal yüzü yönlendirmek.
4. Mikro enjeksiyon Prosedürü
NOT: M. mikro-enjeksiyon prosedürü abscessus M. daha önce tarif edilen bir benzer marinum 32 enjeksiyonları. M. kronolojisini değerlendirmek için abscessus enfeksiyon (hayatta kalma, bakteri yükü, kinetik ve enfeksiyon özellikleri), 30 hpf embriyoların kaudal ven enjeksiyonları tercih edilmektedir. Bağışıklık hücresi alımı görselleştirmek için, enjeksiyon 48 hpf embriyo kuyruk kaslarında olduğu gibi, lokal bölgelerde yapılır.
- CFU sayısı bağlı olarak 1 x PBST (mikobakteriyel aşının seyreltinUygun enjeksiyon kontrol etmek için,% 10, kırmızı fenol ihtiva eden, Aşama 2.2.6) 'de belirlendiği üzere uygulanabilir.
- Bir Microloader ucu kullanarak bakteriyel inokulum 5-10 ul bir microcapillary enjeksiyon iğnesi yükleyin, enjektör bağlı üç boyutlu mikromanipülatör sahibinin içine mikroenjeksiyon iğne bağlamak ve bir elde etmek için ince cımbız ile iğne üst kesiyorum 5-10 mikron çapı açılması.
- Mikroenjeksiyon basıncı (20-50 hPa) ve saati (0.2 sn) ayarlayarak enjeksiyon hacmi kalibre edin.
Not: gerekli enjeksiyon hacmi embriyonun yumurta sarısı içine atılır bir damlacık çapına görsel belirlenmesi ile kalibre edilir. - Kaudal damar enjeksiyonu için (bölüm 3.2.2 açıklandığı gibi) iğne bakacak ventral yüzü embriyo yerleştirin ve kaudal ven hedefleyen ürogenital açılış iğne ucu yakın, koyun ve yavaşça embriyo içine iğne ucu itin Sadece Caud deler kadaral ven bölgesi. Genellikle yaklaşık 100 CFU / nl içeren 1-3 nl, bakteriyel hazırlık istenilen hacmi sunun.
- Kas içi enjeksiyon için, (bölüm 3.2.2 gibi) iğne bakacak dorsal yüzü embriyo yerleştirin tek hücre gruplarının üzerinde iğne yerleştirin ve inokulum küçük bir hacim (1 nl) enjekte edilir.
NOT: kaudal ven enjeksiyonları gelince, kas içi enfeksiyonlar da gerçekleştirmek için zorlu. Bakım çevre dokulara zarar verebilir, bir aşırı yüklenmesini önlemek için alınmalıdır. - Enjeksiyon işlemi sonunda, 7H10 OADC ile kaplama ve CFU saymak suretiyle steril PBST bir damla bakteri süspansiyonu aynı hacimde enjekte inokulum boyutunu kontrol eder. Yaklaşık 100 embriyolar bir iğne ile enjekte edilebilir.
NOT: Çünkü kaba M. abscessus iğne agregatlar oluşturması için devam edebilir, enjeksiyonu inokulum hazırlanmasından hemen sonra yapılması gerekir. - Enfekte fis aktarın2 ml / oyuk balık su ve 28,5 ° C'de inkübe içeren h bireysel olarak 24 oyuklu plakalar. 1-3 nl 1 x PBST ile enjekte edilen embriyolar kontrol olarak da kullanılabilir.
- Embriyolar floresan bakterilerin uygun enfeksiyonu, bir floresans mikroskobu kullanılarak izlenir.
Makrofaj-Tükenmiş Embriyolar 5. Nesil
NOT: dokulardan makrofajlar seçici tüketme enfeksiyonu sırasında katkılarını ve rolünü araştırmak için kullanılır. Makrofajlar uygun tükenmesi görselleştirmek için, MCherry özellikle makrofaj belirli bir MPEG1 promoterinin 19 kontrolü altında ifade edilir flüoresan makrofajlar ile bir transgenik hattı kullanmak tavsiye edilir.
- Lipo-klodronat bazlı prosedür
NOT: lipo-klodronat prosedür dokulardan makrofajların seçici tükenmesi (ancak hiçbir nötrofiller) 19 verir. Bu bileşik, ne embriyoların ne af hayatta değiştirmez yokBakterilerin bütünlüğünü fect. Lipozomla kapsüllenmiş klodronat hazırlamak için ayrıntılı bir protokol daha önce 33 bildirilmiştir.- 24 hpf, embriyolar dechorionate ve 3.2.2 de tarif edildiği gibi, püskürtme işleminin sonuna kadar anestezi altında halde embriyolar korumak için tricaine ile takviye edilmiş balık su ile dolu bir "V" şeklinde püskürtme kabı aktarın. Aşağıya doğru dorsal yüzü yönlendirmek.
- Lipozom kapsüllü klodronat (lipo-klodronat) ile microcapillary enjeksiyon iğnesi yükleyin, üç boyutlu mikromanipülatör sahibinin içine mikroenjeksiyon iğne bağlayın ve 10 um bir ucu açılış çapı elde etmek için ince cımbız ile iğne üst kesiyorum.
- Enjeksiyon hacmi kalibre etmek için, 20 hPa mikroenjeksiyon basıncı ve 0.2 sn enjeksiyon süresini ayarlayın. Kaudal ven hedefleyen, ürogenital açılış iğne ucu yakın yerleştirin ve yavaşça içine iğne ucu itinEmbriyo sadece kaudal ven bölgesini deler ve çözümün istenilen hacmi (2-3 nl, 3 kez) teslim kadar.
NOT: lipo-klodronat süspansiyon çok yapışkan ve embriyonun damar sistemi ve öldürme engellenmesini önlemek için enjeksiyondan önce vortekslenmiş edilmelidir. Bu küçük hacimli birkaç ardışık enjeksiyonlar devam etmek çok önemlidir. - Balık su içeren 100 mm petri kaplarına embriyo transferine ve enfeksiyon kadar 28.5 ° C saklayın.
- Floresan mikroskobu ile makrofajlar uygun tükenmesi kontrol edin.
Not: Tam makrofaj tükenmesi lipo clodoronate uygulamadan sonra 4 gün süre ile etkilidir.
- Morfolino bazlı prosedür
- 2 erkek ve bir üreme odasında plastik bariyer ile ayrılmış 1 kadın koyarak yumurtlama, cins yetişkin zebrafish gün önce.
- Ertesi gün, ışık zebrabalıkları tesiste yanar sonra ≈ 30 dakika, ayırma bariyer kaldırmakkadın ve erkekler. Fertilizasyon hızını optimize etmek üzere yumurtlama başlangıcından sonra yaklaşık 20 dakika boyunca bekleyin. Yumurtaları hasat ve soğuk mavi balık su (4 ° C) ile dolu bir 100 mm petri aktararak onların gelişimini yavaşlatır.
NOT: yumurtlama kontrolü morpholinos tabanlı deneyler için çok önemlidir. Morpholinos sadece dört hücre aşamasına kadar yumurta içine enjekte edilebilir. - Bir pipet kullanarak yumurta toplamak ve soğuk mavi balık su dolu "U" şeklindeki enjeksiyon odasında yumurta aşağı yatırmak ve bir ev yapımı Microloader ucu aracını kullanarak kanallarında yumurta engeller.
- Daha önce tarif edildiği gibi 19, fenol kırmızısı% 10 ihtiva eden pu.1 morfolino çözeltisi hazırlayın. Morfolino hazırlık olan bir microcapillary enjeksiyon iğnesi yükleyin ve üç boyutlu mikromanipülatör sahibinin içine mikroenjeksiyon iğne bağlamak, sonra obtai ince cımbız ile iğne ucu koparak5-10 um na ucu açılış çapı.
- Enjeksiyon hacmi kalibre etmek için, 20-50 hPa mikroenjeksiyon basıncı ve 0.2 sn enjeksiyon süresini ayarlayın. Yumurta yakın iğne ucu yerleştirin ve yavaşça istenen morfolino çözüm hacmi, genellikle 3-5 nl yumurtanın içine koryon yoluyla iğne ucu itin ve teslim.
- Mikro-enjeksiyon sonra balık su içinde 100 mm petri çanağına yumurta transferi ve enfeksiyon işlemi başlar kadar 28.5 ° C 'de inkübe edilir.
- 30 48 hpf floresan mikroskobu ile pu.1 morphants makrofajların uygun (tam) tükenmesini analiz edin..
Not: enjekte edilen konsantrasyona bağlı olarak, p u.1 morpholinos erken nötrofil sayısını etkileyebilir. Nötrofil sayısının değiştirmeden makrofajlar uygun tükenmesi onaylamak için, GFP ile (floresan makrofajlar ve nötrofiller ile çift transgenik zebrafish hattını kullanmanız tavsiye edilirözellikle Mpx promoteri tarafından tahrik edilen sentezleme) 19.
6. Bakteriyel Yükü Ölçümü
- CFU numaralandırma tarafından belirlenmesi
- Arzu edilen zaman noktasında, bir 1.5 ml mikrosantrifüj tüpleri içinde enfekte embriyo grupları (koşullarına göre 5) (1 embriyo / tüp), 10 dakika boyunca buz üzerinde kuluçkalama ile embriyolar cryo-anestezisi ve tricaine bir doz aşımı ile ötenazi (300- toplamak 500 mg / L)
- Iki kez steril su ile embriyolar yıkayın ve yeni bir tüp içinde dağıtılması, lize her embriyo% 2 Triton X-100, bir 26-G iğne kullanılarak ve tam liziz kadar süspansiyon homojenize 1 x PBST içinde seyreltilmiştir. Süspansiyon santrifüj ve% 0.05 Tween homojenatlarının 80 seri seyreltileri Middlebrook 7H10 OADC üzerine kaplanmıştır ve üretici firmanın yönergelerine göre BBL MGIT PANTA ile takviye edilmektedir 1 x PBST pelletini.
NOT: M. NaOH Terbiyede daha duyarlı olma abscessusM. den t M. etkilemeden balık lizatlarının marinum, dekontaminasyon abscessus büyüme başarıyla BBL MGIT PANTA antibiyotik kokteyli kullanılarak elde edilebilir. - 30 ° C ve sayım koloni olacak şekilde, 4 gün boyunca inkübe edin.
- Floresan Pixel belirlenmesi canlı embriyolar (FPC) ölçümleri Sayısı
NOT: floresan emisyon yoluyla bakteri yüklerini belirlemek için, enfekte embriyoların seri görüntüleri elde edilir ve FPC (partikül analizi ile bakterilerin tanımlanması) ile ölçülen floresan yoğunluğu ImageJ freeware için geliştirilmiş bir ev yapımı makro kullanarak. Bir parçacık analizi kökenli ilgi floresan sinyal ayırt olanak sağlayan bir eşik aralığına dayanan bir ikili siyah beyaz resmi gerektirir.- 3.2.2 tarif edildiği gibi arzu edilen bir zaman noktasında, 35 mm Petri tabaklarda enfekte embriyolar (koşul başına 5-10) tricain-anestetize.
- Su ve subme kaldırrge embriyolar ve balık su içinde% 1 düşük erime noktası agaroz ile tüm çanak yüzeyi, daha sonra yanal embriyoların hizalayın. Balık suyu tricaine içeren katılaşmış agaroz örtün.
- 10 x hedefi ile bir Epifloresans mikroskop kullanılarak tüm embriyo floresan görüntüler elde.
NOT: floresan görüntü alma FPC ölçümleri prosedürün kritik bir adımdır. Bir renk kalibrasyon prob ile kalibre edilmiş bir monitör kullanmak önemlidir. Iktisap sinyalinin doygunluk engeller sırasında maruz optimal süresi ayarlama minimal bir arka plan elde etmek. Görüntüler bir 8-bit tiff formatında olmalıdır. Özdeş ayarlar kantitatif amaçlar için bütün deney sırasında tutulur. - Bir ev yapımı Microloader ucu aracı ile embriyolardan dikkatlice agaroz çıkarın. Gerekirse bu embriyolar, daha sonraki analizler için de kullanılabilir. Bakteri yükünün miktarının öncesinde her resim kalitesi kontrol edilir. Bir içingörüntüleri nalyze ve balık başına FPC içine floresan dönüştürmek, ImageJ freeware açın.
NOT: FPC değeri bakteri yükünü yansıtan önceden M. kullanılarak gösterildiği gibi marinum 34. - Bulaşmamış embriyo, bir görüntü kullanılarak görüntü analizi için gereken eşik belirleme (birkaç kontrol embriyoları ortalama eşiği elde etmek için kullanılabilir). → → Eşik ayarlayın ve sonra arka plan tamamen siyah oluncaya kadar (yani sıfır olmalı bir arka plan elde etmek için) sağa eşik penceresinde alt kaydırıcıyı Image gidin. İlgili değerini kaydedin.
- Görüntü J içinde, FPC makro (ek dosyası) açın ve yönergeleri izleyin: Görüntülerin klasörünün ölçülecek bulmak ve önceden belirlenen ve "Tamam" üzerine tıklayın olarak sonra eşiği girin.
NOT: Makro otomatik arka plan çıkarır. Bir eşik daha sonra tatbik edilir. Floresan sinyalleri tanımladı vardırparçacık analizi aşağıdaki fied. - Kopya veri analizi için istenen yazılıma özet penceresinden verileri yapıştırın ve.
NOT: CFU belirlenmesi yöntemine aksine, FPC yöntemi non-invaziv ve dinamikleri izleme önemlisi, daha sonraki analizler için embriyolar yeniden kullanımı ve izin verir / bireysel olarak bakteri yükünün kinetiği. Bu nedenle, önemli ölçüde etik kurallara uyum içinde, hayvanların sayısını azaltarak sağlar.
7. Görüntüleme M. abscessus- enfekte Embriyolar
- M. Canlı görüntüleme abscessus enfeksiyon
- Montaj tricaine anestezi embriyolar (3.2.2) epifloresans mikroskobu gözlemler öncesinde 35 mm petri kabı içinde% 1 düşük erime noktalı agarozda. Ters konfokal mikroskobu veya dik konfokal mikroskobu için tek kavite depresyon slayt bir cam alt çanak kullanın. Istenen konuma ve kapağa embriyo yönlendirmekBalık suyu tricaine içeren katılaşmış agaroz.
- Tüm embriyonun sıralı floresan toplama ve iletim görüntüler için 10 x hedefi ile bir Epifloresans mikroskop kullanın. Alternatif olarak, bir enfeksiyon sonrası bağışıklık hücrelerinin aktivitesini görselleştirmek için 40X veya 63X hedefleri ile bir konfokal mikroskop kullanın.
- Görüntüleme M. Sabit abscessus enfekte embriyolar
- 6.1.1 tarif edildiği gibi embriyolar Euthanize 4 ° C'de oda sıcaklığında ya da O / N, 2 saat boyunca 1 x PBST içinde% 4 paraformaldehid içinde embriyolar 1.5 mi mikro santrifüj tüplerine transfer ve düzeltin. 10 dakika boyunca 1 x PBST ile iki kere embriyo yıkanmasıyla paraformaldehid çıkarın.
NOT: floresan korumak için sabitlenmiş embriyolar ışıktan korunmalıdır. - Doku ve floresan bütünlüğünü korumak için, embriyolar için, (1 x PBST içinde seyreltilmiş 10, 20, 30, 40 ve% 50), gliserol konsantrasyonu çözümleri artan art arda inkübe edilirKoşul başına 10 dak.
Not: Sabit embriyolar 4 ° C'de% 50 gliserol içinde birkaç ay depolanabilir. - Bir görüntüleme odası (Şekil 1B) 31,% 50 gliserol içinde gömülü embriyo yerleştirin.
- Konfokal mikroskop 40X veya 63X hedefleri kullanarak görüntü.
- 6.1.1 tarif edildiği gibi embriyolar Euthanize 4 ° C'de oda sıcaklığında ya da O / N, 2 saat boyunca 1 x PBST içinde% 4 paraformaldehid içinde embriyolar 1.5 mi mikro santrifüj tüplerine transfer ve düzeltin. 10 dakika boyunca 1 x PBST ile iki kere embriyo yıkanmasıyla paraformaldehid çıkarın.
Sonuçlar
Çeşitli anatomik yerler 32 enjekte edilebilir, ancak, kuyruk damarı enjeksiyonu genellikle sağkalım deneylerde bakteriyel yük belirleme, fagositoz aktivitesi veya kordon oluşumu da dahil olmak üzere daha sonraki analizler için sistemik bir enfeksiyon elde etmek için kullanılır. Kuyruk kaslarda Enjeksiyonlar Enjeksiyon (Şekil 3A) yerinde makrofajların işe değerlendirmek için kullanılır. Araştırmak ve M. R ve S varyantları virülansını karşılaştırmak abs...
Tartışmalar
Zebra balığı son gerçek zamanlı 36 geniş bir alan ve konfokal görüntüleme kullanılarak bakteriyel enfeksiyon dinamiklerini incelemek için mükemmel bir omurgalı bir model sistem olarak ortaya çıkmıştır. Birlikte mikro-enjeksiyon yöntemleri (protokol 4) ile dağınık mikobakteriyel süspansiyonlar (protokol 2.2) kombinasyonu tekrarlanabilir sistemik enfeksiyonlar ve daha sonraki izleme ve ev sahibi makrofajlar ile bakteriyel etkileşimleri üzerine özel bir odaklanma ile enfeksiyonun ilerle...
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
Yazarlar yararlı tartışmalar için sırasıyla, tdTomato ve Wasabi ifadesini sağlayan pTEC27 ve pTEC15 cömert hediye için lipo-klodronat ve L. Ramakrishnan sağlamak için K. Kissa minnettarız. Fransız Ulusal Araştırma Ajansı projelerinden (ZebraFlam ANR-10-MIDI-009 ve DIMYVIR ANR-13-BSV3-007-01) ve Avrupa Topluluğu'nun Yedinci Çerçeve Programı Bu çalışma parçasını oluşturmaktadır (FP7-PEOPLE-2011-ITN) Hibe sözleşmesi kapsamında hayır. PITN-GA-2011-289209 Marie-Curie İlk Eğitim Ağı FishForPharma için. Biz CM Dupont fon Derneği Gregory Lemarchal ve Vaincre La mukoviskidoz (RF20130500835) teşekkür etmek de isterdim.
Malzemeler
| Name | Company | Catalog Number | Comments |
| BBL MGIT PANTA | BD Biosciences | 245114 | |
| Bovine Serum Albumin | Euromedex | 04-100-811-E | |
| Catalase from Bovine Liver | Sigma-Aldrich | C40 | |
| Difco Middlebrook 7H10 Agar | BD Biosciences | 262710 | |
| Difco Middlebrook 7H9 Broth | BD Biosciences | 271310 | |
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | A5040 | |
| Oleic Acid | Sigma-Aldrich | O1008 | |
| Paraformaldehyde | Delta Microscopie | 15710 | |
| Phenol Red | Sigma-Aldrich | 319244 | |
| Tween 80 | Sigma-Aldrich | P4780 | |
| Agar | Gibco Life Technologie | 30391-023 | |
| Low melting agarose | Sigma-Aldrich | ||
| Instant Ocean Sea Salts | Aquarium Systems Inc | ||
| Borosilicate glass capillaries | Sutter instrument Inc | BF100-78-10 | 1 mm O.D. X 0.78 mm I.D. |
| Micropipette puller device | Sutter Instrument Inc | Flamming/Brown Micropipette Puller p-87 | |
| Microinjector | Tritech Research | Digital microINJECTOR, MINJ-D | |
| Tweezers | Sciences Tools inc | Dumont # M5S | |
| Microloader Tips | Eppendorf |
Referanslar
- Brown-Elliott, B. A., Wallace, R. J. Clinical and taxonomic status of pathogenic nonpigmented or late-pigmenting rapidly growing mycobacteria. Clinical Microbiology Reviews. 15 (4), 716-746 (2002).
- Aitken, M. L., Limaye, A., et al. Respiratory outbreak of Mycobacterium abscessus subspecies massiliense in a lung transplant and cystic fibrosis center. American Journal of Respiratory and Critical Care Medicine. 185 (2), 231-232 (2012).
- Gilljam, M., Lindblad, A., Ridell, M., Wold, A. E., Welinder-Olsson, C. Molecular epidemiology of Mycobacterium abscessus, with focus on cystic fibrosis. Journal of Clinical Microbiology. 45 (5), 1497-1504 (2007).
- Roux, A. -. L., Catherinot, E., et al. Multicenter study of prevalence of nontuberculous mycobacteria in patients with cystic fibrosis in France. Journal of Clinical Microbiology. 47 (12), 4124-4128 (2009).
- Lee, M. -. R., Cheng, A., et al. CNS infections caused by Mycobacterium abscessus complex: clinical features and antimicrobial susceptibilities of isolates. The Journal of Antimicrobial Chemotherapy. 67 (1), 222-225 (2012).
- Talati, N. J., Rouphael, N., Kuppalli, K., Franco-Paredes, C. Spectrum of CNS disease caused by rapidly growing mycobacteria. The Lancet Infectious Diseases. 8 (6), 390-398 (2008).
- Medjahed, H., Gaillard, J. -. L., Reyrat, J. -. M. Mycobacterium abscessus: a new player in the mycobacterial field. Trends in Microbiology. 18 (3), 117-123 (2010).
- Griffith, D. E., Girard, W. M., Wallace, R. J. Clinical features of pulmonary disease caused by rapidly growing mycobacteria. An analysis of 154 patients. The American Review of Respiratory Disease. 147 (5), 1271-1278 (1993).
- Nessar, R., Cambau, E., Reyrat, J. M., Murray, A., Gicquel, B. Mycobacterium abscessus: a new antibiotic nightmare. The Journal of Antimicrobial Chemotherapy. 67 (4), 810-818 (2012).
- Sanguinetti, M., Ardito, F., et al. Fatal pulmonary infection due to multidrug-resistant Mycobacterium abscessus a patient with cystic fibrosis. Journal of Clinical Microbiology. 39 (2), 816-819 (2001).
- Griffith, D. E., Aksamit, T., et al. An official ATS/IDSA statement: diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. American Journal of Respiratory and Critical Care Medicine. 175 (4), 367-416 (2007).
- Howard, S. T., Rhoades, E., et al. Spontaneous reversion of Mycobacterium abscessus a smooth to a rough morphotype is associated with reduced expression of glycopeptidolipid and reacquisition of an invasive phenotype. Microbiology (Reading, England). 152 (Pt 6), 1581-1590 (2006).
- Chardi, A., Olivares, F., Byrd, T. F., Julián, E., Brambilla, C., Luquin, M. Demonstration of cord formation by rough Mycobacterium abscessus variants: implications for the clinical microbiology laboratory. Journal of Clinical Microbiology. 49 (6), 2293-2295 (2011).
- Byrd, T. F., Lyons, C. R. Preliminary characterization of a Mycobacterium abscessus mutant in human and murine models of infection. Infection and Immunity. 67 (9), 4700-4707 (1999).
- Catherinot, E., Clarissou, J., et al. Hypervariance of a rough variant of the Mycobacterium abscessus type strain. Infection and Immunity. 75 (2), 1055-1058 (2007).
- Catherinot, E., Roux, A. -. L., et al. Acute respiratory failure involving an R variant of Mycobacterium abscessus. Journal of Clinical Microbiology. 47 (1), 271-274 (2009).
- Bernut, A., Le Moigne, V., Lesne, T., Lutfalla, G., Herrmann, J. -. L., Kremer, L. In vivo assessment of drug efficacy against Mycobacterium abscessus using the embryonic zebrafish test system. Antimicrobial Agents and Chemotherapy. 58 (7), 4054-4063 (2014).
- Oh, C. -. T., Moon, C., Jeong, M. S., Kwon, S. -. H., Jang, J. Drosophila melanogaster for Mycobacterium abscessus infection. Microbes and Infection / Institut Pasteur. 15 (12), 788-795 (2013).
- Bernut, A., Herrmann, J. -. L., et al. Mycobacterium abscessus cording prevents phagocytosis and promotes abscess formation. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), E943-E952 (2014).
- Dubée, V., Bernut, A., et al. β-Lactamase inhibition by avibactam in Mycobacterium abscessus. Journal of Antimicrobial Chemotherapy. 70 (4), 1051-1058 (2015).
- Torraca, V., Masud, S., Spaink, H. P., Meijer, A. H. Macrophage-pathogen interactions in infectious diseases: new therapeutic insights from the zebrafish host model. Disease Models Mechanisms. 7 (7), 785-797 (2014).
- Alibaud, L., Rombouts, Y., et al. A Mycobacterium marinum TesA mutant defective for major cell wall-associated lipids is highly attenuated in Dictyostelium discoideum and zebrafish embryos. Molecular Microbiology. 80 (4), 919-934 (2011).
- Clay, H., Volkman, H. E., Ramakrishnan, L. Tumor necrosis factor signaling mediates resistance to mycobacteria by inhibiting bacterial growth and macrophage death. Immunity. 29 (2), 283-294 (2008).
- Palha, N., Guivel-Benhassine, F., et al. Real-time whole-body visualization of Chikungunya Virus infection and host interferon response in zebrafish. PLoS pathogens. 9 (9), e1003619 (2013).
- Mostowy, S., Boucontet, L., et al. The zebrafish as a new model for the in vivo study of Shigella flexneri with phagocytes and bacterial autophagy. PLoS pathogens. 9 (9), e1003588 (2013).
- Prajsnar, T. K., Cunliffe, V. T., Foster, S. J., Renshaw, S. A. A novel vertebrate model of Staphylococcus aureus reveals phagocyte-dependent resistance of zebrafish to non-host specialized pathogens. Cellular Microbiology. 10 (11), 2312-2325 (2008).
- Van der Sar, A. M., Appelmelk, B. J., Vandenbroucke-Grauls, C. M. J. E., Bitter, W. A star with stripes: zebrafish as an infection model. Trends in Microbiology. 12 (10), 451-457 (2004).
- Vergunst, A. C., Meijer, A. H., Renshaw, S. A., O’Callaghan, D. Burkholderia cenocepacia creates an intramacrophage replication niche in zebrafish embryos, followed by bacterial dissemination and establishment of systemic infection. Infection and Immunity. 78 (4), 1495-1508 (2010).
- Levraud, J. -. P., Disson, O., et al. Real-time observation of Listeria monocytogenes-phagocyte interactions in living zebrafish larvae. Infection and Immunity. 77 (9), 3651-3660 (2009).
- Meijer, A. H., Spaink, H. P. Host-pathogen interactions made transparent with the zebrafish model. Current Drug Targets. 12 (7), 1000-1017 (2011).
- Westerfield, M. . The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Danio Rerio). , (2007).
- Benard, E. L., van der Sar, A. M., Ellett, F., Lieschke, G. J., Spaink, H. P., Meijer, A. H. Infection of zebrafish embryos with intracellular bacterial pathogens. Journal of Visualized Experiments. (61), e3781 (2012).
- Van Rooijen, N., Sanders, A. Liposome mediated depletion of macrophages: mechanism of action, preparation of liposomes and applications. Journal of Immunological Methods. 174 (1-2), 83-93 (1994).
- Adams, K. N., Takaki, K., et al. Drug tolerance in replicating mycobacteria mediated by a macrophage-induced efflux mechanism. Cell. 145 (1), 39-53 (2011).
- Ramakrishnan, L. Looking within the zebrafish to understand the tuberculous granuloma. Advances in Experimental Medicine and Biology. 783, 251-266 (2013).
- Davis, J. M., Clay, H., Lewis, J. L., Ghori, N., Herbomel, P., Ramakrishnan, L. Real-time visualization of Mycobacterium-macrophage interactions leading to initiation of granuloma formation in zebrafish embryos. Immunity. 17 (6), 693-702 (2002).
- Lamason, R. L., Mohideen, M. -. A. P. K., et al. SLC24A5, a putative cation exchanger, affects pigmentation in zebrafish and humans. Science (New York, NY). 310 (5755), 1782-1786 (2005).
- Renshaw, S. A., Loynes, C. A., Trushell, D. M. I., Elworthy, S., Ingham, P. W., Whyte, M. K. B. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Hall, C., Flores, M. V., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC developmental biology. 7, 42 (2007).
- Takaki, K., Davis, J. M., Winglee, K., Ramakrishnan, L. Evaluation of the pathogenesis and treatment of Mycobacterium marinum in zebrafish. Nature Protocols. 8 (6), 1114-1124 (2013).
- Stoop, E. J. M., Schipper, T., et al. Zebrafish embryo screen for mycobacterial genes involved in the initiation of granuloma formation reveals a newly identified ESX-1 component. Disease Models Mechanisms. 4 (4), 526-536 (2011).
- Carvalho, R., de Sonneville, J., et al. A high-throughput screen for tuberculosis progression. PloS One. 6 (2), e16779 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır