É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Decifrar e Imagem Patogênese e Cording de
Neste Artigo
Resumo
Optically transparent zebrafish embryos are widely used to study and visualize in real time the interactions between pathogenic microorganisms and the innate immune cells. Micro-injection of Mycobacterium abscessus, combined with fluorescence imaging, is used to scrutinize essential pathogenic features such as cord formation in zebrafish embryos.
Resumo
Zebrafish (Danio rerio) embryos are increasingly used as an infection model to study the function of the vertebrate innate immune system in host-pathogen interactions. The ease of obtaining large numbers of embryos, their accessibility due to external development, their optical transparency as well as the availability of a wide panoply of genetic/immunological tools and transgenic reporter line collections, contribute to the versatility of this model. In this respect, the present manuscript describes the use of zebrafish as an in vivo model system to investigate the chronology of Mycobacterium abscessus infection. This human pathogen can exist either as smooth (S) or rough (R) variants, depending on cell wall composition, and their respective virulence can be imaged and compared in zebrafish embryos and larvae. Micro-injection of either S or R fluorescent variants directly in the blood circulation via the caudal vein, leads to chronic or acute/lethal infections, respectively. This biological system allows high resolution visualization and analysis of the role of mycobacterial cording in promoting abscess formation. In addition, the use of fluorescent bacteria along with transgenic zebrafish lines harbouring fluorescent macrophages produces a unique opportunity for multi-color imaging of the host-pathogen interactions. This article describes detailed protocols for the preparation of homogenous M. abscessus inoculum and for intravenous injection of zebrafish embryos for subsequent fluorescence imaging of the interaction with macrophages. These techniques open the avenue to future investigations involving mutants defective in cord formation and are dedicated to understand how this impacts on M. abscessus pathogenicity in a whole vertebrate.
Introdução
Mycobacterium abscessus é um agente patogénico emergente que faz com que um largo espectro de síndromes clínicos em seres humanos. Estes incluem infecções cutâneas, bem como infecções pulmonares crônicas graves, principalmente encontrados em imunocomprometidos e em pacientes com fibrose cística 1,2,3,4. M. abscessus também é considerado como um dos principais rápido crescimento espécies de micobactérias responsáveis por infecções hospitalares e iatrogênica em seres humanos. Além disso, vários relatórios recentes em destaque a possibilidade de que M. abscessus pode atravessar a barreira sangue-cérebro e induzir lesões importantes no sistema nervoso central (SNC) 5,6. Apesar de ser um cultivador rápido, M. exposições abscessus também várias características patogênicas que estão relacionados com os do Mycobacterium tuberculosis, incluindo a capacidade de permanecer em silêncio durante anos dentro de estruturas granulomatosas e gerar lesões caseosas nos pulmões 7. Mais alarmante é a baixa sensensibili- de M. abscessus aos antibióticos, tornando estas infecções extremamente difícil de tratar levando a uma taxa de insucesso terapêutico significativo 8,9. A ameaça importante desta espécie é principalmente a sua resistência intrínseca a antibióticos, que é de grande preocupação em instituições de saúde públicas 10 e uma contra-indicação para transplante pulmonar 11.
M. abscessus exibe lisas (S) ou ásperas morfotipos (R) da colônia que levam a desfechos clínicos diferentes. Em contraste com a estirpe S, R bactérias têm uma tendência para crescer uma extremidade à outra, levando a uma corda ou cabo, como a estrutura 12,13. Vários estudos independentes com base em modelos celulares e animais seja revelado o fenótipo hiper-virulência do morfotipo R 14,15. A partir de estudos epidemiológicos, os casos mais graves de M. infecções pulmonares abscessus parecem estar associados com R 16 variantes que são a única variante quetem sido visto a persistir por anos em um hospedeiro infectado 3. A diferença morfotipo depende da presença (em S) ou perda (em R $) de glycopeptidolipids associada de superfície (GPL) 12. No entanto, devido às limitações inerentes dos modelos celulares / animais actualmente disponíveis utilizados para estudar M. infecção abscessus, o nosso conhecimento sobre os eventos fisiopatológicos das variantes R ou S permanece obscura. A infecção de ratos imuno-competentes através de via intravenosa ou aerossóis conduz à colonização transiente, o que dificulta a utilização de ratos para estudar infecções persistentes e in vivo para os testes de susceptibilidade droga 17. Por conseguinte, o desenvolvimento de modelos animais susceptíveis à manipulação da resposta do hospedeiro é um grande desafio. Neste contexto, os modelos não-mamíferos de infecção foram recentemente desenvolvidos, incluindo Drosophila melanogaster 18 que oferece várias vantagens, tais como custos, velocidade e ética o aceitabilidadeVer o modelo de mouse. O modelo de peixe-zebra (Danio rerio) de infecção também tem sido explorada para visualizar, por imagem não-invasivo, a progressão e cronologia da M. abscessus infecção em um animal vivo 19. Importante, uma prova de conceito também foi criado para demonstrar a sua aptidão para avaliações in vivo de antibióticos contra M. abscessus 17,20.
O peixe-zebra têm sido amplamente utilizados durante as duas últimas décadas para estudar as interacções entre vários agentes patogénicos e o sistema imune do hospedeiro 21. O crescente sucesso deste modelo vertebrado alternativa depende de grandes e únicas oportunidades que motivaram e validados a sua utilização para uma melhor compreensão das inúmeras infecções virais e bacterianas 19,22,23,24,25,26,27,28,29. Ao contrário da maioria dos outros modelos animais, embriões de peixe-zebra são opticamente transparentes, permitindo que imagens de fluorescência não-invasivo 30. Esta has levou a estudar M. abscessus infectado embriões de peixe-zebra com detalhes sem precedentes, culminando com a descrição dos cordões extracelular, que representam um exemplo de plasticidade morfológica bacteriana. Cordões representa um novo mecanismo de subverter o sistema imunitário e um mecanismo de chave promover patogénese de M. aguda infecção abscessus 19.
Este relatório descreve novas ferramentas e métodos que utilizam o embrião de peixe-zebra para decifrar os traços fisiopatológicos da M. abscessus infecção e para estudar as interacções entre os bacilos íntimas e do sistema imune inato. Em primeiro lugar, um protocolo detalhado microinjecção que inclui o processamento do inoculo bacteriano, preparação de embriões, e infecção por si só, é apresentada. Métodos especificamente adaptado para avaliar M. virulência abscessus medindo vários parâmetros, tais como a sobrevivência do hospedeiro e a carga bacteriana, são apresentados. É dado especial relevo sobre comopara monitorar, a um nível de espaço-temporal, o destino e a progressão da infecção e da resposta imune do hospedeiro a M. abscessus usando microscopia de vídeo. Além disso, para investigar a contribuição eo papel dos macrófagos durante M. abscessus infecção, métodos para gerar macrófagos-empobrecido embriões (usando abordagens quer genetically- ou baseados em quimicamente) são descritos. Finalmente, os protocolos para visualizar as interações específicas com macrófagos ou neutrófilos seja utilizando embriões fixos ou vivem são documentados.
O objetivo deste relatório é estimular novos estudos para lançar uma nova luz em M. mecanismos de virulência abscessus e particularmente o papel de cordões no estabelecimento de um processo de infecção aguda e descontrolada.
Protocolo
Procedimentos experimentais de peixes-zebra deve cumprir os regulamentos institucionais e governamentais relevantes. Para o presente estudo, as experiências de peixe-zebra foram feitas na Universidade Montpellier, de acordo com as orientações da União Europeia para o manuseio de animais de laboratório (http://ec.europa.eu/environment/chemicals/lab_animals/home_en.htm) e aprovado sob a referência CEEA-LR-13007.
1. Preparação dos Reagentes e Equipamento Microinjeção
- Prepare peixes de água por dissolução de 0,06 g de sal do mar Instant Ocean em 1 L de água destilada 31, em seguida, autoclave para esterilizar (120 ° C por 20 min) e armazenar a 28,5 ° C por até 1 mês.
- Preparar a solução de azul de metileno por dissolução de 1 g de azul de metileno em 1 L de água destilada. Adicione 300 ml de solução de azul de metileno em 1 L de peixes de água para obter água azul peixes, então autoclave para esterilizar e armazenar a 28,5 ° C por até 1 mês.
NOTA: O additiem de azul de metileno em água peixe impede o crescimento de fungos. - Preparação de Solução Salina Tamponada com Fosfato (PBS)
- Prepara-se uma solução estoque de 10 X PBS por dissolução de 5,696 g de Na 2 HPO 4, 680 mg de KH 2 PO 4, 969 mg de KCl e 78,894 g de NaCl em 1 L de água destilada e ajustar o pH para 7,0 com HCl. Para obter 1 X PBS, dilui-se 100 ml da solução de 10 x PBS, em 900 ml de água destilada e em autoclave durante 20 min a 120 ° C para se esterilizar.
- Adicionar 0,05% de Tween 80 para se obter 1 X PBST e armazenar a temperatura ambiente durante até 1 ano.
- Prepare ácido oleico Dextrose Catalase (OADC) enriquecimento por dissolução de 8,5 g de NaCl, 50 g de Albumina de Soro Bovino, 20 g de D-glucose, 40 mg de catalase de fígado de bovino e 0,5 g de ácido oleico em 1 L de água destilada, em seguida, filtrar esterilizar a solução e armazená-lo a 4 ° C durante até 6 meses.
- Preparação de 100 ml de ácido metanossulfónico acetato de 3-aminobenzoato de metilo (tricaina) da solução, por dissolução de 400 mg tricaine pó em 97,9 ml de água destilada. Adicionar 2,1 ml de Tris 1 M (pH 9) para ajustar o pH a 7,0 e armazenar a solução a -20 ° C.
- Prepare as agulhas de injeção microcapilar puxando capilares de vidro de borosilicato (1mm OD X 0,78 milímetros ID) usando um dispositivo micropipeta extrator com as seguintes configurações: pressão de ar de 650; Aquecer 999; Puxe 50; Velocity 80; Tempo 200.
- Preparar uma solução agar 1,5% na água azul peixe e despeje 25 ml de agar derretido em 100 mm placas de petri. Na parte superior do agar derretido, colocar moldes caseiros, a fim de imprimir canais específicos. "V" -shaped canais são usados para embriões posição, enquanto o "U" em forma de ovos são utilizados para (Figura 1) 31. Uma vez solidificado, retire cuidadosamente a marca.
NOTA: Cubra o agar com água azul de peixes para evitar a desidratação e armazenar a 4 ° C por até 2 meses.
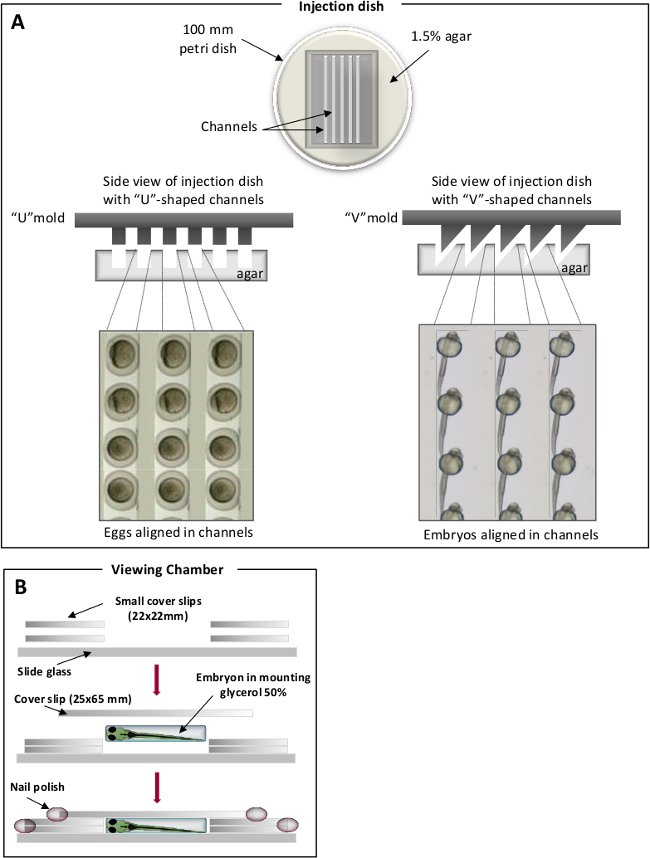
Figura 1. câmaras de posicionamento para injecções de peixe-zebra. (A) canais em forma de U para ovos (painel esquerdo) e canais em forma de V para embriões (painel direito). Ovos de peixe-zebra / embriões são colocados nos canais e alinhadas ao longo do mesmo eixo. Câmaras (B) Visualização para observação microscópica. Por favor clique aqui para ver uma versão maior desta figura.
2. Preparação e armazenamento do M. abscessus inóculo
- M. condições de crescimento abscessus
- Placa out M. abscessus a partir de um estoque de -80 ° C em glicerol agar Middlebrook 7H10 uma contendo 10% de OADC e 0,5% de glicerol (7H10 OADC) e suplementado com o antibiótico apropriado, dependendo do marcador de resistência transportado pelo vector que codifica a proteína fluorescente. Incubar as placasa 30 ° C durante 4-5 dias.
- Pegue uma colônia micobactérias fluorescência positivo e inocular 1 ml de caldo Middlebrook 7H9 suplementado com OADC, 0,2% de glicerol, 0,05% Tween 80 (7H9 OADC / T) com o antibiótico necessário em um tubo de 15 ml de plástico estéril. Incubar a 30 ° C durante 1 semana sem agitação.
NOTA: Tween 80 restringe aglomeração e agregação bacteriana. - Ressuspender o pré-cultura obtida em 2.1.2 em 50 mL de meio Middlebrook 7H9 OADC / T de 150 cm 2 frascos de cultura de tecidos para uma final de 0,1 OD 600 (correspondente a cerca de 5,10 7 bactérias / ml) e incubar ainda mais a 30 ° C durante 4 dias para se obter uma cultura exponencial de crescimento (OD600 = 0,6 a 0,8).
NOTA: Para minimizar a aglomeração, especialmente da variante áspero, incubação não deve exceder 5 dias. Ambas as variantes lisas e ásperas apresentar uma taxa de crescimento semelhante.
- Preparação do M. inóculos abscessus60;
NOTA: Devido a alta propensão de áspero M. abscessus para formar grandes agregados e para produzir cordas, um tratamento específico é necessário para gerar inóculos homogénea e quantitativamente controlada antes microinjections nos embriões. Este tratamento também é aplicado para suavizar as bactérias que produzem agregados, embora em menor grau do que a estirpe rugosa.- Colheita culturas crescendo exponencialmente a partir de 150 cm 2 frascos de cultura de tecido por centrifugação a 4 000 x g durante 15 min à temperatura ambiente num tubo de plástico de 50 ml estéril e ressuspender o sedimento de bactérias em 1 ml de 7H9 OADC / T. Alíquota de 200 ul de suspensões bacterianas em tubos de microcentrífuga de 1,5 ml.
NOTA: Trabalhando com pequenos volumes em seringas de 1 ml é necessário obter suspensões altamente homogêneos. - Homogeneizar as suspensões bacterianas com uma agulha 26 G (15 up-and-down sequências), sonicar três vezes durante 10 segundos (com 10 intervalos entre cada sec sonicação SEquência) usando um sonicador de banho de água. Adicionar 1 ml de 7H9 OADC / T e vortex brevemente. Centrifugar 3 min a 100 x g.
- Recolher cuidadosamente os sobrenadantes contendo micobactérias para evitar as aglomerações e concentrem as suspensões homogêneas em um tubo de 50 ml de plástico estéril.
- Verifique visualmente quanto à presença de eventuais agregados bacterianos remanescentes.
NOTA: Se agregados ainda estão presentes, proceder a uma etapa de centrifugação adicional a 100 xg por 2 min, e recolher o sobrenadante. - Centrifugar a suspensão a 4000 xg durante 5 min, ressuspender o sedimento em 200 ul 7H9 OADC / T e proceder à injecção.
- Avaliar a concentração bacteriana final, por plaqueamento de diluições em série (1 x em PBST) em ágar 7H10 OADC e contagem de unidades formadoras de colónias (CFU) após 4 dias de incubação a 30 ° C. UFC deve ser determinado para cada novo lote.
- Preparar inóculos stocks congelados, armazenando 5 mL alíquotas a -80 & #176; C.
NOTA: A avaliação CFU dos -80 ° C aliquotas congeladas é um pré-requisito para determinar o número exacto de bactérias viáveis como congelamento / descongelamento podem afectar a viabilidade bacteriana do inoculo. Estes inóculos congelados estão prontos para serem utilizados para injecções subsequentes. Uma vez que todas as alíquotas contêm o mesmo número de CFU, que permitem a injecção de bactérias de forma reprodutível a partir de uma experiência para outra.
- Colheita culturas crescendo exponencialmente a partir de 150 cm 2 frascos de cultura de tecido por centrifugação a 4 000 x g durante 15 min à temperatura ambiente num tubo de plástico de 50 ml estéril e ressuspender o sedimento de bactérias em 1 ml de 7H9 OADC / T. Alíquota de 200 ul de suspensões bacterianas em tubos de microcentrífuga de 1,5 ml.
- Inóculo de controlo de qualidade
NOTA: a coloração de Ziehl-Neelsen (específicos para micobactérias) pode ser utilizado para comparar a qualidade das suspensões bacterianas antes e após os procedimentos de homogeneização descritos em 2.2.- Spot e espalhar-se uma gota da suspensão bacteriana homogeneizada sobre uma lâmina de vidro e deixe-o secar completamente, fixar o esfregaço por pelo menos 30 min em uma placa quente a 65-70 ° C e mancha usando um protocolo de coloração de Ziehl-Neelsen .
- Observe a mancha bacteriana com um microscópio usando um 100Objectivo X e comparar com um esfregaço de uma suspensão não-processado bacteriano (Figura 2).
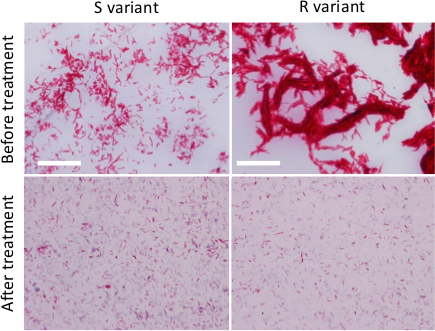
Figura 2. Preparação de disperso M. inóculos abscessus. Ziehl-Neelsen de R ou S variantes cultivadas em meio de caldo, antes de qualquer tratamento (painéis superiores) ou após o tratamento (painéis inferiores) para reduzir o tamanho e o número de agregados de micobactérias (etapas sucessivas de syringing, sonicação e decantação) . As bactérias foram observadas utilizando um microscópio com 100 X de óleo 1.4 NA objetivo APO). Barras de escala:. 20 um favor clique aqui para ver uma versão maior desta figura.
3. Preparar embriões Zebrafish
- Desova e coleta de ovos de peixe-zebra
- Um dia antes de spenhor, raça adulto peixe-zebra, colocando 2 machos e 1 fêmea (geralmente uma proporção de 2: 1 permite uma taxa de fertilização óptima) para uma câmara de criação de animais, que consiste de um tanque de peixe separada com um cesto de recolha 31 de ovo.
NOTA: cestas de coleta de ovos são utilizados para proteger os ovos de ser comido pelos pais e facilitar a colheita de ovos. - Em 1 hpf, ovos e embriões de colheita única devidamente desenvolvidas em um prato de 100 milímetros Petri cheio com 25 ml azul peixes de água (no máximo 100 embriões por placa) e mantê-los em 28,5 ° C. Ovos não-fertilizados são descartados.
- Um dia antes de spenhor, raça adulto peixe-zebra, colocando 2 machos e 1 fêmea (geralmente uma proporção de 2: 1 permite uma taxa de fertilização óptima) para uma câmara de criação de animais, que consiste de um tanque de peixe separada com um cesto de recolha 31 de ovo.
- Preparação de embriões de peixes-zebra para injecções
- Por volta das 24 horas pós-fecundação (hpf), dechorionate os embriões com uma pinça fina em um prato de 100 milímetros Petri e mantê-los a 28,5 ° C.
- Recolher os 30-48 embriões HPF utilizando uma pipeta e transferi-los para um "V" em forma de câmara de posicionamento preenchido com 25 mL de água de peixe contendo 270 mg / L tricaina.Coloque os embriões corretamente nos canais usando uma ferramenta de ponta microloader caseiro (ponta carregador micro caseiro cortada) otimizado para uma micro-manipulação mais fácil.
NOTA: Orientar o lado dorsal para baixo para injeções intravenosas na veia caudal ou o lado dorsal para cima para injeções musculares cauda.
4. Micro-injecção Procedimento
NOTA: O procedimento de micro-injecção para M. abscessus é semelhante à descrita anteriormente para o M. marinum injeções 32. Para avaliar a cronologia do M. abscessus infecção (sobrevivência, cargas bacterianas, e as características da cinética de infecção), são preferidas as injecções na veia da cauda de 30 hpf embriões. Para visualizar o recrutamento de células imunes, as injeções são feitas em sites localizados tais como é nos músculos da cauda em 48 hpf embrião.
- Dilui-se o inoculo por micobactérias em 1 X PBST (dependendo do número de CFU paraser administrada como determinado no passo 2.2.6), contendo 10% de vermelho de fenol para verificar uma injecção adequada.
- Carregar uma agulha de injecção microcapilar com 5-10 ul do inoculo bacteriano utilizando uma ponta de microloader, ligar-se a agulha de microinjecção no suporte do micromanipulador tridimensional ligado ao injector e cortar a parte superior da agulha com uma pinça fina para obter um abertura de diâmetro de 5-10 | im.
- Calibra-se o volume de injecção através do ajuste da pressão microinjecção (20-50 hPa) e tempo (0,2 seg).
NOTA: O volume de injecção necessária é calibrado por determinação visual do diâmetro de uma gota expelido para a gema de um embrião. - Para injecção na veia caudal, posicionar o embrião com o lado ventral de frente para a agulha (como descrito na secção 3.2.2) e colocar a ponta da agulha perto da abertura urogenital, direccionamento da veia caudal, e empurrar suavemente a ponta da agulha para dentro do embrião até que ela só perfura a CAUDregião veia ai. Entregar o volume desejado da preparação bacteriana, geralmente 1-3 nl contendo cerca de 100 CFU / nl.
- Para injecção intramuscular, posicione o embrião com o lado dorsal de frente para a agulha (como no ponto 3.2.2), coloque a agulha sobre uma somite e injetar um volume pequeno (1 nl) de inóculo.
NOTA: Quanto a injeções veia caudal, infecções intramusculares também são um desafio para executar. Cuidados devem ser tomados para evitar uma sobrecarga que pode lesar os tecidos circundantes. - No final do procedimento de injecção, controlar o tamanho do inoculo através da injecção do mesmo volume de suspensão bacteriana numa gota de PBST estéril seguido por plaqueamento em 7H10 OADC e contagem de CFU. Cerca de 100 embriões podem ser injectadas com uma agulha.
NOTA: Devido áspero M. abscessus podem continuar a formar agregados na agulha, injecções necessitam de ser feito imediatamente após a preparação do inoculo. - Transfira os fis infectadosh placas individualmente em 24 poços contendo 2 ml / poço de água de peixe e incuba-se a 28,5 ° C. Os embriões injectados com 1-3 nl PBST 1 X podem ser utilizados como controlos.
- Adequado da infecção de bactérias fluorescentes em embriões é monitorizada utilizando um microscópio de fluorescência.
5. Geração de Macrófagos depletados Embriões
NOTA: a depleção selectiva de macrófagos de tecidos é usado para investigar o seu contributo eo papel durante a infecção. Para visualizar a depleção de macrófagos apropriada, é recomendado o uso de uma linha transgénica com macrófagos fluorescentes, onde mCherry é especificamente expresso sob o controlo do promotor específico de macrófago MPEG1 19.
- Procedimento baseado em Lipo-clodronate
NOTA: O procedimento de lipo-clodronate permite uma depleção seletiva de macrófagos de tecidos (mas não os neutrófilos) 19. Este composto não altera a sobrevivência de embriões nem affect a integridade das bactérias. Um protocolo detalhado para preparar clodronato encapsulada em lipossomas tem sido relatado previamente 33.- Aos 24 hpf, dechorionate os embriões e transferi-los para um "V" em forma de prato de injecção cheia de água de peixe complementado com tricaina para manter os embriões em um estado anestesiado até o final do procedimento de injecção, tal como descrito em 3.2.2. Orientar o lado dorsal para baixo.
- Carregar uma agulha de injecção microcapilar com encapsulada em lipossomas clodronato (lipo-clodronato), ligar-se a agulha de microinjecção no suporte do micromanipulador tridimensional e cortar a parte superior da agulha com uma pinça fina para obter um diâmetro de 10 um de abertura da ponta.
- Para calibrar o volume de injecção, microinjecção ajustar a pressão a 20 hPa e o tempo de injecção para 0,2 seg. Coloque a ponta da agulha perto da abertura urogenital, visando a veia caudal, e empurre a ponta da agulha noembrião até que apenas penetra a região veia caudal e entregar o volume desejado de solução (2-3 nl, 3 vezes).
NOTA: A suspensão de lipo-clodronato é muito pegajoso e devem ser agitadas antes da injecção para evitar o bloqueio do sistema vascular e morte do embrião. É fundamental proceder a várias injecções sucessivas de pequenos volumes. - Transferir os embriões em placas de 100 mm de petri contendo água de peixe e mantê-los em 28.5 ° C até que a infecção.
- Controlar a depleção adequada de macrófagos por microscopia fluorescente.
NOTA: a depleção de macrófagos completa é eficaz durante 4 dias após a administração lipo-clodoronate.
- Procedimento baseia-morfolino
- O dia antes da desova, raça adulto peixe-zebra, colocando 2 machos e 1 fêmea separadas por uma barreira de plástico numa câmara de criação.
- No dia seguinte, ≈ 30 min depois que a luz acende-se na instalação de peixe-zebra, remover a barreira de separaçãomachos e fêmeas. Aguarde cerca de 20 minutos após o início da desova para otimizar a taxa de fertilização. Colher os ovos e retardar seu desenvolvimento, transferindo-os em uma placa de Petri 100 milímetros cheio de água peixe azul frio (4 ° C).
NOTA: O controlo da desova é crucial para as experiências baseadas em morpholinos. Morpholinos só pode ser injetado nos ovos até à fase quatro células. - Recolher os ovos usando uma pipeta e depositar os ovos para baixo no "U" de injecção de câmara em forma de enchido com água fria peixe azul e bloquear os ovos nos canais usando uma ferramenta de ponta microloader caseiro.
- Preparar a solução de PU.1 morfolino que contém 10% de vermelho de fenol, tal como previamente descrito 19. Carregar uma agulha de injecção microcapilar com a preparação morfolino e ligar-se a agulha de microinjecção no suporte do micromanipulador tridimensional, em seguida, romper a ponta da agulha com uma pinça fina para obtina abertura da ponta diâmetro de 5-10 mm.
- Para calibrar o volume de injecção, ajustar a pressão microinjecção 20-50 hPa, e o tempo de injecção para 0,2 seg. Coloque a ponta da agulha perto do ovo e empurre a ponta da agulha através da chorion no ovo e entregar o volume da solução morfolino desejado, tipicamente 3-5 nl.
- Após micro-injecção, transferência dos ovos numa placa de Petri de 100 mm em água de peixe e incuba-se a 28,5 ° C até que o processo de infecção começa.
- Analisar o bom (completo) depleção de macrófagos em morphants PU.1 por microscopia fluorescente em 30 a 48 hpf..
NOTA: Dependendo da concentração injetada, morpholinos p U.1 também pode afetar o número de início de neutrófilos. Para confirmar a adequada depleção de macrófagos, sem alteração do número de neutrófilos, é recomendado o uso de uma linha de peixes-zebra transgénicos com dupla fluorescentes macrófagos e neutrófilos (com GFPespecificamente a expressão conduzida pelo promotor MPX) 19.
6. A quantificação bacteriana Burden
- Determinação por CFU enumeração
- No ponto de tempo desejado, os grupos de recolher embriões infectados (5 por condições) em tubos de microcentrífuga de 1,5 ml (1 embrião / tubo), Cryo-anestesiar os embriões por incubação em gelo durante 10 min e a eutanásia através de uma dose excessiva (entre 300 e tricaina 500 mg / L)
- Lavar os embriões com água esterilizada, duas vezes e, dispensar-se em um novo tubo, lisam cada embrião com 2% de Triton X-100 diluído em PBST, 1 X usando uma agulha 26 G e homogeneizar a suspensão até lise completa. Centrifugar a suspensão e ressuspender o sedimento em 1 X PBST com 0,05% de Tween 80. As diluições em série do homogeneizado são colocadas em meio Middlebrook 7H10 suplementado com OADC e BBL MGIT PANTA, tal como recomendado pelo fornecedor.
NOTA: M. abscessus sendo mais suscetíveis a NaOH treatment de M. marinum, descontaminação de lisados de peixe sem afetar M. abscessus crescimento pode ser conseguido com sucesso utilizando o cocktail de antibióticos BBL MGIT PANTA. - Incubar as placas durante 4 dias a 30 ° C e a contagem de colónias.
- Determinação por Fluorescência Pixel Contagem medições (FPC) em embriões vivos
NOTA: Para determinar as cargas bacterianas através de emissão de fluorescência, as imagens seriadas de embriões infectados são adquiridos e intensidade de fluorescência medido pela CPE (identificação de bactérias por análise de partículas) usando um macro caseiro desenvolvido para o ImageJ gratuito. Uma análise de partículas requer uma imagem binária a preto e branco que se baseia em uma gama limiar que permite discriminar o sinal fluorescente de interesse a partir do fundo.- No ponto de tempo desejado, tricain-anestesiar embriões infectados (5-10 por condição) em placas de petri de 35 mm, como descrito em 3.2.2.
- Retire a água e submerge os embriões e a superfície prato inteiro com 1% de baixo ponto de fusão agarose em água de peixe, em seguida, alinhe lateralmente os embriões. Cubra a agarose solidificada com água contendo peixes tricaina.
- Adquirir imagens de fluorescência de todo o embrião usando um microscópio de epifluorescência, com uma objectiva 10 x.
NOTA: A aquisição de imagem de fluorescência é uma etapa crítica do processo de medições FPC. É importante usar um monitor calibrado com uma sonda de calibração de cores. Ajustando o tempo de exposição óptima para se obter um fundo mínimo durante a aquisição impede a saturação do sinal. As imagens devem estar em formato TIFF de 8 bits. Configurações idênticas são mantidos durante todo o experimento para fins quantitativos. - Remova cuidadosamente a agarose dos embriões com uma ferramenta de ponta microloader caseiro. Estes embriões podem ser utilizados para análises posteriores se necessário. Antes da quantificação da carga bacteriana, cada imagem deve ser de qualidade controlada. Para umnalyze as imagens e converter a intensidade de fluorescência em FPC por peixes, abrir o freeware ImageJ.
NOTA: O valor FPC reflete a carga bacteriana, como mostrado anteriormente usando M. marinum 34. - Determinar o limiar requerido para análise de imagem utilizando uma imagem de um embrião não infectado (vários embriões de controlo pode ser usado para obter um limiar médio). Vá a Image → Ajustar → Limite e, em seguida, mova o controle deslizante inferior na janela do limiar para a direita até que o fundo torna-se completamente preta (ou seja, para obter um fundo deve ser de zero). Grave o valor correspondente.
- Dentro Imagem J, abra a macro FPC (arquivo suplementar) e siga as instruções: localize a pasta de imagens a ser medido e, em seguida, entrar no limiar como previamente determinado e clique em "OK".
NOTA: A macro subtrai automaticamente o fundo. Um limiar é então aplicada. Sinais fluorescentes são identicadas na sequência da análise de partículas. - Copie e cole os dados da janela de resumo para o software desejado para a análise de dados.
NOTA: Em contraste com o método de determinação de CFU, o método FPC é não-invasivo e permite a re-utilizar os embriões para análises posteriores e, sobretudo, monitoramento da dinâmica / cinética da carga bacteriana em uma base individual. É, portanto, permite reduzir significativamente o número de animais, de acordo com regras éticas.
7. Criação de Imagens M. Os embriões infectados abscessus-
- Imagens ao vivo de M. infecção abscessus
- Montagem embriões anestesiados-tricaina (ver 3.2.2) em 1% baixo ponto de fusão agarose em uma placa de Petri 35 milímetros antes de observações de microscopia de epifluorescência. Use um prato fundo de vidro para microscopia confocal invertido ou em um único slide depressão cavidade para microscopia confocal vertical. Orientar o embrião para a posição desejada e a tampaa agarose solidificada com água contendo peixes tricaina.
- Use um microscópio de epifluorescência, com um objectivo de 10 X para aquisição e de transmissão de fluorescência imagens seqüenciais de todo o embrião. Em alternativa, usar um microscópio confocal com 40X ou 63X objectivos para visualizar a actividade de células imunitárias após uma infecção.
- Imagem fixa M. abscessus embriões infectados
- Eutanásia os embriões como descrito em 6.1.1 e transferi-los para tubos de 1,5 ml de micro-centrífuga e fixar os embriões em 4% de paraformaldeído em 1 X PBST durante 2 h à TA ou O / N a 4 ° C. Remover paraformaldeído por lavagem dos embriões duas vezes com 1 X PBST, durante 10 min.
NOTA: Para preservar fluorescência, embriões fixos devem ser protegidos da luz. - Para preservar a integridade dos tecidos e de fluorescência, os embriões foram incubados sucessivamente crescente em soluções de concentração de glicerol (10, 20, 30, 40 e 50% diluído em PBST, 1 X), para10 min por condição.
NOTA: Fixa embriões podem ser armazenados durante vários meses em glicerol a 50% a 4 ° C. - Deite o embrião incorporado em 50% de glicerol em uma câmara de visionamento (Figura 1B) 31.
- Imagem usando 40X ou 63X objetivos em um microscópio confocal.
- Eutanásia os embriões como descrito em 6.1.1 e transferi-los para tubos de 1,5 ml de micro-centrífuga e fixar os embriões em 4% de paraformaldeído em 1 X PBST durante 2 h à TA ou O / N a 4 ° C. Remover paraformaldeído por lavagem dos embriões duas vezes com 1 X PBST, durante 10 min.
Resultados
Apesar de vários sítios anatômicos podem ser injetados 32, injeções veia caudal são muitas vezes utilizados para gerar infecção sistêmica para análises posteriores, incluindo experiências de sobrevivência, determinação carga bacteriana, atividade fagocitose ou a formação do cordão umbilical. As injecções nos músculos da cauda são usados para avaliar o recrutamento de macrófagos no local da injecção (Figura 3A). Para investigar e comparar a virulência de R e S va...
Discussão
O peixe-zebra emergiu recentemente como um excelente sistema modelo para o estudo dos vertebrados dinâmica da infecção bacteriana usando um campo largo e de imagem confocal em tempo real 36. A combinação de suspensões de micobactérias dispersas (protocolo 2.2), juntamente com métodos micro-injecção (protocolo 4) permite infecções sistêmicas, reprodutíveis e posterior acompanhamento e visualização da progressão da infecção com um foco especial sobre as interações bacterianas com macrófago...
Divulgações
The authors have nothing to disclose.
Agradecimentos
Os autores agradecem a K. Kissa para discussões úteis e para a prestação de lipo-clodronate e L. Ramakrishnan pelo dom generoso de pTEC27 e pTEC15 que permitir a expressão de tdTomato e Wasabi, respectivamente. Este trabalho faz parte dos projetos da Agência Nacional de Investigação francesa (ZebraFlam ANR-10 MIDI-009 e DIMYVIR ANR-13-BSV3-007-01) e Sétimo Programa-Quadro da Comunidade Europeia (FP7-PEOPLE-2011-ITN) sob acordo de subvenção não. PITN-GA-2011-289209 para a Marie-Curie de Formação Inicial Rede FishForPharma. Gostaríamos também de agradecer à Associação Gregory Lemarchal e Vaincre La mucoviscidose (RF20130500835) para o financiamento CM Dupont.
Materiais
| Name | Company | Catalog Number | Comments |
| BBL MGIT PANTA | BD Biosciences | 245114 | |
| Bovine Serum Albumin | Euromedex | 04-100-811-E | |
| Catalase from Bovine Liver | Sigma-Aldrich | C40 | |
| Difco Middlebrook 7H10 Agar | BD Biosciences | 262710 | |
| Difco Middlebrook 7H9 Broth | BD Biosciences | 271310 | |
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | A5040 | |
| Oleic Acid | Sigma-Aldrich | O1008 | |
| Paraformaldehyde | Delta Microscopie | 15710 | |
| Phenol Red | Sigma-Aldrich | 319244 | |
| Tween 80 | Sigma-Aldrich | P4780 | |
| Agar | Gibco Life Technologie | 30391-023 | |
| Low melting agarose | Sigma-Aldrich | ||
| Instant Ocean Sea Salts | Aquarium Systems Inc | ||
| Borosilicate glass capillaries | Sutter instrument Inc | BF100-78-10 | 1 mm O.D. X 0.78 mm I.D. |
| Micropipette puller device | Sutter Instrument Inc | Flamming/Brown Micropipette Puller p-87 | |
| Microinjector | Tritech Research | Digital microINJECTOR, MINJ-D | |
| Tweezers | Sciences Tools inc | Dumont # M5S | |
| Microloader Tips | Eppendorf |
Referências
- Brown-Elliott, B. A., Wallace, R. J. Clinical and taxonomic status of pathogenic nonpigmented or late-pigmenting rapidly growing mycobacteria. Clinical Microbiology Reviews. 15 (4), 716-746 (2002).
- Aitken, M. L., Limaye, A., et al. Respiratory outbreak of Mycobacterium abscessus subspecies massiliense in a lung transplant and cystic fibrosis center. American Journal of Respiratory and Critical Care Medicine. 185 (2), 231-232 (2012).
- Gilljam, M., Lindblad, A., Ridell, M., Wold, A. E., Welinder-Olsson, C. Molecular epidemiology of Mycobacterium abscessus, with focus on cystic fibrosis. Journal of Clinical Microbiology. 45 (5), 1497-1504 (2007).
- Roux, A. -. L., Catherinot, E., et al. Multicenter study of prevalence of nontuberculous mycobacteria in patients with cystic fibrosis in France. Journal of Clinical Microbiology. 47 (12), 4124-4128 (2009).
- Lee, M. -. R., Cheng, A., et al. CNS infections caused by Mycobacterium abscessus complex: clinical features and antimicrobial susceptibilities of isolates. The Journal of Antimicrobial Chemotherapy. 67 (1), 222-225 (2012).
- Talati, N. J., Rouphael, N., Kuppalli, K., Franco-Paredes, C. Spectrum of CNS disease caused by rapidly growing mycobacteria. The Lancet Infectious Diseases. 8 (6), 390-398 (2008).
- Medjahed, H., Gaillard, J. -. L., Reyrat, J. -. M. Mycobacterium abscessus: a new player in the mycobacterial field. Trends in Microbiology. 18 (3), 117-123 (2010).
- Griffith, D. E., Girard, W. M., Wallace, R. J. Clinical features of pulmonary disease caused by rapidly growing mycobacteria. An analysis of 154 patients. The American Review of Respiratory Disease. 147 (5), 1271-1278 (1993).
- Nessar, R., Cambau, E., Reyrat, J. M., Murray, A., Gicquel, B. Mycobacterium abscessus: a new antibiotic nightmare. The Journal of Antimicrobial Chemotherapy. 67 (4), 810-818 (2012).
- Sanguinetti, M., Ardito, F., et al. Fatal pulmonary infection due to multidrug-resistant Mycobacterium abscessus a patient with cystic fibrosis. Journal of Clinical Microbiology. 39 (2), 816-819 (2001).
- Griffith, D. E., Aksamit, T., et al. An official ATS/IDSA statement: diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. American Journal of Respiratory and Critical Care Medicine. 175 (4), 367-416 (2007).
- Howard, S. T., Rhoades, E., et al. Spontaneous reversion of Mycobacterium abscessus a smooth to a rough morphotype is associated with reduced expression of glycopeptidolipid and reacquisition of an invasive phenotype. Microbiology (Reading, England). 152 (Pt 6), 1581-1590 (2006).
- Chardi, A., Olivares, F., Byrd, T. F., Julián, E., Brambilla, C., Luquin, M. Demonstration of cord formation by rough Mycobacterium abscessus variants: implications for the clinical microbiology laboratory. Journal of Clinical Microbiology. 49 (6), 2293-2295 (2011).
- Byrd, T. F., Lyons, C. R. Preliminary characterization of a Mycobacterium abscessus mutant in human and murine models of infection. Infection and Immunity. 67 (9), 4700-4707 (1999).
- Catherinot, E., Clarissou, J., et al. Hypervariance of a rough variant of the Mycobacterium abscessus type strain. Infection and Immunity. 75 (2), 1055-1058 (2007).
- Catherinot, E., Roux, A. -. L., et al. Acute respiratory failure involving an R variant of Mycobacterium abscessus. Journal of Clinical Microbiology. 47 (1), 271-274 (2009).
- Bernut, A., Le Moigne, V., Lesne, T., Lutfalla, G., Herrmann, J. -. L., Kremer, L. In vivo assessment of drug efficacy against Mycobacterium abscessus using the embryonic zebrafish test system. Antimicrobial Agents and Chemotherapy. 58 (7), 4054-4063 (2014).
- Oh, C. -. T., Moon, C., Jeong, M. S., Kwon, S. -. H., Jang, J. Drosophila melanogaster for Mycobacterium abscessus infection. Microbes and Infection / Institut Pasteur. 15 (12), 788-795 (2013).
- Bernut, A., Herrmann, J. -. L., et al. Mycobacterium abscessus cording prevents phagocytosis and promotes abscess formation. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), E943-E952 (2014).
- Dubée, V., Bernut, A., et al. β-Lactamase inhibition by avibactam in Mycobacterium abscessus. Journal of Antimicrobial Chemotherapy. 70 (4), 1051-1058 (2015).
- Torraca, V., Masud, S., Spaink, H. P., Meijer, A. H. Macrophage-pathogen interactions in infectious diseases: new therapeutic insights from the zebrafish host model. Disease Models Mechanisms. 7 (7), 785-797 (2014).
- Alibaud, L., Rombouts, Y., et al. A Mycobacterium marinum TesA mutant defective for major cell wall-associated lipids is highly attenuated in Dictyostelium discoideum and zebrafish embryos. Molecular Microbiology. 80 (4), 919-934 (2011).
- Clay, H., Volkman, H. E., Ramakrishnan, L. Tumor necrosis factor signaling mediates resistance to mycobacteria by inhibiting bacterial growth and macrophage death. Immunity. 29 (2), 283-294 (2008).
- Palha, N., Guivel-Benhassine, F., et al. Real-time whole-body visualization of Chikungunya Virus infection and host interferon response in zebrafish. PLoS pathogens. 9 (9), e1003619 (2013).
- Mostowy, S., Boucontet, L., et al. The zebrafish as a new model for the in vivo study of Shigella flexneri with phagocytes and bacterial autophagy. PLoS pathogens. 9 (9), e1003588 (2013).
- Prajsnar, T. K., Cunliffe, V. T., Foster, S. J., Renshaw, S. A. A novel vertebrate model of Staphylococcus aureus reveals phagocyte-dependent resistance of zebrafish to non-host specialized pathogens. Cellular Microbiology. 10 (11), 2312-2325 (2008).
- Van der Sar, A. M., Appelmelk, B. J., Vandenbroucke-Grauls, C. M. J. E., Bitter, W. A star with stripes: zebrafish as an infection model. Trends in Microbiology. 12 (10), 451-457 (2004).
- Vergunst, A. C., Meijer, A. H., Renshaw, S. A., O’Callaghan, D. Burkholderia cenocepacia creates an intramacrophage replication niche in zebrafish embryos, followed by bacterial dissemination and establishment of systemic infection. Infection and Immunity. 78 (4), 1495-1508 (2010).
- Levraud, J. -. P., Disson, O., et al. Real-time observation of Listeria monocytogenes-phagocyte interactions in living zebrafish larvae. Infection and Immunity. 77 (9), 3651-3660 (2009).
- Meijer, A. H., Spaink, H. P. Host-pathogen interactions made transparent with the zebrafish model. Current Drug Targets. 12 (7), 1000-1017 (2011).
- Westerfield, M. . The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Danio Rerio). , (2007).
- Benard, E. L., van der Sar, A. M., Ellett, F., Lieschke, G. J., Spaink, H. P., Meijer, A. H. Infection of zebrafish embryos with intracellular bacterial pathogens. Journal of Visualized Experiments. (61), e3781 (2012).
- Van Rooijen, N., Sanders, A. Liposome mediated depletion of macrophages: mechanism of action, preparation of liposomes and applications. Journal of Immunological Methods. 174 (1-2), 83-93 (1994).
- Adams, K. N., Takaki, K., et al. Drug tolerance in replicating mycobacteria mediated by a macrophage-induced efflux mechanism. Cell. 145 (1), 39-53 (2011).
- Ramakrishnan, L. Looking within the zebrafish to understand the tuberculous granuloma. Advances in Experimental Medicine and Biology. 783, 251-266 (2013).
- Davis, J. M., Clay, H., Lewis, J. L., Ghori, N., Herbomel, P., Ramakrishnan, L. Real-time visualization of Mycobacterium-macrophage interactions leading to initiation of granuloma formation in zebrafish embryos. Immunity. 17 (6), 693-702 (2002).
- Lamason, R. L., Mohideen, M. -. A. P. K., et al. SLC24A5, a putative cation exchanger, affects pigmentation in zebrafish and humans. Science (New York, NY). 310 (5755), 1782-1786 (2005).
- Renshaw, S. A., Loynes, C. A., Trushell, D. M. I., Elworthy, S., Ingham, P. W., Whyte, M. K. B. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Hall, C., Flores, M. V., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC developmental biology. 7, 42 (2007).
- Takaki, K., Davis, J. M., Winglee, K., Ramakrishnan, L. Evaluation of the pathogenesis and treatment of Mycobacterium marinum in zebrafish. Nature Protocols. 8 (6), 1114-1124 (2013).
- Stoop, E. J. M., Schipper, T., et al. Zebrafish embryo screen for mycobacterial genes involved in the initiation of granuloma formation reveals a newly identified ESX-1 component. Disease Models Mechanisms. 4 (4), 526-536 (2011).
- Carvalho, R., de Sonneville, J., et al. A high-throughput screen for tuberculosis progression. PloS One. 6 (2), e16779 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados