È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Decifrare e Imaging Patogenesi e Cording di
In questo articolo
Riepilogo
Optically transparent zebrafish embryos are widely used to study and visualize in real time the interactions between pathogenic microorganisms and the innate immune cells. Micro-injection of Mycobacterium abscessus, combined with fluorescence imaging, is used to scrutinize essential pathogenic features such as cord formation in zebrafish embryos.
Abstract
Zebrafish (Danio rerio) embryos are increasingly used as an infection model to study the function of the vertebrate innate immune system in host-pathogen interactions. The ease of obtaining large numbers of embryos, their accessibility due to external development, their optical transparency as well as the availability of a wide panoply of genetic/immunological tools and transgenic reporter line collections, contribute to the versatility of this model. In this respect, the present manuscript describes the use of zebrafish as an in vivo model system to investigate the chronology of Mycobacterium abscessus infection. This human pathogen can exist either as smooth (S) or rough (R) variants, depending on cell wall composition, and their respective virulence can be imaged and compared in zebrafish embryos and larvae. Micro-injection of either S or R fluorescent variants directly in the blood circulation via the caudal vein, leads to chronic or acute/lethal infections, respectively. This biological system allows high resolution visualization and analysis of the role of mycobacterial cording in promoting abscess formation. In addition, the use of fluorescent bacteria along with transgenic zebrafish lines harbouring fluorescent macrophages produces a unique opportunity for multi-color imaging of the host-pathogen interactions. This article describes detailed protocols for the preparation of homogenous M. abscessus inoculum and for intravenous injection of zebrafish embryos for subsequent fluorescence imaging of the interaction with macrophages. These techniques open the avenue to future investigations involving mutants defective in cord formation and are dedicated to understand how this impacts on M. abscessus pathogenicity in a whole vertebrate.
Introduzione
Mycobacterium abscessus è un patogeno emergente che provoca un ampio spettro di sindromi cliniche nell'uomo. Questi includono le infezioni cutanee e polmonari croniche gravi infezioni, soprattutto incontrate in immunocompromessi e nei pazienti affetti da fibrosi cistica 1,2,3,4. M. abscessus è anche considerato come una delle principali specie di micobatteri rapida crescita responsabili di infezioni nosocomiali e iatrogene negli esseri umani. Inoltre, diversi rapporti recenti hanno evidenziato la possibilità che M. abscessus potrebbe attraversare la barriera emato-encefalica e indurre lesioni importanti del sistema nervoso centrale (CNS) 5,6. Pur essendo un produttore rapida, M. mostre abscessus inoltre diverse funzionalità patogeni che sono legati a quelli di Mycobacterium tuberculosis, tra cui la capacità di rimanere in silenzio per anni all'interno delle strutture granulomatose e di generare lesioni caseosi nei polmoni 7. Più allarmante è il basso sensibilità di M. abscessus agli antibiotici, rendendo queste infezioni estremamente difficili da trattare portando ad un significativo tasso di fallimento terapeutico 8,9. La minaccia importante di questa specie è soprattutto la sua resistenza intrinseca agli antibiotici, che è di grande preoccupazione nelle istituzioni sanitarie pubbliche di 10 e una controindicazione al trapianto polmonare 11.
M. abscessus display lisce (S) o ruvidi morfotipi (R), colonia che portano a differenti esiti clinici. In contrasto con il ceppo S, R batteri hanno una tendenza a crescere un'estremità all'altra, portando ad una fune o cavo struttura simile 12,13. Diversi studi indipendenti sulla base di modelli o cellulari o animali hanno rivelato il fenotipo iper-virulenza del R morfotipo 14,15. Da studi epidemiologici, i casi più gravi di M. infezioni polmonari abscessus sembrano essere associati con R varianti 16 che sono l'unica variante cheè stato visto a persistere per anni in un host infetto 3. La differenza morfotipo si basa sulla presenza (in S) o perdita (in R) di glycopeptidolipids-superficie associato (GPL) 12. Tuttavia, a causa delle limitazioni intrinseche dei modelli cellulari / animali usati attualmente disponibili per studiare M. infezione abscessus, le nostre conoscenze sugli eventi fisiopatologici delle varianti R o S rimane oscuro. L'infezione di topi immuno-competenti via endovenosa o aerosol porta alla colonizzazione transitoria, impedendo l'uso di topi per studiare le infezioni persistenti e in vivo droga suscettibilità test 17. Pertanto, lo sviluppo di modelli animali suscettibili alla manipolazione della risposta dell'ospite è una sfida importante. In questo contesto, i modelli non mammiferi di infezione sono stati sviluppati recentemente, compresi Drosophila melanogaster 18 che offre diversi vantaggi come il costo, velocità e etico accettabilità over il modello di topo. Il pesce zebra (Danio rerio) modello di infezione è stata anche esplorata da visualizzare, per l'imaging non invasivo, la progressione e la cronologia di M. infezione abscessus in un animale vivo 19. È importante sottolineare che una prova di concetto è stato anche istituito per dimostrare la sua idoneità per le valutazioni di antibiotici in vivo contro M. abscessus 17,20.
Il pesce zebra sono stati ampiamente utilizzati nel corso degli ultimi due decenni a studiare le interazioni tra vari agenti patogeni e il sistema immunitario dell'ospite 21. Il crescente successo di questo modello vertebrato alternativa si basa su grandi e uniche opportunità che motivati e convalidati suo utilizzo per una migliore comprensione di numerose infezioni virali e batteriche 19,22,23,24,25,26,27,28,29. A differenza di molti altri modelli animali, embrioni di zebrafish sono otticamente trasparente, consentendo non invasivo imaging di fluorescenza 30. Questo hās portato a studiare M. abscessus infettato embrioni di zebrafish con dettagli senza precedenti, che si conclude con la descrizione di cording extracellulare, che rappresentano un esempio di batterica plasticità morfologica. Cording rappresenta un nuovo meccanismo di eversione del sistema immunitario e un meccanismo chiave promuovere patogenesi acuta M. infezione abscessus 19.
Questo rapporto descrive nuovi strumenti e metodi che utilizzano l'embrione zebrafish di decifrare i tratti fisiopatologiche di M. abscessus infezione e per studiare le interazioni intime tra i bacilli e il sistema immunitario innato. Innanzitutto, un protocollo microiniezione dettagliata che comprende l'elaborazione dell'inoculo batterico, preparazione embrione, e l'infezione di per sé, è presentato. Metodi specificamente adattato per valutare M. virulenza abscessus misurando diversi parametri, come la sopravvivenza di accoglienza e la carica batterica, sono presentati. Particolare attenzione è data da comemonitorare, a livello spazio-temporale, il destino e la progressione dell'infezione e la risposta immunitaria a M. abscessus usando la microscopia video. Inoltre, per indagare il contributo e il ruolo dei macrofagi durante M. abscessus infezione, i metodi per generare macrofagi-impoverito embrioni (utilizzando approcci sia genetically- o basati su chimicamente) sono descritte. Infine, i protocolli di visualizzare le specifiche interazioni con macrofagi o neutrofili utilizzando sia gli embrioni fissi o viventi sono documentati.
Lo scopo di questo rapporto è quello di stimolare ulteriori studi per gettare nuova luce in M. meccanismi di virulenza abscessus e in particolare il ruolo del cording nella creazione di un processo di infezione acuta e incontrollata.
Protocollo
Le procedure sperimentali zebrafish devono rispettare le relative norme istituzionali e governativi. Per il presente studio, esperimenti zebrafish sono stati fatti presso l'Università di Montpellier, secondo le linee guida dell'Unione europea per la movimentazione di animali da laboratorio (http://ec.europa.eu/environment/chemicals/lab_animals/home_en.htm) e approvati con il riferimento CEEA-LR-13007.
1. Preparazione dei reagenti e Microiniezione attrezzature
- Preparare pesce acqua sciogliendo 0,06 g di sale Immediata Oceano Mare in 1 l di acqua distillata 31, poi in autoclave per la sterilizzazione (120 ° C per 20 min) e conservare a 28,5 ° C per un massimo di 1 mese.
- Preparare metilene soluzione blu sciogliendo 1 g di blu di metilene in 1 l di acqua distillata. Aggiungere 300 ml di soluzione di blu di metilene in 1 l di acqua i pesci per ottenere acqua pesce azzurro, poi autoclave per sterilizzare e conservare a 28,5 ° C per un massimo di 1 mese.
NOTA: Il additiil blu di metilene in acqua pesce previene la formazione di muffe. - Preparazione del tampone fosfato (PBS)
- Preparare una soluzione madre di 10 X PBS sciogliendo 5,696 g di Na 2 HPO 4, 680 mg di KH 2 PO 4, 969 mg di KCl e 78,894 g NaCl in 1 l di acqua distillata e regolare il pH a 7,0 con HCl. Per ottenere 1 X PBS, diluire 100 ml di soluzione di 10 X PBS in 900 ml di acqua distillata e autoclave per 20 min a 120 ° C per sterilizzare.
- Aggiungere 0,05% di Tween 80 per ottenere 1 X PBST e conservare a temperatura ambiente per un massimo di 1 anno.
- Preparare oleico Acido destrosio catalasi (OADC) arricchimento sciogliendo 8,5 g di NaCl, 50 g di albumina sierica bovina, 20 g di D-glucosio, 40 mg di catalasi da fegato bovino e 0,5 g di acido oleico in 1 l di acqua distillata poi filtrare sterilizzare la soluzione conservarlo a 4 ° C per 6 mesi.
- Preparare 100 ml di acido metansolfonico etil-3 amminobenzoato (tricaine) soluzione madre, sciogliendo 400 mg tricaine polvere in 97,9 ml di acqua distillata. Aggiungere 2,1 ml di 1 M Tris (pH 9) per regolare il pH a 7,0 e conservare la soluzione a -20 ° C.
- Preparare gli aghi di iniezione microcapillare tirando capillari di vetro borosilicato (1 millimetro OD X 0,78 millimetri ID) utilizzando un dispositivo micropipetta estrattore con le seguenti impostazioni: pressione dell'aria 650; Riscaldare 999; Pull 50; Velocity 80; Tempo 200.
- Preparare una soluzione di agar 1,5% in acqua il pesce azzurro e versare 25 ml di agar fuso in 100 mm piatti Petri. Sulla parte superiore della agar fuso, posizionare stampi artigianali per imprimere canali specifici. "V" canali sagomate sono utilizzati per embrioni posizione mentre la "U" sono utilizzati per le uova (Figura 1) 31. Una volta solidificato, rimuovere con attenzione l'impronta.
NOTA: Coprire l'agar con acqua pesce azzurro per evitare la disidratazione e conservare a 4 ° C per un massimo di 2 mesi.
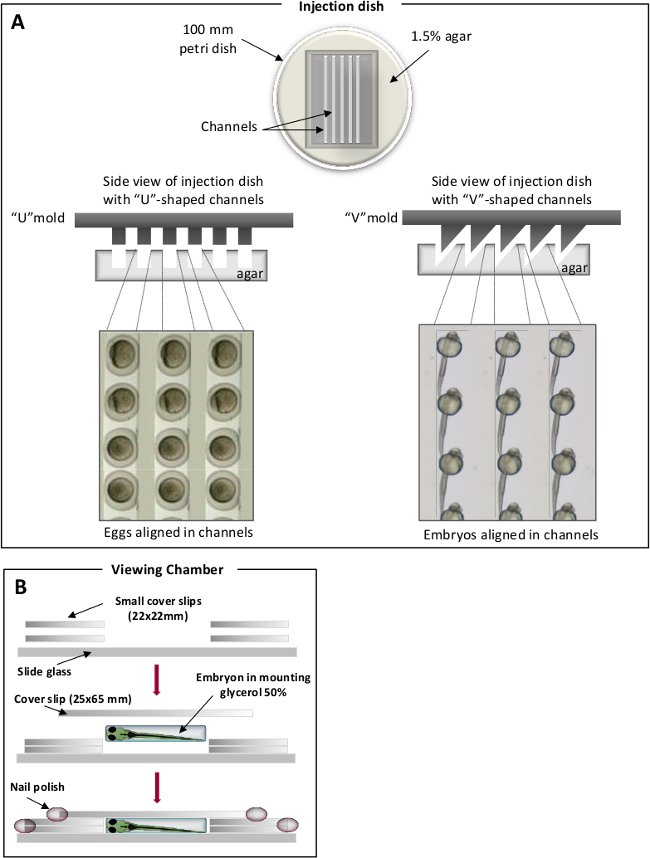
Figura 1. camere di posizionamento per le iniezioni di zebrafish. (A) i canali a forma di U per le uova (pannello di sinistra) e canali a forma di V per gli embrioni (pannello di destra). Uova zebrafish / embrioni sono contenute nei canali e allineati lungo lo stesso asse. (B) Visualizzazione di camere per l'osservazione al microscopio. Cliccate qui per vedere una versione più grande di questa figura.
2. Preparazione e conservazione del M. abscessus inoculo
- M. condizioni di crescita abscessus
- Piatto fuori M. abscessus da un -80 ° C stock di glicerolo su un agar Middlebrook 7H10 contenente il 10% di OADC e 0,5% glicerolo (7H10 OADC) e integrato con l'antibiotico appropriata a seconda del marcatore di resistenza effettuati dal vettore che codifica per la proteina fluorescente. Incubare le piastrea 30 ° C per 4-5 giorni.
- Prendete una colonia micobatteri fluorescenza positiva e inoculare 1 ml di brodo Middlebrook 7H9 integrato con OADC, 0,2% glicerolo, 0,05% di Tween 80 (7H9 OADC / T) con l'antibiotico richiesto in un 15 ml di tubo di plastica sterile. Incubare a 30 ° C per 1 settimana senza agitare.
NOTA: Tween 80 limita aggregazione e di aggregazione batterica. - Risospendere il pre-coltura ottenuta in 2.1.2 in 50 ml Middlebrook 7H9 OADC / T in 150 cm 2 palloni di coltura tissutale a una finale 0,1 OD 600 (corrispondenti a circa 5,10 7 batteri / ml) ed incubare ulteriormente a 30 ° C per 4 giorni per ottenere una cultura esponenziale crescita (OD 600 = 0,6 a 0,8).
NOTA: Per ridurre al minimo aggregazione, in particolare della variante di massima, di incubazione non deve superare i 5 giorni. Entrambe le varianti lisce e ruvide mostrano un tasso di crescita simile.
- Preparazione del M. inoculi abscessus60;
NOTA: A causa della forte propensione del grezzo M. abscessus per formare grandi aggregati e per produrre corde, un trattamento specifico è necessario generare inoculi omogenea e controllata quantitativamente prima microiniezioni negli embrioni. Questo trattamento viene applicato anche per lisciare i batteri che producono aggregati, sebbene in misura minore rispetto al ceppo grezzo.- Raccolto esponenziale crescita culture da 150 cm 2 fiasche di coltura dei tessuti per centrifugazione a 4, 000 xg per 15 minuti a temperatura ambiente in un tubo di plastica da 50 ml sterile e risospendere il pellet batterico in 1 ml 7H9 OADC / T. Aliquota 200 ml di sospensioni batteriche in provette da 1,5 ml microcentrifuga.
NOTA: lavorare con piccoli volumi di 1 ml siringhe è necessaria per ottenere sospensioni altamente omogenei. - Omogeneizzare le sospensioni batteriche con un ago 26-G (15 up-and-down sequenze), Sonicare tre volte per 10 secondi (con 10 sec pause tra ogni sonicazione sesequenza) utilizzando un sonicatore bagnomaria. Aggiungere 1 ml di 7H9 OADC / T e vortex brevemente. Centrifugare 3 min a 100 x g.
- Raccogliere accuratamente il surnatante-micobatteri che contiene per evitare i grumi e piscina le sospensioni omogenee in 50 ml di tubo di plastica sterile.
- Controllare visivamente per la presenza di eventuali aggregati batterici rimanenti.
NOTA: Se gli aggregati sono ancora presenti, procedere ad una ulteriore fase di centrifugazione a 100 xg per 2 minuti e raccogliere il surnatante. - Centrifugare la sospensione a 4.000 xg per 5 minuti, risospendere il pellet in 200 ml 7H9 OADC / T e procedere per l'iniezione.
- Valutare la concentrazione batterica finale placcatura diluizioni seriali (in 1 x PBST) su 7H10 OADC agar e contando unità formanti colonie (CFU) dopo 4 giorni di incubazione a 30 ° C. CFU deve essere determinata per ogni nuovo lotto.
- Preparare le scorte inoculi congelati memorizzando 5 aliquote microlitri a -80 & #176; C.
NOTA: La valutazione CFU dei -80 ° C aliquote congelate è un pre-requisito per determinare il numero esatto di batteri vitali come congelamento / scongelamento può influire vitalità batterica dell'inoculo. Questi inoculi congelati sono pronti per essere utilizzati per iniezioni successive. Poiché tutti aliquote contengono lo stesso numero di CFU, permettono di iniettare batteri in modo riproducibile da un esperimento all'altro.
- Raccolto esponenziale crescita culture da 150 cm 2 fiasche di coltura dei tessuti per centrifugazione a 4, 000 xg per 15 minuti a temperatura ambiente in un tubo di plastica da 50 ml sterile e risospendere il pellet batterico in 1 ml 7H9 OADC / T. Aliquota 200 ml di sospensioni batteriche in provette da 1,5 ml microcentrifuga.
- Controllo qualità inoculo
NOTA: Ziehl-Neelsen (specifico per micobatteri) può essere utilizzata per confrontare la qualità delle sospensioni batteriche prima e dopo le procedure descritte in 2.2 omogeneizzazione.- Spot e diffondere uno goccia di sospensione batterica omogeneizzato su un vetrino e lasciarlo asciugare completamente, fissare lo striscio per almeno 30 minuti su una piastra calda impostato a 65-70 ° C e macchia con un protocollo di colorazione Ziehl-Neelsen .
- Osservare lo striscio batterico con un microscopio con un 100Obiettivo X e confrontarlo con uno striscio di una sospensione non trasformati batterica (Figura 2).
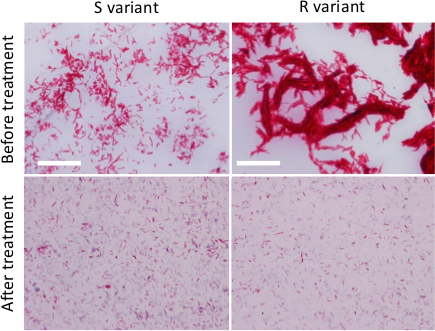
Figura 2. Preparazione del disperso M. inoculi abscessus. Ziehl-Neelsen di R o S varianti cresciuto su brodo di coltura prima di qualsiasi trattamento (pannelli superiori) o dopo il trattamento (pannelli inferiori) per ridurre le dimensioni e il numero di aggregati micobatterici (fasi successive di syringing, sonicazione e decantazione) . I batteri sono stati osservati utilizzando un microscopio con 100 X APO olio 1.4 obiettivo NA). Bar Scala:. 20 micron Cliccate qui per vedere una versione più grande di questa figura.
3. Preparazione embrioni di zebrafish
- La deposizione delle uova e la raccolta delle uova zebrafish
- Il giorno prima spegno, razza adulto zebrafish posizionando 2 maschi e 1 femmina (di solito un rapporto 2: 1 permette fertilizzazione ottimale) in una camera di allevamento, costituito da un serbatoio di pesce separata con una raccolta delle uova cesto 31.
NOTA: cestini di raccolta delle uova sono usati per proteggere le uova di essere mangiato dai genitori e facilitare la raccolta delle uova. - Al 1 HPF, uova raccolto ed embrioni solo adeguatamente sviluppate in un piatto da 100 millimetri di Petri riempita con 25 ml di acqua blu pesce (massimo 100 embrioni per piatto) e tenerli a 28,5 ° C. Uova non fecondate vengono scartati.
- Il giorno prima spegno, razza adulto zebrafish posizionando 2 maschi e 1 femmina (di solito un rapporto 2: 1 permette fertilizzazione ottimale) in una camera di allevamento, costituito da un serbatoio di pesce separata con una raccolta delle uova cesto 31.
- Preparazione di embrioni di zebrafish per le iniezioni
- A circa 24 ore dopo la fecondazione (HPF), dechorionate gli embrioni con una pinzetta sottile in una capsula di 100 millimetri di Petri e tenerli a 28,5 ° C.
- Raccogliere le distanziate di 30-48 embrioni HPF con una pipetta e trasferirli su una "V" camera di posizionamento a forma riempita con 25 ml di acqua pesce contenente 270 mg / l tricaine.Posare gli embrioni correttamente nei canali utilizzando uno strumento di punta microloader fatto in casa (in casa tagliata micro punta caricatore) ottimizzato per una più facile micro-manipolazione.
NOTA: Orientare il lato dorsale verso il basso per iniezioni endovenose in vena caudale o il lato dorsale verso l'alto per le iniezioni muscolari coda.
4. Micro-iniezione Procedura
NOTA: La procedura micro-iniezione per M. abscessus è simile a quello descritto in precedenza per M. marinum iniezioni 32. Per valutare la cronologia di M. infezione abscessus (sopravvivenza, cariche batteriche, cinetica e caratteristiche di infezione), iniezioni in vena caudale del 30 HPF embrioni sono preferiti. Per visualizzare il reclutamento di cellule immunitarie, le iniezioni sono fatte in siti localizzati, come è nei muscoli di coda a 48 HPF embrione.
- Diluire l'inoculo micobatterica in 1 X PBST (a seconda del numero di CFUessere somministrato come determinato al punto 2.2.6), contenente il 10% rosso fenolo per controllare l'iniezione corretto.
- Caricare un ago per iniezione microcapillari con 5-10 ml dell'inoculo batterico con una punta microloader, collegare l'ago microiniezione nel supporto del micromanipolatore tridimensionale collegata all'iniettore e rompere la parte superiore dell'ago con pinzette sottili per ottenere un diametro di apertura di 5-10 micron.
- Calibrare il volume di iniezione regolando la pressione microiniezione (20-50 hPa) e l'ora (0,2 sec).
NOTA: Il volume di iniezione desiderato viene calibrato mediante determinazione visiva del diametro di una gocciolina espulsa nel tuorlo di un embrione. - Per l'iniezione vena caudale, posizionare l'embrione con il lato ventrale rivolto verso l'ago (come descritto nella sezione 3.2.2) e posizionare la punta dell'ago vicino all'apertura urogenitale, puntando la vena caudale, e spingere delicatamente la punta dell'ago nel embrione fino a che trafigge il proprio caudregione della vena al. Consegnare il volume desiderato di preparazione batterica, di solito 1-3 nl contenente circa 100 UFC / nl.
- Per l'iniezione intramuscolare, posizionare l'embrione con il lato dorsale di fronte al ago (come nella sezione 3.2.2), posizionare l'ago oltre un somite e iniettare un piccolo volume (1 nl) di inoculo.
NOTA: Come per le iniezioni vena caudale, infezioni intramuscolari sono anche difficili da eseguire. Si deve prestare attenzione al fine di evitare un sovraccarico che può danneggiare i tessuti circostanti. - Al termine della procedura di iniezione, controllare la dimensione dell'inoculo iniettando volume di sospensione batterica in una goccia di PBST sterile seguita da placcatura sul 7H10 OADC e contando il CFU. Circa 100 gli embrioni possono essere iniettati con un ago.
NOTA: Perché ruvido M. abscessus può continuare a formare aggregati nell'ago, iniezioni devono essere fatte immediatamente dopo la preparazione dell'inoculo. - Trasferire i fis infetteh piastre singolarmente in 24 pozzetti contenenti 2 ml / acqua di pozzo pesce e incubare a 28.5 ° C. Embrioni iniettati con 1-3 nl 1 X PBST possono essere utilizzati come controlli.
- La corretta infezione di batteri fluorescenti embrioni è controllata mediante un microscopio a fluorescenza.
5. Generazione di macrofagi impoverito Embrioni
NOTA: la deplezione selettiva dei macrofagi dai tessuti è utilizzato per studiare il loro contributo e il ruolo durante l'infezione. Per visualizzare la corretta deplezione dei macrofagi, si raccomanda di utilizzare una linea transgenica con macrofagi fluorescenti, dove mCherry è specificamente espresso sotto il controllo del promotore specifico macrofago mpeg1 19.
- Procedura basata-lipo-clodronato
NOTA: La procedura di lipo-clodronato permette una deplezione selettiva dei macrofagi da tessuti (ma non neutrofili) 19. Questo composto non altera né la sopravvivenza degli embrioni né affetto l'integrità dei batteri. Un protocollo dettagliato per preparare clodronato incapsulata all'interno dei liposomi è stata riportata in precedenza 33.- A 24 HPF, dechorionate gli embrioni e trasferirli ad una "V" piatto a forma di iniezione riempita con acqua pesci integrato con tricaine per mantenere gli embrioni in uno stato anestetizzato fino al termine della procedura di iniezione, come descritto in 3.2.2. Orientare il lato dorsale verso il basso.
- Caricare un ago per iniezione microcapillare con incapsulata all'interno dei liposomi clodronato (lipo-clodronato), collegare l'ago microiniezione nel supporto del micromanipolatore tridimensionale e rompere la parte superiore dell'ago con una pinzetta fini di ottenere un diametro di 10 micron tipo apertura.
- Per calibrare il volume di iniezione, regolare la pressione a 20 hPa microiniezione e il tempo di iniezione a 0,2 sec. Posizionare la punta dell'ago vicino all'apertura urogenitale, puntando la vena caudale, e spingere delicatamente la punta dell'ago nelembrione fino appena fora regione vena caudale e fornire il volume desiderato di soluzione di (2-3 nl, 3 volte).
NOTA: La sospensione lipo-clodronato è molto appiccicoso e dovrebbe essere in agitazione prima di iniezione per evitare di bloccare il sistema vascolare e l'uccisione dell'embrione. È fondamentale procedere con diverse iniezioni successive di piccoli volumi. - Trasferire gli embrioni in 100 piatti mm Petri contenenti acqua i pesci e li conservano a 28,5 ° C fino a quando l'infezione.
- Controllare il corretto svuotamento dei macrofagi mediante microscopia a fluorescenza.
NOTA: Completa macrofagi esaurimento è efficace per 4 giorni dopo la somministrazione lipo-clodoronate.
- Procedura basata-morfolino
- Il giorno prima deposizione delle uova, razza adulto zebrafish posizionando 2 maschi e 1 femmina separati da una barriera di plastica in una camera di allevamento.
- Il giorno dopo, ≈ 30 minuti dopo che la luce si accende nella struttura zebrafish, rimuovere la barriera che separamaschi e femmine. Attendere circa 20 minuti dopo l'inizio della deposizione delle uova per ottimizzare il tasso di fecondazione. Raccogliere le uova e rallentare il loro sviluppo da parte loro trasferimento in una capsula di Petri 100 millimetri riempita con acqua fredda pesce azzurro (4 ° C).
NOTA: Il controllo della deposizione delle uova è di fondamentale importanza per gli esperimenti basati morpholinos. Morpholinos può essere iniettato solo nelle uova fino alla fase quattro celle. - Raccogliere le uova con una pipetta e depositare le uova nel "U" a forma di iniezione-camera riempita con acqua fredda pesce azzurro e bloccare le uova nei canali utilizzando uno strumento di punta microloader fatto in casa.
- Preparare la soluzione PU.1 morfolino contenente il 10% di rosso fenolo, come descritto in precedenza 19. Caricare un ago per iniezione microcapillare con la preparazione morfolino e collegare l'ago microiniezione nel supporto del micromanipolatore tridimensionale, quindi rompere la punta dell'ago con le pinzette multa per ottena diametro di apertura punta di 5-10 micron.
- Per calibrare il volume di iniezione, regolare la pressione microiniezione di 20-50 hPa e il tempo di iniezione di 0,2 sec. Posizionare la punta dell'ago vicino all'uovo e spingere delicatamente la punta dell'ago attraverso il corion nell'uovo e fornire il volume della soluzione morfolino desiderato, generalmente 3-5 nl.
- Dopo micro-iniezione, trasferire le uova in una capsula di Petri di 100 mm in acqua i pesci e incubare a 28,5 ° C fino alla procedura di infezione ha inizio.
- Analizzare il corretto (completo) esaurimento dei macrofagi in morphants PU.1 al microscopio a fluorescenza, al 30 a 48 HPF..
NOTA: a seconda della concentrazione iniettato, morpholinos pag U.1 possono influire sul numero di primi neutrofili. Per confermare il corretto svuotamento dei macrofagi senza alterare il numero di neutrofili, si consiglia di utilizzare una doppia linea zebrafish transgenico con macrofagi e neutrofili fluorescenti (con GFPespressione specificamente guidata dal promotore mpx) 19.
6. batterica Burden Quantificazione
- Determinazione da CFU enumerazione
- Al punto di tempo desiderato, di raccogliere gruppi di embrioni infetti (5 per le condizioni) in provette da 1,5 ml microcentrifuga (1 embrione / tubo), crio-anestetizzare gli embrioni di incubazione in ghiaccio per 10 minuti e eutanasia con una dose eccessiva di tricaine (300- 500 mg / L)
- Lavare gli embrioni con acqua sterile e dispensare due volte in una nuova provetta, lisare ogni embrione con 2% Triton X-100 diluito in PBST 1 X usando un ago 26-G e omogeneizzare la sospensione fino a completa lisi. Centrifugare la sospensione e risospendere il pellet in 1 X PBST con 0,05% di Tween 80. diluizioni seriali dei omogenati sono placcati su Middlebrook 7H10 OADC e integrati con PANTA BBL MGIT, come raccomandato dal fornitore.
NOTA: M. abscessus essere più suscettibili di NaOH treatment di M. marinum, decontaminazione di lisati di pesce senza influenzare M. crescita abscessus può essere raggiunto con successo utilizzando l'antibiotico cocktail PANTA BBL MGIT. - Incubare le piastre per 4 giorni a 30 ° C e conteggio delle colonie.
- Determinazione da fluorescenza Conteggio pixel (FPC) misurazioni in embrioni vivi
NOTA: Per determinare le cariche batteriche tramite emissione di fluorescenza, immagini seriali di embrioni infetti vengono acquisiti e intensità di fluorescenza misurata da FPC (identificazione di batteri di analisi delle particelle) utilizzando una macro in casa sviluppata per il freeware ImageJ. Un'analisi particella richiede un'immagine in bianco e nero binario che si basa su una serie di soglia che permette di discriminare il segnale fluorescente di interesse dallo sfondo.- Al punto di tempo desiderato, tricain-anestetizzare gli embrioni infetti (5-10 per condizione) in 35 mm capsule di Petri come descritto in 3.2.2.
- Rimuovere l'acqua e submerge gli embrioni e tutta la superficie piatto con 1% a basso punto di fusione agarosio in acqua i pesci, quindi allineare lateralmente gli embrioni. Coprire il agarosio solidificato con acqua i pesci contenente tricaine.
- Acquisire immagini di fluorescenza dell'intero embrione utilizzando un microscopio a epifluorescenza dotato di un obiettivo 10 X.
NOTA: L'acquisizione delle immagini di fluorescenza è una fase critica del procedimento misurazioni FPC. È importante utilizzare un monitor calibrato con una sonda di calibrazione del colore. Regolazione del tempo ottimale di esposizione per ottenere uno sfondo minima durante l'acquisizione impedisce la saturazione del segnale. Le immagini devono essere in formato TIFF a 8 bit. Impostazioni identici vengono mantenute durante l'intero esperimento per scopi quantitative. - Rimuovere accuratamente l'agarosio dagli embrioni con uno strumento di punta microloader fatto in casa. Questi embrioni possono essere utilizzati per analisi successive, se necessario. Prima della quantificazione della carica batterica, ogni immagine è qualità controllata. Per unnalyze le immagini e convertire l'intensità di fluorescenza in FPC per pesce, aprire il freeware ImageJ.
NOTA: Il valore FPC riflette la carica batterica, come illustrato in precedenza utilizzando M. marinum 34. - Determinare la soglia richiesta per l'analisi delle immagini utilizzando l'immagine di un embrione non infetto (diversi embrioni di controllo possono essere utilizzati per ottenere un livello soglia medio). Vai Immagine → → Regolare soglia e quindi spostare il cursore inferiore nella finestra di soglia verso destra fino lo sfondo diventa completamente nero (cioè, per ottenere un fondo deve essere a zero). Registrare il valore corrispondente.
- All'interno Immagine J, aprire la macro FPC (file supplementare) e seguire le istruzioni: individuare la cartella di immagini da misurare e quindi inserire la soglia precedentemente determinata e cliccare su "OK".
NOTA: La macro sottrae automaticamente lo sfondo. Una soglia viene quindi applicato. Segnali fluorescenti sono identicato a seguito dell'analisi delle particelle. - Copiare e incollare i dati dalla finestra di riepilogo per il software desiderato per l'analisi dei dati.
NOTA: A differenza del metodo di determinazione CFU, il metodo di FPC non è invasivo e consente di riutilizzare il embrioni per successive analisi e, soprattutto, il monitoraggio delle dinamiche / cinetica della carica batterica su base individuale. E, quindi, permette di ridurre sensibilmente il numero di animali, in accordo con le norme etiche.
7. Imaging M. Gli embrioni infetti abscessus-
- Immagini dal vivo di M. infezione abscessus
- Mount embrioni tricaine-anestetizzato (vedi 3.2.2) a 1% a basso punto di fusione agarosio in una capsula di Petri 35 millimetri prima di osservazioni al microscopio a fluorescenza. Utilizzare un piatto fondo di vetro per microscopia confocale invertita o in una singola diapositiva depressione cavità per microscopia confocale in posizione verticale. Orientate l'embrione nella posizione desiderata e coperchiol'agarosio solidificato con acqua i pesci contenente tricaine.
- Utilizzare un microscopio a epifluorescenza con un obiettivo 10 X per acquisizione fluorescenza e trasmissione immagini sequenziali dell'intero embrione. In alternativa, utilizzare un microscopio confocale con 40X o 63X obiettivi di visualizzare l'attività delle cellule del sistema immunitario dopo un'infezione.
- Imaging fisso M. abscessus infettato embrioni
- Eutanasia gli embrioni come descritto in 6.1.1 e trasferirli provette da 1,5 ml di micro-centrifuga e fissare gli embrioni in paraformaldeide al 4% in 1 X PBST per 2 ore a temperatura ambiente o O / N a 4 ° C. Rimuovere paraformaldeide lavando gli embrioni due volte con PBST 1 X per 10 minuti.
NOTA: Per conservare la fluorescenza, gli embrioni fisse devono essere protette dalla luce. - Per preservare l'integrità dei tessuti e la fluorescenza, embrioni vengono incubati successivamente ascendente soluzioni di concentrazione glicerolo (10, 20, 30, 40 e 50% diluito in PBST) X 1, per10 min per condizione.
NOTA: fissa gli embrioni possono essere conservati per diversi mesi nel 50% glicerolo a 4 ° C. - Disporre l'embrione incorporato in 50% glicerolo in una camera di osservazione (Figura 1B) 31.
- Immagine utilizzando 40X o 63X obiettivi su un microscopio confocale.
- Eutanasia gli embrioni come descritto in 6.1.1 e trasferirli provette da 1,5 ml di micro-centrifuga e fissare gli embrioni in paraformaldeide al 4% in 1 X PBST per 2 ore a temperatura ambiente o O / N a 4 ° C. Rimuovere paraformaldeide lavando gli embrioni due volte con PBST 1 X per 10 minuti.
Risultati
Anche se vari siti anatomici possono essere iniettati 32, iniezioni vena caudale sono spesso utilizzati per generare infezioni sistemiche per le successive analisi, tra cui esperimenti di sopravvivenza, la determinazione della carica batterica, attività fagocitosi o formazione cavo. Iniezioni nei muscoli posteriori sono utilizzati per valutare il reclutamento di macrofagi al sito di iniezione (Figura 3A). Per studiare e confrontare la virulenza di varianti R e S di M. abscessus,...
Discussione
Il pesce zebra è recentemente emerso come un ottimo sistema modello vertebrato per lo studio delle dinamiche di infezione batterica con ampio campo e l'imaging confocale in tempo reale 36. La combinazione di sospensioni disperse micobatterici (protocollo 2.2) insieme con i metodi di micro-iniezione (protocollo 4) permette di infezioni sistemiche, riproducibili e successivo monitoraggio e visualizzazione della progressione dell'infezione con un focus particolare sulle interazioni batteriche con macrof...
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
Gli autori sono grati a K. Kissa per le discussioni utili e per fornire lipo-clodronato e L. Ramakrishnan per il dono generoso di pTEC27 e pTEC15 che permettono espressione di tdTomato e Wasabi, rispettivamente. Questa opera fa parte dei progetti dell'Agenzia nazionale di ricerca francese (ZebraFlam ANR-10-MIDI-009 e DIMYVIR ANR-13-BSV3-007-01) e il Settimo Programma Quadro della Comunità Europea (FP7-PEOPLE-2011-ITN) sotto contratto di concessione n. PITN-GA-2011-289209 per il Marie Curie Initial Training Network FishForPharma. Desideriamo inoltre ringraziare l'Associazione Gregory Lemarchal e Sconfiggere la mucoviscidosi (RF20130500835) per il finanziamento di CM Dupont.
Materiali
| Name | Company | Catalog Number | Comments |
| BBL MGIT PANTA | BD Biosciences | 245114 | |
| Bovine Serum Albumin | Euromedex | 04-100-811-E | |
| Catalase from Bovine Liver | Sigma-Aldrich | C40 | |
| Difco Middlebrook 7H10 Agar | BD Biosciences | 262710 | |
| Difco Middlebrook 7H9 Broth | BD Biosciences | 271310 | |
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | A5040 | |
| Oleic Acid | Sigma-Aldrich | O1008 | |
| Paraformaldehyde | Delta Microscopie | 15710 | |
| Phenol Red | Sigma-Aldrich | 319244 | |
| Tween 80 | Sigma-Aldrich | P4780 | |
| Agar | Gibco Life Technologie | 30391-023 | |
| Low melting agarose | Sigma-Aldrich | ||
| Instant Ocean Sea Salts | Aquarium Systems Inc | ||
| Borosilicate glass capillaries | Sutter instrument Inc | BF100-78-10 | 1 mm O.D. X 0.78 mm I.D. |
| Micropipette puller device | Sutter Instrument Inc | Flamming/Brown Micropipette Puller p-87 | |
| Microinjector | Tritech Research | Digital microINJECTOR, MINJ-D | |
| Tweezers | Sciences Tools inc | Dumont # M5S | |
| Microloader Tips | Eppendorf |
Riferimenti
- Brown-Elliott, B. A., Wallace, R. J. Clinical and taxonomic status of pathogenic nonpigmented or late-pigmenting rapidly growing mycobacteria. Clinical Microbiology Reviews. 15 (4), 716-746 (2002).
- Aitken, M. L., Limaye, A., et al. Respiratory outbreak of Mycobacterium abscessus subspecies massiliense in a lung transplant and cystic fibrosis center. American Journal of Respiratory and Critical Care Medicine. 185 (2), 231-232 (2012).
- Gilljam, M., Lindblad, A., Ridell, M., Wold, A. E., Welinder-Olsson, C. Molecular epidemiology of Mycobacterium abscessus, with focus on cystic fibrosis. Journal of Clinical Microbiology. 45 (5), 1497-1504 (2007).
- Roux, A. -. L., Catherinot, E., et al. Multicenter study of prevalence of nontuberculous mycobacteria in patients with cystic fibrosis in France. Journal of Clinical Microbiology. 47 (12), 4124-4128 (2009).
- Lee, M. -. R., Cheng, A., et al. CNS infections caused by Mycobacterium abscessus complex: clinical features and antimicrobial susceptibilities of isolates. The Journal of Antimicrobial Chemotherapy. 67 (1), 222-225 (2012).
- Talati, N. J., Rouphael, N., Kuppalli, K., Franco-Paredes, C. Spectrum of CNS disease caused by rapidly growing mycobacteria. The Lancet Infectious Diseases. 8 (6), 390-398 (2008).
- Medjahed, H., Gaillard, J. -. L., Reyrat, J. -. M. Mycobacterium abscessus: a new player in the mycobacterial field. Trends in Microbiology. 18 (3), 117-123 (2010).
- Griffith, D. E., Girard, W. M., Wallace, R. J. Clinical features of pulmonary disease caused by rapidly growing mycobacteria. An analysis of 154 patients. The American Review of Respiratory Disease. 147 (5), 1271-1278 (1993).
- Nessar, R., Cambau, E., Reyrat, J. M., Murray, A., Gicquel, B. Mycobacterium abscessus: a new antibiotic nightmare. The Journal of Antimicrobial Chemotherapy. 67 (4), 810-818 (2012).
- Sanguinetti, M., Ardito, F., et al. Fatal pulmonary infection due to multidrug-resistant Mycobacterium abscessus a patient with cystic fibrosis. Journal of Clinical Microbiology. 39 (2), 816-819 (2001).
- Griffith, D. E., Aksamit, T., et al. An official ATS/IDSA statement: diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. American Journal of Respiratory and Critical Care Medicine. 175 (4), 367-416 (2007).
- Howard, S. T., Rhoades, E., et al. Spontaneous reversion of Mycobacterium abscessus a smooth to a rough morphotype is associated with reduced expression of glycopeptidolipid and reacquisition of an invasive phenotype. Microbiology (Reading, England). 152 (Pt 6), 1581-1590 (2006).
- Chardi, A., Olivares, F., Byrd, T. F., Julián, E., Brambilla, C., Luquin, M. Demonstration of cord formation by rough Mycobacterium abscessus variants: implications for the clinical microbiology laboratory. Journal of Clinical Microbiology. 49 (6), 2293-2295 (2011).
- Byrd, T. F., Lyons, C. R. Preliminary characterization of a Mycobacterium abscessus mutant in human and murine models of infection. Infection and Immunity. 67 (9), 4700-4707 (1999).
- Catherinot, E., Clarissou, J., et al. Hypervariance of a rough variant of the Mycobacterium abscessus type strain. Infection and Immunity. 75 (2), 1055-1058 (2007).
- Catherinot, E., Roux, A. -. L., et al. Acute respiratory failure involving an R variant of Mycobacterium abscessus. Journal of Clinical Microbiology. 47 (1), 271-274 (2009).
- Bernut, A., Le Moigne, V., Lesne, T., Lutfalla, G., Herrmann, J. -. L., Kremer, L. In vivo assessment of drug efficacy against Mycobacterium abscessus using the embryonic zebrafish test system. Antimicrobial Agents and Chemotherapy. 58 (7), 4054-4063 (2014).
- Oh, C. -. T., Moon, C., Jeong, M. S., Kwon, S. -. H., Jang, J. Drosophila melanogaster for Mycobacterium abscessus infection. Microbes and Infection / Institut Pasteur. 15 (12), 788-795 (2013).
- Bernut, A., Herrmann, J. -. L., et al. Mycobacterium abscessus cording prevents phagocytosis and promotes abscess formation. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), E943-E952 (2014).
- Dubée, V., Bernut, A., et al. β-Lactamase inhibition by avibactam in Mycobacterium abscessus. Journal of Antimicrobial Chemotherapy. 70 (4), 1051-1058 (2015).
- Torraca, V., Masud, S., Spaink, H. P., Meijer, A. H. Macrophage-pathogen interactions in infectious diseases: new therapeutic insights from the zebrafish host model. Disease Models Mechanisms. 7 (7), 785-797 (2014).
- Alibaud, L., Rombouts, Y., et al. A Mycobacterium marinum TesA mutant defective for major cell wall-associated lipids is highly attenuated in Dictyostelium discoideum and zebrafish embryos. Molecular Microbiology. 80 (4), 919-934 (2011).
- Clay, H., Volkman, H. E., Ramakrishnan, L. Tumor necrosis factor signaling mediates resistance to mycobacteria by inhibiting bacterial growth and macrophage death. Immunity. 29 (2), 283-294 (2008).
- Palha, N., Guivel-Benhassine, F., et al. Real-time whole-body visualization of Chikungunya Virus infection and host interferon response in zebrafish. PLoS pathogens. 9 (9), e1003619 (2013).
- Mostowy, S., Boucontet, L., et al. The zebrafish as a new model for the in vivo study of Shigella flexneri with phagocytes and bacterial autophagy. PLoS pathogens. 9 (9), e1003588 (2013).
- Prajsnar, T. K., Cunliffe, V. T., Foster, S. J., Renshaw, S. A. A novel vertebrate model of Staphylococcus aureus reveals phagocyte-dependent resistance of zebrafish to non-host specialized pathogens. Cellular Microbiology. 10 (11), 2312-2325 (2008).
- Van der Sar, A. M., Appelmelk, B. J., Vandenbroucke-Grauls, C. M. J. E., Bitter, W. A star with stripes: zebrafish as an infection model. Trends in Microbiology. 12 (10), 451-457 (2004).
- Vergunst, A. C., Meijer, A. H., Renshaw, S. A., O’Callaghan, D. Burkholderia cenocepacia creates an intramacrophage replication niche in zebrafish embryos, followed by bacterial dissemination and establishment of systemic infection. Infection and Immunity. 78 (4), 1495-1508 (2010).
- Levraud, J. -. P., Disson, O., et al. Real-time observation of Listeria monocytogenes-phagocyte interactions in living zebrafish larvae. Infection and Immunity. 77 (9), 3651-3660 (2009).
- Meijer, A. H., Spaink, H. P. Host-pathogen interactions made transparent with the zebrafish model. Current Drug Targets. 12 (7), 1000-1017 (2011).
- Westerfield, M. . The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Danio Rerio). , (2007).
- Benard, E. L., van der Sar, A. M., Ellett, F., Lieschke, G. J., Spaink, H. P., Meijer, A. H. Infection of zebrafish embryos with intracellular bacterial pathogens. Journal of Visualized Experiments. (61), e3781 (2012).
- Van Rooijen, N., Sanders, A. Liposome mediated depletion of macrophages: mechanism of action, preparation of liposomes and applications. Journal of Immunological Methods. 174 (1-2), 83-93 (1994).
- Adams, K. N., Takaki, K., et al. Drug tolerance in replicating mycobacteria mediated by a macrophage-induced efflux mechanism. Cell. 145 (1), 39-53 (2011).
- Ramakrishnan, L. Looking within the zebrafish to understand the tuberculous granuloma. Advances in Experimental Medicine and Biology. 783, 251-266 (2013).
- Davis, J. M., Clay, H., Lewis, J. L., Ghori, N., Herbomel, P., Ramakrishnan, L. Real-time visualization of Mycobacterium-macrophage interactions leading to initiation of granuloma formation in zebrafish embryos. Immunity. 17 (6), 693-702 (2002).
- Lamason, R. L., Mohideen, M. -. A. P. K., et al. SLC24A5, a putative cation exchanger, affects pigmentation in zebrafish and humans. Science (New York, NY). 310 (5755), 1782-1786 (2005).
- Renshaw, S. A., Loynes, C. A., Trushell, D. M. I., Elworthy, S., Ingham, P. W., Whyte, M. K. B. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Hall, C., Flores, M. V., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC developmental biology. 7, 42 (2007).
- Takaki, K., Davis, J. M., Winglee, K., Ramakrishnan, L. Evaluation of the pathogenesis and treatment of Mycobacterium marinum in zebrafish. Nature Protocols. 8 (6), 1114-1124 (2013).
- Stoop, E. J. M., Schipper, T., et al. Zebrafish embryo screen for mycobacterial genes involved in the initiation of granuloma formation reveals a newly identified ESX-1 component. Disease Models Mechanisms. 4 (4), 526-536 (2011).
- Carvalho, R., de Sonneville, J., et al. A high-throughput screen for tuberculosis progression. PloS One. 6 (2), e16779 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon