Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Sapphire ve OPO Lazer Bazlı Standart Lazer Tarama Mikroskobu: Bir Ti bir Tutarlı Anti-Stokes Raman saçılması (CARS) Sisteminin Uygulanması
Bu Makalede
Özet
molekül bağlarının doğasında titreşim dayalı Tutarlı bir anti-Stokes Raman saçılması (CARS) mikroskopi etiket ücretsiz kimyasal seçici canlı hücre görüntüleme izin verir. safir lazer ve bir OPO lazer: Bu çalışma femtosaniye Ti dayalı standart bir multiphoton lazer tarama mikroskobu tamamlayıcı mikroskopi tekniği uygulanmasını sunar.
Özet
Bir femtosaniye Ti birleştirerek lazer tarama mikroskobu: Lazer çizgisini çoğaltmak için safir lazer ve optik parametrik osilatör (OPO) biyologlar için kullanılabilir hale gelmiştir. Bu sistemler, öncelikle çok kanallı iki foton floresan mikroskobu için tasarlanmıştır. Ancak, herhangi bir değişiklik olmadan, bu tür ikinci harmonik nesil (SHG) veya üçüncü harmonik nesil (THG) gibi tamamlayıcı doğrusal olmayan optik mikroskop da yapılandırılmış moleküller veya sulu Gelir Orta etiketi içermeyen görüntüleme sağlayan bu set-up ile yapılabilir lipit arayüzleri. Bu teknikler, in vivo gözlem için uygundur, ancak kimyasal özgüllük sınırlıdır. Kimyasal seçici görüntüleme Raman saçılması dayalı doğal titreşim sinyalleri elde edilebilir. Konfokal Raman mikroskobu 3D uzaysal çözünürlüğü sağlar, ancak yüksek ortalama güç ve uzun edinimi süresi gerektirir. Bu zorlukları aşmak için, lazer teknolojisindeki son gelişmeler devel izin vardoğrusal olmayan optik titreşim mikroskopi opment, özellikle tutarlı bir anti-Stokes Raman içinde (CARS) saçılma. ARABALAR mikroskopi Bu nedenle kimyasal eşleştirme (OH streç titreşimler yoluyla) (CH streç titreşim yoluyla) lipidler, su, proteinler veya DNA, biyolojik ve canlı hücre görüntüleme için güçlü bir araç olarak ortaya çıkmıştır. Bu çalışmada, standart bir OPO-birleştiğinde multiphoton lazer tarama mikroskobu CARS tekniğin uygulanmasını açıklar. Bu lazer ışını yolu birinin uzunluğunun ayarlanması ile iki lazer hatları arasında zamanlı senkronizasyon dayanır. Biz varolan multiphoton sistemi üzerinde bu tekniğin bir adım-adım uygulama mevcut. Deneysel optik bir temel arka plan yararlı ve sunulan sistem pahalı ek donanım gerektirmez. Ayrıca kemirgen siyatik sinirinin miyelin kılıflarının elde görüntüleme CARS göstermektedir, ve bu görüntü, standart t gibi doğrusal olmayan optik görüntüleme ile eş zamanlı olarak gerçekleştirilebilir göstermektedirwo-foton floresan tekniği ve ikinci harmonik nesil.
Giriş
Optik mikroskop bir hücre içi çözünürlük ile biyolojik sistemlerin canlı dinamik süreçlerin tahribatsız görselleştirme için önemli bir teknik haline gelmiştir. Floresan mikroskobu nedeniyle yüksek özgüllük ve duyarlılık 1 şu anda canlı hücrelerde kullanılan en popüler görüntüleme kontrast. flüoresan büyük bir palet (eksojen boyalar, genetik olarak kodlanmış proteinleri, yarıiletken nanopartiküller) ortaya çıkmıştır. Çeşitli örnek aydınlatma floresan tabanlı teknikler 3D görüntüleme gerçekleştirmek için ve 2 photobleaching bu tekniğin ana dezavantajı azaltmak için (örneğin konfokal veya iki foton mikroskopi gibi) gelişmiştir. Moleküler türlerin çoğu özünde floresan değildir ve bu nedenle bu fluorophores yapay görüntülü numunede tanıtılacak zorunda çünkü başka sınırlamalar fluorofor etiketleme şartını içermektedir. Bu yapay manipülasyon küçük moleküller özellikle yıkıcı olabilir ya da pot uyarır olabilirential foto-toksisite. Bu sebepler in vivo gözlemler için floresan mikroskopi değil uygundur olun. Bu nedenle, flüoresan moleküller kullanılmadan yüksek hassasiyet ve özel moleküler kontrastlı optik görüntüleme tekniklerinin kullanımı biyomedikal son derece arzu edilir.
Etiketleme veya lekelenme olmadan birkaç doğrusal olmayan optik görüntüleme teknikleri ikinci harmonik nesil (SHG) 3,4 ve üçüncü harmonik nesil (THG) 5 de dahil olmak üzere, ortaya çıkmıştır. SHG mikroskobu gibi mikrotübüllerin veya kollajen 6 olarak supramoleküler düzeyde görüntü yapısal düzenlemelerle için kullanılır olmuştur. THG gibi bir sulu ortam ve lipid 7 arasındaki ara optik çoktürellik oluşturulur. THG aynı zamanda görüntü miyelin 8,9 gösterildi. Her iki teknik, bir iki-fotonlu floresan mikroskop üzerinde uygulanan ve tek bir lazer ışını gerektiren edilebilir. yüksek güç lazer yoğunluğu gerektiren Ancak (tipik olarak 50yaşam örneklerinde zararlı olduğunu ve net bir şekilde görüntü özgü biyolojik yapıları için gerekli olan kimyasal özgüllük vermeyin THG 9 için 1180 nm), 50 mW - SHG 10, 25 860 nm'de mW.
Kimyasal olarak, seçici görüntüleme Raman saçılımı göre temel molekül titreşim sinyallerinden elde edilebilir. bir ışık demeti meselesi çarptığında, fotonlar emilir ve atomlar veya moleküller tarafından dağınık olabilir. Dağınık fotonların çoğu gelen fotonların aynı enerjiyi, yani frekansı olacaktır. Bu süreç Rayleigh saçılması denir. Bununla birlikte, bir foton az sayıda Raman saçılımı adlandırılan bir inelastik partikül saçma işlemi ile örneğin, gelen fotonların, bir frekansından farklı bir optik frekansta saçılan edilecektir. enerji farkı moleküler yapı ve çevreye bağlı olarak titreşim modlarının uyarma kaynaklanır. Bu nedenle, ani Raman saçılımı ataides kimyasal seçici görüntüleme gibi farklı moleküller belirli titreşim frekansları vardır. Ancak nedeniyle, son derece zayıf bir sinyalin sınırlıdır. Konfokal Raman mikroskobu geliştirdi ve 3D uzaysal çözünürlüğü sağlar, ancak yüksek ortalama güç ve uzun edinimi süresi 11 gerektirir olmuştur. Bu zorlukları aşmak için, lazer teknolojisindeki son gelişmeler, özellikle tutarlı bir anti-Stokes Raman saçılması nonlineer optik titreşim mikroskopi yükselişi, (CARS) 11,12,13 sağladı.
ARABALAR üçüncü mertebeden doğrusal olmayan optik bir süreçtir. Frekans ω P bir pompa ışınının oluşan üç lazer ışınları, frekans ω S bir Stokes ışın ve bir prob ışın (genellikle pompa olmak üzere) bir numunede odaklı ve (frekans ω AS = bir anti-Stokes ışını oluşturmak 2ω P - ω G) 14. Anti-Stokes sinyali önemli ölçüde geliştirilmiş olabilir zaman frekans farkı(- ω S ω P) pompa ve Stokes Raman moleküler titreşim Ω R = için ayarlanmıştır kirişler arasındaki. ARABALAR sinyal birden foton etkileşimi dayanmaktadır. Bu nedenle spontan Raman saçılması daha güçlü büyüklükte bir tutarlı sinyal emir üretir.
ARAÇLAR mikroskopi ilk deneysel Duncan ve ark., 15 ile gösterilmiştir. Zumbusch ve diğ., Yüksek sayısal açıklık bir objektif lens iki odaklı yakın kızılötesi femtosaniye lazer ışınları kullanılarak ARAÇLAR faz eşleme koşulunu sağlayan ve iki foton olmayan rezonans arka plan 16 kaçınarak, daha sonra teknik geliştirilmiştir. ARABALAR mikroskopi Bu nedenle kimyasal canlı hücrelerde 19,20 yılında (CH streç titreşim yoluyla) gibi lipidler gibi molekülleri 17,18, su (OH streç titreşimler yoluyla), proteinler, DNA tespit ederek, canlı hücre ve dokular görüntüleme için güçlü bir araç olarak ortaya çıkmıştır aynı zamanda kimyasal bileşiğin dötereilaç 21 ve kozmetik uygulamalar 22 s.
doğrusal olmayan mikroskopi önemli bir sınırlama karmaşıklığı ve optik kaynakların maliyeti kaynaklanır. Bir OTOMOBİLLER sistemin kısa darbe süreleri ile ve zamansal ve mekansal senkronize darbe trenler ile iki dalga boyu ayarlanabilir lazer gerektirir. Erken OTOMOBİLLER mikroskoplar iki senkronize pikosaniye Ti dayanmaktadır: safir lazerler 20. Bir supercontinuum ışık kaynağı 23 üreten safir lazer: CARS görüntüleme ayrıca tek bir femtosaniye Ti elde edilmiştir. Son zamanlarda, tek femto saniye Ti oluşan lazer kaynakları: ayarlanabilir bir optik parametrik osilatör (OPO) pompalama safir lazeri arabalar mikroskopi için kullanılmıştır. Bu set-up özünde geçici pompa ve tam moleküler titreşim spektrum 24 kapsayan Stokes kiriş arasındaki bir frekans farkı ile kirişler senkronize sağlar. Buna ek olarak, lazer tarama mikroskobu Ayrıntılı bir yol tarifi göreöncelikle iki foton floresan (TPF) için kullanılan anahtar fs lazer ve OPO olmayan fizikçiler için şimdi mevcuttur. Her doğrusal olmayan (NLO) görüntüleme yöntemi özel yapılar veya moleküller duyarlı olduğu gibi set-up potansiyeli büyük ölçüde diğer doğrusal olmayan optik görüntüleme katılmasıyla ek yatırımı gerektirmeden gelişmiş olabilir. Multimodal NLO görüntüleme nedenle karmaşık biyolojik örneklerinde 25 NLO mikroskopi potansiyelini büyük harfe çevirir. Bu tekniklerin birleştirme lipid metabolizması, deri ya da kanser gelişimi 26, iskelet kas gelişimi 27 aterosklerotik lezyonlar 28, özellikle de bir çok biyolojik soru incelemeye olanak sağlamaktadır. Ayrıca, ARABALAR ile lazer ışını tarama uygulaması yüksek oranlı görüntüleme, yani in vivo dinamik süreçleri incelemek için cazip bir aracın yeteneği kazandırır.
Bu çalışmanın amacı, t uygulamak için her adımı göstermektirStandart multiphoton lazer tarama mikroskobu o CARS tekniği. Mikroskop FSEC Ti dayanmaktadır: safir lazer ve bir OPO: biyologlar için bir yazılım tarafından işletilen (Ti tarafından pompalanan lazer safir). entegrasyon zaman iki ışın senkronize etmek için lazer ışını yolu birinin uzunluğunun ayarlanmasıyla gerçekleştirilmiştir. Biz deneysel optik sadece temel bir arka plan gerektiren bu tekniğin adım adım uygulanması açıklanmaktadır. Biz de CARS kemirgenler siyatik sinirin miyelin kılıflarının elde görüntüleme göstermek ve bu görüntüleme gibi standart iki-foton floresan tekniği ve ikinci harmonik nesil olarak, diğer doğrusal olmayan optik görüntüleme ile eş zamanlı olarak yapılabilir göstermektedir.
Access restricted. Please log in or start a trial to view this content.
Protokol
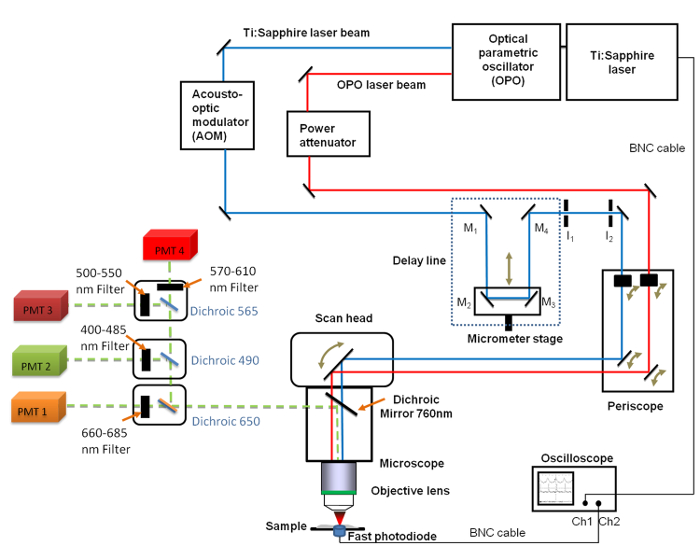
Şekil 1. Genel set-up şematik görünümü Bu Ti içerir. Safir (680 - 1080 nm) ve OPO (1050 - 1300 nm) lazerler, (M 4 M 1) 4 aynalarla gecikme hattı, hızlı osiloskop, fotodiyot ve iki sabit iris diyaframlar Ben 1 ve 2. Aynalar M 2 ve M 3 mikrometre çözünürlük ile gecikme hattı uzunluğunu değiştirmek sağlayan bir doğrusal çeviri aşamasında sabitlenir. A 660 -. 685 nm bant geçiren filtre OTOMOBİLLER görüntüleme için kullanılan photomultiplier tüp (PMT) önüne yerleştirilmiş olan bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
Lazer Sisteminin 1. Başlangıç
- safir dalga boyu 800 nm ayarlanır veya tanımlamak: Ti doğrulayınTi bu dalga boyu: Güç kaynağı denetleyicisi safir. Ti açmak için Açık Bekleme anahtarı çevirin: lazer safir.
- OPO kontrolör arkasındaki OPO Lazer açın ve Ti açın: Ti safir çekim: Güç kaynağı denetleyicisi safir.
- OPO pompalamak için tablet bilgisayar açın. tabletteki OPO Bağlı ve Uzaktan Bağlı simgeleri tıklayın. Isınma için 40 dakika - 30 bekleyin.
- mikroskop bilgisayarda açın ve "Mikroskop Bileşenleri" anahtarları açın. çift tıklayarak masaüstündeki simgeyi yazılımını başlatın.
- Yazılım Edinme sekmesine, yazılım hem lazerleri çalışmasına Kur Yöneticisi Lazer aracını açın. Ti Seçenekler şunlardır: On Açık safir lazer ve OPO lazer. Optik lazer güç değerini (800 nm'de 3.700 mW tipik değerleri ve 700 mW 1,000 nm) kontrol edin.
- ışın yolu ve lazerler yapılandırmak için,Kurulum Yöneticisi aracını grubunda Işık Yolu aracını açın ve ilk Photomultiplier tüp (PMT) kutusunu işaretleyin.
- Ti kontrol etmek için: hedefi çıkışındaki safir lazer nokta, Toplama Parametre aracı grubundaki Kanallar aracını açın. Ti seçin: düşük değeri (yaklaşık% 1) safir gücü, 0 kazanç (no image bu aşamada tabi) azaltmak ve mikroskop objektif ile lazer ışını başlatmak için tarama işlemini başlatmak için sürekli butonuna tıklayın. Hava mikroskop objektif (10X) çıkışındaki IR lazer izleme kartı yerleştirerek doğrudan gözlem yoluyla bir kırmızı nokta varlığını kontrol edin.
- OPO lazer nokta kontrol Ti taramayı durdurmak için: Stop düğmesine tıklayarak safir lazer. Kanallar penceresindeki düşük değerde OPO gücünü seçin ve C tıklayınontinuous düğmesine basın.
2. Mikroskop Ayarları
- El ile olmayan descanned algılama (NDD) modunda Proje Yönetim Ekipleri içine numuneden 760 nm ışık başlatmak için objektif burunluk yukarıdaki sonsuzluk uzayda SidePort kaydırıcısında 760 nm'de bir kesim dalga boyu ile dikroik ayna yerleştirin.
- Sadece ARABALAR Bu çalışmada sunulan sonuçları çoğaltmak 670 nm sinyal kaydetmek için PMT1 önünde NDD reflektör küp 685 nm - 660 dar bant geçiş filtresi ayarlayın.
- 500 miyelin floresan gözlem için PMT3 önünde NDD reflektör küp 550 nm arasında değişen dar bir bant filtresi yerleştirin. 565 SHG gözlem PMT4 önünde reflektör küp 610 nm arasında değişen dar bir bant filtresi yerleştirin.
- Yazılım ad hoc bant geçiren filtre ile dedektör üzerinde sinyal kaydı seçin Kurulum Yöneticisi menüsünde Işık Yolu aracını açmak için Edinme sekmesinde. İstenilen PMT (onay kutusu) etkinleştirmek ve bu kanal için bir renk seçin. Bu çalışmada, yeşil SHG için floresan ve eflatun kırmızı ARAÇLAR için seçildi.
3. Geçici Senkronizasyon
Not: iki lazer ışınları aynı Ti kaynaklanan: safir lazer ama OPO ışını onlar mikroskop ulaştığında iki kiriş zamanlı olarak senkronize edilmez böylece oluşturulduğunda gecikir. Burada amaç onlar mikroskop ulaşmadan zaman bunları yeniden senkronize etmek için iki kiriş birini geciktirmek için olduğunu.
- BNC kablolar ile elektrik BNC lazer çıkışı (Sync. Out) osiloskoptan giriş kanalını CH1 bağlayın. Giriş kanalı fotodiyot osiloskoptan CH2 bağlayın ve TETİK MENÜ, daha sonra ana menü butonu Kaynak ve ardından C seçilen kanala karşılık gelen yan menü düğmesine basarak tetik kanalı olarak CH1 kanalı seçmekH1.
- Pozisyon ve objektif çıkardıktan sonra optik montaj mesajlar ile bir hava mikroskop objektif (10X) ya da mikroskop ışın yolunda odak düzleminde fotodiyot düzeltin. Not: Gerekirse, kondenser ve taşıyıcı kaldırın.
- Kanallar aracı (Toplama Parametre aracı grubu), Ti tanımlayın: düşük güçte 830 nm'de safir lazer dalga boyu (yani, tam güç% 1'den az). Toplama Modu aracında ufak ışın ile fotodiyot aydınlatmak amacıyla bir noktada tarama alanını azaltır. Sürekli düğmeye tıklayarak lazer tarama açın.
- Basın osiloskop Ön paneldeki AUTOSET ve elle ekranda nabız trenler almak için fotodiyot konumunu değiştirmek. Basın RUN / STOP düğmesine ekranı dondurmak için.
- osiloskop görüntünün bir kopyasını kaydetmek için, bir 3.5 eklemekdisket sürücüsüne disketi inç veya bir bilgisayara arka paneldeki GPIB portuna bağlayın. Sonra çıkış kanalını TIFF görüntü formatını seçin ve Liman menüde belirtmek için SHIFT HARDCOPY MENU tuşuna basın FORMAT (ana) tuşuna basın. Basın HARDCOPY düğmeye Ti darbe trenler osiloskop görüntüsünü kaydetmek için: lazer safir.
- Durdur düğmesine tıklayarak safir lazer tarama: Ti kapatın. Kanallar aracını tıklatarak 1107 nm ve düşük güçte OPO sinyali tanımlar. OPO lazer tarama açın ve osiloskop OPO lazer darbe trenler kaydedin. OPO lazer tarama kapatın.
- safir ve OPO sinyallerini: Temporal Ti arasındaki kayma karşılaştırın.
NOT: Temporal vardiya t vardiya denklemi aşağıdaki uygulanacak vardır gecikme hattı L DelayLine uzunluğunu verir: L delayLine = c5; c, ışığın hızı, burada T geçiş. - Lazer hatlarından birini seçin.
NOT: Bu çalışmada, Ti: boş alan bu lazer çizgisi yakınlarındaki çünkü safir lazer çizgisi seçildi. Buna ek olarak, bu seçenek, görünür bir lazer ışığı ile lazer hattının yeniden hizalama elde sağlar. - Gecikme hattı uygulanacak pozisyonda koruyucu tüpler kaldırarak lazer çizgisi açın.
! Dikkat uygun koruyucu gözlük kullanın ve zincir bilezik kaldırabilir veya bileklerini izlemek. - Sırayla görünür aralığında bir dalga boyuna seçin kolayca (yazılım Kanallar aracında düşük güçte, örneğin 700 nm) lazer ışını gözlemlemek mümkün. Lazer tarama açın.
- Yerleştirin ve iki iris diyaframlar açık lazer hattı boyunca optik montaj mesajlar ayarlayın. Pozisyon bir gecikme hattının çıkışında iris ve periskop girişinde diğer iris yerleştirin.
NOT: peLazer tarama mikroskobu tarama kafasına yazılım tarafından lazer ışınının giriş açısı pilot iki motorlu aynalarla riscope kontrol eder. - iris diyaframı diyafram azaltmak ve lazer ışını yolunu uyacak şekilde diyafram pozisyonları ayarlayın. Optik masaya onları düzeltmek. arda gecikme hattının dört ayna konumlandırma sırasında lazer ışınının yüksekliğini kontrol etmek için, üçüncü bir mobil iris diyafram dikey konumunu ayarlar.
NOT: Bu iris diyaframlar izlenecek yolun göstererek yeniden hizalama işlemi için kontrol olarak görev yapacak. - M1 kompakt kinematik ayna monte edilmiş bir ayna (Şekil 1 'de gösterildiği gibi), gecikme hattının girişinde monte ve konumunu ve mobil iris diyaframı kullanımı ile kiriş yüksekliğini korumak için yönünü ayarlamak için koyun. Yeri M2 ve M3 midco konumlandırılmış edilecek çeviri sahneye 90 ° (aynı zamanda kompakt kinematik ayna bağlar üzerine monte) aynalarURSE. Daha önce hesaplandığı gibi gecikme hattı uzunluğuna uyacak şekilde onları konumlandırmak.
- Mobil iris diyafram kullanımı ile M2 ve M3 yönünü ayarlamak. Iki sabit iris diyaframlar aracılığıyla lazer ışını yolunu uyacak şekilde konumunu ve açısını ayarlamak dikkatlice (Şekil 1'de gösterildiği gibi sadece iris I 1 öncesi) ve M4 Set gecikme hattının çıkışında (aynı zamanda kompakt bir montaj sabit).
- Mikroskop objektif çıkışında lazer görüntüleme kartı yerleştirin ve lazer tarama açmak için sürekli tıklayarak lazer ışını profilini kontrol edin. düzgün bir parlak diski gözlemleyin. Gerekirse, hafif M4 yönünü ayarlamak.
- Yine pozisyon mikroskop numune odak düzleminde lazer ışını altında hızlı fotodiyot. safir lazer ışını ve osiloskop üzerinde OPO ışınını: Ti arasındaki zamansal değişime uyun.
Not: tüm sistemi M2 hareket ettirerek gecikme hattı uzunluğunu değiştirmek Gerekirse, M3 üzerine monte(Çeviri sahne ayarlama değiştirmeden) çeviri aşaması hem darbeleri senkronize etmek. birkaç santimetrelik değişiklikler gerekli olabilir.
Kiriş 4. Mekansal Bindirme
Not: arabalar sinyalinin üretilmesi için, iki lazer ışınları mekansal örtüşen gereklidir. iki farklı floresan boyalar ile birlikte boyunca lekeli aynı boncuklar üzerinde her iki kiriş alternatif aydınlatma mekansal Shift belirtmek için kullanılabilir. ayna konumları Güzel ayarlamalar sonra vardiya en aza indirebilirsiniz.
- Kullanım floresan mikroküreler önceden monte edilmiş. aşağıda tarif edildiği gibi ya da temiz mikroskop slaytlar üzerinde süspansiyon içinde mikroküreler monte:
- örnekleme önce, (a korteks mikser veya sonicating) tarafından boncuk çözeltinin karışımı boncuk eşit askıya emin olmak için.
- Bir slayt yüzeyine boncuk süspansiyonu 5 ul uygulayın ve pipet ile yayıldı. montaj 5 ul kurulayın ve ardından uygulamak için damlacık bekleyinBu tür boncukların kuru numune üzerine gliserol, su veya daldırma bir yağ olarak, orta ing. bir lamel ile örnek Kapak ve çabuk kuruyan yapıştırıcı veya erimiş parafin ile lamel mühür.
- 20X su hedefi altında bir mikroskop lamı üzerine sabitlenmiş floresan polistiren boncuklar yerleştirin. hedefi sokmak için su birkaç damla ekleyin.
- Online tuşuna basarak, gözle numunenin doğrudan gözlem için lazer tarama moduna geçmek için yazılımda sekmesini bulun açın, boncuk odaklanmayı sağlamak için. Ad hoc filtreyi seçin ve ikonlara tıklayarak halojen lamba açmak için Göz aracını açın.
- El ile sonsuzluk uzayda SidePort kaydırıcısında dikroik ayna kaldırmak ve Okülerin ile boncuk gözlemleyerek örnek uçağı odaklanmak için mikroskop odaklama sürücü kullanın. dikroik ayna değiştirin.
- içindeSekmesini bulun Çevrimdışı düğmesine basarak lazer tarama moduna geçin. Tarama parametrelerini tanımlamak için Acquisition sekmesine gidin: 512 piksel çerçeve boyutu, 9 bir tarama hızı, 1 bir ortalamasının, 8 bit bir bit derinliği seçin ve maksimum tarama alanını artırmak.
- Toplama sekmesinin Kanallar aracında, önceden oluşturulmuş değilse bir Track (Parça 1) ekleyin. . Ti için 830 nm'de dalga boyu ve düşük güç seçin: safir lazer ışınını Kanallar penceresinden ve PMT3 veya Işık Yolu penceresinden PMT4 kutusuna Track 1 kutuda yeşil renk işaretleyin.
- Toplama sekmesinin Kanallar aracında, ikinci Track (Parça 2) ekleyin. OPO lazer ışını için 1,107 nm ve düşük güçte dalga boyu seçin. Kanallar penceresinden ve gelen PMT3 kutusuna Track 2 kutuda kırmızı renk Kene Işık Yolu penceresi.
- Sırayla Sürekli tıklayarak numune üzerine iki kiriş tarama uygulamak, sonra 600 her iki parça kazanç ayarlayın.
- 2B görünümüne ekran alanındaki görüntüyü gözlemleyin. Ekran View Seçeneği denetim bloğu, ekran yoğunluğunu ayarlayın.
Not: boncuk odak düzlemini bulmak biraz odaklama sürücüyü hareket Gerekirse. Bitki ayarlayın ve tek bir boncuk veya bitişik boncuklar bir grup görüntüyü yakınlaştırmak. - xy düzleminde kirişler üst üste periskop denetleyicisi kullanın. Yazılımda, Bakım sekmesini açın. Sistem Seçenekleri tıklayın ve Motorlu Periskop aracı penceresini görüntüler. Uzayda her iki görüntüleri senkronize etmek için safir lazer ışınını: kaba ve ince Ti periskop aynaları ayarlamaları kullanın.
- periskop manipülasyon için, dikey ve seco ilk ayar çubukları kullanmakLazer ışınının yatay hareketler için ND on. Görüntü biraz görülene kadar giriş ayna ile ışın taşıyın ve sonra "giriş" ve "çıkış" butonuna tıklayarak periskop çıkış ayna lazer yoğunluğu telafi.
- Safir lazer ışınını: dikey, koruyun sekmesinde, kirişler üst üste Kolimatör aracını açın ve Ti odak uzaklığı değerini ayarlamak için.
- yavaşça her iki görüntülerde odak farkı kontrol etmek için objektif dikey konumunu taşıyın. Ya da, Edinme sekmesi Z-Stack aracı açıklıktan numunenin z-yığını almak ve farklı parametreler (aralık, dilim sayısı) seçin. görüntü ekranı alanında basın Ortho eksenel kesitte kirişleri görmek için. Aynı prosedür birkaç kez yaparak z örtüşme en üst düzeye çıkarmak.
5. Son Düzenlemeler ve Tutarlı Anti-Stokes Raman saçılması (CARS) Zeytinyağı Dr Sinyal Gözlemoplets
- Bir cam levha üzerine zeytinyağı bir damlacık koyun ve bir cam kapak slip ile kaplayın. 20X suya daldırma hedefi sokmak için su birkaç damla ekleyin. (4.2 daha önce açıklandığı gibi) Okülerin kullanarak kapak kayma kenarında odaklanın.
- Safir lazer ışını ve OPO için 1107 nm: Toplama sekmesinin Kanallar aracında, Parça 1 Ti için 830 nm dalga boyu seçmek. Her iki lazerler aynı anda tarama için Takip 1'de her iki lazerleri işaretleyin. Bir başlangıç için düşük değerde set güçler.
- Işık Yolu penceresinde, PMT1 seçin. Sürekli düğmeye tıklayarak lazer taramaları açın. Yağ ince bir tabaka halinde lazer ışığını sağlamak için hafifçe odağı taşıyın.
- Gerekirse, her iki lazer optik gücünü artırmak. Ekran View Seçeneği denetim bloğu ekran yoğunluğunu ayarlayın. sig sinyali hale gelinceye kadar yavaş yavaş gecikme hattının çeviri sahneye taşımakölçüde artırmada.
- İnce hizalamaların tamamlandıktan sonra, bir ARABALAR sinyal gerçekten olup olmadığını kontrol edin: hafifçe çeviri aşamasında taşı; sinyal yoğunluğu zayıf haline gelmelidir. Ve / veya ya, Ti lazer ışınının birini kapatın: safir lazer veya OPO. Yine arabalar sinyale göre yoğunluğu güçlü bir bozunma olmalıdır.
- (Ekran alanı sekmesinin Histo görünümünde) Tüm görüntünün ortalama yoğunluğu bir değer sağlamak için yazılım üzerinde seçeneğini, maksimum ARABALAR sinyal elde etmek. dalga boyu (birkaç nm) ayarlayın, ardından odak ışınının x, y, z pozisyonları ortalama yoğunluk değerini maksimize etmek.
Gecikme Hattı Işık Yolu 6. Muhafaza
- Son sistem dışı fizikçiler adamıştır beri, zararlı olmayan görünür yüksek tepe gücü lazer ışınına doğrudan erişim önlemek için, tüpler veya bir muhafaza kutusu ile gecikme hattının ışık yolu içine alın. çeviri aşamasında bir erişim sağlamak için özentopuzu.
CARS 7. Dalgaboyu Tuning
- denklemini kullanın
 İstenen Raman titreşime ayarlamak için lazer dalga boyları. Safir = 830 nm ve λ OPO = 1,095 nm: Görüntü ARAÇLAR Bu çalışmada sunulan sonuçları yeniden oluşturmak için Ti λ seçin 3015 cm -1, titreşimi germe sahip CH bağlarından sinyal.
İstenen Raman titreşime ayarlamak için lazer dalga boyları. Safir = 830 nm ve λ OPO = 1,095 nm: Görüntü ARAÇLAR Bu çalışmada sunulan sonuçları yeniden oluşturmak için Ti λ seçin 3015 cm -1, titreşimi germe sahip CH bağlarından sinyal.
Not:.., Su gibi biyolojik numunelerde, gözlenen Raman özelliği titreşim frekansları, CH bağı Evans ve arkadaşları 13 bölgesi veya Ellis ve arkadaşları 29 bulunabilir. - denklemini kullanın
 ARAÇLAR sinyal yayma dalga boyu belirleme. ARABALAR CH bağ görüntüleme için, λ ARABALAR beri 670 nm dar bant filtre seçmek = lazer dalga boyu ile 670 nm 7.1 sundu.
ARAÇLAR sinyal yayma dalga boyu belirleme. ARABALAR CH bağ görüntüleme için, λ ARABALAR beri 670 nm dar bant filtre seçmek = lazer dalga boyu ile 670 nm 7.1 sundu.
NOT: Bir cep telefonu uygulaması av olduğunuadlı λ CARS hesaplamak ailable λ P ve λ S değerleri (referans 30).
Siyatik Sinir Cuts CARS Sinyal ve Lekeli Miyelin 8. Gözlem
Not: Tüm hayvan deneyleri kurumsal düzenlemelere uygun olarak gerçekleştirilmiştir.
- Özçelik ve ark., 31 gösterildiği gibi bir mikroskop lamı üzerine eksenel ve uzunlamasına siyatik siniri keser hazırlayın.
- PBS içine stok solüsyonu, 300 kat seyreltilmesi ile fluoromyelin kırmızı boyama çözeltisi hazırlayın. Oda sıcaklığında 20 dakika boyunca boyama solüsyonu ile sinir keser boyayın. çözelti çıkarın ve PBS ile 10 dakika boyunca 3 kez yıkayın.
- 20X suya daldırma hedefi altında kesik yerleştirin. lamel yerleştirin. hedefi batırmak ve (daha önce 4.2 ayrıntılı olarak) Okülerin yoluyla kesim net bir görüntü elde etmek için objektif odağını ayarlamak için PBS birkaç damla ekleyin. 830 nm ve 1095 nm dalga boylarını kendi tanımlayın: Parça 1'de li> Ti seçin. Işık Yolu penceresinde, PMT1 ve yeşil renk seçin.
- Parça 2, OPO lazer sadece (1095 nm dalga boyu) seçin. Işık Yolu penceresinde, PMT4 ve kırmızı renk seçin.
- Her iki lazer, düşük güç seçmek ve bir başlangıç için 600 kazanç ayarlayın. lazer taramaları açın ve CARS artırmak için aşağıdaki parametrelerini ayarlamak ve floresan sinyali tezat: Güç değerleri, çeviri sahne düğmesini (çok az), dalga boylarını (birkaç nm), ekran yoğunluğu.
- Yüksek çözünürlükte final görüntüleri kaydetmek için, Toplama Modu aracı aşağıdaki parametreleri seçin: 1.024 piksel çerçeve boyutu, 7 tarama hızı, tek bir görüntü kaydetmek için Yapış düğmesini 4. tıklayınız ortalamasını. özel formda görüntü kaydetmeGörüntüyü ve tam elde etme parametrelerini kaydetmek için.
Siyatik Sinir Cuts gelen ARAÇ ve SHG Sinyallerin 9. Gözlem
- Özçelik ve ark., 31 de gösterildiği gibi siyatik siniri hazırlayın.
- Okülerin aracılığıyla bir görüntü elde etmek bölüm 8 açıklandığı ve otomobil sinyal parametresi (Parça 1) seçmek için prosedürü izleyin.
- Parça 2, OPO lazer sadece (1095 nm dalga boyu) seçin. Işık Yolu penceresinde, PMT3 ve eflatun rengi seçin.
- lazer taramaları açmak ve yüksek çözünürlüklü görüntülerini kaydetmek için kısmen 8'de açıklandığı gibi prosedürü takip ediniz.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Standart Ti darbe tren sıklığı: safir lazer, genellikle yaklaşık 80 MHz. lazer safir: OPO o Ti tarafından pompalanır beri aynı frekansa sahiptir. En az 200 MHz hızlı osiloskop nedenle gereklidir. aralığında hızlı bir fotodiyot 600 1100 nm de gereklidir. Safir ve OPO sinyalleri 1 / (2 × 80 × 10 6) = 6.2 nanosaniye kaydırılır: Ti zaman maksimum zamansal kayma oluşur. Bu 1.9 M maksimum ışın yolu kaymasına karşılık gelen Ti 2 OPO...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
işin en zorlu kısmı lazer ışınları zamansal eşitleme olduğunu. Bu hızlı bir osiloskop ile birlikte hızlı bir fotodiyot gerektirir, ancak zaman içinde sadece kaba bir örtüşen ilk başta yapılabilir. Sonra birkaç cm daha ayarlaması gerekmemektedir. Son olarak, bir lineer çeviri aşamasında tarafından mikrometre hareket OTOMOBİLLER sinyali tetiklemek için gecikme hattı uzunluğunun nihai ince ayar yapmak mümkündür. yapıldı aşaması mikrometre sürücü ayarlanması sureti ile gözlemlenen Bu...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
The authors want to thank Dr. Philippe Combette (IES, UM, Montpellier, France) for the loan of the fast oscilloscope and acknowledge financial supports from Montpellier RIO Imaging (MRI). HR acknowledges ANR grants France Bio Imaging (ANR-10-INSB-04-01) and France Life Imaging (ANR-11-INSB-0006) infrastructure networks for coherent Raman imaging developments. This work was mainly supported by an European Research Council grant (FP7-IDEAS-ERC 311610) and an INSERM - AVENIR grant to NT.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Oscilloscope | Tektronix | TDS 520D | 500 MHz |
| Photodetector | Thorlabs | DET08C/M, T4290 | 5 GHz InGaAs, 800 - 1,700 nm |
| Ti:Sapphire laser Chameleon Ultra Family II | Coherent | ||
| Optical parametric oscillator OPO Compact Family | APE Berlin | ||
| Axio Examiner microscope LSM 7 MP | Carl Zeiss | ||
| Motorized periscope | Newport | ||
| Objective W Plan-Apochromat 20X/1.0 | Carl Zeiss | ||
| Beam combiner | Carl Zeiss | ||
| Acousto-optic modulator | Carl Zeiss | ||
| OPO power attenuator | Carl Zeiss | ||
| Photomultiplier tube | Carl Zeiss | ||
| ZEN software | Carl Zeiss | ||
| Bandpass filters | Carl Zeiss | LSM BiG 1935-176 | 400 - 480 nm; 500 - 550 nm; 465 - 610 nm |
| Dichroic mirror | Carl Zeiss | Cutoff wavelength 760 nm | |
| Silver mirrors | Newport | 10D20ER.2 | λ/10, 480 - 20,000 nm, Quantity 4 |
| Single-axis translation stage with standard micrometer | Thorlabs | PT1/M | Quantity 1 |
| Aluminium breadboard | Thorlabs | MB1015/M | Quantity 1 |
| Mirror mount | Thorlabs | KMSS/M | Quantity 4 |
| Mirror holder for Ø1" Optics | Thorlabs | MH25 | Quantity 4 |
| Iris diaphragms | Thorlabs | ID8/M | Quantity 3 |
| Protective box | Thorlabs | TB4, XE25L900/M, T205-1.0, RM1S | Quantity 1 |
| Optical posts | Thorlabs | TR40/M, PH50/M, PH75/M, BA2/M | Quantity 8 (lengths depending on the set-up) |
| 661 - 690 nm bandpass filter | Semrock | 676/29 nm BrightLine® single-band bandpass filter | Quantity 1 |
| Fluorescent beads | ThermoFisher | TetraSpeck™ Fluorescent Microspheres Size Kit | |
| Laser viewing card | Thorlabs | IR laser viewing card | |
| Laser safety glass | Newport | LV-F22.P5L07 | |
| FluoroMyelin™ Red Fluorescent Myelin Stain | ThermoFisher | F34652 |
Referanslar
- Valeur, B., Berberan-Santos, M. N. Molecular Fluorescence: Principles and Applications. , 2nd Edition, Wiley-VCH Verlag GmbH. (2012).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Moreaux, L., Sandre, O., Mertz, J. Membrane imaging by second-harmonic generation microscopy. JOSA B. 17 (10), 1685-1694 (2000).
- Zoumi, A., Yeh, A., Tromberg, B. J. Imaging cells and extracellular matrix in vivo by using second-harmonic generation and two-photon excited fluorescence. Proc. Natl. Acad. Sci. USA. 99 (17), 11014-11019 (2002).
- Yelin, D., Silberberg, Y. Laser scanning third-harmonic-generation microscopy in biology. Opt. Express. 5 (8), 169-175 (1999).
- Campagnola, P. J., Millard, A. C., Terasaki, M., Hoppe, P. E., Malone, C. J., Mohler, W. A. Three-dimensional high-resolution Second-Harmonic Generation imaging of endogenous structural proteins in biological tissues. Biophys. J. 81 (1), 493-508 (2002).
- Olivier, N., et al. Cell lineage reconstruction of early zebrafish embryos using label-free nonlinear microscopy. Science. 329 (5994), 967-971 (2010).
- Farrar, M. J., Wise, F. W., Fetcho, J. R., Schaffer, C. B. In vivo imaging of myelin in the vertebrate central nervous system using third harmonic generation microscopy. Biophys. J. 100 (5), 1362-1371 (2011).
- Lim, H., Sharoukhov, D., Kassim, L., Zhang, Y., Salzer, J. L., Melendez-Vasquez, C. V. Label-free imaging of Schwann cell myelination by third harmonic generation microscopy. Proc. Natl. Acad. Sci. U.S.A. 111 (50), 18025-18030 (2014).
- Strupler, M., Pena, A. M., Hernest, M., Tharaux, P. L., Martin, J. L., Beaurepaire, E., Schanne-Klein, M. C. Second harmonic imaging and scoring of collagen in fibrotic tissues. Opt. Express. 15 (7), 4054-4065 (2007).
- Cheng, J. X., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: Instrumentation, theory, and applications. J. Phys. Chem. B. 108 (3), 827-840 (2004).
- Volkmer, A. Vibrational imaging and microspectroscopies based on coherent anti-Stokes scattering microscopy. J. Phys. D: Appl. Phys. 38, R59-R81 (2005).
- Evans, C. L., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: chemical imaging for biology and medicine. Annu. Rev. Anal. Chem. 1, 883-909 (2008).
- Mukamel, S. Principles of nonlinear optical spectroscopy. , Oxford University Press. New York. (1995).
- Duncan, M. D., Reintjes, J., Manuccia, T. J. Scanning coherent anti-Stokes Raman microscope. Opt. Lett. 7 (8), 350-352 (1982).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering. Phys. Rev. Lett. 82 (20), 4142-4145 (1999).
- Folick, A., Min, W., Wang, M. C. Label-free imaging of lipid dynamics using Coherent Anti-Stokes Raman Scattering (CARS) and Stimulated Raman Scattering (SRS) microscopy. Curr. Opin. Genet. Dev. 21 (5), 585-590 (2011).
- Wang, P., Liu, B., Zhang, D., Belew, M. Y., Tissenbaum, H. A., Cheng, J. X. Imaging lipid metabolism in live Caenorhabditis elegans using fingerprint vibrations. Angew. Chem. Int. Ed. Engl. 53 (44), 11787-11792 (2014).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annu. Rev. Phys. Chem. 62, 507-530 (2011).
- Cheng, J. X., Jia, Y. K., Zheng, G., Xie, X. S. Laser-scanning coherent anti-Stokes Raman scattering microscopy and applications to cell biology. Biophys J. 83 (1), 502-509 (2002).
- Chiu, W. S., Belsey, N. A. N., Garrett, L., Moger, J., Delgado-Charro, M. B., Guy, R. H. Molecular diffusion in the human nail measured by stimulated Raman scattering microscopy. Proc Natl. Acad. Sci. U.S.A. 112, 7725-7730 (2015).
- Chen, X., Grégoire, S., Formanek, F., Galey, J. -B., Rigneault, H. Quantitative 3D molecular cutaneous absorption in human skin using label free nonlinear microscopy. J. of Control. Release. 200, 78-86 (2015).
- Kano, H., Hamaguchi, H. In vivo multi-nonlinear optical imaging of a living cell using a supercontinuum light source generated from a photonic crystal fiber. Opt. Express. 14 (7), 2798-2804 (2006).
- Brustlein, S., Ferrand, P., Walther, N., Brasselet, S., Billaudeau, C., Marguet, D., Rigneault, H. Optical parametric oscillator-based light source for coherent Raman scattering microscopy: practical overview. J. Biomed. Opt. 16 (2), 021106(2011).
- Chen, H., et al. A multimodal platform for nonlinear optical microscopy and microspectroscopy. Opt. Express. 17 (3), 1282-1290 (2009).
- Yue, S., Slipchenko, M. N., Cheng, J. X. Multimodal nonlinear optical microscopy. Laser Photonics Rev. 5 (4), 496-512 (2011).
- Sun, Q., Li, Y., He, S., Situ, C., Wu, Z., Qu, J. Y. Label-free multimodal nonlinear optical microscopy reveals fundamental insights of skeletal muscle development. Biomed Opt Express. 5 (1), 158-166 (2013).
- Le, T. T., Langohr, I. M., Locker, M. J., Sturek, M., Cheng, J. X. Label-free molecular imaging of atherosclerotic lesions using multimodal nonlinear optical microscopy. J. Biomed. Opt. 12 (5), 054007(2007).
- Ellis, D. I., Cowcher, D. P., Ashton, L., O'Hagana, S., Goodacre, R. Illuminating disease and enlightening biomedicine: Raman spectroscopy as a diagnostic tool. Analyst. 138, 3871-3884 (2013).
- A•P•E Angewandte Physik & Elektronik GmbH. , Germany. Available from: http://www.ape-berlin.de/en/page/calculator (2015).
- Ozçelik, M., et al. Pals1 is a major regulator of the epithelial-like polarization and the extension of the myelin sheath in peripheral nerves. J Neurosci. 30 (11), 4120-4131 (2010).
- Heinrich, C., Hofer, A., Ritsch, A., Ciardi, C., Bernet, S., Ritsch-Marte, M. Selective imaging of saturated and unsaturated lipids by wide-field CARS-microscopy. Opt. Express. 16 (4), 2699-2708 (2008).
- Kyriakidis, N. B., Skarkalis, P. Fluorescence spectra measurement of olive oil and other vegetable oils. J. AOAC Int. 83 (6), 1435-1439 (2000).
- King, R. Microscopic anatomy: normal structure. Handb. Clin. Neurol. 115, 7-27 (2013).
- Monsma, P. C., Brown, A. FluoroMyelin Red is a bright, photostable and non-toxic fluorescent stain for live imaging of myelin. J. Neurosci. Methods. 209 (2), 344-350 (2012).
- Wang, H., Fu, Y., Zickmund, P., Shi, R., Cheng, J. X. Coherent anti-stokes Raman scattering imaging of axonal myelin in live spinal tissues. Biophys. J. 89 (1), 581-591 (2005).
- Wang, H. W., Fu, Y., Huff, T. B., Le, T. T., Wang, H., Cheng, J. X. Chasing lipids in health and diseases by coherent anti-Stokes Raman scattering microscopy. Vib. Spectrosc. 50 (1), 160-167 (2009).
- Jung, Y., Tam, J., Jalian, H. R., Anderson, R. R., Evans, C. L. Longitudinal, 3D in vivo imaging of sebaceous glands by coherent anti-stokes Raman scattering microscopy: normal function and response to cryotherapy. J. Invest. Dermatol. 135 (1), 39-44 (2015).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır