Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Внедрение системы Связной Антистоксова комбинационное рассеяние (CARS) на Ti: Sapphire и ОРО лазер на основе стандартного лазерного сканирующего микроскопа
В этой статье
Резюме
Когерентная антистоксова комбинационного рассеяния света (КАРС) микроскопии на основе присущей вибрации молекул облигаций позволяет без наклеек химически селективное изображений живых клеток. Эта работа представляет реализацию дополнительного метода микроскопии на стандартной многофотонная лазерного сканирующего микроскопа, основанного на фемтосекундного Ti: сапфирового лазера и лазера ОРО.
Аннотация
Лазерное сканирующих микроскопов, сочетающие фемтосекундного титан-сапфирового лазера и оптический параметрический генератор (OPO), чтобы дублировать лазерной линии стали доступны для биологов. Эти системы предназначены в первую очередь для многоканальных двухфотонному флуоресцентной микроскопии. Тем не менее, без каких-либо изменений, дополняют друг друга нелинейна оптическая микроскопия, такие как генерации второй гармоники (ГВГ) или генерации третьей гармоники (THG) также могут быть выполнены с этой установкой, что позволяет без наклеек визуализации структурированных молекул или водной средне- липидные интерфейсы. Эти методы хорошо подходят для наблюдения в естественных условиях, но ограничены в химической специфичности. Химически селективного формирования изображения может быть получена из присущих вибрационных сигналов на основе комбинационного рассеяния. Конфокальной микроскопии комбинационного рассеяния обеспечивает 3D пространственное разрешение, но это требует высокой средней мощности и долгое время приобретения. Для преодоления этих трудностей, последние достижения в области лазерной технологии позволили развитие нелинейной оптической колебательной микроскопии, в частности когерентного антистоксова комбинационного рассеяния света (КАРС). АВТОМОБИЛИ микроскопии поэтому возникла как мощный инструмент для биологического и живого изображения клеток, путем химического картирования липидов (через CH стретч вибрации), воды (через ОН-стретч вибрации), белков или ДНК. В этой работе мы опишем реализацию метода Машинки на стандартной ОРО связью многофотонная лазерного сканирующего микроскопа. Он основан на синхронизации в конкретный момент времени двух лазерных линий путем регулировки длины одного из пути лазерного луча. Мы представляем реализацию шаг за шагом этой методики на существующей системе многофотонном. Основной фон в экспериментальной оптике является полезным и представленная система не требует дорогостоящего дополнительного оборудования. Мы также иллюстрируют АВТОМОБИЛИ формирования изображения, полученные на миелиновых оболочек седалищного нерва грызуна, и мы покажем, что это формирование изображений может выполняться одновременно с другими нелинейной оптической визуализации, такие как стандартные тWO-фотоном техники флуоресценции и генерации второй гармоники.
Введение
Оптическая микроскопия стала основным методом для неразрушающего визуализации динамических процессов в живых биологических систем с внутриклеточной разрешением. Флуоресцентная микроскопия в настоящее время является наиболее популярным контраст изображения используются в живых клетках благодаря своей высокой специфичности и чувствительности 1. Большая палитра флуоресцентных зондов возникла (экзогенные красители, генетически кодируемых ими белков, полупроводниковых наночастиц). Различные образцы освещения люминесцентными на основе методики процветали (например, конфокальной или двухфотонного микроскопии) для выполнения 3D - изображений и уменьшить основной недостаток этого метода , который фотообесцвечиванию 2. Другие ограничения включают требование маркировки флуорофора, так как большинство видов молекул не свойственно флуоресцентный и, следовательно, эти флуорофоры должны быть искусственно введен в изображаемого образца. Это искусственное манипулирование может быть разрушительным, особенно для малых молекул или вызывает горшокренциальный фото-токсичность. Эти причины делают флуоресценция не микроскопии хорошо подходит для в естественных условиях наблюдений. Следовательно, применение оптических методов визуализации с высокой чувствительностью и специфических молекулярных контрастах без использования флуоресцентных молекул является весьма желательным в биомедицине.
Несколько нелинейных оптических методов визуализации без маркировки или окрашивания появились, в том числе генерации второй гармоники (ГВГ) 3,4 и генерации третьей гармоники (THG) 5. SHG микроскопии была использована для изображения структурных механизмов на супрамолекулярном уровне , такие как микротрубочки или коллагена 6. ГТГ генерируется из оптических неоднородностей , таких как интерфейс между водной средой и липидов 7. THG было также продемонстрировано на изображении миелина 8,9. Обе методики могут быть реализованы на двухфотонного флуоресцентного микроскопа и требуют только один лазерный луч. Однако они требуют интенсивности лазерного излучения высокой мощности (обычно 50мВт при 860 нм для SHG 10, 25 - 50 мВт при 1180 нм для THG 9), который является вредным в живых образцах, и не обеспечивают химическую специфичность, которая необходима для однозначного изображения конкретных биологических структур.
Химически селективного формирования изображения могут быть получены из сигналов, присущих молекулярных колебаний на основе комбинационного рассеяния. Когда луч света попадает материя, фотоны могут поглощаться и рассеиваются атомами или молекулами. Большая часть рассеянных фотонов будет иметь ту же энергию, то есть, частота, как падающих фотонов. Этот процесс называется рэлеевское рассеяние. Однако небольшое число фотонов будет рассеиваться на оптической частоте , отличной от частоты падающих фотонов, то есть с неупругого процесса рассеяния называемого комбинационного рассеяния. Разница в энергии происходит от возбуждения колебательных мод в зависимости от молекулярной структуры и окружающей среды. Поэтому СКР пров рассеяниеязей химически селективных изображений, как различные молекулы имеют определенные частоты колебаний. Тем не менее она ограничена из-за его чрезвычайно слабого сигнала. Конфокальной микроскопии комбинационного рассеяния была разработана и обеспечивает 3D - пространственное разрешение, но это требует высокой средней мощности и долгое время захвата 11. Для преодоления этих трудностей, последние достижения в области лазерной техники позволили возникновение нелинейной оптической колебательной микроскопии, в частности когерентного рассеяния антистоксова рассеяния света (КАРС) 11,12,13.
CARS представляет собой нелинейный оптический процесс третьего порядка. Три лазерные лучи, состоящие из пучка накачки на частоте © P, пучок Стокса на частоте со S и зонд пучка (чаще всего является насос) сосредоточены в образце и генерируют пучок антистоксова на частоте со As = ( 2ω P - ω S) 14. Сигнал антистоксово может быть значительно повышена, если разность частотмежду насосом и Стокса пучков настроен на комбинационном молекулярных колебаний Ом R = (ω P - ω S). Сигнал АВТОМОБИЛЕЙ основан на возможности взаимодействия нескольких фотонов. Он генерирует поэтому когерентный заказы сигнал величины сильнее, чем СКР.
АВТОМОБИЛИ микроскопии впервые была экспериментально продемонстрирована Дункана и др. 15. Zumbusch и др. Улучшилось , то технику, с помощью двух ориентированных в ближней инфракрасной области фемтосекундных лазерных лучей с объективом высокой числовой апертурой, что позволяет фазового согласования состояния автомобилей и избежать двухфотонную нерезонансную фон 16. АВТОМОБИЛИ микроскопии поэтому возникла как мощный инструмент для клеток и тканей живого изображения, путем химического обнаружения молекул , таких как липиды (через CH стретч вибрации) 17,18, воду (через ОН - стретч вибрации), белки, ДНК в живых клетках 19,20 но и дейтерированный химическое соединениеs для фармацевтических и косметических 21 приложений 22.
Основным недостатком нелинейной микроскопии происходит из-за сложности и стоимости оптических источников. Система АВТОМОБИЛИ требует двух длин волн перестраиваемых лазеров с короткими длительности импульсов и с во времени и пространстве синхронизированных импульсов. Ранние АВТОМОБИЛИ микроскопов были основаны на двух синхронизированных пикосекундном Ti: сапфирового лазеров 20. АВТОМОБИЛИ изображений была также получена из одного фемтосекундного Ti: сапфирового лазера , генерирующего источника света суперконтинуум 23. В последнее время лазерные источники, состоящие из одного фемтосекундного Ti: сапфирового лазера накачки перестраиваемого оптических параметрических генераторов (OPO) были использованы для АВТОМОБИЛЕЙ микроскопии. Эта установка позволяет внутренне синхронизирован по времени лучи с разницей частот между насосом и пучка Стокса , охватывающих весь молекулярный спектр колебаний 24. Кроме того, лазерное сканирование микроскопов основан на Turn-ключ фс лазер и ОПО, в основном используется для двухфотонная флуоресценции (ТПФ) теперь доступны для не-физиков. Потенциал таких наборов параметров может быть значительно повышена, не требуя дополнительного инвестиций за счет включения других нелинейных оптических изображений, так как каждая нелинейная (НКП) методом визуализации чувствителен к определенным структурам или молекул. Поэтому мультимодальные NLO изображений заглавной потенциал NLO микроскопии для сложных биологических образцов 25. Сочетание этих методов позволило исследование многих биологических вопросов, в частности , на липидный обмен, кожи или рак развития 26, развития скелетных мышц 27, атеросклеротических поражений 28. Кроме того, реализация лазерного сканирования луча с АВТОМОБИЛЕЙ дает возможность визуализации с высокой частотой, т.е. привлекательным инструментом для изучения динамических процессов в естественных условиях.
Целью данной работы является показать каждый шаг к реализации тон АВТОМОБИЛИ технику на стандартном многофотонная лазерного сканирующего микроскопа. Микроскопа основан на фс Ti: сапфировый лазер и ОПО (нагнетанию титан-сапфирового лазера), приводимый в действие программного обеспечения для биологов. Интеграция была выполнена путем регулировки длины одного из пути лазерного луча с целью синхронизации во времени двух пучков. Мы опишем реализацию шаг за шагом этой техники, которая требует только базовые знания в экспериментальной оптике. Мы также иллюстрируют АВТОМОБИЛИ формирования изображения, полученные на миелиновых оболочек седалищного нерва грызунов, и мы покажем это формирование изображений может выполняться одновременно с другими нелинейной оптической визуализации, такие как стандартные двухфотонному техники флуоресценции и генерации второй гармоники.
Access restricted. Please log in or start a trial to view this content.
протокол
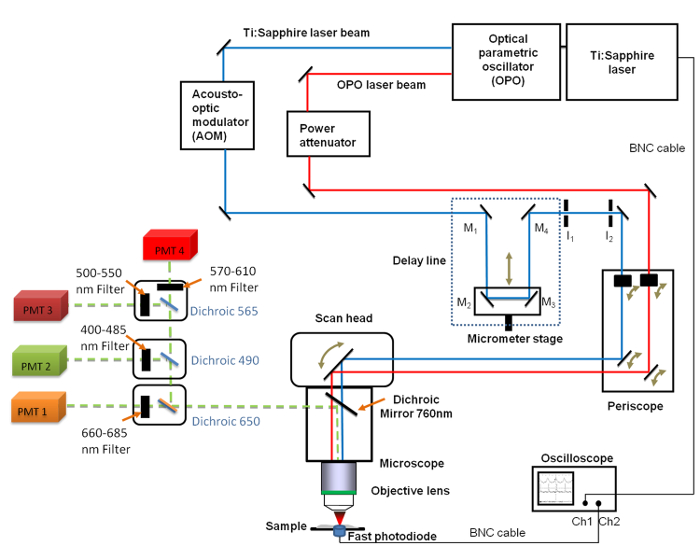
Рисунок 1. Схематическое изображение общей настройки Она включает в себя : Ti. Сапфир (680 - 1080 нм) и ОПГ (1,050 - 1300 нм) лазеров, линии задержки с 4 зеркалами (M 1 до M 4), быстрый осциллограф, фотодиод и два фиксированных ирис диафрагмы I 1 и I 2. Зеркала M 2 и M 3 закрепляются на линейной стадии перевода , позволяющей изменять длину линии задержки с разрешением микрометра. 660 -. 685 нм фильтр нижних частот полоса была расположена в передней части трубки фотоумножителя (ФЭУ) , используемые для работы с изображениями CARS Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
1. Запуск лазерной системы
- Убедитесь в том, что Ti: сапфировый длину волны устанавливают на 800 нм или определитьэта длина волны на Ti: сапфировый контроллер питания. Поверните ключ из режима ожидания Вкл для включения Ti: сапфировый лазер.
- Включите ОРО лазера на задней панели контроллера ОРО и откройте Ti: сапфировый затвор на Ti: сапфировый контроллер питания.
- Включите планшетный компьютер, чтобы накачать ОПГ. Нажмите на ОПО Connected и удаленного Connected иконки на планшете. Подождите 30 - 40 минут для разогрева.
- Включите микроскоп компьютер и включите переключатели "Микроскоп компоненты". Запустите программу, дважды щелкнув значок на рабочем столе.
- В закладке приобретение программного обеспечения, откройте инструмент Laser в диспетчере установки , чтобы управлять обоими лазерами с программным обеспечением. Выберите Ti: сапфировый лазер на и ОРО лазер. Проверьте значение оптической мощности лазера (типичные значения 3,700 мВт при длине волны 800 нм и 700 мВт при 1000 нм).
- Чтобы настроить траекторию луча и лазеры,откройте инструмент Light Path в группе диспетчера установки и проверьте поле первого ФЭУ (ФЭУ).
- Для проверки Ti: сапфировый лазерное пятно на выходе объектива, откройте инструмент каналов в группе инструментов сбора параметров. Выберите Ti: сапфировый мощность при низком значении (около 1%), уменьшить коэффициент усиления до 0 (никакого изображения не требуется на данном этапе) и нажмите на кнопку Непрерывный , чтобы начать процедуру сканирования , чтобы запустить лазерный луч через объектив микроскопа. Проверьте наличие красного пятна путем прямого наблюдения, расположив ИК-лазера карту просмотра на выходе объектива воздуха микроскопа (10x).
- Для проверки ОРО лазерное пятно, остановить сканирование титан-сапфирового лазера, нажав на кнопку Stop. Выберите мощность ОРО при низком значении в окне каналов и нажмите на Continuous кнопку.
2. Микроскоп Настройки
- Вручную поместите дихроичное зеркало с длиной волны отсечки при 760 нм в ползунком Sideport в бесконечности пространства над объективной носика, чтобы запустить свет до 760 нм от образца в ФЭУ в режиме (NDD) без descanned обнаружения.
- Установите узкий полосовой фильтр на 660 - 685 нм в отражателе куба NDD перед PMt1 для записи только сигнала КАРС при 670 нм, чтобы воспроизвести результаты, представленные в данной работе.
- Поместите узкополосный фильтр в диапазоне от 500 до 550 нм в отражателе кубе NDD перед PMT3 для наблюдения флуоресценции миелина. Поместите узкополосный фильтр в диапазоне от 565 до 610 нм в рефлекторной куба перед PMT4 для наблюдения ГВГ.
- Чтобы выбрать в программном обеспечении записи сигнала на детекторе с специальной полосового фильтра, откройте Light инструмент Path в меню Setup Manager , на вкладке Acquisition. Активируйте нужный PMT (флажок) и выберите цвет для этого канала. В этой работе, зеленый был выбран для автомобилей, красный для флуоресценции и пурпурного для ГВГ.
3. Синхронизация Temporal
Примечание: Два лазерных луча исходят из того же Ti: сапфировый лазер, но ОРО луч задерживается, когда он создается таким образом, два луча не синхронизированы во времени, когда они достигают микроскопа. Цель здесь заключается в задержке одного из двух пучков, чтобы повторно синхронизировать их во времени, прежде чем они достигнут микроскопа.
- Подключение с помощью кабелей BNC входного канала CH1 осциллографа к электрической BNC выходной мощности лазера (Sync. Out). Подключите входной канал CH2 осциллографа на фотодиод и выбрать канал CH1 в качестве канала запуска, нажав TRIGGER меню, а затем главного меню кнопки источника , а затем кнопку бокового меню, соответствующее выбранному каналу CH1.
- Положение и зафиксировать с помощью оптических сообщений монтажа фотодиод в фокальной плоскости объектива микроскопа воздуха (10Х) или на пути луча микроскопа после удаления цели. Примечание: При необходимости, удалить конденсатор и его носитель.
- В инструменте Channels (Приобретение параметров инструмента группы), определяют Ti: сапфировый лазер длиной волны 830 нм при малой мощности (т.е. менее 1% от полной мощности). В режиме обнаружения инструмента, уменьшить область сканирования в одну точку, чтобы осветить фотодиод с мельчайшей пучком. Включите лазерного сканирования, нажав на кнопку Непрерывный.
- Нажмите AUTOSET на передней панели осциллографа и вручную переместить положение фотодиода , чтобы получить импульсов на экране. Нажмите кнопку RUN / STOP , чтобы заморозить дисплей.
- Чтобы сохранить копию экране осциллографа, вставьте 3.5дюймовый гибкий диск в дисковод или подключите порт GPIB на задней панели к компьютеру. Затем нажмите SHIFT HardCopy MENU, нажмите FORMAT (основной) , чтобы выбрать формат изображения TIFF и указать в меню Порт выходного канала. Нажмите кнопку HARDCOPY для записи экрана осциллографа импульса поездов титан-сапфирового лазера.
- Выключите Ti: сапфировый лазерное сканирование, нажав на кнопку Stop. Щелкнув Каналы инструмента определяют сигнал ОПО на 1,107 нм и малой мощности. Включите лазерного сканирования ОРО и записи импульсов ОПГ лазера на осциллографе. Выключите ОРО лазерное сканирование.
- Сравните временной сдвиг между Ti: Sapphire и ОРО сигналы.
Примечание: Временной сдвиг т сдвиг задает длину линии задержки L Delayline , который должен быть реализован следующим уравнением: L = C Delayline5; т сдвиг где с скорость света. - Выберите один из лазерных линий.
Примечание: В этой работе, Ti: сапфировый лазер линия была выбрана потому, что свободное пространство было доступно вблизи лазерной линии. Кроме того, этот выбор позволяет добиться повторного выравнивания линии лазера с видимым лазерным светом. - Откройте линию лазера удалением защитных труб в месте, где будет реализована линия задержки.
Внимание! Носить соответствующие защитные очки и снимите цепи браслеты или часы из запястья. - Выберите длину волны в видимом диапазоне, чтобы иметь возможность легко наблюдать за лазерным лучом (700 нм , например, при низкой мощности в инструменте каналов программного обеспечения). Включите лазерного сканирования.
- И установлен с оптическими посты установки двух ирис диафрагмы вдоль открытой линии лазера. Позиция одной радужной оболочки на выходе линии задержки и поместите другой радужной оболочки у входа в перископ.
Примечание: Пеуправления riscope по два моторизованных зеркала пилотируемых программным обеспечением угла входа лазерного луча в сканирующей головки лазерного сканирующего микроскопа. - Уменьшите отверстие диафрагмы диафрагмы и регулировки положения диафрагмы, чтобы соответствовать траектории лазерного луча. Закрепить их на оптическом столе. Регулировка вертикального положения третьей подвижной ирисовой диафрагмой, чтобы проверить высоту лазерного луча при позиционировании последовательно четыре зеркала линии задержки.
ПРИМЕЧАНИЕ: Эти ирис диафрагмы будет служить в качестве контроля для процедуры повторного выравнивания, показывая путь, чтобы следовать. - Поместите зеркало M1 , установленный на компактном кинематической зеркало крепление на входе линии задержки (как показано на рисунке 1) и регулировать его положение и ориентацию , чтобы поддерживать высоту пучка с использованием подвижной ирисовой диафрагмой. Место зеркала M2 и M3 (также установлены на компактных кинематических зеркальных креплениями) под углом 90 ° на этапе перевода, который будет расположен в midcourse. Расположите их, чтобы соответствовать длине линии задержки, рассчитанные ранее.
- Отрегулировать ориентацию М2 и М3 с использованием мобильной ирисовой диафрагмой. Установить M4 (также фиксируется на компактном монтировки) на выходе из линии задержки ( как раз перед радужкой I 1 , как показано на рисунке 1) и тщательно регулировать его положение и угол , чтобы соответствовать траектории лазерного луча через две фиксированной диафрагмой диафрагм.
- Поместите лазерный карту просмотра на выходе объектива микроскопа и проверить профиль лазерного луча, нажав на Непрерывный , чтобы включить лазерное сканирование. Соблюдайте однородный яркий диск. При необходимости, слегка скорректировать ориентацию M4.
- Положение снова быстрый фотодиод под лазерного луча в фокальной плоскости образца микроскопа. Обратите внимание на временной сдвиг между титан-сапфирового лазера луч и ОРО луч на экране осциллографа.
Примечание: При необходимости, изменить длину линии задержки, перемещая всю систему M2, M3, установленный наэтап перевода (без изменения настройки этапе перевода) для синхронизации обоих импульсов. Изменения нескольких сантиметров может потребоваться.
4. Пространственное перекрывание пучков
Примечание: для получения сигнала тележкам, пространственное перекрытие двух лазерных лучей требуется. Альтернативное освещение обоих пучков на тех же самых бусинок, окрашенных по всему с двумя различными флуоресцентными красителями, могут быть использованы для указания пространственного смещения. Мелкие корректировки позиций зеркал могут затем минимизировать сдвиг.
- Используйте предварительно смонтированы флуоресцентные микросферы. Или смонтировать микросферы в виде суспензии на чистые предметные стекла микроскопа, как описано ниже:
- Перед отбором перемешайте (на коркового смесителе или путем обработки ультразвуком) раствора бусин, чтобы убедиться, что гранулы равномерно приостановлено.
- Нанесите 5 мкл суспензионной на поверхности скольжения и распространяться с наконечником пипетки. Подождите, пока капли, чтобы высохнуть, а затем применить 5 мкл монтировкиИнг среды, такие как глицерин, вода или иммерсионного масла через сухой образец гранул. Накройте образца с покровным и печатью покровное с быстрой сушки клея или расплавленного парафина.
- Поместите флуоресцентных гранул полистирола, закрепленную на предметное стекло микроскопа под объектива 20X воды. Добавьте несколько капель воды, чтобы погрузить цель.
- Для достижения фокуса на шариках, откройте вкладку Найдите в программном обеспечении для переключения из режима лазерного сканирования для прямого наблюдения образца с глазом, нажав на кнопку Online. Откройте Глазной инструмент , чтобы выделить специальный фильтр и включите галогенной лампы, нажав на иконки.
- Вручную удалите дихроичное зеркало в слайдере Sideport в бесконечности пространства и использовать фокусировочное диск микроскопа, чтобы сосредоточить внимание плоскости образца, наблюдая за бусинки с окуляров. Заменить дихроичное зеркало.
- вНайдите вкладку, перейти в режим сканирования лазерного, нажав на кнопку Offline. Перейдите на вкладку Acquisition , чтобы определить параметры для сканирования: выберите размер кадра до 512 пикселей, скорость сканирования 9, усреднение 1, битовую глубину 8 бит и увеличить область сканирования до максимума.
- В инструменте Каналы на вкладке Acquisition, добавить трек (Track 1) , если уже не создан. Выберите длину волны при 830 нм и низкой мощности для Ti:. Сапфировый лазерный луч Tick цвет на зеленый в окне Track 1 из окна каналов и в PMT3 или поле PMT4 от света окна Path.
- В инструменте Каналы на вкладке Acquisition, добавьте второй дорожки (Track 2). Выберите длину волны, при 1,107 нм и малой мощности для ОРО лазерного луча. Отметьте цвет на красный в окне Track 2 из окна каналов и в поле PMT3 из Окно Light Path.
- Отрегулируйте усиление обоих треков до 600. Затем последовательно применить проверку двух пучков на образец, нажав на Непрерывный.
- Обратите внимание на изображение в области экрана в 2D вид. На дисплее блока управления View Option, регулировать интенсивность дисплея.
Примечание: При необходимости, слегка смещаться фокусировки диск, чтобы найти фокальную плоскость шариков. Кадрировать и изменять масштаб изображения в одной бусинки или в группе соседних бусин. - С помощью контроллера перископа для перекрытия пучков в плоскости ху. В программном обеспечении откройте вкладку Ведение. Нажмите на параметры системы и отображения окна инструмента моторизованный Перископа. Использование грубой и точной регулировки перископа зеркал титан-сапфирового лазера луч для того, чтобы синхронизировать в пространстве обоих изображений.
- Для манипулирования перископа, используйте первые такты регулировки для вертикального и Секой один для горизонтальных движений лазерного луча. Перемещение луча с входным зеркалом, пока изображение не будет слегка виден, а затем компенсировать интенсивности лазерного излучения с выходным зеркалом перископ, нажав на "вход" и "выход".
- Для того , чтобы перекрывать вертикально балки, на вкладке Ведение, откройте инструмент коллиматора и корректировать значение фокусного расстояния титан-сапфирового лазера луч.
- Переместить аккуратно объективную вертикальное положение, чтобы проверить разницу фокусировки на обоих изображениях. Или, возьмите Z-стек образца путем открытия в закладке приобретения инструмента Z-Stack и выбрать различные параметры (диапазон, количество срезов). Нажмите Орто в области экрана изображение, чтобы увидеть лучи в осевом поперечном сечении. Максимизация Z-перекрытия, выполнив ту же самую процедуру несколько раз.
5. Заключительные корректировки и когерентные Антистоксова комбинационного рассеяния света (КАРС) Сигнал наблюдения из оливкового масла Droplets
- Поместите капельку оливкового масла на стеклянную пластину и покрывают его с помощью покровным стеклом. Добавьте несколько капель воды, чтобы погрузить цель погружения в воду 20X. Фокус на краю покровного стекла, используя окуляры (как описано ранее в разделе 4.2).
- В инструменте Каналы на вкладке Acquisition, выберите на дорожке 1 длина волны 830 нм для Ti: сапфирового лазерного луча и на 1,107 нм для ОРО. Tick обоих лазеров в Track 1, чтобы получить одновременное сканирование обоих лазеров. Установить полномочия при низком значении для начала.
- В окне Light Path выберите PMt1. Включите лазерного сканирования, нажав на кнопку Непрерывный. Перемещение немного фокуса, чтобы доставить лазерное излучение в масляном тонким слоем.
- При необходимости увеличить оптическую мощность обоих лазеров. Регулировка яркости дисплея на дисплее блока управления View Option. Медленно перемещайте этап перевода линии задержки, пока сигнал не станет сигчительно усиливается.
- После того, как мелкие выравнивания завершены, проверьте, является ли это на самом деле сигнала КАРС: Перемещение немного этап перевода; интенсивность сигнала должна стать слабее. И / или выключить один из лазерного луча, либо титан-сапфирового лазера или OPO. Опять же должно быть сильное затухание интенсивности по сравнению с сигналом АВТОМОБИЛЕЙ.
- Для достижения сигнала максимальных CARS, выберите опцию на программное обеспечение, чтобы обеспечить значение средней интенсивности всего изображения (в представлении Histo вкладки площади экрана). Отрегулируйте длину волны (несколько нм), то х, у, г позиции фокусировки луча, чтобы максимизировать величину средней интенсивности.
6. Вложение пути света линии задержки
- Поскольку конечная система предназначена для не-физиков, заключите путь света линии задержки с трубками или коробку шкафа, чтобы избежать прямого доступа к вредным невидимом высокой пиковой мощности лазерного луча. Позаботьтесь, чтобы обеспечить доступ к стадии переводарегулятор.
7. Длина волны Тюнинг для автомобилей
- С помощью уравнения
 чтобы настроиться лазерные длины волн до желаемой вибрации комбинационного рассеяния. Чтобы воспроизвести результаты , представленные в этой работе АВТОМОБИЛЕЙ сигнал изображения от СН - связей , имеющих валентного колебания 3015 см -1, выберите λ Ti: сапфировый = 830 нм и λ = ОРО 1095 нм.
чтобы настроиться лазерные длины волн до желаемой вибрации комбинационного рассеяния. Чтобы воспроизвести результаты , представленные в этой работе АВТОМОБИЛЕЙ сигнал изображения от СН - связей , имеющих валентного колебания 3015 см -1, выберите λ Ti: сапфировый = 830 нм и λ = ОРО 1095 нм.
Примечание: Raman характеристические частоты колебаний , наблюдаемые в биологических образцах, таких как вода, Н связь можно найти в Evans и др 13 или в Ellis и др. 29.. - С помощью уравнения
 для определения длины волны излучения сигнала КАРС. Для визуализации CH связи легковыми автомобилями, выбирают узкополосный фильтр при 670 нм , так как Х МАШИН = 670 нм с длиной волны лазера представлены в 7.1.
для определения длины волны излучения сигнала КАРС. Для визуализации CH связи легковыми автомобилями, выбирают узкополосный фильтр при 670 нм , так как Х МАШИН = 670 нм с длиной волны лазера представлены в 7.1.
Примечание: Приложение мобильный телефон прailable вычислить Л - кары от λ P и λ S значения (см ссылку 30).
8. Наблюдение сигнала КАРС и окрашивали миелина от седалищного нерва Cuts
Примечание: Все эксперименты на животных были проведены в соответствии с институциональными нормами.
- Подготовьте осевые и продольные разрезы седалищного нерва на предметное стекло микроскопа , как представлено в Ozcelik и др. 31.
- Подготовьте fluoromyelin красное окрашивание раствора путем разбавления исходного раствора в 300 раз в PBS. Наводнение нервные разрезы с окрашивающим раствором в течение 20 мин при комнатной температуре. Удалить раствор и промыть 3 раза в течение 10 минут с PBS.
- Поместите разрезы под целью погружения в воду 20X. Поместите покровное. Добавьте несколько капель PBS, чтобы погрузить цель и отрегулировать фокус объектива, чтобы получить четкое изображение прорезает окуляров (как ранее подробно описано в разделе 4.2).
- В Track 1, выберите Ti: Sapphire и ОРО лазеров и определить их длину волны 830 нм и 1095 нм, соответственно. В окне Light Path, выберите PMt1 и зеленый цвет.
- В Track 2, выберите Opo лазер только (длина волны в 1095 нм). В окне Light Path, выберите PMT4 и красный цвет.
- Для обоих лазеров выберите низкое энергопотребление и установите усиление на 600 для начала. Включите лазерного сканирования и настроить следующие параметры для улучшения АВТОМОБИЛИ и сигнала флуоресценции контрасты: значения мощности, этап перевода ручки (очень немного), длины волн (несколько нм) яркости дисплея.
- Для записи окончательных изображений с высоким разрешением, выберите в инструменте режиме обнаружения следующих параметров: размер кадра 1,024 пикселей, скорость сканирования 7, усреднение 4. Нажмите на кнопку Привязать для записи одного изображения. Сохранить изображение в виде фирменнойпри записи изображения и полные параметры сбора данных.
9. Наблюдение АВТОМОБИЛЕЙ и SHG сигналы от седалищного нерва Cuts
- Подготовьте седалищный нерв , как представлено в Ozcelik и др. 31.
- Следуйте процедуре, как описано в части 8, чтобы получить изображение через окуляры и выбрать CARS параметр сигнала (Track 1).
- В Track 2, выберите Opo лазер только (длина волны в 1095 нм). В окне Light Path, выберите PMT3 и пурпурного цвета.
- Следуйте процедуре, как описано в части 8, чтобы переключиться на лазерного сканирования и сохранения изображений с высоким разрешением.
Access restricted. Please log in or start a trial to view this content.
Результаты
Частота импульсов стандартного Ti: сапфирового лазера обычно составляет около 80 МГц. ОПО имеет ту же частоту, так как она накачанной титан-сапфирового лазера. Быстрый осциллограф, по меньшей мере, 200 МГц, поэтому требуется. Быстрый фотодиод в диапазоне также требуетс...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Самой сложной частью работы является временная синхронизация лазерных лучей. Это требует быстрого фотодиода в сочетании с быстрым осциллографом, но только грубое совмещение во времени, может быть выполнена в первую очередь. Затем требуется дополнительное регулирование нескольких см...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
The authors want to thank Dr. Philippe Combette (IES, UM, Montpellier, France) for the loan of the fast oscilloscope and acknowledge financial supports from Montpellier RIO Imaging (MRI). HR acknowledges ANR grants France Bio Imaging (ANR-10-INSB-04-01) and France Life Imaging (ANR-11-INSB-0006) infrastructure networks for coherent Raman imaging developments. This work was mainly supported by an European Research Council grant (FP7-IDEAS-ERC 311610) and an INSERM - AVENIR grant to NT.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Oscilloscope | Tektronix | TDS 520D | 500 MHz |
| Photodetector | Thorlabs | DET08C/M, T4290 | 5 GHz InGaAs, 800 - 1,700 nm |
| Ti:Sapphire laser Chameleon Ultra Family II | Coherent | ||
| Optical parametric oscillator OPO Compact Family | APE Berlin | ||
| Axio Examiner microscope LSM 7 MP | Carl Zeiss | ||
| Motorized periscope | Newport | ||
| Objective W Plan-Apochromat 20X/1.0 | Carl Zeiss | ||
| Beam combiner | Carl Zeiss | ||
| Acousto-optic modulator | Carl Zeiss | ||
| OPO power attenuator | Carl Zeiss | ||
| Photomultiplier tube | Carl Zeiss | ||
| ZEN software | Carl Zeiss | ||
| Bandpass filters | Carl Zeiss | LSM BiG 1935-176 | 400 - 480 nm; 500 - 550 nm; 465 - 610 nm |
| Dichroic mirror | Carl Zeiss | Cutoff wavelength 760 nm | |
| Silver mirrors | Newport | 10D20ER.2 | λ/10, 480 - 20,000 nm, Quantity 4 |
| Single-axis translation stage with standard micrometer | Thorlabs | PT1/M | Quantity 1 |
| Aluminium breadboard | Thorlabs | MB1015/M | Quantity 1 |
| Mirror mount | Thorlabs | KMSS/M | Quantity 4 |
| Mirror holder for Ø1" Optics | Thorlabs | MH25 | Quantity 4 |
| Iris diaphragms | Thorlabs | ID8/M | Quantity 3 |
| Protective box | Thorlabs | TB4, XE25L900/M, T205-1.0, RM1S | Quantity 1 |
| Optical posts | Thorlabs | TR40/M, PH50/M, PH75/M, BA2/M | Quantity 8 (lengths depending on the set-up) |
| 661 - 690 nm bandpass filter | Semrock | 676/29 nm BrightLine® single-band bandpass filter | Quantity 1 |
| Fluorescent beads | ThermoFisher | TetraSpeck™ Fluorescent Microspheres Size Kit | |
| Laser viewing card | Thorlabs | IR laser viewing card | |
| Laser safety glass | Newport | LV-F22.P5L07 | |
| FluoroMyelin™ Red Fluorescent Myelin Stain | ThermoFisher | F34652 |
Ссылки
- Valeur, B., Berberan-Santos, M. N. Molecular Fluorescence: Principles and Applications. , 2nd Edition, Wiley-VCH Verlag GmbH. (2012).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Moreaux, L., Sandre, O., Mertz, J. Membrane imaging by second-harmonic generation microscopy. JOSA B. 17 (10), 1685-1694 (2000).
- Zoumi, A., Yeh, A., Tromberg, B. J. Imaging cells and extracellular matrix in vivo by using second-harmonic generation and two-photon excited fluorescence. Proc. Natl. Acad. Sci. USA. 99 (17), 11014-11019 (2002).
- Yelin, D., Silberberg, Y. Laser scanning third-harmonic-generation microscopy in biology. Opt. Express. 5 (8), 169-175 (1999).
- Campagnola, P. J., Millard, A. C., Terasaki, M., Hoppe, P. E., Malone, C. J., Mohler, W. A. Three-dimensional high-resolution Second-Harmonic Generation imaging of endogenous structural proteins in biological tissues. Biophys. J. 81 (1), 493-508 (2002).
- Olivier, N., et al. Cell lineage reconstruction of early zebrafish embryos using label-free nonlinear microscopy. Science. 329 (5994), 967-971 (2010).
- Farrar, M. J., Wise, F. W., Fetcho, J. R., Schaffer, C. B. In vivo imaging of myelin in the vertebrate central nervous system using third harmonic generation microscopy. Biophys. J. 100 (5), 1362-1371 (2011).
- Lim, H., Sharoukhov, D., Kassim, L., Zhang, Y., Salzer, J. L., Melendez-Vasquez, C. V. Label-free imaging of Schwann cell myelination by third harmonic generation microscopy. Proc. Natl. Acad. Sci. U.S.A. 111 (50), 18025-18030 (2014).
- Strupler, M., Pena, A. M., Hernest, M., Tharaux, P. L., Martin, J. L., Beaurepaire, E., Schanne-Klein, M. C. Second harmonic imaging and scoring of collagen in fibrotic tissues. Opt. Express. 15 (7), 4054-4065 (2007).
- Cheng, J. X., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: Instrumentation, theory, and applications. J. Phys. Chem. B. 108 (3), 827-840 (2004).
- Volkmer, A. Vibrational imaging and microspectroscopies based on coherent anti-Stokes scattering microscopy. J. Phys. D: Appl. Phys. 38, R59-R81 (2005).
- Evans, C. L., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: chemical imaging for biology and medicine. Annu. Rev. Anal. Chem. 1, 883-909 (2008).
- Mukamel, S. Principles of nonlinear optical spectroscopy. , Oxford University Press. New York. (1995).
- Duncan, M. D., Reintjes, J., Manuccia, T. J. Scanning coherent anti-Stokes Raman microscope. Opt. Lett. 7 (8), 350-352 (1982).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering. Phys. Rev. Lett. 82 (20), 4142-4145 (1999).
- Folick, A., Min, W., Wang, M. C. Label-free imaging of lipid dynamics using Coherent Anti-Stokes Raman Scattering (CARS) and Stimulated Raman Scattering (SRS) microscopy. Curr. Opin. Genet. Dev. 21 (5), 585-590 (2011).
- Wang, P., Liu, B., Zhang, D., Belew, M. Y., Tissenbaum, H. A., Cheng, J. X. Imaging lipid metabolism in live Caenorhabditis elegans using fingerprint vibrations. Angew. Chem. Int. Ed. Engl. 53 (44), 11787-11792 (2014).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annu. Rev. Phys. Chem. 62, 507-530 (2011).
- Cheng, J. X., Jia, Y. K., Zheng, G., Xie, X. S. Laser-scanning coherent anti-Stokes Raman scattering microscopy and applications to cell biology. Biophys J. 83 (1), 502-509 (2002).
- Chiu, W. S., Belsey, N. A. N., Garrett, L., Moger, J., Delgado-Charro, M. B., Guy, R. H. Molecular diffusion in the human nail measured by stimulated Raman scattering microscopy. Proc Natl. Acad. Sci. U.S.A. 112, 7725-7730 (2015).
- Chen, X., Grégoire, S., Formanek, F., Galey, J. -B., Rigneault, H. Quantitative 3D molecular cutaneous absorption in human skin using label free nonlinear microscopy. J. of Control. Release. 200, 78-86 (2015).
- Kano, H., Hamaguchi, H. In vivo multi-nonlinear optical imaging of a living cell using a supercontinuum light source generated from a photonic crystal fiber. Opt. Express. 14 (7), 2798-2804 (2006).
- Brustlein, S., Ferrand, P., Walther, N., Brasselet, S., Billaudeau, C., Marguet, D., Rigneault, H. Optical parametric oscillator-based light source for coherent Raman scattering microscopy: practical overview. J. Biomed. Opt. 16 (2), 021106(2011).
- Chen, H., et al. A multimodal platform for nonlinear optical microscopy and microspectroscopy. Opt. Express. 17 (3), 1282-1290 (2009).
- Yue, S., Slipchenko, M. N., Cheng, J. X. Multimodal nonlinear optical microscopy. Laser Photonics Rev. 5 (4), 496-512 (2011).
- Sun, Q., Li, Y., He, S., Situ, C., Wu, Z., Qu, J. Y. Label-free multimodal nonlinear optical microscopy reveals fundamental insights of skeletal muscle development. Biomed Opt Express. 5 (1), 158-166 (2013).
- Le, T. T., Langohr, I. M., Locker, M. J., Sturek, M., Cheng, J. X. Label-free molecular imaging of atherosclerotic lesions using multimodal nonlinear optical microscopy. J. Biomed. Opt. 12 (5), 054007(2007).
- Ellis, D. I., Cowcher, D. P., Ashton, L., O'Hagana, S., Goodacre, R. Illuminating disease and enlightening biomedicine: Raman spectroscopy as a diagnostic tool. Analyst. 138, 3871-3884 (2013).
- A•P•E Angewandte Physik & Elektronik GmbH. , Germany. Available from: http://www.ape-berlin.de/en/page/calculator (2015).
- Ozçelik, M., et al. Pals1 is a major regulator of the epithelial-like polarization and the extension of the myelin sheath in peripheral nerves. J Neurosci. 30 (11), 4120-4131 (2010).
- Heinrich, C., Hofer, A., Ritsch, A., Ciardi, C., Bernet, S., Ritsch-Marte, M. Selective imaging of saturated and unsaturated lipids by wide-field CARS-microscopy. Opt. Express. 16 (4), 2699-2708 (2008).
- Kyriakidis, N. B., Skarkalis, P. Fluorescence spectra measurement of olive oil and other vegetable oils. J. AOAC Int. 83 (6), 1435-1439 (2000).
- King, R. Microscopic anatomy: normal structure. Handb. Clin. Neurol. 115, 7-27 (2013).
- Monsma, P. C., Brown, A. FluoroMyelin Red is a bright, photostable and non-toxic fluorescent stain for live imaging of myelin. J. Neurosci. Methods. 209 (2), 344-350 (2012).
- Wang, H., Fu, Y., Zickmund, P., Shi, R., Cheng, J. X. Coherent anti-stokes Raman scattering imaging of axonal myelin in live spinal tissues. Biophys. J. 89 (1), 581-591 (2005).
- Wang, H. W., Fu, Y., Huff, T. B., Le, T. T., Wang, H., Cheng, J. X. Chasing lipids in health and diseases by coherent anti-Stokes Raman scattering microscopy. Vib. Spectrosc. 50 (1), 160-167 (2009).
- Jung, Y., Tam, J., Jalian, H. R., Anderson, R. R., Evans, C. L. Longitudinal, 3D in vivo imaging of sebaceous glands by coherent anti-stokes Raman scattering microscopy: normal function and response to cryotherapy. J. Invest. Dermatol. 135 (1), 39-44 (2015).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены