Method Article
Bir Geçirgen Membran Ekle tabanlı Enfeksiyon Sisteminin Uygulanması memeli konakçı hücreleri üzerinde salgılanan Bakteriyel Toksinler Etkilerinin Eğitim için
Bu Makalede
Özet
Burada, keratinositler üzerinde sterptolisin S, grup A streptococcus tarafından üretilen bir salgılanmış toksin etkilerini incelemek için geçirgen bir membran geçme tabanlı enfeksiyon sistemi kullanılarak bir yöntem tarif edilmektedir. Bu sistem, kolaylıkla enfeksiyon sırasında çeşitli ev sahibi hücre tipleri diğer salgılanan bakteriyel proteinlerin çalışmaya uygulanabilir.
Özet
Birçok bakteriyel patojenler güçlü toksinler konakçı hücrelerde sinyal değişiklikleri başlatmak için ya da enfeksiyon sırasında bağışıklık sistemi yanıtlarını işlemek için, konakçı doku yıkımına yardımcı olmak için salgılarlar. Yöntemleri başarıyla arındırmak için geliştirilmiş ve bu önemli virülans faktörlerinin çoğu üretmek edilmiş olsa da, hala kimin benzersiz yapı veya geniş post-translasyonel modifikasyonlar arındırmak ve in vitro sistemlerde çalışmaya zorlaştıran birçok bakteriyel toksinler vardır. Ayrıca, saf toksin elde edilebilir bile, ilgili fizyolojik koşullar altında bir toksinin belirli etkilerini araştırmak ile ilgili pek çok sorun vardır. Ev sahibi hücreleri üzerinde salgılanan bakteriyel toksinlerin etkilerini değerlendirmek için tasarlanmış vitro hücre kültürü modelleri en toksinin bir defalık bir dozla konakçı hücreleri inkübe barındırır. Bu tür yöntemler kötü toksin sürekli tarafından üretilen bir enfeksiyon sırasında aslında ne konakçı hücreler deneyim yaklaştığıBakteriyel hücreler ve enfeksiyon süresince tedricen birikmesine izin verdi. Bu protokol, insan epitel keratinositler üzerinde sterptolisin S, grup A streptococcus tarafından üretilen bir toksin, etkilerini incelemek için geçirgen bir membran geçme bazlı bakteriyel enfeksiyon sistem tasarımını tarif eder. Bu sistem daha yakından saf toksin veya bakteri süpernatantlar doğrudan hücrelere barındırmak için uygulanan yöntemlerden daha bir enfeksiyon sırasında doğal fizyolojik bir ortam taklit eder. Önemli olarak, bu yöntem, bakterilerin ve konak hücreleri arasında doğrudan temas nedeniyle ana yanıtlarının önyargı ortadan kaldırır. Bu sistem etkin bir şekilde ev sahibi membran bütünlüğü, hücresel canlılığı ve hücresel sinyal yanıtları Streptolizin S (SLS) etkilerini değerlendirmek için kullanılmıştır. Bu teknik, hali hazırda, bir salgılanan bakteriyel faktör D ile spesifik rolünü araştırmak için, memeli konakçı hücre türleri çeşitli başka salgılanmış hastalık oluşturma faktörlerinin çalışmaya uygulanabilirenfeksiyonu esnasında uring.
Giriş
konakçı hücre, enfeksiyon bağlamında bakteriyel hastalık oluşturma faktörlerinin fonksiyonunun anlaşılması bakteriyel hastalık oluşumunun araştırmalar için önemli bir odak noktasıdır. 10 - Birçok bakteriyel patojenler aktif konak hücrelerde sinyal değişiklikleri başlatmak için veya enfeksiyon 1 seyri sırasında bağışıklık sistemi yanıtlarını işlemek için, konakçı doku yıkımına yardımcı olmak için toksinlerin ve diğer çözünür faktörler salgılar. Yöntem başarılı bir şekilde temizlemek için geliştirilmiş ve çalışma için bu önemli hastalık oluşturma faktörlerinin çok üretmek edilmiş olmasına rağmen, bazı bakteriyel ürünler in vitro sistemlerde kullanılan izole çal edilemez ve böylece saflaştırma yöntemleri için de dirençli aday yapmak ve benzersiz yapıları veya yaygın post-translasyonel değişikliklere sahip . Örneğin, Grup A Streptokok, farenjit gelen nekrotizan fasiit ve toksik şok sendromu arasında değişen enfeksiyonların sayısız sorumlu bakteri patojen, bir salgılanan üretir17 - sterptolisin S (SLS) 11 olarak bilinen bakteriyel toksin. Bu ribosomally üretilen peptit sterptolisin S ilişkili geni (SAG) küme tarafından kodlanan ve olgun ürün boyutu 14 2.7 kDa olduğu tahmin edilmektedir - 17. 17 - Saga tarafından kodlanan protoksin, olgun, fonksiyonel formu 15 üretmek için çeşitli enzimler (SAGB, SagC ve SagD) tarafından translasyon sonrası modifiye edilir. Toksinin olağandışı amino asit dizisi ile birleştiğinde bu post-translasyonel modifikasyonlar karmaşıklığı 15,17 bugüne kadar denenmiştir tüm arıtılması ve yapısının açıklanması çabaları ile uyumsuz toksin kılmıştır. Bu sorunlar konak patogenezinde bu toksin özel rolünü belirlemek için karmaşık çabaları var.
saflaştınldı toksinlerin veya diğer salgılanan faktörler hazırlanması mümkün kompleks değil ya da durumlarda için mekanizmalar olarak20 - Bu ürünlerin işlevi geleneksel sonra hücreler 18 barındırmak için uygulanan filtre edilmiş bakteriyel yüzen, hazırlanması yoluyla incelenmiştir açıklamak. Bu teknik ile ilişkili çeşitli zorluklar vardır. saklanır ve daha sonraki bir zamanda konukçu hücrelere uygulandığında şeyden önce, SLS dahil olmak üzere bu salgılanan faktörler, birçok maksimal ya da tutarlı aktivitesi muhafaza yoktur. süpernatanlar tek bir zaman noktasında toplanan ve daha sonra konakçı hücreleri uygulanır, ayrıca, fizyolojik belirlemek üzere ve salgılanan faktörler enfeksiyon seyri sırasında birikmesine izin verildiği doğal enfeksiyon süreci, hakkında doğrudan sonuçlara varmak zordur fizyolojik olarak uygun konsantrasyonu. 3,8 - Bu ikinci zorluk bakteriyel süpernatantlar kullanımıyla değil, aynı zamanda bir ev sahibi hücre çalışmaları 1 saflaştırılmış toksin kullanımı için geçerlidir. Bu sorunları, geçirgen bir zar INSE gidermek içinRT-bazlı enfeksiyon sistemi uygun toksin aktivitesini muhafaza ve bakteri ve konakçı hücreler arasında doğrudan temas değişken ortadan kaldıran bir şekilde konakçı hücreler üzerinde SLS etkisi değerlendirmek için geliştirilmiştir. Bu sistemde, insan epitel hücreler, iki bölmenin taban bölmesine bir tek tabakalı yetiştirilir ve bakteri aynı kuyunun üst odasına yerleştirilir. Bir gözenekli membran (0.4 um gözenekler) salgılanan faktörler iki oda arasında değiştirilmesine olanak verir, ancak bakterilerin geçişini engelleyen, üst ve alt bölmeleri birbirinden ayırır. Bu sistem A Grubu Streptokoksik enfeksiyon sırasında doğrudan temas yoluyla oluşabilecek herhangi bir yanıt ortadan kaldırarak sadece sürekli salgılanan bakteri bileşenleri nedeniyle ev sahibi tepkilerin etkili değerlendirilmesi için izin verdi. SLS yanında diğer salgılanan bakteriyel faktörler de gözenekli bir membrandan geçebilir rağmen, vahşi tip (WT) içeren bir izogenik mutant panelin kullanımı, bir SLS knockout (ΔsagA) ve destan tamamlanmaktadır suş (ΔsagA + SAGA) kesinlikle SLS bağımlı 21 olan ev sahibi tepkilerin kesin değerlendirme için izin verir.
Benzer geçirgen zar uç sistemler salgılanan viral enfeksiyonlar dahil faktörler, kanser biyolojisi ve immün hücre göçü 22 çalışması için kullanılmış olmasına rağmen - konakçı hücreler, bakteriyel etkileşimi içeren 26 birkaç çalışmada bu yaklaşım 6,27,28 kullanmışlardır. Bakteri ve konakçı hücreler arasındaki etkileşimleri keşfetmek için bu sistemleri kullanmışlardır da çalışmaları esas olarak geçirgen zar ekleme üzerine kaplanmış bir epitelial veya endotelial tek tabaka ile iltihap hücrelerinde ya da bakterilerin göç odaklanmıştır. Burada tarif edilen geçirgen zar uç tabanlı enfeksiyon sistemi effe değerlendirmek için bir gözenekli zar ile bakteri ve konak hücrelerin ayrılmasına dayanan bir basit ve etkili bir yöntemdirev sahibi membran bütünlüğü, hücresel canlılığı, hücresel sinyal iletimi ve salgılanan konak hücre faktörlere salgılanan toksin, SLS, bir cts. Bu teknik, bir enfeksiyonun boyunca belirli bir bakteriyel etken rolünü araştırmak için, memeli konakçı hücre türleri çeşitli başka salgılanmış hastalık oluşturma faktörlerinin çalışmaya adapte edilebilir.
Protokol
1. Bakteriyel kültür
- Izogenik mutant türünü oluşturmak ilgi 21 spesifik salgılanan faktörü çalışma için kullanılır.
Not: söz Bu deneyler için kullanılan GASM1T1 5448 suşları WT GAZ ', bir destan Δ kedi (Δ destan olarak metinde kısaltılır) SLS-eksikli mutant ve destan tamamlanmaktadır suş 21 (Δ destan + destan olarak metinde kısaltılır). - ilgi bakteri suşlarının bir gece sıvı kültürleri hazırlanır. önceden insan hücrelerini enfekte etmek 16-20 saat boyunca 37 ° C'de gaz M1T1 Todd-Hewitt lapası -10 ml 5448 suşları büyütün.
- taze bakteri ortamda Santrifüj gecede bakteri kültürleri (10 dakika 2400 RCF) ve tekrar süspansiyon.
Not: aynı hacimde yeniden süspansiyon gece boyunca kültürler (5-10 mi) içinde büyütüldü, genel olarak arzu edilen bir ilk optik yoğunluk verir. - bakteriyel kültürler normalizeTüm suşlar (OD değeri yaklaşık 1.0, 600 kolaylık için tavsiye edilir) test edilecek olan 600 nm (OD 600) de, aynı optik yoğunluğa kadar daha fazla bakteriyel ortam içinde yeniden süspansiyon haline getirildi kültürleri seyreltilmesiyle eşit bir başlangıç konsantrasyonu elde edilir.
Not: Bu çalışmalarda, sabit faz bakteriyel kültür hemen normale Aşağıdaki konakçı hücreleri enfekte etmek için kullanıldı. Ancak, bakteri çıkış sabit faz bazı suşları olarak nonsynchronously ilgi suşları için durum tespit edilmesi halinde log fazı kültürleri ile konak enfeksiyonları başlamak için daha uygun olabilir. - daha fazla analiz öncesinde, enfeksiyon (MOI), veya konakçı hücre başına bakteri oranı tespit edilebilir, böylece başlangıç kültürünün mililitre mevcut başına koloni oluşturan birim (CFU) belirlenmesi için tahlil sayan bir koloni gerçekleştirin.
- 1 ml arzu edilen bir optik DENSI normalize edilmiş bakteri kültürlerinin seri dilüsyonları hazırlanmasıty fosfat tamponlu tuzlu su (PBS) ya da uygun bir bakteriyel büyüme ortamında (Todd-Hewitt brotu bu çalışmalarda kullanıldı). Sayılabilir koloniler (30-300 koloni) agar levhalarının en az bir görüntü seti üretmek üzere 10 -1 -6 ila 10 arasında değişen dilüe. üç nüsha olarak tüm dilüsyonları gerçekleştirin.
- bakteri türleri için uygun bir ortam ihtiva eden bir agar plaka üzerine analiz edilen her seri seyreltme 100 ul aktarın.
Not: Todd-Hewitt agar bu çalışmalarda kullanıldı. - eşit agar levhasının tüm yüzeyi boyunca 100 ul tablet dağıtma, sıvı agar emilene kadar yayılan devam etmek için bir cam ya da plastik bakteriyel yayıcı kullanın. Steril teknik kullanılarak, alev altında gerçekleştirin.
- bir gecede ya da sayılabilir koloniler görünene kadar 37 ° C'de agar inkübe edin.
- Her plaka üzerinde büyümek koloniler sayın ve aşağıdaki Formu orijinal kültüründe CFU / ml hesaplamakla: kolonilerin sayısı mililitre kaplama seri seyreltme / kültür hacminin tersini x.
örneğin (200 koloni x 1/10 -5 seyreltme) / = 2.0 x 10 8 CFU / ml kaplı 0.1 ml
2. Ana Hücre Kültürü
- İstenen analizler için uygun bir konakçı hücre hattı elde edilir.
Not: HaCaT insan epitel keratinositler 29, V. NIZET bir tür hediye, bu çalışmalar için kullanılmıştır.- % 10 ısı ile inaktive edilmiş fetal büyükbaş hayvan serumu ile Dulbecco Modifiye Eagle Ortamı (DMEM) (FBS) içinde, 100 mm kültür tabaklanna HaCaT hücreleri koruyun. % 5 CO2 ile 37 ° C'de inkübe edilir.
Geçirgen Membran insert, sistemin 3. Ana hücre enfeksiyon
- onlar% 90 confluency ulaşana kadar uygun doku kültürü yemekleri Levha hücreleri ve onları büyümeye olanak sağlar.
Not: Genellikle 2-3 gün içerisinde confluency ulaşmak bu çalışmalarda kullanılan HaCaT hücrelerisonra kaplama ays.- Lizat toplanması için (örneğin, bir analiz ve adenosin trifosfat (ATP) tayini testleri sinyal), / oyuk yaklaşık olarak 3 x 10 5 hücre ilk önce tohum ekme yoğunluğu 6 oyuklu tabaklarda HaCaT hücreleri plaka.
- / Oyuk yaklaşık olarak 3 x 10 5 hücre ilk önce tohum ekme yoğunluğu 6 oyuklu tabaklara olan steril cam lameller üzerine immünofloresan görüntüleme deneyleri, levha hücreleri için.
- Etidyum homodimer membran geçirgenliği ve laktat dehidrojenaz (LDH) salım deneyleri için, / oyuk yaklaşık 5 x 10 4 hücrelerinin bir çekirdek yoğunluğunda 24 oyuklu tabaklarda HaCaT hücreleri plaka.
- Tedaviye hemen önce, 1 x steril PBS ile yıkama hücreleri.
- hücrelere taze büyüme ortamı uygulayın. Burada tarif edilen koşullar için, 6 yuvalı plakalar veya 24 kuyucuğu için oyuk başına 0.5 mi orta oyuk başına 2 ml'lik ortam uygulanır. farmakolojik tedaviler test ediliyor ise, taze ortam ile karıştırın ve bu ste sırasında uygulamaks.
Not: Bazı tahliller alternatif medyayı gerektirebilir. Örneğin, fenol kırmızı ve yüksek serum konsantrasyonları LDH salınımı testi ile müdahale, fenol kırmızısı içermeyen DMEM% 1 sığır serum albümini (BSA) (ağ / hac), 2 mM L-glutamin ile takviye edilmiş, ve 1 mM sodyum piruvat oldu bu deneyler için kullanılan. - taze ortam uygulandıktan sonra, dikkatli bir şekilde her bir steril bir 0.4 um geçirgen zar ekleme yerleştirin. bir laminar akış başlığı içinde Bu adım, ve de her birine geçirgen zar ekleme aktarmak için steril forseps kullanır.
- üreticinin talimatlarına uygun olarak her bir üst bölmesi taze hücre kültür ortamı uygulanır. Burada tarif edilen koşullar için, 6 yuvalı plakalar veya 24 kuyucuğu için oyuk başına 0.1 mi orta oyuk başına 1 mi ortam uygulanır.
- geçirgen zar insert, sistemin üst bölmeye normalize bakteriyel kültürler (bakınız bölüm 1) uygun bir hacimde uygulanır. enfekte edilmemiş Contr bakteriyel ortamı kullanınol tedaviler. Burada tarif edilen sonuçları elde etmek için, 24 yuvalı plakalar ile bölme başına normalize kültürler 25 ul, 6 kuyucuğu için her bölmede kültürlerin 100 ul ilave edin.
Not: Bu çalışmalarda, vahşi tip veya mutant GAZ konukçu hücrelere uygulandı 10. İçişleri Bakanlığı bir İçişleri Bakanlığı nihai ökaryotik hücre sayıları ile hesaplanmıştır de (örneğin 2 x 10 6 hücre / kuyu) 10 kat daha fazla bakteri enfeksiyonu döneminin başında (örneğin 2 x ev sahibi hücre başına eklenen şekilde, oyuk başına 10 7 cfu). Uygun MOI farklı bakteri türleri ve istenen takip analizi ile değişecektir.
Not: enfekte olmamış kontrollere, ısı ile öldürülmüş bakterilerin veya karşılaştırma için harcanan bakteriyel ortamını içerebilir, bu tekniğin bazı uygulamalar için diğer yararlı kontrol bakteriyel ortamı kullanılarak ek olarak. - % 5 CO2 ile 37 ° C 'de enfekte hücreler inkübe edin.
4. Örnek Toplama
- Dikkatle steril forseps ile geçirgen zar inserti kaldırarak başlayacaktır analizleri takip için sağlam hücreler ile hücre kültür ortamı, konakçı hücre lizatları veya cam lamelleri toplamak.
- Salgılanan Ana Protiens Değerlendirilmesine için:
- 1.5 ml tüpler içinde Alt bölmeden alınan orta toplayın. toplama sırasında tek tabaka rahatsız etmemek.
- 4 ° C'de 10 dakika 14,000 RCF örnekleri Santrifüj selüler artığın ayrılması için.
- -20 ° C'de yeni bir 1.5 ml'lik tüp ve saklamak için süpernatan 50 ul ama kaldırmak veya hemen kullanın.
- Ana Hücre Lystates Değerlendirme:
- Yavaşça konak hücrelerin tek tabaka üzerinde orta aspire. Bu örnek kaybına neden olabilir, tek tabaka rahatsız etmemek.
- 1x PBS ile bir kez hücreler durulayın.
- Yavaşça PBS aspire. Hemen istenen protein konsantrasyonu elde etmek için buz-soğuğu liziz tamponu uygun bir hacim uygulanır ve inkübe15 dakika boyunca buz üzerinde örnekler. 0.5 ve 1.5 mg / ml arasında, protein konsantrasyonları elde etmek için 200 ul her bir 6 yuvalı plaka her bir oyuk başına liziz tamponunda 350 ul arasında uygulanır.
Not: Bu çalışmalarda kullanılan parçalama tampon deiyonize su oluşmaktadır,% 1 (h / h) Nonidet P40 Yedek bir fosfataz inhibitörü kokteyl ve bir proteaz inhibitör kokteyli. Belirli reaktifler Malzemeler ve Ekipmanları bölümünde listelenmiştir. - her bir plaka yüzeyinden hücreleri ayırmak için bir hücre kazıyıcı kullanın ve iyi bir 1.5 ml tüp içine her tüm içeriğini pipetle.
- Santrifüj örnekleri 4 ° C'de 20 dakika 14,000 RCF.
- çözünür lizat bileşenlerini değerlendirmek için, -20 ° C'de yeni bir tüpe ve saklamak için süpernatant kaldırmak veya hemen kullanın.
- nükleer ya da diğer çözünmeyen lizat bileşenlerini değerlendirmek için, -20 ° C'de pelet ve mağaza rezerv ya da hemen kullanın.
- İmmünofloresan Görüntüleme tarafından Değerlendirme:
- Gibikorsan orta ve 1x soğuk PBS hücrelerin yıkayın.
- PBS içinde bir gece boyunca 4% paraformaldehit (PFA) çözeltisi içinde hücreler giderme (a / h).
Not: Bu çalışmalarda, PFA 1 mi, her 6 plaka oyuk başına ilave edildi.
5. Önerilen Uygulamalar
- SDS-Page ve Western Blot tarafından Sinyal İletimi Analizi ev sahipliği
- Bölüm 4.3 de tarif edildiği gibi konak hücre lisatlan toplayın.
- Bisinkoninik asit (BCA) deneyi veya eşdeğeri kullanılarak Protein standartlarının 30 ile her bir örnek lizat protein konsantrasyonu belirlenir.
- Yüklemeden önce ve 4-15% poliakrilamid jel veya uygun alternatif 31 örnekleri çalışan örnekler arasında protein konsantrasyonları normalleştirmek.
- Örnek hacmi - Yeni 1.5 ml tüp içine her bir örnek (örneğin 20 mikrogram) aynı protein miktarı pipetle ve değişken lizis tamponu hacimleri (tampon hacmi = toplam hacmi ekleyerek örnek konsantrasyonlarını Normaleörnekleri arasında toplam hacmi (örneğin 50 | il) ve son protein konsantrasyonuna yapmak için her bir tüpe) ilave edildi.
- poliviniliden florür (PVDF) zarı (veya eşdeğeri) aktarın örnekler. Burada tarif edilen sonuçları elde etmek için, ilave bir 45 dakika boyunca 70 volt gerilim yükseltmeden önce, 2 saat 25 volt örnekleri aktarın. 200 mM Tris baz, 1.5 M glisin ve deiyonize su içinde% 20 metanol (hac / hac) oluşan aktarım tamponu kullanın.
- Tris içinde% 5 BSA +% 0.1 Tween 20 engelleme membranlar tuzlu su (TBS) tampon. Antikor kullanılmak üzere ayarlayın buna göre üretici tavsiyelerine göre.
- gece boyunca 4 ° C 'de primer antikor ile zarları inkübe edin. üreticisinde kullanın seyreltme önerilir.
- TBS +% 0.1 Tween 20 1.5 saat membranları yıkamak; Her 10-15 dk tampon yenileyin.
- oda sıcaklığında bir 1,5 saat boyunca 5000: yaban turpu peroksidaz (HRP) ile inkübe 1 bir seyreltmede ikincil antikor ile konjüge edilmişure.
- TBS +% 0.1 Tween 20 1.5 saat membranları yıkamak; 15 dk - Her 10 tampon yenileyin.
- önceden, üretici talimatlarına uygun olarak film geliştirmek için kemilüminesans belirleme reaktifi ile zarları inkübe edin. arzu edildiği gibi diğer algılama yöntemleri de kullanılabilir.
- Sunucu Hücre İmmünofloresan Boyama ve Görüntüleme
- bölüm 4.4 de açıklandığı gibi konakçı hücreleri içeren lamelleri sabitleyin.
- Yıkamalar arasında aspire, PFA çözüm çıkarın ve PBS içinde muamele edilmiş hücreler, iki kez içeren lamelleri yıkayın.
Not: PFA son derece zehirli olan ve uygun bertaraf edilmelidir. - % 1 PBS içinde oda sıcaklığında 2 saat boyunca lamelleri bloke normal keçi serumu (w / v),% 2 (v / v) Triton X-100 ve% 0.5 (h / h) Tween 20.
- bir tampon, her 10 dakikada bir, ferahlatıcı, 30 dakika boyunca PBS ile lamelleri yıkayın.
- 1:50 oranında primer antikor ile lamelleri inkübe (ya da üretici tarafından tavsiye edildiği gibi) sol engellemeKatkı gece boyunca 4 ° C 'de.
- Her 30 dakikada bir tampon, canlandırıcı PBS içinde 1.5 saat lamelleri yıkayın.
- ikincil antikor oda sıcaklığında 2 saat boyunca inkübe lamelleri (keçi anti-tavşan IgG AlexaFluor488 bu çalışmalar için kullanılmıştır), 1 kullanılarak: çözeltisi bloke antikorun 200 oranına sahiptir.
- Yıkama tamponu, her 20 dakikada bir, ferahlatıcı, 1 saat boyunca lamelleri.
- İstenilen lekeleri uygulayın.
Not: çözümü engelleme 1.000: DAPI (nükleer leke) ve 1 oranlarında rodamin-Phalloidin (aktin leke) kullanılmıştır Bu çalışmalar. - Oda sıcaklığında 30 dakika boyunca nükleer ve aktin lekeleri lamelleri inkübe edin.
- Her 10 dakikada bir tampon, serinletici oda sıcaklığında 30 dakika boyunca PBS içinde lamelleri yıkayın.
- montaj orta kullanarak cam slaytlar lamelleri monte edin.
- lamelleri sızdırmazlık ve görüntüleme gecede önce slaytlar üzerinde ayarlamak için izin ver. Burada açıklanan sonuçlar için, bir floresan mikroskop usi görüntüleri toplamakStandart bir 20x objektif ng. Çekilen görüntüleri işlemek için ImageJ ve mikroskop görüntüleme yazılımı kullanın.
- Etidyum homodimer Hücre Ölümü Deneyi
- her bir ve steril PBS ile iki kez yıkama hücreleri aspire ortamı.
- PBS 4 mcM etidyum homodimer-1 uygulayın.
- Karanlıkta 30 dakika boyunca oda sıcaklığında inkübe hücreleri.
- 528 nm'de uyarma ve 590 nm'de bir kesim değeri ile 617 nm emisyona ayarlanmış bir plaka okuyucusu kullanılarak flüoresan seviyesini belirler.
- Saponin (w / v) her bir takip eden ilk okuma% 0.1 ekleyin ve plaka, aynı ayarlarda plaka bir kez okunmasından önce (sallanarak), oda sıcaklığında, ilave bir 20 dakika boyunca inkübe edin.
- (Post-saponin) okuyarak ikinci floresan ilk floresan okuma (tedavi sonrası) bölünmesi ile her kuyu için ayrı ayrı yüzde membran geçirgenliği belirleyin.
- ATP belirlenmesi Deneyi
- Yukarıdaki bölümde 4.3 açıklandığı gibi lizatları toplayın.
- BCA veya benzeri 30 üzerinden lizatları protein düzeylerini normale.
- Bir parlaklık tabanlı ATP belirleme kiti veya üreticinin talimatlarına göre eşdeğer kullanarak hücresel ATP düzeylerini belirlemek.
- İlgili bulaşmamış kontrol örnekleri tedavi değerlerini normalize.
- LDH salımı, Deneyi
- Bölüm 4.3 de tarif edildiği gibi enfeksiyon sonrasında süpernatanlar toplanır.
- üreticinin talimatlarına göre LDH bırakılması için bir Sitotoksite Saptama Kiti kullanılarak LDH salımını değerlendirir.
Sonuçlar
Salgılanan bakteriyel faktörler çalışma için geliştirilmiş geçirgen zar uç tabanlı enfeksiyon sistemi protokolü, bu durumda, Şekil Bu sistem, salgılanan bakteriyel faktörlerinin etkilerini değerlendirmek için, gözenekli bir membran ile bakteri ve konakçı hücrelerin ayrılmasına dayanır 1'de ayrıntılı sterptolisin S (SLS), bu ana bilgisayar membran bütünlüğü, hücre canlılığı, hücresel sinyal transdüksiyonu ve salgılanan konakçı hücre faktörleri gibi konakçı yanıtları. 2, bu sistem temas aktivasyonunda değişiklikleri değerlendirmek için kullanılabilir olduğunu gösteren temsili bir Western blot verileri sağlar Şekil -bağımsız ana sinyal proteinleri. Özel olarak, Örnek verileri önemli ölçüde SLS üreten gaz türlerinin varlığında p38 MAPK aktivasyonu, geliştirilmiş göstermektedir. Bu sistem aynı zamanda Şekil 3). Veri aktivasyon 21 üzerine sitoplazmadan çekirdeğe yer değiştirir önemli enflamatuar aracı Nükleer Faktör kappa B (NFKB) SLS bağımlı aktivasyonunu gösterir. Şekiller 2 ve 3'teki sonuçlar, hem SLS bağımlı olduğu inflamatuar sinyal tepkileri bakteri ve konakçı hücreler arasında doğrudan teması gerektirmez göstermektedir. Önceki deneyler zaten gösterdiği gibi SLS bağımlı p38 ve doğrudan enfeksiyon modellerinde 21, geçirgen zar insert tabanlı sistemde üç GAZ suşları arasında p38 veya NFKB aktivasyon benzer seviyelerde NFKB aktivasyon cevabı arasında doğrudan temas gerekli olduğunu göstermiştir olurdu bakteri ve konakçı hücreler sunar. Şekil 4, bu enfeksiyonun sistemi etidyum homodimer ve LDH salınımı deneyleri ile ana sitotoksisite toksin bağlı değişiklikleri değerlendirmek tatbik edilebilir olduğunu göstermektedir. Bu önemli bir artış i kanıtladığımembran geçirgenleştirilmesi ve SLS eksikliği gerilmeye maruz enfekte olmamış hücreler ya da hücreleri ile karşılaştırıldığında SLS içeren gaz suşları maruz konakçı hücrelerin LDH salınımı n her ikisi de. önemli bir etkisi 12 saat sonrası membran geçirgenliği durumunda enfeksiyon ve LDH salınımı durumunda 16 saat kadar belirgin değil gibi sitotoksisite bu değişiklikler, acil değildir. Örnek veriler, bu ev sahibi tepkilerin değerlendirilmesi için uygun zaman noktalarında ve enfeksiyon koşullarının seçilmesi önemini göstermektedir. Ev sahibi sinyal değişiklik ve sitotoksisite değerlendirmesi için izin vermeye ek olarak, geçirgen zar uç tabanlı enfeksiyon sistemi konakçı hücre lizatları bakteriyel kontaminasyonu engelleyerek bu konakçı ATP seviyeleri doğru belirlenmesi gibi metabolik değişimlerin incelenmesi için de geçerlidir (Şekil 5) . Bu veriler, gelişmiş ATP kaybıyla, enfeksiyondan 16 saat sonra GAZ enfeksiyona yanıt olarak keratinosit ATP önemli bir kayıp gösterir In SLS varlığı. Bu sonuçlar, bir ev sahibi stres-yanıt sinyal ve sitotoksisite gözlenen toksin bağımlı artışlar ile tutarlıdır.
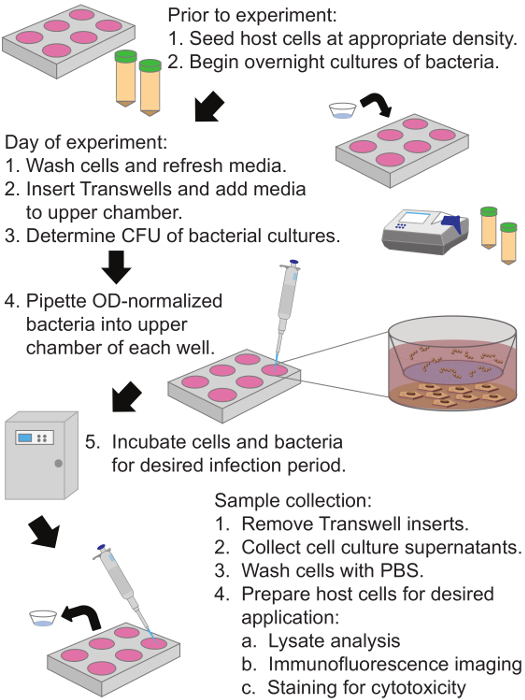
Şekil 1: Diyagram Geçirgen Membran Ekle Tabanlı Enfeksiyon Sistemi Protokolü Konak Hücreler üzerinde salgılanan Bakteriyel Faktörlerin Etkileri değerlendirmek için İnsan keratinositler alt bölmesinde kaplama ve% 90 izdiham yetiştirilmektedir.. 0.4 um gözeneklere sahip bir kollajen kaplı membran üst ve alt bölmeleri ayıran ve bakteri istenen enfeksiyonu süreyle geçirgen zar insert, sistemin üst bölmeye eklenir. Hücre kültürü süpernatanları ve konakçı hücreler enfeksiyon dönemini takiben toplanan ve analiz çeşitli kullanılabilir. Büyük halini görmek için tıklayınızbu rakamın.
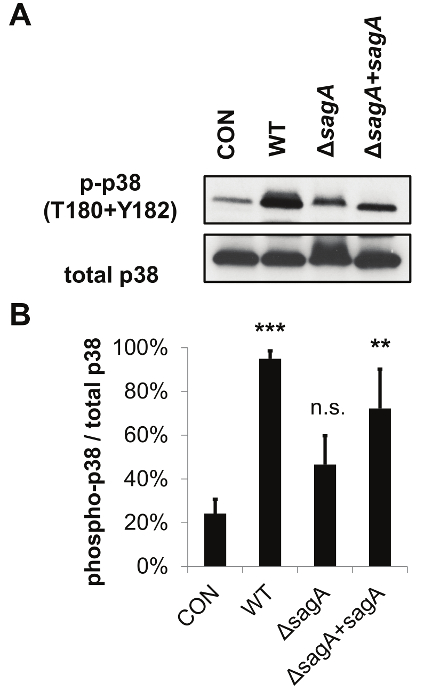
Şekil 2:. Geçirgen membran yerleştirin Tabanlı enfeksiyon sistemi, SDS-PAGE ve Western blotting ile ana hücre lizatı Analiz için kullanılabilir Örnek veriler SLS'nin enfekte keratinositlerinde p38 MAPK yolağının aktivasyonunu göstermektedir. (İB 10 = en) (A) HaCaTs geçirgen zar uç enfeksiyonu sistemi ile 7 saat için gaz ile enfekte edilmiş ve lisatlar, p38 aktivasyonu için değerlendirildi. Üç bağımsız Western Blots (B) Dansitometri GAS'infection yanıt olarak p38 göreli aktivasyonunun ölçülmesi için yapıldı. Üç biyolojik çoğaltır Ortalamalar standart sapmayı temsil hata barları ile gösterilir. p38 göreceli aktivasyonu fosforile / toplam protein düzeyi olarak temsil edilir. İstatistiksel anlamlılık göre belirlendiEnfekte olmamış hücreler. Genel olarak, p-değeri, ANOVA (p = 0.0063) ile belirlenmiştir. Dunnett testleri ortalama tekabül bulaşmamış kontrolü için her koşul karşılaştırmak için post hoc yapıldı. * P = 0.01-0.05; ** P = 0,001-0,01; *** P = 0,0001-0,001; ****, P <0.0001. Bu rakam Flaherty ve ark., 2015 21 modifiye edilmiştir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
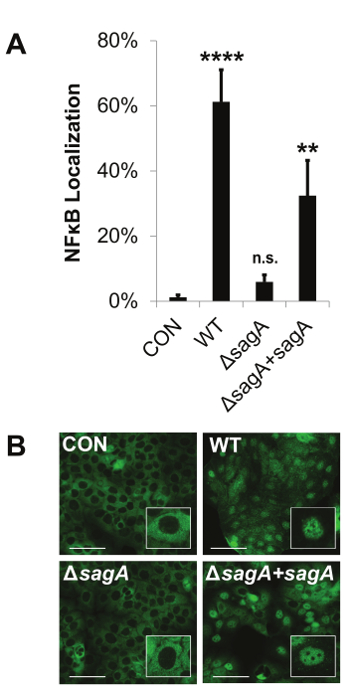
Şekil 3:. Geçirgen Membran Ekle Tabanlı Enfeksiyon Sistemi İmmünofloresan Mikroskopi Host Sinyal Değişikliklerin Görselleştirme için izin verir temsilci veri Streptolizin S NFKB aktivasyonu yoluyla pro-enflamatuar sinyalizasyon artırdığını göstermektedir. HaCaT insan keratinositler bir M de GAS ile enfekte edildi geçirgen zar uç tabanlı enfeksiyon sistemi kullanılarak 8 saat 10 OI. NFKB (A ve B) nükleer lokalizasyon immünofloresan görüntüleme ile değerlendirildi. Nükleer lokalize hücre yüzdesi NFKB, belirli bir alan için sitoplazmadan çekirdeğe transloke sahip olduğu hücre sayısının sayılması ve aynı alanda hücrelerin sayısı ile bu sayı bölünmesi ile elde edilmiştir. Ölçek çubukları 100 um göstermektedir. (A) üç biyolojik çoğaltır ortalama standart sapma temsil hata barları ile her durum için temsil edilir. Genel olarak, p-değeri, ANOVA ile belirlenmiştir; p <0.0001. Dunnett testi gelen enfekte olmamış kontrol koşulu, her bir durum karşılaştırma yapıldı. * P = 0.01-0.05; ** P = 0,001-0,01; *** P = 0,0001-0,001; ****, P <0.0001. Bu rakam Flaherty'ye ve ark., 2015 21 modifiye edilmiştir./ftp_upload/54406/54406fig3large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.

Şekil 4:. Geçirgen Membran Ekle Tabanlı Enfeksiyon Sistemi Bakteri ve Host Hücreler arasında doğrudan temas yokluğunda Bakteriyel-Aracılı membran geçirgenliği ve Sitotoksitenin belirlenmesi için izin verir temsilci veri keratinosit canlılığı aktif SLS toksin varlığı azaldığını göstermektedir . GAZ - indüklenmiş hücre ölümü WT mevcudiyetinde HaCaT hücrelerinde değerlendirildi SLS eksikliği ya Saga GAS tamamlanmaktadır Keratinosit 10 MOl'de (8-16 saat boyunca geçirgen zar uç tabanlı enfeksiyon sistemi kullanılarak gaz maruz bırakılmıştır. A) Canlılık etidyum homodimer deneyi ya da (B), LDH salınımı testi ile değerlendirildi. Her iki panelde de 3: Yenidenrumu ortalaması alınır ve Hata çubukları standart sapmayı temsil etmektedir. Her bir zaman noktası için Önemi ANOVA (A) 8 saat, p = 0.0241 ile belirlenmiştir; 12 saat, p <0.0001 (B) 8 saat, p = 0,0287; 12 saat, p = 0,1977; 16 saat, p = 0.0031. Dunnett testi, karşılık gelen bir zaman noktası için, vahşi tipte enfeksiyondan her durumdan karşılaştırmak için yapıldı. * P = 0.01-0.05; ** P = 0,001-0,01; *** P = 0,0001-0,001; ****, P <0.0001. Bu rakam Flaherty ve ark., 2015 21 modifiye edilmiştir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
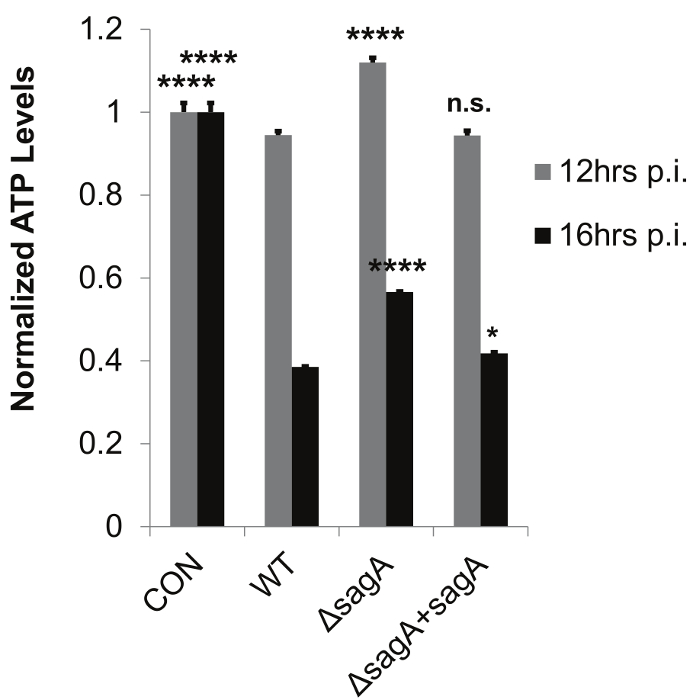
Şekil 5: Geçirgen Membran Ekle Tabanlı Enfeksiyon Sistemi BacT Önleme Host ATP Düzeylerinin Doğru belirlenmesi için izin verirAna Hücre erial Kirlilik Lizatları. temsili verileri A Grubu Streptokoksik enfeksiyon sırasında ATP SLS bağımlı kaybı göstermektedir. HaCaT hücreleri geçirgen zar uç tabanlı enfeksiyon sistemi kullanılarak 8-16 saat için gaz ile enfekte edilmiştir. Teknik çoğaltır (n = 3) tek bir temsili biyolojik tekrarında (numune başına 2 x 10 6 hücre), standart sapmayı ifade eder hata çubukları ile beraber, her bir durum için ortalama arasında. Genel olarak, p-değerleri, varyans analizi ile belirlenir (12 saat, p <0.0001, 16 saat, p <0.0001). Dunnett testi, karşılık gelen bir zaman noktası için, vahşi tipte enfeksiyondan her durum karşılaştırma yapıldı. * P = 0.01-0.05; ** P = 0,001-0,01; *** P = 0,0001-0,001; ****, P <0.0001. Bu rakam Flaherty ve ark., 2015 21 modifiye edilmiştir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tartışmalar
Burada, bir in vitro sistemde insan epitel keratinositler üzerinde bakteriyel toksin sterptolisin S etkilerini incelemek için geçirgen bir membran geçme tabanlı enfeksiyon sistemi kullanılarak bir yöntem tarif edilmektedir. Bu protokol için diğer salgılanan bakteriyel hastalık oluşturma faktörlerinin çalışma hem de alternatif bir ev sahibi hücre tipleri için uyarlanabilir. 3,8,18 - - 20 Bu yeni geliştirilen sistem saflaştırılmış toksinler veya filtrelenmiş bakteriyel üst fazlar 1 kullanan deneysel yöntemler üzerinde çeşitli avantajlar sağlamaktadır. geçirgen zar uç dayalı sistem maksimum toksin aktivitesi muhafaza edilmesini sağlar üretildiği konakçı hücreleri, ilgili bakteriyel toksin, bir sürekli muhafaza dozu sağlar ve deneyler arasındaki tutarlılık artırır. Ayrıca, bu sistem daha yakından enfeksiyon ilerledikçe salgılanan faktör zamanla birikmesine izin vererek ve Elimi tarafından fizyolojik koşullar taklitkeyfi spesifik toksin konsantrasyonları seçmek ihtiyacını engelleyecek düzeyde hücreleri barındırmak için uygulanacak. Araştırmacılar ilgi konusu bir bakteriyel etken iletişim bağımlı bir şekilde konukçu hücrelere teslim değerlendirmeye için Bundan başka, bu sistem, aynı zamanda araç sağlayacaktır. İletişim bağımlılık genellikle bağlılık ya da yapışmayı önleyici reaktif kullanımı ile yetersiz izogenik bakteriyel mutantların nesil boyunca test edilir. Burada anlatılan sistem tamamlayacak ya da bu geleneksel yaklaşımların yerine basit bir alternatif sağlayacaktır.
protokol 5. bölümünde anlatılan test uygulamalara ek olarak, diğer uygulamalar hangi kolayca adapte edilebilir, bu enfeksiyon sistemi sitokin diziler ve ELISA testleri için numune toplama dahil etmek. Bu durumların her ikisinde de, LDH salınımı deneyleri için tarif edilene benzer bir protokol takip edilebilir. Burada gösterilmemiş olan rağmen, bu sistem, etkili bir şekilde konakçı hücre örnekleri toplamak için kullanılmaktadırflow sitometri ile nalyzed. Bu uygulamada, geçirgen zar uç enfeksiyon evresinden sonra kaldırılır, hücreler hücre kültürü vasatı çıkarmak için yıkanır, ve tripsin analizleri için hücreler toplanmasına izin uygulanır. aksi akış sitometresi ile doğru hücre sayımı müdahale edebilecek yapışmış bakteri ve konakçı hücrelerde oluşan büyük agregatların oluşumunu engellemeye yardımcı olur, çünkü ana hücrelerden bakteri fiziksel olarak ayrılması, bu uygulama için özellikle yararlıdır.
Geleneksel doğrudan enfeksiyon çalışmaları ile geçirgen zar insert tabanlı enfeksiyon çalışmalarının sonuçlarını karşılaştırırken çok tutarlı konak yanıtları gözlenmiştir rağmen, bu konak tepkilerin kinetik bazı önemli farklılıklar 21 gözlenmiştir. Örneğin, ev sahibi sinyalizasyon ve membran bazlı sitotoksisite değişiklikler cor daha geçirgen zar uç tabanlı enfeksiyon modelinde ortaya uzun% 30-50 almakdoğrudan enfeksiyon modelleri yanıt. geçirgen zar uç dayalı sistem her bir üst ve alt bölmelere uygulanacak ortam gerektirdiğinden, burada tarif edilen çalışmalar için geliştirilmiş sistem iyi karşılaştırıldığında başına doğrudan enfeksiyon modelleri daha önce kullanılan karşılık gelen toplam bir ortam hacminde% 30 bir artış gereklidir 21. doğrudan temas yasak olduğu bakteri ve konak hücreler arasındaki mesafenin artması ile birleştiğinde, toplam orta hacimli bu fark, muhtemelen SLS konakçı hücrelerin ulaşmak için aracılığıyla yaygın ve gözlenen etkileri ortaya çıkarmak için gereken süreyi artırır. Ayrıca, geçirgen zar insert tabanlı sistem hücre hasarını barındırmak için katkıda bulunması olasıdır birçok GAZ virülans faktörleri ortadan kaldırır; Bu sistemde bu ek faktörlerin yokluğu da konak hücre ölümü ve doğrudan enfeksiyon 21 oranla ev sahibi sinyal olayların başlamasında gecikme katkıda muhtemeldir. Bu faktörler dikkate alınmalıdırDeney tasarlarken diğer salgılanan bakteri bileşenleri değerlendirmek için.
Konak hücreleri üzerinde salgılanan bakteri faktörlerin etkilerini test tavsiye edilir geçirgen zar insert tabanlı enfeksiyon sistemi her uygulama için zaman noktalarında bir dizi test için en anlamlı şartlarını belirlemek. Koşulları özel ilgi hastalık oluşturma faktörü en iyi şekilde başarıyla etkilerini gözlemlemek için (belirli çevresel sinyallere yanıt olarak, örneğin günlük faz durağan faz, vs.) üretilenlerin altında dikkate alınması önemlidir. Ev sahibi sinyal proteinleri değişiklikleri üzerine odaklanmış deneylerinde, SLS konakçı hücreleri ulaşmak ve sinyal 21 değişiklikleri sağlamak için yeterli miktarlarda üretilecek için yeterli süre izin verilen zaman noktalarını seçmek için gerekliydi. Aynı zamanda, gereken sinyal ev değişikliklerin değerlendirilmesi Bu etki, c, önceden SLS ile indüklenen membran geçirgenliği için yapılacakAnaliz için konakçı hücre lizatları toplanmasını omplicates. SLS ile indüklenen hücre ölümü optimal birkaç saat bildirilen sinyal olayını 21 başlandıktan sonra doğrudan ve geçirgen membran çanağının tabanlı enfeksiyon modellerinde gözlenebilir. Ayrıca, ilgi zaman noktalarını seçerek, o çalışılan bakteri çalışma döneminde gözenekli insert membran nüfuz edemiyoruz olmasını sağlamak için de önemlidir. uzun bir süre boyunca belirli bir bakteriyel bileşenlerin üretimi membran bütünlüğünü bozabilir ve alt bölme bakterilerin geçişine izin verebilir. Bu ilgi sisteminde potansiyel bir problem olup olmadığını belirlemek için, üzerinde çalışılacak olan bakteri ırkları zaman noktalarının aralığında geçirgen zar uç bazlı sisteminin üst bölmeye uygulanabilir. Her zaman noktasında, uç dikkatli bir şekilde temizlenebilir ve alt bölmeden ortam toplandı ve standart koloni CO kullanılabilirunting tahlil (bölüm 1.5 bakınız). Resim koloniler alt bölme hücre kültür ortamından oluşan ise, membran çanağı etkili bir şekilde test zaman noktasında ve bakteriyel yükte bakterilerin geçişini engelleyen olduğu kabul edilebilir.
salgılanan bakteri faktörlerin etkili analizi için optimizasyon gerektirecek muhtemelen başka bir deneysel tasarım bileşeni enfeksiyonu (İçişleri Bakanlığı) çokluğu olduğunu. İB konakçı hücre başına bakteriyel hücrelerin oranı anlamına gelir ve bu nedenle, enfeksiyon sırasında ve bakteri kolonisi oluşturan birimlerin (CFU) ile bir ev sahibi hücre konfluent etkisinde hücrelere uygulanır. Bu çalışmalarda, keratinosit hücreleri, bu hücrelerin dokunulmamış sıkı bırleşme ile uyumlu bir mono-katman oluşturmak için izin% 90 konfluansa e büyütülmüştür. incelenecek olan konakçı hücrelerin fizyolojik organizasyonu gözler önüne enfeksiyon deneyler için uygun bir konfluent seçmek gereklidir. Bir appropr keziyi bir şekilde belirlenmiş olan ortalama bir ev sahibi hücre iate sayısı, uygun bir bakteriyel CFU hesaplanan istenen MOI kapalı tabanlı olabilir. Burada tarif edilen çalışmalarda, GAS, farklı bakteri ve istenen izleme analizleri ile değişir 10. Uygun MOI bir MOI'da konukçu hücrelere uygulandı. Düşük başlangıç İçişleri Bakanlığı genellikle daha fizyolojik ilgili olduğu ve belirgin konak hücre canlılığı dramatik değişikliklerden önceki konak hücre sinyalizasyon ince değişiklikleri yakalamak için yeterince yavaş birikir ilgi bakteriyel faktörü sağlar. Daha yüksek ıslak temizleme sitotoksisite değerlendirmek çok çalışmada kullanılır, ancak bu etki, aynı zamanda, düşük MOI ile başlayan ve enfeksiyon uzun bir süre boyunca ilerlemesine izin veren ile elde edilebilir. Tüm bakteri soyları test edilmesi için izogenik mutantlar vahşi tip bakterilere kıyasla değiştirilmiş bir büyüme oranına sahip olabilir, optik yoğunluk doğal sonucu doğru bir CFU belirlenmesi önemlidir ve bu nedenle daha yüksek veya daha düşük bir CFU oyuğa ilave edilmesi gerekebilirsuşları arasındaki konak yanıtının uygun bir karşılaştırma sağlamak. çalışılan memeli konakçı hücreleri bakterileri öldürerek ya da büyümesini inhibe veya bakteri türleri arasında nonsynchronous büyüme şüphesi varsa, o da enfeksiyon dönemi sonunda nihai bakteri yükü değerlendirmek için çalışmalar yapmak yararlı olabilir yeteneğine sahiptirler durumlarda. Bu geçiren parçanın içeriğini toplamak ve işlem bölümünde 1.5 'de tarif edilene benzer bir koloni sayma tahlili yapılarak gerçekleştirilebilir.
İstenen deney için uygun boyutta kuyu seçmek, en iyi sonuçları elde etmek için önemlidir. Geçirgen zar uçlar çeşitli boyutlarda mevcuttur, ancak burada gösterilen çalışmaları için en anlamlısı 24 oyuk, 6 oyuklu doku kültürü plakaları için tasarlanmış uçlar kullanılarak gözlenmiştir. Bu ekleme boyutları steril forseps ile ele nispeten kolay ve manipülasyon kolaylığı Önleme çok önemlidirKuyunun alt bölme üst bölmeden bakterilerin istenmeyen transferi ing. konak hücre lizatları koleksiyonu içeren deneyler için, 6 kuyu yemekleri çoğu analizler için durum başına uygun bir hücre sayısını sağlamak ve örnek toplama hücre kazıyıcı karşılamak için yeterince büyüktür. Konakçı hücreler yapışkan kalır ve (örneğin, etidyum homodimer deneyi, tripan mavisiyle çıkarma deneyi), bir plaka okuyucusu üzerinde ölçülebilen bir floresan veya kolorimetrik bir boya ile işaretlenmiş olduğu sitotoksisite deneyleri için, karşılık gelen ekler ile 24 plaka kullanımı Tavsiye edilen. Hücre kültürü ortamı toplandı ve analiz edilecek olan deneyler (örneğin, LDH salımı, sitokin çalışmaları) için ya 24 küçük oyuklar tipik olarak, bu analizler için yeterli örnek hacimleri sağlamalı ve kullanımını en aza indirmek de olsa ya da 6 yuvalı plakalar kullanılabilir, Reaktifler. Genel olarak, yöntem, oldukça çok yönlü olan ve SAMPL hazırlanması için gerektiği şekilde uyarlanabilirÇok sayıda takip uygulamaları için es.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
We thank our fellow Lee Lab colleagues, who provided valuable insight and expertise that greatly assisted this research. This work was supported by the Young Innovator Award from the National Institute of Health, awarded to S.W. Lee (NIH-1DP2OD008468-01). R.A. Flaherty is supported by the Albertus Magnus Fellowship provided by Dr. Robert C. Boguslaski, and a teaching assistantship through the Eck Institute for Global Health at the University of Notre Dame.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Todd-Hewitt broth | Acumedia | 7161A | Use appropriate broth for bacterial species of interest. |
| BioSpectrometer | Eppendorf | basic model | Any UV-Vis spectrophotometer is suitable. |
| Petri Dishes | Fisher Scientific | FB0875713 | Other brands are suitable. |
| Agar | Sigma | A1296-1kg | Other brands are suitable. |
| HaCaT human epithelial keratinocytes | Gift from lab of Victor Nizet. | ||
| Dulbecco's Modified Eagle's Medium (DMEM) | Life Technologies | 11995-073 | Use appropriate media for cell line of interest. |
| Fetal Bovine Serum (FBS) | Biowest | S162H | Use appropriate media additives for cell line of interest. |
| 10 cm tissue culture dishes | Nunc | 150350 | Other brands are suitable. |
| 6 well tissue culture dishes | CytoOne | cc7682-7506 | Other brands are suitable but need to be compatible with the Corning insert. |
| 24 well tissue culture dishes | CytoOne | cc7682-7524 | Other brands are suitable but need to be compatible with the Corning insert. |
| Glass coverslips | Fisherbrand | 12-541-B | These must be autoclaved prior to use for cell plating. |
| Phosphate Buffered Saline (PBS) | Gibco | 10010-023 | |
| Phenol Red Free DMEM | Life Technologies | 31053028 | Phenol Red Free media is only required for the LDH release assay. |
| Bovine Serum Albumin (BSA) | Fisher Scientific | BP1600-100 | |
| L-glutamine | Gibco | 25030149 | Only required to supplement cell culture media for LDH release assay. |
| Sodium pyruvate | Gibco | BP356100 | Only required to supplement cell culture media for LDH release assay. |
| Collagen-coated 0.4 μm Transwell inserts (6 well) | Corning | 3540 | |
| Collagen-coated 0.4 μm Transwell inserts (24 well) | Corning | 3595 | |
| Forceps | Fisher | 3120018 | These must be sterilized with ethanol prior to handeling Transwell inserts. |
| Cell scrapers | Fisherbrand | 08-100-241 | These are only required for the collection of cell lysates. |
| Paraformaldehyde | Fisher Scientific | 04042-500 | TOXIC. This is only required for immunofluorescence imaging. |
| Bicinchoninic acid (BCA) assay kit | Pierce | 23227 | Other protein quantification assays may be used. |
| Tris-glycine 4 - 15% polyacrylamide gels | BioRad | 4561083 | Buffer system and percent polyacrylamide should be selected based on proteins of interest. |
| Electrophoresis cassette supplies | BioRad | 1658063 | Only required for Western Blotting. |
| Electrophoresis power supply | BioRad | 1645050 | Only required for Western Blotting. |
| Western blot transfer cassette | BioRad | Only required for Western Blotting. | |
| Polyvinylidene (PVDF) Membrane | EMD Millipore | IPVH00010 | Only required for Western Blotting. |
| Tween 20 | Sigma | P1379-500ml | |
| Rabbit IgG-HRP secondary antibody | Santa Cruz Biotechnology | sc2030 | The secondary antibody should be determined based on the selected method of detection. |
| Mouse IgG-HRP secondary antibody | Santa Cruz Biotechnology | sc2031 | The secondary antibody should be determined based on the selected method of detection. |
| Phospho-p38 (T180 + T182) MAPK antibody | Cell Signaling | 4511 | Select appropriate primary antibodies based on proteins of interest. |
| Total p38 MAPK antibody | Cell Signaling | 8690 | Select appropriate primary antibodies based on proteins of interest. |
| Goat anti-rabbit IgG Alexafluor 488 | Molecular Probes | A-11034 | Other secondary antibodies may be used for immunofluoresence imaging detection. |
| LumiGLO Detection Reagent | KPL | 54-61-00 | Only required for Western Blotting with detection on film. |
| Detection film | Biodot | BDB57 | Only required for Western Blotting with detection on film. |
| DeltaVision Nikon 90i fluoresence microscope | Nikon | Other fluorescence microscopes are suitable for these analyses. | |
| Normal goat serum | Thermo Scientific | 31873 | |
| Triton X-100 | Sigma | T9284-500mL | |
| DAPI nuclear stain | Cell Signaling | 4083 | Select stains based on specific immunofluorescence applications of interest. |
| Rhodamine-phalloidin actin stain | Molecular Probes | R415 | Select stains based on specific immunofluorescence applications of interest. |
| Fluoromount-G | Southern Biotech | 0100-01 | Only required for immunofluorescence imaging. |
| Ethidium homodimer 1 | Molecular Probes | E1169 | Only required for membrane permeabilization cytotoxicity assay. |
| Spectramax M5 Microplate Reader | Molecular Devices | Other microplate readers capable of detecting UV-vis, fluorescence and luminescence may be suitable. | |
| Saponin | Sigma | 47036-50G-F | Only required for membrane permeabilization cytotoxicity assay. |
| Molecular Probes ATP Determination Kit | Life Technologies | A22066 | Other kits are likely to be suitable. |
| Cytotoxicity Detection Kit for LDH release | Roche | 11644793001 | Other kits are likely to be suitable. |
| Nonidet P40 Substitute | Sigma | 74385-1L | Other suppliers are suitable. |
| HALT Phosphatase Inhibitor Cocktail | Thermo Scientific | 78420B | Other cocktails are likely to be suitable. |
| SIGMAFAST Protease Inhibitor Cocktail Tablets, EDTA-free | Sigma | S8830-2TAB | Other cocktails are likely to be suitable. |
Referanslar
- Wiles, T. J., Dhakal, B. K., Eto, D. S., Mulvey, M. A. Inactivation of host Akt/protein kinase B signaling by bacterial pore-forming toxins. Mol Biol Cell. 19 (4), 1427-1438 (2008).
- Kao, C. Y., Los, F. C. O., et al. Global functional analyses of cellular responses to pore-forming toxins. PLoS Pathog. 7 (3), e1001314(2011).
- Ma, X., Chang, W., Zhang, C., Zhou, X., Yu, F. Staphylococcal Panton-Valentine Leukocidin Induces Pro-Inflammatory Cytokine Production and Nuclear Factor-Kappa B Activation in Neutrophils. PLoS ONE. 7 (4), e34970(2012).
- Sumitomo, T., Nakata, M., et al. Streptolysin S contributes to group A streptococcal translocation across an epithelial barrier. J Biol Chem. 286 (4), 2750-2761 (2011).
- Miyoshi-Akiyama, T., Takamatsu, D., Koyanagi, M., Zhao, J., Imanishi, K., Uchiyama, T. Cytocidal effect of Streptococcus pyogenes on mouse neutrophils in vivo and the critical role of streptolysin S. J Infect Dis. 192 (1), 107-116 (2005).
- Goldmann, O., Sastalla, I., Wos-oxley, M., Rohde, M., Medina, E. Streptococcus pyogenes induces oncosis in macrophages through the activation of an inflammatory programmed cell death pathway. Cell Microbiol. 11 (1), 138-155 (2009).
- Lin, A., Loughman, J. A., Zinselmeyer, B. H., Miller, M. J., Caparon, M. G. Streptolysin S inhibits neutrophil recruitment during the early stages of Streptococcus pyogenes infection. Infect Immun. 77 (11), 5190-5201 (2009).
- Ratner, A. J., Hippe, K. R., Aguilar, J. L., Bender, M. H., Nelson, A. L., Weiser, J. N. Epithelial cells are sensitive detectors of bacterial pore-forming toxins. J Biol Chem. 281 (18), 12994-12998 (2006).
- Stassen, M., Müller, C., et al. The streptococcal exotoxin streptolysin O activates mast cells to produce tumor necrosis factor alpha by p38 mitogen-activated protein kinase- and protein kinase C-dependent pathways. Infect Immun. 71 (11), 6171-6177 (2003).
- Porta, H., Cancino-Rodezno, A., Soberón, M., Bravo, A. Role of MAPK p38 in the cellular responses to pore-forming toxins. Peptides. 32 (3), 601-606 (2011).
- Walker, M. J., Barnett, T. C., et al. Disease manifestations and pathogenic mechanisms of group a Streptococcus. Clin Microbiol Rev. 27 (2), 264-301 (2014).
- Carapetis, J. R., Steer, A. C., Mulholland, E. K., Weber, M. The global burden of group A streptococcal diseases. Lancet Infect Dis. 5 (11), 685-694 (2005).
- Cunningham, M. W. Pathogenesis of group A streptococcal infections. Clin Microbiol Rev. 13 (3), 470-511 (2000).
- Molloy, E. M., Cotter, P. D., Hill, C., Mitchell, D. A., Ross, R. P. Streptolysin S-like virulence factors: the continuing sagA. Nature Rev Microbiol. 9 (9), 670-681 (2011).
- Datta, V., Myskowski, S. M., et al. Mutational analysis of the group A streptococcal operon encoding streptolysin S and its virulence role in invasive infection. Mol Microbiol. 56 (3), 681-695 (2005).
- Lee, S. W., Mitchell, D. A., et al. Discovery of a widely distributed toxin biosynthetic gene cluster. Proc Natl Acad Sci USA. 105 (15), 5879-5884 (2008).
- Mitchell, D. A., Lee, S. W., et al. Structural and functional dissection of the heterocyclic peptide cytotoxin streptolysin S. J Biol Chem. 284 (19), 13004-13012 (2009).
- Bárcena-Uribarri, I., Benz, R., et al. Characterization of Clostridium perfringens TpeL Toxin Gene Carriage Production, Cytotoxic Contributions, and Trypsin Sensitivity. Biochim Biophys Acta Biomem. 1848 (6), 2369-2381 (2015).
- Bárcena-Uribarri, I., Benz, R., Winterhalter, M., Zakharian, E., Balashova, N. Pore forming activity of the potent RTX-toxin produced by pediatric pathogen Kingella kingae: Characterization and comparison to other RTX-family members. Biochim Biophys Acta Biomem. 1848 (7), 1536-1544 (2015).
- Carr, A., Sledjeski, D. D., Podbielski, A., Boyle, M. D., Kreikemeyer, B. Similarities between complement-mediated and streptolysin S-mediated hemolysis. J Biol Chem. 276 (45), 41790-41796 (2001).
- Flaherty, R. A., Puricelli, J. M., Higashi, D. L., Park, C. J., Lee, S. W. Streptolysin S Promotes Programmed Cell Death and Enhances Inflammatory Signaling in Epithelial Keratinocytes during Group A Streptococcus Infection. Infect Immun. 83 (10), 4118-4133 (2015).
- Guedon, J. T., Luo, K., Zhang, H., Markham, R. B. Monoclonal and Single Domain Antibodies Targeting β-Integrin Subunits Block Sexual Transmission of HIV-1 in In Vitro and In Vivo Model Systems. J Acquir Immune Defic Syndr. 69 (3), 278-285 (2015).
- Hu, D., Zhou, J., Wang, F., Shi, H., Li, Y., Li, B. HPV-16 E6/E7 promotes cell migration and invasion in cervical cancer via regulating cadherin switch in vitro and in vivo. Arch Gynecol Obstet. 292 (6), 1345-1354 (2015).
- Gangl, K., Waltl, E. E., et al. Infection with Rhinovirus Facilitates Allergen Penetration Across a Respiratory Epithelial Cell Layer. Int Arch Allergy Immunol. 166 (4), 291-296 (2015).
- Peng, X., Zhang, Q., Zeng, Y., Li, J., Wang, L., Ai, P. Evodiamine inhibits the migration and invasion of nasopharyngeal carcinoma cells in vitro via repressing MMP-2 expression. Cancer Chemother Pharmacol. 76 (6), 1173-1184 (2015).
- Zheng, Y., Guo, J., et al. FoxM1 transactivates PTTG1 and promotes colorectal cancer cell migration and invasion. BMC Med Genomics. 8, 49(2015).
- Losa, D., Köhler, T., et al. Airway Epithelial Cell Integrity Protects from Cytotoxicity of Pseudomonas aeruginosa Quorum-Sensing Signals. Am J Respir Cell Mol Biol. 53 (2), 265-275 (2015).
- Cook, K. W., Letley, D. P., et al. CCL20/CCR6-mediated migration of regulatory T cells to the Helicobacter pylori-infected human gastric mucosa. Gut. 63 (10), 1550-1559 (2014).
- Boukamp, P., Petrussevska, R. T., Breitkreutz, D., Hornung, J., Markham, A., Fusenig, N. E. Normal keratinization in a spontaneously immortalized aneuploid human keratinocyte cell line. J Cell Biol. 106 (3), 761-771 (1988).
- Krieg, R. C., Dong, Y., Schwamborn, K., Knuechel, R. Protein quantification and its tolerance for different interfering reagents using the BCA-method with regard to 2D SDS PAGE. J Biochem Biophys Methods. 65 (1), 13-19 (2005).
- Brunelle, J. L., Green, R. One-dimensional SDS-polyacrylamide gel electrophoresis (1D SDS-PAGE). Methods Enzymol. 541, 151-159 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır