Method Article
Kemirgenler dorsal kök gangliyon Omurilik ve İzolasyon hidrolik eldesi
Bu Makalede
Özet
Here, we present a protocol for hydraulic extrusion of the spinal cord as well as identification and isolation of specific dorsal root ganglia (DRGs) in the same rodent. Compared to standard spinal cord isolation methods, this method is significantly faster and reduces the risk of tissue damage.
Özet
Traditionally, the spinal cord is isolated by laminectomy, i.e. by breaking open the spinal vertebrae one at a time. This is both time consuming and may result in damage to the spinal cord caused by the dissection process. Here, we show how the spinal cord can be extruded using hydraulic pressure. Handling time is significantly reduced to only a few minutes, likely decreasing protein damage. The low risk of damage to the spinal cord tissue improves subsequent immunohistochemical analysis. By performing hydraulic spinal cord extrusion instead of traditional laminectomy, the rodents can further be used for DRG isolation, thereby lowering the number of animals and allowing analysis across tissues from the same rodent. We demonstrate a consistent method to identify and isolate the DRGs according to their localization relative to the costae. It is, however, important to adjust this method to the particular animal used, as the number of spinal cord segments, both thoracic and lumbar, may vary according to animal type and strain. In addition, we illustrate further processing examples of the isolated tissues.
Giriş
Bu yöntem genel amacı omurilik izole etmek için ayrıca, 2 DRG'ler 1 belirlemek ve izole etmek. Omuriliğin hidrolik ekstrüzyon aynı anda spinal vertebra bir kırarak yani laminektomi ile omurilik izolasyonu, geleneksel bir şekilde daha önemli ölçüde daha hızlı bir yöntemdir ve bu yöntem diseksiyon işlemi 3, 4 yol açtığı doku hasarı riskini azaltır . DRG belirlemek zor olabilir. Doğru tanımlama, örneğin siyatik sinir yaralanmasından sonra, doku analizi için son derece önemlidir. costadan kendi lokalizasyon göreli göre DRG'ler numaralama ile, DRG tutarlı tespit edilebilir.
Burada gösterilen tekniklerle izole edilmiş bir doku, Western blotting 5 de dahil olmak üzere analiz, geniş bir aralığına uygulanabilmektedir6, qPCR 7 ve immünohistokimyasal 8.
DRG'ler belirlenmesi, omurilik segment sayısı hayvan türü ve zorlanma 9, 10, 11 ile değiştiği bilinmektedir dikkate almak önemlidir. Farelerde bu yöntemin gerçekleştirilmesi avantajları mevcut genetiği değiştirilmiş çeşitleri ve nispeten düşük konut giderlerinin yüksek sayısıdır. fareler kullanarak avantajları nispeten yüksek doku verim ve sinir yaralanmaları içeren eğer, prosedür boyutu ile hafifletti olacaktır.
Protokol
Bütün hayvanlar Danimarka ve Avrupa yönetmeliklerine tam uyum içinde ele alınmıştır. İzin numarası: 2012-15-2934.
Omurilik Hidrolik eldesi için Şırınga 1. Hazırlık
- bir yetişkin farenin, bir 10 ml şırınga kullanın. Yetişkin fare için, 5 ml şırınga kullanın. Yavruların için, 2.5 ml şırınga kullanın.
- o şırıngaya sıkıca oturana kadar pipet büyük ucunu kırparak 2-200 uL pipetler için evrensel uygun olmayan bir filtre pipet ayarlayın. şırınga düzeltilmiş pipet yerleştirin. Yavruların için ayarlanmış bir pipet yerine 23 G veya benzeri iğne kullanın.
- Aspire buz soğukluğunda steril PBS ve sonraki kullanıma kadar buz üzerinde şırınga bırakın.
2. Ötenazi
- Bu imkansız ekstrüzyon render sırt omurgasını rahatsız edecek şekilde, servikal dislokasyon yapmayın.
- Yetişkin sıçan / fare için, örneğin CO 2 veya isoflu olarak gaz kullanılarak euthanizerane. Bu maddeler zararlıdır. Davlumbaz ötanazi gerçekleştirin ve kurum yönergelerine göre maddeleri işlemek. (DİKKAT: CO 2: H280, P410, P403; izofluran: H361d, P260, P281, P280)
- kemirgen ölü olduğundan emin olmak için, cımbız ile bir pençe sıkıştırarak refleksinin yokluğu sağlamak. Büyük makas kullanılarak kemirgen başını kesmek. Yavruların için, boyunları vurularak euthanize.
Spinal sütun 3. İzolasyon
- saç kontrol etmek için kürk üzerine su serpin.
- makas kullanılarak, bir uzak doğrultuda omurga boyunca kürk kesilerek açılır ve pelvis kemiği, son omurga boyunca her iki tarafta da kesilerek omuriliğe izole eder. bir makas ile pelvis kemiğinin distalinde omuriliği kesin.
NOT: rostral-kaudal eksen protokol boyunca proksimal-distal ekseni olarak gösterilir.- proximal- önlemek için bir makas kullanarak omuriliğe Trimbunlar gibi en distal-çoğu alanlarda çok başarılı omurilik ekstrüzyon için S-şekilli omuriliğe hale getirebilir. Omurilik iki ucunda görünür olduğundan emin olun. Omurilik görünür değilse omurilik görünür hale gelinceye kadar, makasla omurga düzeltin.
Omurilik 4. Hidrolik eldesi
- Buz üzerinde, steril PBS ile doldurulmuş bir petri çanağı (100 mm çapında) yerleştirilir.
- böylece mümkün olduğunca fazla omurga düzleştime, omurganın bükük kısmı (proksimal-en sonu) bir parmağı uygulanarak omuriliğe düzleştirin.
- Omurlar imkansız omurilik ekstrüzyon render bozulacak şekilde yavruların için, omurga eğilmesini önlemek.
- pipet omurganın uzak-en sonunda (yavruların 23 G iğne, yetişkin fareler için alternatif 18 G iğne) yerleştirin. doğru takılmış ise, ucu omurilik boşluğuna stabilize edilir.
- omurga mümkün olduğu kadar düzleştirilmiş olduğundan emin olun. sabit bir basınç uygulayın ve buz üzerinde Petri kabı içine omurilik a'ya. Omurilik daha sonraki işlemler kadar PBS içinde tutarak buz üzerinde nemli tutulan olduğundan emin olun.
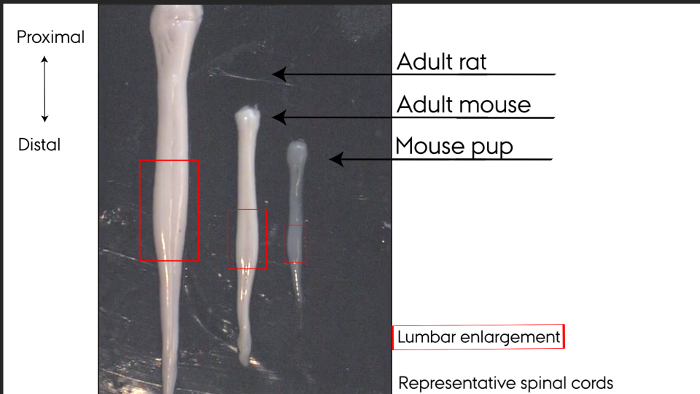
Şekil 1: Temsilci omurilik. Hidrolik omurilik presten. yetişkin sıçan, yetişkin fare, fare yavru: Soldan sağa. Lomber büyütme kutu ile işaretlenmiş. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Dorsal Kök Ganglia 5. Tanımlama (DRG)
- makas kullanılarak iki eşit uzunlamasına parça omurga bölünmüş ve mikroskop altında bölünmüş omuriliğe yerleştirin.
- tarafından T13 vertebra segmenti tanımlamak omurga ödeyen dikkat distal-en costadan bağlanma sitesini yerini yakın interkostal sinirler ile costae şaşırtmak için değil. Distal-en costae proksimal T13 vertebra segmenti parçası ve T13 DRG L1 vertebra için distal vertebra T13 ve proksimal bulunduğu bağlıdır.
- uzak yönde birlikte DRG'ler tanımlar. Yetişkin bir sıçan için, eşlik eden DRG açıkça görülebilir dorsal ve ventral kökleri beyaz görünür. Yetişkin bir fare için, eşlik eden DRG açıkça görülebilir dorsal ve ventral kökleri beyaz görünür. Yavruların için, eşlik eden DRG net küreler görünür.
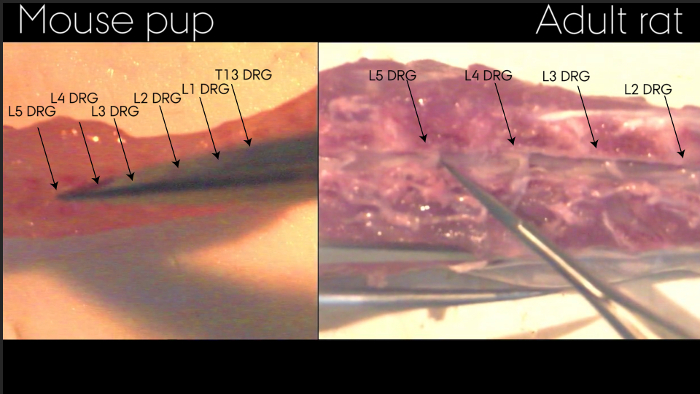
Şekil 2: omuriliğin ekstrüzyon sonrası omurga TİG'lerin tanımlanması. omurga oklarla gösterildiği gibi TİG'lerin görselleştirme izin bölünmüş edilmiştir. Yetişkin sıçan ve fare yavru ile örneklenen. ref = "http://ecsource.jove.com/files/ftp_upload/55226/55226fig2large.jpg" target = "_ blank"> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
DRG'ler 6. İzolasyonu
- Belirli DRG'lerde göre Sayı Petri kapları (çapı 30 mm), örneğin L3, L4, L5, izole edilmesi. buz gibi soğuk steril PBS ile Petri kapları doldurun ve buz üzerine koyun.
- DRG'ler zarar kaçınarak mümkün olduğunca DRG'lerde yakın mikro makas, kesip dorsal ve ventral kökleri kullanarak onları serbest bırakmak için.
- Kapalı cımbız ucu ile hafifçe DRG'ler kepçe ve ilgili sayılı Petri aktarabilirsiniz.
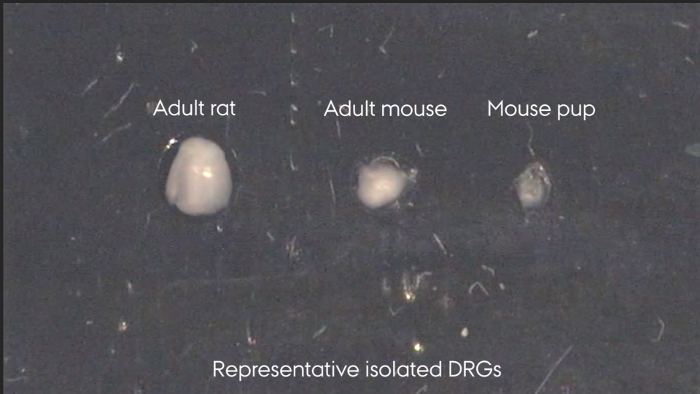
Şekil 3: Temsilci DRG'ler izole edilmiştir. yetişkin sıçan, yetişkin fare, fare yavru: Soldan sağa."_blank"> Bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
Daha fazla Analizi Doku 7. İşleme
- Western lekeleme
- Omurilik lomber genişleme örneğin, ilgi doku alanını izole edin. Gerekirse, ipsilateral ve kontralateral tarafta içine ve daha dorsal ve ventral boynuz içine omurilik ayırın.
- Bu buz üzerinde uygun bir enzim inhibitörleri ihtiva eden (iki kez damıtılmış H2 O, 10 mM Tris-baz, 150 mM NaCI, 1 mM EDTA,% 1 NP40) TNE parçalama tamponu gibi liziz tamponu içinde doku yerleştirin.
- mekanik öğütme havaneli kullanılarak buz üzerinde yaklaşık 30 saniye boyunca doku homojenize edilir.
- 4 ° C'de 16,000 x g'de 15 dakika boyunca santrifüj ve standart protokoller 5, 6'ya uygun daha fazla işlem için süpernatan kullanmak ya da daha fazla, kullanılıncaya kadar -20 ° C'de süpernatan tutun.
- RNA analizi
- ilgi doku izole.
- Hemen depolama RNA'yı stabilize RNA stabilizasyonu solüsyon içerisinde dokuyu yerleştirin.
- Standart protokollere 7'ye göre RNA izole.
- CDNA RNA dönüştürmek ve standart protokoller 7'ye göre qPCR gerçekleştirin.
- immünohistokimya
- (Omurilik için geçerlidir) taze donmuş dokular için:
- toz, iki çorba kaşığı tekabül eden bir miktarda kuru buz küpleri toz haline kuru buz tozu hazırlamak. Bir bez kuru buz küpleri Kapak ve bir çekiç kullanarak küpleri pulverize. Kuru buz bir tabakası üzerinde gümüş folyo (yaklaşık 5 cm x 5 cm) yerleştirilir ve kuru buz tozu gümüş folyo kapağı.
- cımbız kullanarak kuru buz tozu ile ilgili daha fazla analiz için seçilen omurilik alanını yerleştirin, bu ek bileşenini donma ve cryo tüp omurilik transfer edelim. her zaman kuru buz üzerinde tutun ya da bizi daha da kadar -80 ° C saklayıne.
- Bir kriostada omurilik aktarın (-20 ° C). Gerekirse, kriyostat içinde omurilik kırpın. örnek diske bağlamak için kriyostat içinde gömülü malzemenin içinde omuriliği yerleştirin.
- Örneğin 5 mikron, istenilen kalınlıkta omuriliği kesilmiş ve cam plakalar üzerinde toplamak. Daha iyi eki için doku koleksiyonuna hemen önce bir parmak ile cam plakalar ısıtın. sonraki kullanıma kadar -80 ° C 'de kriyo boruları içinde kalmış herhangi bir doku tutun.
- post-sabitleme için hazır olana kadar kriyostat içinde cam plakalar üzerine bölümleri bırakın.
- Oda sıcaklığında 10 dakika boyunca% 4 PFA içine daldırılarak kesitlere düzeltin.
- Standart protokollere 8'e göre boyama gerçekleştirin.
- (Spinal kord ve DRG'lerde için geçerlidir) cryo kesit için sabit doku
- % 4 PFA (omurilik 2 H, fare DRG'ler 1.5 saat ve sıçan DRG'ler 4 saat), spinal kordon ve DRG'ler saptamak4 ° C (yatay konuma omurilik bükülmüş pozisyonda sabitlenmesi önlemek için).
- 4 ° C'de bir gece / hac sakaroz% 25 ağ doku aktarın. Doku daha sonra kullanmak kadar 4 ° C 'de mikrobiyal kirlenmenin önlenmesi için,% 10 sodyum azid birkaç damla ile takviye / hac sakaroz% 25 ağ saklanabilir. Gerekirse, sadece silikon tahta veya benzeri lomber genişleme telafi etmek için omurilik kırpın.
- Bir kağıt havlu ucunu kullanarak, doku fazlalığı sakaroz çözeltisini aspire.
- gömülü malzemenin bir cryo kalıp yarım doldurun. Böyle kapalı cımbız gibi araçlarla kriyo kalıp kenarlarına kabarcıkları itin.
- cımbız kullanarak gömülü malzemenin üzerine doku yerleştirin ve istenen doku yönlendirmesini sağlamak.
- Gömülü malzemenin tamamen cryo kalıp doldurun ve olduğunca uzak (kapalı cımbız kullanarak örneğin) mümkün olduğunca dokudan kabarcıkları itin.
- (100 mm Petri doldurun2-metilbütan çapında) 'de. Bu madde zararlıdır. Davlumbaz bu adımı gerçekleştirin ve kurum kurallarına göre maddeyi işlemek (DİKKAT: H224, H304, H336, H411, P210, P280, P273, P301, P331, P304 / P340, P309 / P310).
- Kuru buz tabakası Petri tabağına yerleştirin ve Petri kabı, iki kuru buz küpleri ekleyin. Petri kabındaki cryo kalıp yerleştirin ve gömme malzeme tamamen dondurmak için izin.
- Her zaman kuru buz üzerinde gömülü doku tutun veya daha fazla işlem kadar Parafilm sarılmış -80 ° C'de ilave edildi.
- Bir kriyostat (-20 ° C) istenen kalınlık doku, örneğin, 5 um kesin.
- Standart protokollere 8'e göre boyama gerçekleştirin.
- (Spinal kord ve DRG'lerde için geçerlidir) parafin katıştırma için sabit doku
- 4 ° C (yer omurilik% 4 PFA (omurilik için 2 saat, fare DRG'lerde için 1.5 saat ve sıçan DRG'lerde için 4 saat) omuriliği ve DRG'ler Fixyatay konumda) bükülmüş pozisyonda sabitlenmesi engellemek için.
- 4 ° C'de bir gece / hac sakaroz% 25 ağ doku aktarın. Doku daha sonra kullanmak kadar 4 ° C 'de mikrobiyal kirlenmenin önlenmesi için,% 10 sodyum azid birkaç damla ile takviye / hac sakaroz% 25 ağ saklanabilir.
- Omurilik lomber genişleme örneğin, ilgi doku alanını izole edin.
- parafin ile gömme kalıp yarım doldurun.
- hafifçe parafin sertleşmesine gömme makinenin soğutma alanında yerleştirerek gömme kalıp kısaca serinleyin. Bu iyi bir doku konumlandırma için izin verir.
- gömme kalıp içinde istenilen yönde doku yerleştirin. parafin ile gömme kalıp doldurun ve hemen serin.
- tamamen sertleşmeye ve gömme kalıp doku içeren parafin blok kaldırmak izin 4 ° C gece boyunca parafin içeren gömme kalıp yerleştirin.
- Kes bölümler oistenilen kalınlıkta na mikrotom, örneğin 5 mikron.
- Standart protokollere 8'e göre boyama gerçekleştirin.
- (Omurilik için geçerlidir) taze donmuş dokular için:
Sonuçlar
Hidrolik ekstrüde omurilikler, Şekil 1 'de gösterilen düz bir hasarsız bir yüzey gösterir. Bel genişliğine kolaylıkla Şekil 1 'de kutulu omurilik kalınlaştırılmış alanı olarak tanımlanabilir. omurilik dorsal ve ventral taraf morfolojiye göre göz ile tespit edilebilir. Şekil 1'de, ventral tarafı tüm omurilik boyunca açık bir orta hat ile tanımlanabilir görüntüleyici karşı karşıyadır. omurilik boyunca iki geniş çizgiler sırt tarafında tanımlanmasını sağlar. uzak-en sonunda, KES zaman yetişkin farelerde ve yetişkin farelerde takılı kalabilir.
Omurga, Şekil 2'de yer alan ise bireysel DRG'ler yalnızca tespit edilebilir. Izolasyon, Şekil 3 ardından, bireysel DRG görünüm tarafından tespit edilemez. Gerekirse, bu nedenle,Onları tutmak için önemlidir açıkça izolasyon üzerine ayrılmış. Aşama 7.3'deki ve Şekil 4'te gösterildiği gibi izole edildikten sonra, omurilik ve DRG işlenir ve boyandı. Şekil 4a nöronlar ve onların çevresindeki uydu glial hücreler açıkça görülebilir bir DRG bölümünün bir immunohistokimyasal boyanma gösterir. DRG doğru tanımlanması ile o yaralı nöronun soma yanı sıra çevrelerindeki uydu glial hücreler üzerinde siyatik sinir yaralanması etkisini analiz etmek mümkündür. Şekil 4b bölümün düzgün kenarlı tarafından yansıtılan doku bozulmamış bir hidrolik presten omuriliğin bir Nissl boyamasını göstermektedir.
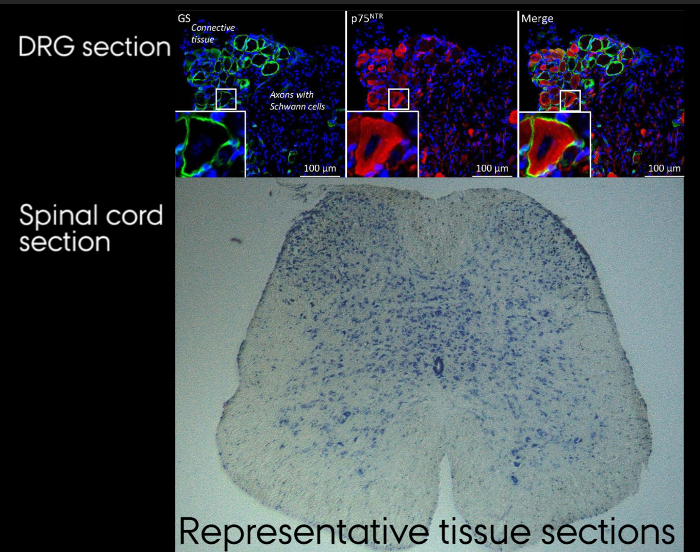
Şekil 4: Örnek doku bölümleri. Bir. DRG bölümünün immünohistokimyasal boyama. B. Nissl lekeli sectiohidrolik ekstrude omurilik n. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tartışmalar
Omurga servikal dislokasyon örneğin, rahatsız edilirse, omurilik ekstrüzyon sırasında bölünmüş olacaktır. spinal kord ekstrüde edilemiyorsa, omurga her iki uçta da biraz kesilmiş olabilir ve ekstrüzyon girişimi tekrarlanabilir. Durumda, tüm omurga yani servikal genişleme ve bel genişliğine oluşan daha fazla analiz için gerekli olan, omurga sadece biraz kesilmiş olmalıdır. Sadece bel genişliğine, daha fazla analiz için gerekli olan ise, omurilik, bu protokole göre kesilmiş olmalıdır. Omurga ekstrüzyon kolaylaştırmak için parmak uçlarınızı kullanarak doğruldu gerekir.
Protokol her yaştan kemirgen uygulanabilir ve burada bir yetişkin fare (8 hafta), yavru bir fare (5 gün) ve bir yetişkin farenin (10 hafta) ile tarif edilmektedir. Hayvan Çeşidi ve şekil ile ilgili olarak, torasik ve lumbar bölümlerin sayısı, 9 değişebilir 10, 11. protein bağlı olarak, yetişkin kemirgenler Ötenazi öncesinde enzim inhibe edici çözümler ile perfüze edilebilir, analiz edilecek. tek taraflı sinir hasarı içeren bir deney gerçekleştirmek ise, omurilik hemen ekstrüzyon sonrası ultra-ince cımbız kullanarak ipsilateral ve kontralateral tarafta ayrılabilir. Dahası, her yan dorsal ve ventral tarafı ayrılabilir. Doku daha sonra analiz, örneğin Western blot için işlenebilir.
Bu, omurilik esnek olmayan hale ve omurilik hidrolik ekstrüzyonu engellemektedir Omurilik ekstrüzyon öncesinde PFA transcardial perfüzyon fikse kaçınılmalıdır. Hidrolik omurilik ekstrüzyon dorsal kökleri koparmak olacaktır. Ekli dorsal köklerin gerekli deneyler için, laminektomi tavsiye edilir. Ayrıca, omurga beyin zarı, standart laminektomi önlenebilir hidrolik ekstrüzyon ile kaybolur 3.
spinal kord ve DRG izolasyon hidrolik ekstrüzyon yerine de buz soğukluğunda PBS oksijenlenmiş yapay serebrospinal sıvı (ACSF) ile gerçekleştirilebilir. ACSF kullanımı takip eden elektrofizyolojik kayıtları 12, 13 söz konusu olduğunda özellikle önemlidir, daha iyi bir fizyolojik bir ortamda, izole dokusunun sağlar. ACSF için alternatif bir PBS, 1 g / primer DRG kültürler 14 oluşturulması için L glikoz ihtiva eden olabilir.
Omuriliğin hidrolik ekstrüzyon laminektomi ile omurilik izolasyonu geleneksel şekilde, doku işleme süresini azaltan ve bu nedenle protein hasarı riskini azaltmak daha önemli ölçüde daha hızlı bir yöntemdir. bir sabitleyici ile perfüzyon önce Diseksiyon sırasında ve son çıkarılması sırasında doku hasarı riskini azaltabilir laminektomi ile omurilik izole etmekomurilikten omurilik. Ancak, doku tespit gibi Western blot olarak analizlere uygulanabilirliğini engellemektedir. Hidrolik ekstrüzyon verimi analizler daha geniş bir aralığı için uygun yapısal hasar görmemiş doku 3.
DRG'ler Tutarlı kimlik zor olabilir. Bununla birlikte, bu, örneğin siyatik sinir zedelenmesini takiben, doku analizi için gereklidir. costadan kendi lokalizasyon göreli göre DRG'ler numaralama ile, DRG tutarlı tespit edilebilir. DRG'lerin gibi omurilik dokusu boyama protokolü Adım 7'de tarif gösterilen doku işlem varyasyonları gerçekleştirerek optimize edilebilir.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
We would like to acknowledge David Kiel, Aarhus University, for filming and editing. VirtualDub software was used for processing of microscope video sequences. We thank the Danish Research Institute of Translational Neuroscience - DANDRITE, Nordic EMBL Partnership, for access to equipment and the Aarhus University Research Foundation, EU 7FP project PAINCAGE, Det Frie Forskningsrad (DFF) and The Lundbeck Foundation for funding.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Bonn scissors, extra fine, straight, 8.5 cm | F.S.C. (Fine Science Tools) | # 14084-08 | For cutting open the spinal cord prior to isolation of DRGs (adult mouse, adult rat); Other manufacturer may be used |
| Centrifuge | Eppendorf | # 5427 R | For centrifugation of homogenized tissue |
| Cryostat microtome | Leica Biosystems | # CM 3050 S | For cutting the embedded tissue prior to staining; Other model and manufacturer may be used |
| Forceps, Dumont, # 3 | F.S.C. (Fine Science Tools) | # 11231-30 | For handling of spinal cord after extrusion; Other manufacturer/type may be used |
| Forceps, Dumont, # 5 | F.S.C. (Fine Science Tools) | # 11252-20 | For isolation of DRGs (adult mouse, adult rat, pup); Other manufacturer may be used |
| Isoflurane (furane) IsoFlo Vet 100 % | Abbott | # 002185 | For euthanization; Other manufacturer may be used; CAUTION: toxic |
| Iso-pentane GPR rectapur | VWR chemicals | # 24872.298 | For snap-freezing of tissue; Other manufacturer may be used; CAUTION: toxic |
| Microtome | Leica Biosystems | # RM 2155 | For sectioning of paraffin embedded tissue; Other model and manufacturer may be used |
| Paraffin wax pellets | Sigma-Aldrich | # 76243 | For paraffin embedding; Other manufacturer may be used |
| Paraffin tissue embedding station | Leica Biosystems | # EG1160 | For paraffin embedding of tissue for later sectionning; Other model and manufacturer may be used |
| Pellet pestel, motor cordless | Sigma-Aldrich | # Z359971-1EA | For mechanical homogenization of isolated tissue prior to Western blotting; Other manufacturer may be used |
| Petri dish, 35 mm | Thermo Fischer Scientific | # 121V | For storage of isolated DRGs; Other manufacturer and size may be used |
| Petri dish, 100 mm | Sigma-Aldrich | # P7741 | For spinal cord extrusion; Other manufacturer and size may be used |
| Phosphatase inhibitor, Phosstop | Sigma-Aldrich | # 04906845001 | Phosphatase inhibitor cocktail for addition to TNE-lysis buffer if needed; Other manufacturer may be used |
| Pipette tip, 1-200 μl, no filter | Sarstedt | # 70.1189.105 | For hydraulic extrusion; Other manufacturer may be used |
| Protease inhibitor, Complete | Sigma-Aldrich | # 05892791001 | Protease inhibitor cocktail for addition to TNE-lysis buffer if needed; Other manufacturer may be used |
| RNAlater solution | Sigma-Aldrich | # R0901 | For RNA stabilization for storage; Other manufacturer may be used |
| Rneasy Protect Mini KiT | Qiagen | # 74124 | For RNA isolation; Other manufacturer may be used |
| Scalpel; Swann-Morton surgical blade no. 11 | Swann-Morton | # REF0203 | For isolation of spinal cord lumbar area; Other manufacturer/type may be used |
| Scissors, straight, type 3, 25 mm cutting edge | Bochem | # 4070 | For isolation of spine; Other manufacturer/type may be used |
| Scissors, 130 mm cutting edge | Hounisen | # 1902.0130 | For isolation of spinal cord (adult rat) |
| Spring scissors, straight, 8 mm cutting edge | F.S.C. (Fine Science Tools) | # 15009-08 | For cutting open the spinal column prior to isolation of DRGs (pup) and for isolation of DRGs (adult mouse, adult rat, pup); Other manufacturer may be used |
| Standard syringes, 2.5 ml, 5 ml, 10 ml | Terumo | # SS02SE1; # SS05SE1; # SS10SE1 | For hydraulic extrusion; Other manufacturer may be used |
| Stereomicroscope MZ12.5 with objective 1x and eyepiece 10x | Leica | # 10446370 | Other manufacturer/type may be used |
| Sterile PBS | GIBCO | # 10010-015 | For hydraulic extrusion; Can also be made according to standard protocols |
| Syringe needle 23 G x 1", 0.6 x 25 mm | Terumo Neolus | # NN-2325R | For hydraulic extrusion in pups; Other manufacturer/type may be used |
| Syringe needle 18 G x 1 1/2, 1.2 x 40 mm | Terumo Neolus | # NN-1838S | Alternative to pipette tip for hydraulic extrusion in adult mice; Other manufacturer may be used |
| Tissue-Tek | Sakura | # 4583 | Tssue embedding material for later cryosectionning |
| TNE-lysis buffer | VWR chemicals | # 10128-582 | For tissue lysis prior to Western blotting; Other manufacturer may be used; Can also be made according to standard protocols |
Referanslar
- Malin, S. A., Davis, B. M., Molliver, D. C. Production of dissociated sensory neuron cultures and considerations for their use in studying neuronal function and plasticity. Nat Protoc. 2 (1), 152-160 (2007).
- Sleigh, J. N., Weir, G. A., Schiavo, G. A simple, step-by-step dissection protocol for the rapid isolation of mouse dorsal root ganglia. BMC Res Notes. 9, 82 (2016).
- Kennedy, H. S., Jones, C., Caplazi, P. Comparison of standard laminectomy with an optimized ejection method for the removal of spinal cords from rats and mice. J Histotechnol. 36 (3), 86-91 (2013).
- Meikle, A. D., Martin, A. H. A rapid method for removal of the spinal cord. Stain Technol. 56 (4), 235-237 (1981).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. J Vis Exp. (16), (2008).
- Ogrean, C., Jackson, B., Covino, J. Quantitative real-time PCR using the thermo scientific Solaris qPCR assay. J Vis Exp. (40), (2010).
- . Immunohistochemistry Protocol for Parraffin-embedded Tissue Sections - ADVERTISEMENT Available from: https://www.jove.com/video/5064/immunohistochemistry-protocol-for-paraffin-embedded-tissue-sections (2014)
- Watson, C., Paxinos, G., Puelles, L. . The Mouse Nervous System. , 424-426 (2012).
- Rigaud, M., et al. Species and strain differences in rodent sciatic nerve anatomy: implications for studies of neuropathic pain. Pain. 136 (1-2), 188-201 (2008).
- Green, E. L. Genetic and non-genetic factors which influence the type of the skeleton in an inbred strain of mice. Genetics. 26 (2), 192-222 (1941).
- Meyer, A., Gallarda, B. W., Pfaff, S., Alaynick, W. Spinal cord electrophysiology. J Vis Exp. (35), (2010).
- Ciglieri, E., Ferrini, F., Boggio, E., Salio, C. An improved method for in vitro morphofunctional analysis of mouse dorsal root ganglia. Ann Anat. , 62-67 (2016).
- Peeraer, E., et al. Pharmacological evaluation of rat dorsal root ganglion neurons as an in vitro model for diabetic neuropathy. J Pain Res. 4, 55-65 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır