Method Article
Fagositoz fare makrofajlar tarafından hızlandırılmış 3D görüntüleme
Bu Makalede
Özet
Burada dönen disk confocal mikroskobu görüntüsü tek fagositik olayları için fare ikamet periton makrofajlar tarafından kullanma yöntemleri açıklanmaktadır. İletişim kuralları diğer fagositik hücreler için genişletilebilir.
Özet
Fagositoz konak savunma yanı sıra doku geliştirme ve bakım önemli bir rol oynar ve yakalamak, örtmek ve büyük parçacıklar yutmak aktin sitoiskeleti hızlı, reseptör aracılı düzenlemeler içerir. Fagositik reseptörleri, aşağı akım sinyal yolları ve Rho GTPases gibi effectors tespit rağmen belirsiz kalır dinamik hücre iskeleti reseptör aracılı belirli fagositik olaylarına remodeling. Dört yıl önce fagositoz, Fcγ reseptör (FcγR) - ve kompleman reseptör (CR) - örneği iki farklı mekanizma fagositoz aracılı, Tarama elektron mikroskobu kullanılarak tespit edilmiştir. Bağlama (IgG) immünglobulin G-opsonized parçacıklar FcγRs önce tamamen kapalı olur ve hücre içine geri çektiği ilk parçacık çevresinde sözde fagositik Kupası formu ince zar uzantıları, çıkıntı tetikler. Buna ek olarak, opsonized tamamlayıcı parçacıklar reseptörleri tamamlayacak bağlama aşağıdaki hücre batmaya görünür. Bu iki mod fagositoz, fagositik Kupası oluşumu ve, batan literatürde iyi kurulmuş hale gelmiştir. Ancak, iki modları arasındaki farklılıklar bu kompleman reseptör aracılı fagositoz çeşitli membran çıkıntılar neden olabilir raporları tarafından belirsizleşmiştir. Yüksek çözünürlüklü teknikleri görüntüleme durumu ile fagositoz deneyleri gereklidir buna izin gerçek zamanlı 3D (üç boyutlu) görüntüleme nasıl belirli fagositik reseptörlerinin aracılık bireysel parçacıkların alımını. Daha yaygın olarak kullanılan yaklaşımlar fagositoz, son nokta deneyleri gibi çalışması için parçacıklar ve fagositler arayüzü neler olduğunu anlamak için fırsatı kaçırmayın. Burada biz fagositik deneyleri, tek fagositik olayların 3D görüntüleme sağlayan hızlandırılmış dönen disk confocal mikroskobu, kullanarak açıklar. Ayrıca, belirsizliğe yer bırakmadan Fcγ reseptör - görüntü veya tamamlayıcı reseptör aracılı fagositoz deneyleri açıklamaktadır.
Giriş
Yirmi yıl önce Metchnikoff'ın gözlem 1882, deniz yıldızı larva fagositik Mezenşim hücreleri ve fagositoz1, teorisinin sonraki geliştirme Ernest Haeckel, 1862, erimeyen boya parçacıkları kan tarafından engulfment açıklanan hücreleri Thetis fimbris (Tethys Pilus), bir tür yırtıcı deniz yaratığı (Ernest Haeckel. Radiolarien (Rhizopoda radiaria) die: Eine Monographie; Druck und Verlag von Georg Reimer, Berlin, 1862). Daha sonra sitoplazma almak yukarıya ve hücre çekirdeği biriken parçacıkları, zarflama membran çıkıntılar açıkça tarif etti. Daha--dan 100 yıl sonra Kaplan tarafından öncü bir çalışma vardı fagositoz2en az iki morfolojik farklı mekanizma önerdi. Kaplan bu fare peritoneal elektron mikroskobu tarama yoluyla bir koyun IgG opsonized kadar uzandı ve parçacık sıkıca saran ince zar uzantıları kullanarak, başlangıçta Kupası benzeri sebebiyet veren alyuvar makrofajlar yutulur gösterdi yapısı. Bu hücre geçirgen mantar toksin cytochalasin B, aktin dynamics3blok için bilinen tarafından kaldırıldı beri fagositik Kupası oluşumu aktin polimerizasyon gerekli. Buna ek olarak, her ne kadar bazı görüntülerin membran katlar batan parçacıkların vacinity hemen görülebilir, koyun kırmızı kan hücreleri ile tamamlayıcı opsonized makrofaj membran uzantıları, nesil olmadan doğrudan içine batmaya ortaya çıktı. Fagositik Kupası oluşumu, kompleman reseptör aracılı batan insenstive cytochalasin B tedavi2oldu. Kaplan tarafından açıklanan deneylerde tamamlayıcı opsonizasyonla immünglobulin M kuluçka tarafından gerçekleştirildi (IgM) etiketli koyun kırmızı kan hücreleri ile hemoliz tamamlayıcı C5-bağımlı terminal tarafından circumvents serum kompleman C5-eksik fareler, gelen karmaşık tamamlıyor.
Kaplan tarafından tanımlanan iki mod fagositoz, fagositik Kupası oluşumu ve, batan kurulan görüş alanı4,5,6,7,8,9 olmuştur . Ancak, ultra-yüksek çözünürlük görüntüleri kullanılan Kaplan2tarafından özgün çalışma, hem de benzer bir çalışma tarafından Munthe-Kaas vd. 10, yalnızca anlık görüntülerini fagositik olayları sağlar. Son bir derlemede, Rougerie vd. 11 FcγR ve CR aracılı fagositoz morfolojik farklılıkları netleştirilmelidir kalır ve ayrıca, kompleman reseptör aracılı parçacık alımı2sırasında membran katlar gözlenmiştir, vurguladı. Canlı hücre görüntüleme genetik olarak birlikte içselleştirilmesi için parçacık çekim modundan kapsayan tek fagositik olayların fare modelleri değişiklik, bizim anlayış nasıl fagositler yakalamak ve parçacıklar yemek büyük ölçüde artırabilirsiniz. Uygulanabilecek yöntemlerden biri, canlı hücreler Ultra-yüksek kararlılık (10-20 nm) topografik görüntüleme sağlayan hızlı atomik kuvvet mikroskobu (AFM) kullanmak için olabilir. Son zamanlarda, düşük gürültü ile hızla görüntüleme hücre yüzeyleri için uygun olan bir hızlı AFM sistem12 geliştirilmiştir. Bu teknik avantajı fiksasyon ve kritik nokta, kurutma gerektiren elektron mikroskobu tarama aksine kısa aralıklarla (saniye), hücreleri ölçülebilir yaşayan bu yüksek çözünürlüklü, topografik ve mekanik parametreleri vardır. hücreleri. Hızlandırılmış 3D confocal mikroskobu, fototoksisite ve ağartma faktörler kayıtları sırasında sınırlı hale gelir, ancak yaygın olarak kullanılabilir olan başka bir yaklaşımdır. Bu yaklaşım çok yönlü ve yüksek uzaysal çözünürlük ile kesit optik sağlar ve floresan problar genetik olarak kodlanmış floresan proteinler de dahil olmak üzere, şaşırtıcı bir dizi ile etiketleme olağanüstü esneklik sağlar. Burada belirli olayların reseptör aracılı fagositik yüksek kronolojik zamanmekansal çözümleme'ye izin hızlandırılmış dönen disk confocal mikroskobu kullanılarak fagositoz deneyleri tarif.
Protokol
İletişim kuralları bizim yerel insan Araştırma Etik Komitesi kuralları, hem de hayvan bakımı yönergeleri izleyin.
1. izolasyon ikamet fare Peritoneal makrofajlar
- Kurban fare (3-4 ay-in yaş (her iki cinsiyetten); Örneğin C57BL/6 zorlanma) uçucu anestezik isoflurane aşırı dozda kullanarak (> havada % 5) veya karbon dioksit13servikal çıkığı tarafından takip,. Anestezi indüksiyon kolayca refleks14keşfetmiş kaybı yanı sıra pençe çekilme refleks kaybı tarafından tespit edilebilir.
- Fare ile % 80 etanol suda göbek temizlendikten sonra cilt ensizyon yapmak ve temel karın duvarı bulaşmasına neden.
- Peritonium ve lavaj boşluğu ile 2 x 4.5 mL buz gibi Hank tamponlu tuz solüsyonu (HBSS), Ca2 + ve Mg2 +5 mL plastik enjektör üzerinden olmadan bir 24-G plastik kateter yerleştirin. Enjekte ederken, yaklaşık 0,5 mL artık terk HBSS (5-4.5 (enjekte) mL 0.5 mL =) şırınga durumda doku kateter ucu sucked ve okuldan gerekiyor. Emişli süspansiyon 14 mL polipropilen yuvarlak alt tüp ve 300 x g , santrifüj 6,5 dakika oda sıcaklığında içine aktarın.
Not: Plastik kateter ucu olduğunu blunt, iğne için karşılaştırıldığında, hangi en aza indirir karın içindekilere yaralanma. Genellikle, aşağıdaki karın masaj nazik, 8 mL periton hücre süspansiyon periton boşluğundan alınabilir. - Süpernatant atmak ve periton RPMI 1640 orta bikarbonat ücretsiz 1 mL 20 mM Hepes, % 10 ısı inaktive fetal Sığır serum ve antibiyotikler penisilin (100 adet/mL) ve streptomisin (100 µg/mL), tarafından hazırlanan gibi içeren hücrelerde resuspend 100 x penisilin/streptomisin 1: 100 sulandrarak. Bu genellikle yaklaşık 6 x 106 hücre/mL bir konsantrasyon sağlar.
Not: ise (küçük) diğer hücreleri lenfositler, ağırlıklı olarak B hücreleri makrofajlar, izole periton hücreleri yaklaşık % 30'u vardır.
2. Kanal periton hücrelerinin tohum slaytlar
-
Yukarı ve aşağı topaklanma azaltmak için hücre süspansiyon pipetting sonra 100 µL süspansiyon doldurulmuş Kanal Kanal fibronektin kaplı slayt (hacim, 100 µL) pipet (100 µL kanal boyutları vardır (uzunluk x Genişlik x yükseklik): 50 x 5 mm 0.4 mm).
- 1 mL serum takıma RPMI 1640 (Hepes) orta kanal slayt iki rezervuarlar birine ekleyerek, slayt devirme ve daha sonra aşağı akım rezervuar (Şekil 1) ortamından aspirating odası prefill.
- Kaldır istenmeyen hava kabarcıkları, ya da 1-2 mL orta iki rezervuarlar birine ekleyerek, sıkıca bir rezervuar kap uygulamak ve sonra kapağı üzerinde ritmik başparmak baskı havada dışarı pompalama ve, gerekli hallerde, slayt devirme kanaldaki hava uzun şeritler. Hava kovma sonra kapağını rezervuar slaytla eğilme (ve orta içeren) aşağıya doğru hava kanal içine sucked önlemek için kapağı çıkarmadan önce.
- 1 mL serum takıma RPMI 1640 (Hepes) orta kanal slayt iki rezervuarlar birine ekleyerek, slayt devirme ve daha sonra aşağı akım rezervuar (Şekil 1) ortamından aspirating odası prefill.
- Hücrelerle yokluğunda CO2 , 37 ° C'de 2 h için nemli bir odasında numaralı seribaşı kanal slayt kuluçkaya (CO2 gerekli değildir beri HCO3-Co2 tampon sistemi Hepes tarafından değiştirilmiştir). Kanal slaytlar elverişli bir konuma sahip sekiz slaytlar tutan bir rafa yerleştirilebilir. Tipik olarak, yukarıya için 10 veya daha fazla mümkün olsa da 6-8 slaytlar bir fareden hazırlanır.
-
Rafa kaldırmak ve her bir slayt için penisilin/streptomisin yanı sıra % 10 fetal Sığır serum ile desteklenmiş RPMI 1640 orta içeren bikarbonat RPMI 1640 (Hepes) ortamda değişimi.
- Slayt eğilme ve orta ilk alt rezervuar ve sonra üst rezervuar Aspire edin. Ardından, yeni orta 1 mL rezervuar birine ekleyin, kanalı ile aktı sonra aşağı akım depo, slayt ve Aspire edin ortamından yatır.
- Bu yıkama (medyası takası) adımdan sonra rezervuarlar için 1 mL orta ekleyerek kanal slayt doldurun.
Not: Kanal slaytlar kullanarak adımları yıkama çok basit ve etkili çözüm değişimi ve yapışık olmayan hücreleri çıkarmadan açısından. RPMI 1640 (bikarbonat) orta normalde önceden termal ve pH denge sağlamak için % 5 CO2 ile gecede inkübe olduğuna dikkat edin.
- Gecede 37 ° C'de % 5 CO2ile oksijen bir kuluçka hücreleri kuluçkaya. Deneyler ertesi gün gerçekleştirmek.
3. yalıtım insan kırmızı kan hücrelerinin
- Günde 2 (ikinci gün deneyler; izole periton makrofajlar gecede kuluçka sonra), 1-2 mL periferik venöz kan sağlıklı bir verici, heparinized tüp içine toplamak. Bir yuvarlak alt 2.0 mL (Polipropilen) microcentrifuge Tüp, 18 ° c (ampirik ayarı) 5 min için 300 x g, santrifüj içine 1 mL transfer ve süpernatant (plazma ve buffy kat) kaldırın.
- Yavaşça posalı kırmızı kan hücrelerinin 100 µL Aspire edin ve bu Cilt 1:1 (aşağıda açıklanmıştır) değiştirilmiş RPMI 1640 (Hepes) orta bir yuvarlak alt 2.0 mL microcentrifuge tüp ile karıştırın. Tüp "1:1" etiket.
Not: hücreleri izole sonra günde 2 (deneyleri için) kullanılan RPMI 1640 (Hepes) orta, % 10 ısı inaktive fetal Sığır serum, penisilin (100 adet/mL), streptomisin (100 µg/mL) ve (azaltmak için 1 mM N-(2-mercaptopropionyl) glisin yanı sıra içerir fototoksisite). Bu orta, bundan sonra "tarihinde" RPMI 1640 (Hepes) aracı olarak adlandırılır. - 1:1 seyreltilmiş kırmızı kan hücre süspansiyon 4 µL 2 mL pipet RPMI 1640 (Hepes) orta değiştiren, 2.0 mL microcentrifuge tüp içine önceden pipetted (Bu işlemi tekrarlayın, yani 2 tüpler hazırlamak). Her tüp "4:2000" etiket. "1:1" ve "4:2000" tüpler buza koyun.
4. makrofaj plazma membran etiketleme
- Numaralı seribaşı kanal slaytlar CO2 kuluçka kaldırmak ve her bir slayt için değiştirilmiş RPMI 1640 (Hepes) orta RPMI 1640 (bikarbonat) ortamda değişimi. Daha sonra hücreleri yokluğunda CO2, 37 ° C'de nemli bir odaya yerleştirin.
Not: gece kuluçka ve yıkama sonra lenfositler çoğunu kanaldan kaldırılır. Kalan yapışık hücreleri makrofajlar, morfolojik veya ayirt boyama tarafından anti-F4/80 antikor kullanılarak belirlenebilir çoğu. Etrafında fare ikamet periton makrofajlar % 95'i F4/80 olumlu vardır. - Fluorescently yeşil etiketli Anti-fare F4/80 antikor (4 ° C'de depolanan) 1:40 tarihinde RPMI 1640 (Hepes) orta sulandırmak. Bir slayt al, tilt ve antikor karışımı (damla damla) 100 µL 100 µL kanal slaydın açılış içine pipet (bkz. Şekil 1). Akış aşağı göle akan orta Aspire edin. 20 dk 37 ° C'de (CO2olmadan oksijen çevre) için hücreleri kuluçkaya. Kuluçka döneminde insan kırmızı kan hücreleri (bkz Bölüm 5) etiketleyin.
Not: Yukarıdaki için sorar gibiydi, CO2 HCO3' ten beri gerekli değildir-Co2 tampon sistemi Hepes tarafından değiştirilir. - 1 mL ekleyerek slayt RPMI 1640 (Hepes) orta bir rezervuar ve kanalı ile aktı sonra orta aspirating değiştirme (hangi sırasında insan kırmızı kan hücreleri lekeli opsonized ve) 20 dk kuluçka zamanı, yıkama tarafından kolaylaştırdı sonra Slayt devirme. 1 mL orta kısa süreli depolama için ekleyebilir veya bir deney (parçacıklar (opsonized kırmızı kan hücreleri) pipetting ve hızlandırılmış dönen disk confocal mikroskobu tarafından fagositoz Imagingyani ) geçin.
5. insan kırmızı kan hücrelerinin plazma zarı etiketleme
- İnsan kırmızı kan hücreleri makrofajlar yeşil fluorescently etiketli anti-F4/80 antikor ile slayt (sonra Bölüm 4.2) hemen kuluçka sonra etiketleme başlayın. Nazik karıştırma sonra birinden (bkz. Kısım 3.3) "4:2000" tüpler 400 µL al ve bir (yuvarlak alt) 2.0 mL microcentrifuge tüp içine dağıtmak. Süspansiyon yaklaşık 37 ° C sıcak zaman tanıyın (paragraf aşağıya bakınız). 0.4 µL turuncu/kırmızı floresan plazma zarı leke (aliquots-20 ° C'de depolanan) ekleyin, karıştırın ve 5 min için 37 ° C'de kuluçkaya.
Not: laminar akış başlık içinde yerleştirilen bir ısıtmalı Alüminyum blok slaytlar hazırlarken ısı kaybını en aza indirmek için yararlıdır. Tüpleri Isıtma blok ve ayrı bir geçişli kuyu yerleştirilebilir veya entegre, ısıtmalı alüminyum levha bir çalışma alanı hizmet verebilir. - Sonra 5 dk kuluçka süresi, ilk yıkama adım 1600 µL modifiye RPMI 1640 (Hepes) Orta (2.0 mL microcentrifuge tüp doldurmak için) ekleyerek hazırlayın.
- Santrifüj tüpü 300 x g 18 ° c (ampirik ayarı) 5 min için de kapasitesi. Kompakt bir kırmızı Pelet tüp altındaki (Yani, kapalı-merkezi) duvar görünür olmalıdır. Tüp Pelet yukarı bakacak şekilde döndürme ve tüm 1 – 1,5 mL pipet ucu kullanarak süpernatant gittikçe (iki adımda) dikkatli bir şekilde çıkarın.
- Süpernatant aspirating sonra (resuspend hücreleri) 2000 µL modifiye RPMI 1640 (Hepes) orta, mix ekleyin ve yukarıdaki Santrifüjü ve süpernatant aspirasyon adımları tekrarlayın.
- Pelet (plazma zarı lekeli ve 2 x kırmızı kan hücreleri yıkanmış) değiştirilmiş RPMI 1640 (Hepes) Orta 400 µL ile resuspend. Tüp PMS (plazma zarı leke kısaltması) etiketleyin.
Not: Alternatif olarak, succinimidyl ester daha fazla olur bir pH duyarlı rodamine türev şiddetle floresan Asidik pH, insan kırmızı kan hücreleri etiketlemek için kullanılabilir. Bu durumda, parçacıklar içselleştirilmiş var sonra floresan yoğunluğu phagosome olgunlaşma bir ölçüsü olarak ek olarak hizmet vermektedir.
6. opsonizasyonla (insan (IgG) alyuvarlar fare immünoglobulin G ile etiketleme)
- 1 µL fare (Igg2b) monoklonal (klon HIR2) Anti-insan CD235a Ekle (-20 ° C'de depolanan) (1 mg/mL) antikor plazma zarı içeren PMS (bkz: bölümler 5.2-5,5), etiketli tüp lekeli insan kırmızı kan hücreleri 400 µL ortamda askıya alındı. CD235a (glycophorin A da bilinir) bir erythroid lineage özel membran sialoglycoprotein var.
-
8 dk. Not insan kırmızı kan hücreleri (hücre topaklanma) IgG nedenleri aglutinasyon ile o opsonizasyonla 37 ° C'de kuluçkaya. Aglutinasyon opsonizasyonla görsel bir gösterge hizmet verebilir, tek fagositik efektleri görüntüleme için istenmeyen olsa da. Aglutinasyon aşmak, art arda, örneğin, bir değişken kullanarak hücre süspansiyon (her 1 dk.) 20-200 µL birim pipet mix için 200 µL için ayarlayın.
- 8 dk. kuluçka dönemi sonundaki Eğer istenen, yıkama fluorescently yeşil ile inkübe makrofaj slayt anti-F4/80 antikor etiketli, RPMI 1640 (Hepes) orta 1 mL ile değiştirilmiş. Her iki rezervuarlar kanal slaydın çamaşır adımlardan sonra orta ücretsiz olduğundan emin olun.
7. plazma zarı fagositoz Imaging lekeli ve IgG insan kırmızı kan hücreleri kaplı
- Anti-CD235a antikor (Bölüm 6.2) ile 8 dk kuluçka sonra plazma zarı lekeli ve IgG opsonized insan kırmızı kan hücreleri makrofajlar yeşil flüoresan anti-F4 ile etiketli içeren bir slayt kanalı içine içeren 100 µL süspansiyon pipet / 80 antikor (adım 4). Böylece, kırmızı floresan, IgG opsonized insan kırmızı kan hücreleri yeşil flüoresan fagositler (makrofajlar) eklenir.
- En kısa zamanda insan kırmızı kan hücreleri eklendi, kanal slayt üzerinde dönen disk confocal mikroskop (37 ° C için ayarla sahne kuluçka makinesi ile) Örneğin, bir 60 X görüntüleme için mount / 1,49 petrol-daldırma objektif lens. Parçacıklar 1 dk içinde yerleşmeye başlar bu yana en kısa zamanda görüntüleme başlatın.
Not: floresan boncuk 100 çapı ile kullanarak nm, şiddetindeydi, işlevler, XY çözünürlük x noktası analizi tarafından yayılan 0,22 µm, = y 0,23 µm (488 nm lazer) ve x = 0,27 µm, = y 0,27 µm (561 nm lazer) =. Ancak, photobleaching ve fototoksisite canlı hücreler hızlandırılmış 3D görüntüleme sırasında azaltmak için biz Uzaysal Çözünürlük 2 x 2 binning kullanarak uzlaşma. Binning duyarlılık (geliştirir sinyal-gürültü oranı) ve izin verilen kare hızı artar ama uzaysal çözünürlük pahasına. - Mükemmel bir odak kullanmak (veya benzeri) sistem kayıtları sırasında odak kayması önlemek için. Mükemmel odaklama sistemi aktive sonra makrofaj lamellipodial çıkıntılar hemen üstündeki coverslip üzerine odaklanmak için mahsup denetimini kullanın (aşağıdaki nota bakın) Kanal slayt. Bu odak düzeyi karşılık gelen 0 µm. elde edilir Z-yığınlar-1 µm den 22 Z-dilimlere tutarlar 0.8 µm adımlar, 16 µm için =. Z-yığınlar Örneğin, elde edilebilir (her kanal için) 1 yığın oranında her 15 16 dk toplam s.
Not: Kayıp ana toprak dolay iden photobleaching görüntü kalitesi daha uzun kayıt süre muzdarip. Z-yığınlar her iki kanalı için satın: makrofajlar görüntüsü 488 nm lazer (yeşil kanal) kullanarak ve insan kırmızı kan hücreleri yansıma 561 nm lazer (kırmızı kanalı) kullanarak. Bu yaklaşımı kullanarak, farklı timepoints, insan kırmızı kan hücreleri IgG opsonized sindirerek makrofajlar görünümü elde edilebilir (örneğin, bkz: Şekil 2).
Not: (2 x 2 binning ile) sistemin tipik ayarlar şunlardır: yeşil kanal (%20,5 lazer (50 mW; 488 nm) güç, 101 duyarlılık (Aralık, 0-255) ve 200 ms çekim hızı); kırmızı kanalı (% 10,5 lazer (50 mW; 561 nm) güç, 101 duyarlılık (Aralık, 0-255) ve 98 ms çekim hızı).
Not: Kanal slayt alt bir polimer #1.5 cam coverslip ve cam aynı optik özellikleri olarak aynı kalınlığı ile ancak, özellikle, malzeme gaz geçirgenliği avantajı vardır.
8. fagositoz plazma zarı lekeli ve tamamlayıcı kaplı insan kırmızı kan hücreleri görüntüleme
- Tamamlayıcı opsonize plazma zarı lekeli ve insan kırmızı kan IgG opsonized benzer şekilde bölümler 5 ve 6, dışında 2 mL modifiye RPMI 1640 (Hepes) orta, içine 1:1 seyreltilmiş kırmızı kan hücre süspansiyon pipetting 4 µL yerine kısım 3.3 içinde açıklandığı gibi hücreleri, 4 µL 1 mL modifiye RPMI 1640 (Hepes) orta pipet ve buna göre tüp 4:1, 000 etiket. Böylece, insan kırmızı kan hücreleri 2 x daha fazla konsantre vardır.
- Bölüm 4 ve 5 adımda devam, ama insan kırmızı kan hücrelerinin 4:2,000 seyreltilmiş hisse senedi yerine 4:1,000 ile yola çıkıp (4:1, 000 ve 4:2,000 başlangıçta 1:1 seyreltilmiş insan kırmızı kan hücrelerinin bölümlerde açıklanan sonraki dilutions bakın 3.1 ve 3.2).
- C5 null fare (Örneğin, B10. kurban D2 -Hc0 H2d H2-T18c/oSnJ; Jackson Laboratory) işten çıkarma ve toplama kan tarafından takip (havada % > 5) isoflurane Solunduğunda. Genellikle yaklaşık 0.8 mL kan isoflurane inhalasyon ve işten çıkarma hemen ardından bir yuvarlak alt 14 mL plastik tüp damla.
- Kan tamamen pıhtılaşmış, 1 h sonra içine a 2.0 mL microcentrifuge tüp ve oda sıcaklığında 5 min için 300 x g , santrifüj kalan sıvı aktarın. Daha sonra dikkatle sarımsı serum toplamak. Tipik olarak, en az 200 µL C5 boş serum yeniden elde etmek. C5 boş serum buza koyun.
- İnsan kırmızı kan hücreleri ile IgG plazma zarı 4 dk kuluçka lekeli sonra anti-CD235a antikor (2 x konsantre veren), başka bir 1 µL ekleyin ve sonra hücre süspansiyon 50 µL alıp 50 µL C5 boş içeren bir ayrı 2.0 mL microcentrifuge tüp içinde karıştırın serum. Bölüm 6.2 olduğu gibi başka bir 4 dk için yukarı ve aşağı, pipetting tarafından (her 1 dk.) tekrar tekrar karıştırmak devam edin. Böylece, bu adımdan sonra insan kırmızı kan hücreleri ile anti-CD235a antikor 8 min Toplam inkübe.
Not: 4 dk kuluçka dönemi C5 boş serum ile klasik kompleman cascade etkinleştirip insan kırmızı kan hücreleri oranında ben iC3b için i ciddi C3b ile opsonize yeterlidir.
9. onay, IgG - ve C3b-opsonizasyonla insan kırmızı kan hücrelerinin
-
Fare anti-CD235a (Igg2b; bkz: Bölüm 6.1) IgG antikor ile insan kırmızı kan hücrelerinin opsonizasyonla yeşil veya kırmızı floresan fluorophore için Birleşik keçi Anti-fare (ikincil) IgG antikor ile hücreleri kuluçka onaylayın.
- 1 µL fare anti-CD235a IgG antikor ve 1 µL fluorescently etiketli Anti-fare ikincil antikor insan kırmızı kan hücreleri 400 µL askıya alınmasına ekleyip için 8 dk. 37 ° C'de kuluçkaya. Daha sonra iki kez (Bölüm 5.2-5,5 olduğu gibi) yıkayın.
- Resuspend hücre Pelet 400 µL ile modifiye RPMI 1640 (Hepes) orta ve pipet 100 µL süspansiyon bir kanal içine confocal floresan görüntüleme için slayt (bkz. Şekil 1 c).
Not: Hücreleri olacak takip yıkama ve resuspension ama yıkama yığın (agglutinate) arka plan floresans ilişkisiz ikincil antikor nedeniyle azaltmak gereklidir.
-
Opsonizasyonla insan kırmızı kan hücrelerinin, fare IgG ile önceden etiketli ve C3b/iC3b, örneğin kullanarak, fare Anti-fare C3b/iC3b/C3c antikor ve ikincil bir antikor, örneğin, C5 null fare serum ile Birleşik keçi Anti-sıçan IgG antikor inkübe onaylayın yeşil flüoresan fluorophore için.
- Bölüm 8 günahı insan kırmızı kan hücreleri kullanarak adımlarını yineleyin.
- 0,25 µL Fluorescently etiketli Anti-fare C3b/iC3b/C3c antikor (50 µL IgG etiketli insan kırmızı kan hücreleri + 50 µL C5 null fare serum) 100 µL karışıma ekleyin ve 8 dk 37 ° C'de kuluçkaya.
- İki kere yıka, Pelet 100 µL modifiye RPMI 1640 (Hepes) orta ve pipet süspansiyon bir kanal içine confocal floresan görüntüleme için slayt (bkz. Şekil 1 c) resuspend.
Sonuçlar
Hızlandırılmış iplik confocal mikroskobu tarafından fagositoz görüntüleme için kullanılan kanal slayt bir Şematik diyagramı Şekil 1' de gösterilen. İzole fare ikamet periton makrofajlar (Ms) yeşil flüoresan Alexa Fluor 488 Birleşik anti-F4/80 antikor ile ( etiketlenir ise insan kırmızı kan hücreleri (hRBCs) kırmızı floresan plazma zarı işaretçisiyle CellMask Orange, lekeli Şekil 2), hangi fare makrofajlar belirli bir işaret olarak ve plazma zarı etiket olarak hizmet vermektedir. İnsan kırmızı kan hücreleri fare IgG (mIgG) veya fare IgM (mIgM), (CD235a, olarak da bilinen glycophorin A, özellikle insan kırmızı kan hücreleri üzerinde ifade bir proteindir) IgG (veya IgM) anti-CD235a antikor hücrelerle kuluçka tarafından opsonized. Kırmızı floresan insan kırmızı kan hücreleri ile sunulan yeşil flüoresan makrofajlar hızlandırılmış 3D görüntüleme tek parçacık fagositik Etkinlikler (Şekil 2) görselleştirme sağlar. Tek fagositik olayları yakın gözlem parçacık yakalama ve sindirim belirlenen için ayrıntıları sağlar. Örneğin, bir mIgG opsonized insan kırmızı kan hücresi bir makrofaj filopodium, ince, parmak benzeri bir projeksiyon tarafından yakalanması (Horsthemke ve ark. Ayrıca bkz:Şekil 3A; gözlenen 15). Ayrıca, bir insan kırmızı kan hücre fagositik Kupası oluşumu sırasında sıkma (Şekil 3A) görülebilir. Taze fare serum, mIgG-opsonized, veya mIgM opsonized, insan kırmızı kan hücreleri getirilmesi bir hemolitik membran saldırı kompleks oluşumu culminates klasik kompleman cascade tetikler. Kompleman aracılı hemoliz kinetik hücreleri çift CellMask portakal ve Calcein ile lekeli Imaging tarafından ölçülebilir. Yeşil flüoresan sitozolik Calcein hızla hemoliz (Şekil 3B) sırasında hücrelerden serbest bırakılır.
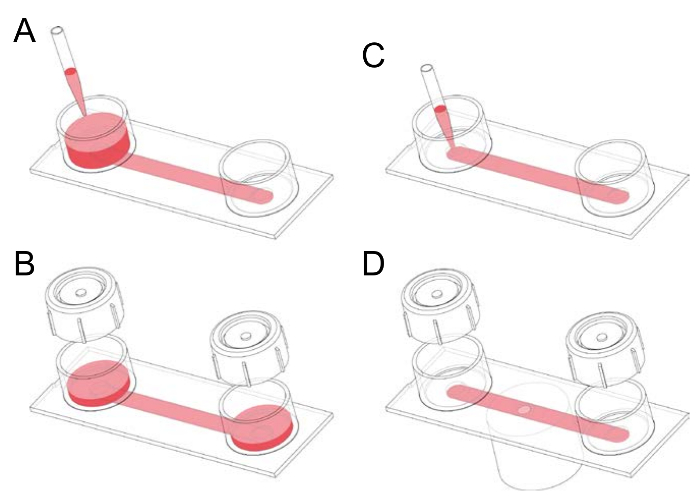
Şekil 1: Kanal fibronektin kaplı slaytları işleme. (A) A Kanal slayt iki rezervuarlar 50 mm x 5 mm 0.4 mm. Kanal slaytlar başlangıçta 1-2 mL orta biri iki rezervuarlar için geçerli ve slayt devirme doldurulmuş boyutlara sahip bir kanal bağlı oluşur. (B) kapaklar rezervuarlar kuluçka önce üzerine yerleştirilebilir. Kapaklar uygun kullanılabilir kanal hücreleri ile tohum önce istenmeyen hava kabarcıkları dışarı pompalamak için. (C) hava kabarcık-Alerjik 100 µL kanal doğrudan bir kanal ağız içine orta pipetting tarafından doldurulabilir. Bu adım, örneğin, tohum makrofajlar içine bir slayt veya gfluorophore (yeşil flüoresan) eklemek için kullanılır-membran etiket, hem de bir fare makrofaj marker hizmet vermektedir konjuge anti-F4/80 antikor. Makrofajlar (opsonized insan kırmızı kan hücreleri gibi parçacıkların bir kanal pipetting ile fluorescently numaralı seribaşı sonraD) lekeli, slayt ters bir mikroskop sahneye yerleştirilebilir ve hızlandırılmış dönen disk confocal mikroskopi olabilir gerçekleştirilen. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 2: fagositoz hızlandırılmış 3D görüntüleme. Fare (m) anti-CD235a immünoglobulin G (mIgG) antikor ve fare makrofajlar (Ms), etiketli hRBCs sunumu ile plazma zarı (kırmızı floresan) insan kırmızı kan hücreleri (hRBCs) lekeli opsonizasyonla gösteren(a)Şematik diyagramı (yeşil floresan) yeşil flüoresan fluorophore Birleşik anti-F4/80 antikor ile etiketlenmiş. (B) Hızlandırılmış görüntüleri (XZ kez), disk confocal mikroskobu, fagositik Kupası oluşumu ve mIgG opsonized hRBCs sindirim gösterilen iplik tarafından elde. Ölçek çubuğu mIgG opsonized hRBCs sindirerek makrofajlar gösterilen 10 µm. (C) 3D rekonstrüksiyon =. (Timepoints 3 için) karşılık gelen XZ görünümleri B. kılavuz boşluğu temsil içinde gösterilir 5.07 µm. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Resim 3: bir parçacık tarafından bir filopodium yakalama. Hızlandırılmış görüntüleri, elde edilen bir fare immünoglobulin G (mIgG) yakalama bir fare makrofaj gösterilen disk confocal mikroskobu iplik tarafından-opsonized insan kırmızı kan hücresi (hRBC) bir filopodium (üst panelinde oklar), üzerinden bir parmak benzeri projeksiyon. Not kırmızı kan hücre erken fagositik Kupası oluşumu sırasında onun crenations kaybeder. Ayrıca, fagositik Kupası saran kırmızı kan hücresi (oklar alt panelinde gösterilir) sıkmak için görünür. Ölçek çubuğu 10 µm. = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Tartışmalar
Fagositoz deneyleri, özellikle son nokta ve yüksek üretilen iş deneyleri, büyük çoğunluğu nasıl parçacıklar aslında yakalanan, zarflı yutulur ve görselleştirme sağlar. Öncü çalışmaları tarafından Munthe-Kaas vd. 10 ve Kaplan2 1970'lerde çarpıcı farklı hücre iskeleti reorganizasyon fagositoz tamamlayıcı opsonized parçacıklar (koyun kırmızı kan hücreleri) karşı IgG opsonized bir yer ileri sürdü. Burada tek fagositik olayların yüksek çözünürlüklü, gerçek zamanlı görüntüleme sağlayan iplik disk confocal mikroskobu kullanılarak fagositoz deneyleri tarif. Bizim model Fagosit bu fare ikamet periton makrofaj hangi-ebilmek var olmak ile en az işleme izole ve taze izole insan kırmızı kan hücreleri tanecik olarak kullanıyoruz. Ancak, fagositoz deneyleri fare kemik iliği türevi makrofajlar veya nötrofil, fare makrofaj hücre hatları, insan monosit kaynaklı makrofajlar veya insan periferik kan nötrofil gibi diğer fagositler için uygulanabilir. İnsan fagositler veya fare nötrofil, alternatif fluorescently antikorlar etiketli, fluorescently etiketli anti-CD14 antikorlar (insan monosit/makrofajlar)16 veya anti-Gr-1 (Ly - 6 G) antikorları (fare gibi gerekli olacaktır nötrofiller).
Unopsonized insan kırmızı kan hücreleri, gibi geleneksel olarak kullanılan koyun kırmızı kan hücreleri, bu hücreler değil (ya da, en az, çok nadiren) fare peritoneal makrofajlar tarafından yutulur anlamda etkisiz. Bu, polistren boncuk aksine düşük arka plan etkinliği sağlar. İnsan kırmızı kan hücreleri elverişli bir konuma sahip fare IgG veya IgM monoklonal antikorlar CD235a karşı kullanarak immünglobulin ile opsonized (a glycophorin) belirli bir işaretleyici insan eritrositler (kırmızı kan hücreleri) ve erythroid öncüleri17, 18. paralel deneyleri içinde fluorescently etiketli Anti-fare IgG veya IgM ikincil antikorlar opsonizasyonla onaylamak için uygulanabilir. IgG ve IgM antikor sınıfları hemagglutinins, agglutinate için kırmızı kan hücreleri neden maddeler (antikor) vardır. Aglutinasyon önlemek için biz zaman zaman hücre süspansiyon 8 dk kuluçka döneminde anti-CD235a antikor ile karıştırın ve daha sonra biz karışık süspansiyon doğrudan bir makrofaj içeren kanal slayt (slayt fibronektin kaplı) yıkama adım olmadan ekleyin . Yıkama adımlar sedimantasyon kırmızı kan hücrelerinin kuvvetle teşvik aglutinasyon Santrifüjü tarafından içerir. İnsan kırmızı kan hücreleri opsonizing önce biz bir lipofilik turuncu/kırmızı floresan sonda ile plazma zarı etiket. Bu sonda parlak hızlandırılmış kayıtları başında floresan, ama sinyal yavaş yavaş, muhtemelen nedeniyle büyük ölçüde19photobleaching kaybolur. Buna ek olarak, makrofajlar ve fibronektin kaplama slaydın zayıf turuncu/kırmızı kayıtları sırasında floresan hale gelebilir. Bu sorun muhtemelen etiketleme sonra yetersiz yıkama insan kırmızı kan hücrelerinin kaynaklanmaktadır. Lipofilik floresan plazma zarı işareti kullanmak yerine, insan kırmızı kan hücreleri, Amin reaktif succinimidyl ester15,20kullanarak pH duyarlı rodamine türevi ile etiketli. Bu görselleştirme phagosome olgunlaşma beri pH15,20azaltılarak floresan yoğunluğu artar ama bu yaklaşım reaktif ester hazırlıklar Şu anda dezavantajı vardır izin vermenin avantajına sahiptir pahalı ve sulu orta rekonstitüsyon sonra kararsız.
IgG-opsonized insan kırmızı kan hücreleri periton makrofajlar kullanarak NOTAM21 ya da Fcer1g- / - izole (Fcer1g nakavt) fareler teyit FcγRs yolu ile yutulur. NOTAM makrofajlar IgG opsonized insan kırmızı kan hücreleri bağlamak ama ITAM (immunoreceptor Tirozin tabanlı etkinleştirme motif) eksikliği - aracılı Fcer1g nakavt makrofajlar yüzey FcγRs. IgG ifade yok ise fagositoz, ikna etmek için gerekli sinyal - veya IgM opsonized insan kırmızı kan hücreleri Ayrıca opsonized (ki iC3b için i ciddi) C3b ile taze izole serum kompleman C5 null fareden hücrelerle kuluçka tarafından (vahşi tipi serum hemoliz neden olur). IgG ve IgM opsonins gözenekleri (membran saldırı kompleksleri) ve hücre lizis oluşumuna yol açar klasik kompleman cascade etkinleştirin. İçinde fare, tamamlayıcı C5 eksik tamamlayıcı cascade C3 bölünme tamamlayacak devam eder, ancak terminal yolu katalize gereken substrat C5 konvertaz yoksun. Tamamlayıcı cascade kinetik ölçmek için basit deneyleri geliştirdik. Kısacası, insan kırmızı kan hücreleri floresan kırmızı, plazma zarı marker ve yeşil floresan, sitozolik fluorophore ile birlikte etiketli olabilir. Karmaşık membran saldırı, C5-C9, kompleman bileşenleri tarafından kurulan sitozolik fluorophore hızla (saniyede) oluşumdur sitozol kaybetti. Görselleştirme tamamlayıcı cascade sonu-efektör (cytolysis) fonksiyonu 4 dk kuluçka süresi insan kırmızı kan hücrelerinin C3b/iC3b opsonizasyonla için yeterli olduğunu belirtti. Paralel deneyleri içinde C3b/iC3b kaplama insan kırmızı kan hücrelerinin kolayca Anti-fare C3b karışımı uyguladıktan sonra değerlendirildi ve fluorescently ikincil antikorlar etiketli. Bu durumda, bir yıkama adım ilişkisiz floresan antikor kaldırmak için gereklidir. Yıkama adım hücre sedimentaion aglutinasyon teşvik, Santrifüjü tarafından içerir rağmen başarılı opsonizasyonla kolayca confocal mikroskobu tarafından tespit edilebilir. Kompleman reseptör aracılı fagositoz yansıma tarafından her iki uygulama IgG- / iC3b-opsonized insan kırmızı kan hücreleri NOTAM veya Fcer1g- / - makrofajlar veya IgM - tanıtımı tarafından / iC3b opsonized insan kırmızı kan hücreleri için vahşi tipi makrofajlar. IgM opsonized kan hücreleri IgG opsonized parçacıklar22fagositoz için gerekli ITAM içeren FcγRs (FcγRI, FcγRIII ve FcγRIV) tarafından tanınmaz.
Fagositik görüntüye olaylar, makrofajlar, plazma zarı da fare makrofajlar belirli bir işareti olarak hizmet vermektedir yeşil flüoresan fluorophore konjuge anti-F4/80 antikor ile etiketli. İnsan kırmızı kan hücreleri kırmızı floresan kuluçka tarafından bir turuncu/kırmızı floresan plazma zarı marker ile yukarıda da açıklandığı gibi işlenebilir. Bu lipofilik plazma zarı işaret etiketleri antikor tabanlı olası karıştırıcı etkilerini önler. Kırmızı floresan insan kırmızı kan hücreleri, ile ya da ezelî opsonizasyonla, doğrudan bir kanal slayt 100 µL kanal pipetted ve 3D hızlandırılmış bir 60 X görüntülü / 1.49 Daldırma yağ (veya benzeri) objektif lens 488 kullanılarak gerçekleştirilen nm ve 561 nm lazer çizgileri , sırasıyla, bir iplik disk confocal (veya benzeri) mikroskop. Bu sistemin yüksek çözünürlüklü görüntü ama tekrarlanan Z yığınlarının üzerinde 16 dk edinimi için en iyi duruma getirmek için cazip olduğunu ya da çok önemli photobleaching ve fototoksisite neden olabilir. 2 x 2 iyi sinyal-gürültü oranı teşvik ve indirimleri uyarma yoğunluğu ve/veya pozlama süreleri, ancak optik çözünürlük sağlamak için binning kullanmayı seçtiniz. Buna ek olarak, fototoksisite azaltmak için biz bir çöpçü reaktif oksijen türleri, Orta olarak ekleyin. Gelecek çalışmalarda, deneyleri apoptotik insan kırmızı kan hücreleri fagositoz görüntü için değiştirilmiş olabilir. Bir Ca2 + ionophore, A23187 gibi uygulanması bir "ye beni" Fosfatidilserin dışa23, sinyal ve hallmark erken apoptozis24,25ikna etmek için kullanılabilir.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu eser HA 3271/4-1 ve HA 3271/4-2 DFG (Deutsche Forschungsgemeinschaft) üzerinden hibe ve hibe FF-2016-05 EXC 1003 (küme, mükemmellik 1003), hareket (CIM), DFG hücreleri tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 24 G plastic catheter | B Braun Mesungen AG, Germany | 4254503-01 | Used for peritoneal lavage |
| Hank’s buffered salt solution without Ca2+ and Mg2+ | Thermo Fisher Scientific | 14170120 | Used for peritoneal lavage |
| 14 mL polypropylene round bottom tubes | BD Falcon | 352059 | Used to collect peritoneal cells |
| RPMI 1640 medium containing 20 mM Hepes | Sigma-Aldrich | R7388 | Basis medium for assays |
| Heat-inactivated fetal bovine serum | Thermo Fisher Scientific | 10082139 | Used as supplement for RPMI 1640 media |
| 100x penicillin/streptomycin | Thermo Fisher Scientific | 15140122 | Used as supplement for RPMI 1640 media |
| Fibronectin-coated µ-Slide I chambers | Ibidi, Martinsried, Germany | 80102 | Channel slides used for assays |
| µ-Slide (anodized aluminum) rack | Ibidi, Martinsried, Germany | 80003 | Autoclavable stackable rack for channel slides |
| RPMI 1640 medium containing bicarbonate | Sigma-Aldrich | R8758 | Medium for overnight culture |
| N-(2-mercaptopropionyl)glycine | Sigma-Aldrich | M6635 | Scavenger of reactive oxygen species |
| Alexa Fluor 488-conjugated rat (IgG2a) monoclonal (clone BM8) anti-mouse F4/80 antibody | Thermo Fisher Scientific | MF48020 | Mouse macrophage marker and plasma membrane label |
| CellMask Orange | Thermo Fisher Scientific | C10045 | Red fluorescent plasma membrane stain |
| Succinimidyl ester of pHrodo | Thermo Fisher Scientific | P36600 | Amine-reactive succinimidyl ester of pHrodo |
| Mouse (IgG2b) monoclonal (clone HIR2) anti-human CD235a | Thermo Fisher Scientific | MA1-20893 | Used to opsonize human red blood cells with IgG |
| Alexa Fluor 594-conjugated goat anti-mouse (secondary) IgG antibody | Abcam | Ab150116 | Used to confirm opsonization of human red blood cells with mouse IgG |
| Rat anti-mouse C3b/iC3b/C3c antibody | Hycult Biotech | HM1065 | Used to confirm C3b/iC3b opsonization of human red blood cells |
| Alexa Fluor 488-conjugated goat anti-rat IgG antibody | Thermo Fisher Scientific | A-11006 | Used as secondary antibody to confirm C3b/iC3b opsonization |
| Calcein/AM | Thermo Fisher Scientific | C3100MP | Used to load human red blood cells with Calcein |
| UltraVIEW Vox 3D live cell imaging system | Perkin Elmer, Rodgau, Germany | Spinning disk confocal microscope system | |
| Nikon Eclipse Ti inverse microscope | Nikon, Japan | Inverted microscope | |
| CSU-X1 spinning disk scanner | Yokogawa Electric Corporation, Japan | Nipkow spinning disk unit | |
| 14-bit Hamamatsu C9100-50 Electron Multiplying-Charged Couple Device (EM-CCD) peltier-cooled camera | Hamamatsu Photonics Inc., Japan | EM-CCD camera of the spinning disk confocal microscope system | |
| 488 nm solid state laser, 50 mW | Perkin Elmer, Rodgau, Germany | Laser (488 nm) source of spinning disk confocal microscope system | |
| 561 nm solid state laser, 50 mW | Perkin Elmer, Rodgau, Germany | Laser (561 nm) source of spinning disk confocal microscope system |
Referanslar
- Tauber, A. I. Metchnikoff and the phagocytosis theory. Nature reviews. Molecular cell biology. 4, 897-901 (2003).
- Kaplan, G. Differences in the mode of phagocytosis with Fc and C3 receptors in macrophages. Scandinavian journal of immunology. 6, 797-807 (1977).
- Cooper, J. A. Effects of cytochalasin and phalloidin on actin. The journal of cell biology. 105, 1473-1478 (1987).
- Caron, E., Hall, A. Identification of two distinct mechanisms of phagocytosis controlled by different Rho GTPases. Science. 282, 1717-1721 (1998).
- Aderem, A., Underhill, D. M. Mechanisms of phagocytosis in macrophages. Annual review of immunology. 17, 593-623 (1999).
- Chimini, G., Chavrier, P. Function of Rho family proteins in actin dynamics during phagocytosis and engulfment. Nature cell biology. 2, E191-E196 (2000).
- Castellano, F., Chavrier, P., Caron, E. Actin dynamics during phagocytosis. Seminars in immunology. 13, 347-355 (2001).
- Swanson, J. A. Shaping cups into phagosomes and macropinosomes. Nature reviews. Molecular cell biology. 9, 639-649 (2008).
- Underhill, D. M., Goodridge, H. S. Information processing during phagocytosis. Nature reviews. Immunology. 12, 492-502 (2012).
- Munthe-Kaas, A. C., Kaplan, G., Seljelid, R. On the mechanism of internalization of opsonized particles by rat Kupffer cells in vitro. Experimental cell research. , 201-212 (1976).
- Rougerie, P., Miskolci, V., Cox, D. Generation of membrane structures during phagocytosis and chemotaxis of macrophages: role and regulation of the actin cytoskeleton. Immunological reviews. , 222-239 (2013).
- Liu, Z., et al. Nanoscale optomechanical actuators for controlling mechanotransduction in living cells. Nature. 13, 143-146 (2016).
- Valentim, A. M., Guedes, S. R., Pereira, A. M., Antunes, L. M. Euthanasia using gaseous agents in laboratory rodents. Laboratory animals. 50, 241-253 (2016).
- McCarren, H. S., Moore, J. T., Kelz, M. B. Assessing changes in volatile general anesthetic sensitivity of mice after local or systemic pharmacological intervention. Journal of visualized experiments. (80), e51079 (2013).
- Horsthemke, M., et al. Multiple roles of filopodial dynamics in particle capture and phagocytosis and phenotypes of Cdc42 and Myo10 deletion. The Journal of biological chemistry. 292, 7258-7273 (2017).
- Bzymek, R., et al. Real-time two- and three-dimensional imaging of monocyte motility and navigation on planar surfaces and in collagen matrices: Roles of Rho. Scientific reports. 6, 25016 (2016).
- Poole, J. Red cell antigens on band 3 and glycophorin A. Blood reviews. 14, 31-43 (2000).
- Aoki, T. A Comprehensive review of our current understanding of red blood cell (RBC) glycoproteins. Membranes. 7, (2017).
- Song, L., Hennink, E. J., Young, I. T., Tanke, H. J. Photobleaching kinetics of fluorescein in quantitative fluorescence microscopy. Biophysical journal. 68, 2588-2600 (1995).
- Miksa, M., Komura, H., Wu, R., Shah, K. G., Wang, P. A novel method to determine the engulfment of apoptotic cells by macrophages using pHrodo succinimidyl ester. Journal of immunological. 342, 71-77 (2009).
- Boross, P., et al. FcRgamma-chain ITAM signaling is critically required for cross-presentation of soluble antibody-antigen complexes by dendritic cells. Journal of immunology. , 5506-5514 (2014).
- Ehrenstein, M. R., Notley, C. A. The importance of natural IgM: scavenger, protector and regulator. Nature reviews. Immunology. 10, 778-786 (2010).
- Closse, C., Dachary-Prigent, J., Boisseau, M. R. Phosphatidylserine-related adhesion of human erythrocytes to vascular endothelium. British journal of haematology. , 300-302 (1999).
- Barth, N. D., Marwick, J. A., Vendrell, M., Rossi, A. G., Dransfield, I. The "phagocytic synapse" and clearance of apoptotic cells. Frontiers in immunology. 8, 1708 (2017).
- Sivagnanam, U., Palanirajan, S. K., Gummadi, S. N. The role of human phospholipid scramblases in apoptosis: An overview. Biochimica et biophysica acta. 1864, 2261-2271 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır