Method Article
마우스 대 식 세포에 의해 식 균 작용의 시간 경과 3D 영상
요약
여기는 마우스 주민 복 막 대 식 세포에 의해 회전 디스크 confocal 현미경 이미지 단일 phagocytic 이벤트를 사용 하 여 방법에 설명 합니다. 프로토콜은 다른 phagocytic 세포를 확장할 수 있습니다.
초록
먹어서 조직 개발 및 유지 보수, 뿐만 아니라 호스트 방어에 핵심적인 역할 그리고 캡처, 봉투 및 큰 입자를 삼 켜 걸 골격의 급속 하 고, 수용 체-중재 재배열을 포함 한다. Phagocytic 수용 체, 하류 신호 경로 이펙터로 GTPases 같은 확인 되었습니다, 있지만 불분명 하 게 남아 있는 특정 수용 체-중재 phagocytic 이벤트의 동적 cytoskeletal 개장. 4 년 전, 식 균 작용, Fcγ 수용 체 (FcγR) 및 보완의 수용 체 (CR)-에 의해 exemplified의 두 가지 메커니즘 먹어서 중재, 스캐닝 전자 현미경을 사용 하 여 발견 했다. 면역 글로불린 G (IgG) 바인딩-FcγRs opsonized 입자가 완전히 동봉 하 고 셀에 철회 된다 전에 처음 입자 주위 소위 phagocytic 컵을 형성 하는 얇은 막 확장의 돌출을 트리거합니다. 반면, 보완 opsonized 입자 보완 하는 수용 체에 바인딩을 다음 식으로 표시 됩니다. 먹어서, phagocytic 컵 형성, 침 몰의 이러한 두 가지 모드는 문학에서 잘 설립 되었다. 그러나, 두 가지 모드 사이의 구분 보고서 보완 수용 체-중재 먹어서 그 다양 한 막 돌출을 유발 수 있습니다 흐리게 되 있다. 이미징 기술을 높은 해상도의 가용성, 먹어서 분석 실험은 필요한 있도록 어떻게 특정 phagocytic 수용 체의 실시간 3D (3 차원) 시각화 중재 하십시오 개별 입자의 통풍 관. 더 일반적으로 먹어서, 끝점 분석 실험 등의 연구에 대 한 접근을 사용, 입자 및 식 세포의 인터페이스에서 일어나는 이해 하는 기회를 놓치지. 여기 phagocytic 분석 실험, 저속 회전 디스크 confocal 현미경 검사 법, 단일 phagocytic 이벤트의 3D 이미지를 허용 하는 사용 하 여 설명 합니다. 또한, 우리는 명확 하 게 이미지 Fcγ 수용 체-또는 수용 체-중재 먹어서 보완을 분석을 설명 합니다.
서문
불가사리 유 충, 1882 년, phagocytic mesenchyme 셀 Metchnikoff의 관찰과 먹어서1의 그의 이론의 후속 개발 하기 전에 20 년 1862, 혈액에 의해 불용 성 염료 입자의 engulfment에서에서 어니스트 Haeckel 설명, Thetis fimbris (테 티 스 fimbria), 육 식 바다 민 달팽이 (어니스트 Haeckel 종의의 셀. Radiolarien (Rhizopoda radiaria)을 다이:의 Monographie; Druck und Verlag 폰 게오르그 Reimer, 베를린, 1862). 그 이후 세포질으로 채택 하 고 세포 핵 주위 축적 했다 입자를 포함 하는 막 돌출 명시적으로 설명 하 고. 이상 100 년 후, 카 플 란에 의해 선구적인 연구 먹어서2의 적어도 2 개의 형태학 상으로 다른 메커니즘 했다 제안 했다. 카 플 란 했다 스캐닝 전자 현미경 복 막 마우스를 사용 하 여 대 식 세포는 IgG opsonized 양 적혈구까지 도달 하 고 단단히 덮여 입자는 얇은 막 확장을 사용 하 여, 처음에 컵 모양의 기한 섭취 구조입니다. 이후 말라 역학3차단 하 알려져 B 세포 침투성 곰 팡이 독 소 cytochalasin에 의해 폐지 되었다 phagocytic 컵 형성 말라 합이 필요 합니다. 반면, 양 적혈구 세포 보완 opsonized 등장 막 확장의 생성 없이 대 식 세포에 직접 하지만, 일부 이미지를 막 주름 침 몰 입자의 바로 근처에서 볼 수 있다. Phagocytic 컵 형성, 달리 보충 수용 체-중재에서 침 몰 했다 insenstive cytochalasin B 치료2. 카 플 란에 의해 설명 된 실험에서 보완 opsonization 수행한 잠복기 면역 글로불린 M (IgM) 라는 양 적혈구 혈 보완 C5-종속 터미널에 의해 circumvents 보완 C5 불충분 한 쥐에서 혈 청으로 복잡 한 보완.
카 플 란에 의해 식별 먹어서, phagocytic 컵 형성, 침 몰의 두 가지 모드는 필드4,,56,7,8,9 설립된 의견 되고있다 . 그러나, 초 고해상도 이미지 Munthe 카스 외 에 의해 비슷한 연구로 서2, 카 플 란 의해 원래 연구에 사용 10, phagocytic 이벤트의 스냅샷을 제공. 최근 리뷰, Rougerie 외. 11 FcγR 및 CR 중재 먹어서 형태학 차이점을 명확히 해야 유지 및 보완 수용 체-중재 입자 통풍 관2중 막 주름 관찰 되었습니다 또한, 강조 했다. 입자 캡처에서 유전자와 결합 하 여 국제화에 걸친 단일 phagocytic 이벤트의 라이브 셀 이미징 마우스 모델을 수정, 크게 식 세포 캡처하고 입자 섭취에 대 한 우리의 이해를 향상 시킬 수 있습니다. 한 가지 방법은 고속 원자 힘 현미경 (AFM) 초 고해상도 (10-20 nm) 지형 영상 살아있는 세포의 수는 사용 될 수 있습니다. 최근, 고속 AFM 시스템12 는 개발 되었습니다, 저 잡음으로 빠르게 이미징 셀 표면에 적합. 이 기술은 장점이 셀 고정 및 한계점의 건조 필요로 하는 전자 현미경을 스캐닝과 달리 짧은 간격 (초)으로 측정 될 수 있다 생활의 그 고해상도, 지형 및 기계적인 매개 변수 셀입니다. 또 다른 방법은 시간 경과 3D confocal 현미경 검사 법, phototoxicity 및 표백 제한 요인 중 녹음 비록 널리 사용할 수 있는 것입니다. 이 이렇게 매우 다양 한 그리고 높은 공간 해상도와 단면 광 수 이며 엄청난 다양 한 유전자 인코딩된 형광 단백질을 포함 하 여 형광 프로브로에 특별 한 유연성을 가능 하 게. 여기 우리가 먹어서 분석 실험 시간 경과 회전 디스크 confocal 현미경 검사 법을 사용 하 여 특정 수용 체-중재 phagocytic 이벤트의 고해상도 spatiotemporal 수 있도록 설명 합니다.
프로토콜
프로토콜 동물 보호 지침 뿐만 아니라 우리 지역 인간 연구 윤리 위원회의 지침을 따릅니다.
1입니다. 거주 마우스 복 막 대 식 세포의 고립
- 희생 마우스 (3-4 개월 (중 성별); 예: C57BL/6 변형) 휘발성 마 취 isoflurane의 과다를 사용 하 여 (> 5% 공기에서) 또는 이산화 탄소13뒤에 자 궁 경관 탈 구. 마 취의 유도 발 철수 반사의 손실에 의해 뿐만 아니라 righting 반사14의 손실에 의해 쉽게 평가 될 수 있다.
- 청소 후 물에 80% 에탄올과 마우스의 배, 중간 피부 절 개를 만들고 기본 복 부 벽을 노출.
- Peritonium와 게와 2 x 4.5 mL 차가운 행 크의 버퍼링 된 소금물 (HBSS), 캘리포니아2 + 그리고 마그네슘2 +5 mL 플라스틱 주사기를 통해 없이 구멍으로 24 G 플라스틱 카 테 터를 놓습니다. 주입, 동안 두고 약 0.5 mL 잔류 HBSS (5-4.5 mL (주입) = 0.5 mL) 경우에서 주사기에 조직 카 테 터의 끝으로 빨려 고 퇴 학. 폴 리 프로필 렌 14 mL 라운드 하단 관과 상 온에서 6.5 분 300 x g 에서 원심 분리기에 aspirated 정지를 전송 합니다.
참고: 플라스틱 카 테 터의 끝은 무딘은 바늘에 비해 복 부 내용에 부상 최소화. 일반적으로, 다음 부드러운 복 부 마사지, 8 mL 복 막 세포 현 탁 액은 복 막 구멍에서 검색할 수 있습니다. - 삭제는 상쾌한 고 1 mL 중 탄산염-무료 RPMI 1640 매체 20 mM Hepes, 10% 열 비활성화 태아 둔감 한 혈 청 및 항생제, 페니실린 (100 단위/mL)와 스 (100 µ g/mL), 준비 등의 복 셀 resuspend 100 x 페니실린/스 1: 100 희석 이 일반적으로 약 6 x 106 셀/mL의 농도 제공합니다.
참고: 격리 된 복 막 세포의 약 30%는 대 식 세포, 반면 다른 (더 작은) 세포는 림프 톨, 주로 B 세포.
2. 채널에 복 막 세포의 시드 슬라이드
-
Fibronectin 코팅 채널 슬라이드의 prefilled 채널 (볼륨, 100 µ L)으로 100 µ L 정지 pipetting 응집 감소를 아래로 세포 현 탁 액, 후 플라스틱 (100 µ L 채널은 크기 (길이 x 너비 x 높이): 50 m m x 5 m m 0.4 m m).
- 채널 슬라이드의 두 저수지 중 하나에 1 mL 보충 하는 혈 청 RPMI 1640 (Hepes) 매체를 추가, 슬라이드, 기울기 및 다음 다운스트림 저수지 (그림 1)에서 중간 발음 하 여 챔버를 프리 필.
- 기포 제거 원치 않는, 또는 두 저수지 중 하나에 1-2 mL 매체를 추가, 단단히 저수지 캡 적용 뚜껑에 리듬 엄지 압력을 통해 공기를 밖으로 양수 하 고, 필요한 경우, 슬라이드를 기울이기 하 여 채널에서 공기의 긴 스트립. 공기를 추방 후 세척제 저수지와 슬라이드 기울기 (와 매체를 포함)는 채널에 다시 빨려 공기를 피하기 위해 모자를 제거 하기 전에 하향.
- 채널 슬라이드의 두 저수지 중 하나에 1 mL 보충 하는 혈 청 RPMI 1640 (Hepes) 매체를 추가, 슬라이드, 기울기 및 다음 다운스트림 저수지 (그림 1)에서 중간 발음 하 여 챔버를 프리 필.
- 품 어 채널 슬라이드, 셀, CO2 의 부재에서 37 ° C에서 2 시간에 대 한 습 한 챔버에 시드 (CO2 HCO3이후 필요 하지 않습니다-/CO2 버퍼 시스템은 Hepes로 대체). 채널 슬라이드 8 슬라이드를 보유 하는 선반에 편리 하 게 놓일 수 있다. 최대에 10 이상의 있지만 일반적으로 6-8 슬라이드 한 마우스에서 준비가 되어 있습니다.
-
랙 제거와 RPMI 1640 중간 포함 중 탄산염, 페니실린/스로 서 10% 태아 둔감 한 혈 청, 보충에 대 한 각 슬라이드에 RPMI 1640 (Hepes) 매체를 교환 합니다.
- 슬라이드를 기울기와 낮은 저수지에서 그리고 위쪽 저수지에서 매체를 먼저 발음. 다음, 저수지 중 하나에 새로운 매체의 1 mL을 추가, 채널을 통해 흘러가 후 다운스트림 저수지에서 슬라이드와 aspirate 매체를 기울이고.
- 이 세척 (중간 교환) 단계 후 1 mL 매체는 저수지 중 하나를 추가 하 여 채널 슬라이드를 작성.
참고: 매우 간단 하 고 효과적인 솔루션 exchange 및 비 부착 한 세포 제거는 채널 슬라이드를 사용 하 여 단계를 세척입니다. RPMI 1640 (중 탄산염) 매체는 일반적으로 5% CO2 하룻밤 열 및 pH 균형을 보장 하기 위해 미리 incubated note.
- 5% CO2습도 인큐베이터에서 37 ° C에서 하룻밤 셀을 품 어. 다음 날에 실험을 수행 합니다.
3입니다. 인간의 혈액 세포의 고립
- 하루에 2 (두 번째 날의 실험, 절연된 복 막 대 식 세포의 하룻밤 부 화 후), heparinized 관으로 건강 한 기증자 로부터 1-2 mL 주변 정 맥 혈액을 수집. 1 mL 둥근 바닥 2.0 mL (폴 리 프로필 렌) microcentrifuge 튜브, 18 ° C (경험적 설정)에서 5 분에 대 한 300 x g에서 원심 분리기로 전송, 상쾌한 (플라즈마와 버 피 코트)를 제거 하 고.
- 부드럽게 sedimented 붉은 혈액 세포의 100 µ L를 발음 하 고 수정 된 RPMI 1640 (Hepes) 매체 (아래 설명 참조) 둥근 바닥 2.0 mL microcentrifuge 관에서이 볼륨 1:1 혼합. "1:1" 튜브를 레이블을 지정 합니다.
참고: 셀을 분리 후 하루에 2 (분석)에 대 한 사용 RPMI 1640 (Hepes) 매체를 포함, 10% 열 비활성화 태아 둔감 한 혈 청, 페니실린 (100 단위/mL), 스 (100 µ g/mL), 및 1 m m N-(2-mercaptopropionyl) 글리신 (감소 시키기 위하여 phototoxicity)입니다. 여기서 부터는,이 매체 이라고에 "수정된" RPMI 1640 (Hepes) 매체. - 2 mL에 1:1 희석된 적혈구 현 탁 액의 4 µ L 플라스틱 RPMI 1640 (Hepes) 매체, 사전 2.0 mL microcentrifuge 튜브에 pipetted (이 단계를 반복 2 튜브를 준비 하는 즉, ). 각 튜브 "4:2000" 상표. 얼음에 "1:1" 및 "4:2000" 튜브를 놓습니다.
4. 대 식 세포 원형질 막의 라벨
- CO2 배양 기에서 시드 채널 슬라이드를 제거 하 고 수정 된 RPMI 1640 (Hepes) 매체에 대 한 각 슬라이드에 RPMI 1640 (중 탄산염) 매체를 교환. 다음, CO2의 부재에서 37 ° C에서 촉촉한 챔버에 세포를 놓습니다.
참고: 야간 보육 세척 후에, 세포의 대부분 채널에서 제거 됩니다. 나머지 부착 세포의 대부분은 대 식 세포, 면역 형광 염색 법 또는 형태학 상으로 안티-F4/80 항 체를 사용 하 여 확인할 수 있습니다. 약 마우스 주민 복 막 대 식 세포의 95%는 긍정적인 F4/80. - 항 체 (4 ° C에서 저장 된) 1:40 수정된 RPMI 1640 (Hepes) 매체에 놓여있는지 녹색 레이블이 반대로 마우스 F4/80 희석. 슬라이드, 틸트 및 슬라이드의 100 µ L 채널의 개통으로 항 체 혼합물의 (드롭) 100 µ L를 플라스틱 ( 그림 1참조). 다운스트림 저수지로 흐르는 매체 발음 37 ° C (CO2없이, 습도 환경)에서 20 분에 대 한 셀을 품 어. 인큐베이션 기간 동안 레이블을 인간의 적혈구 (5 항 참조).
참고: 위의 언급, CO2 필요 하지 않습니다 HCO3이후-/CO2 버퍼 시스템 Hepes로 대체 됩니다. - 후 20 분 부 화 시간 (동안 인간의 적혈구 스테인드 opsonized), 세척 1 mL을 추가 하 여 슬라이드 수정 RPMI 1640 (Hepes) 매체 중 저수지와 후 채널을 통해 이동 했다 매체를 발음에 의해 촉진 슬라이드 기울이기 단기 저장을 위해 1 mL 매체를 추가 하거나 (즉, 입자 (opsonized 붉은 혈액 세포)에 pipetting 및 저속 회전 디스크 confocal 현미경 검사 법에 의해 식 균 작용 이미징) 실험을 진행 합니다.
5. 라벨 인간의 혈액 세포의 원형질 막
- (섹션 4.2) 후 녹색 붙일 레이블된 안티-F4/80 항 체와 세포의 슬라이드 배양 직후 인간의 혈액 세포의 라벨을 시작 합니다. 부드러운 혼합 후, "4:2000" 튜브 (섹션 3.3 참조) 중 하나에서 400 µ L를가지고 고 (둥근 바닥) 2.0 mL microcentrifuge 튜브로 분배. 37 ° C의 주위에 따뜻한 서 스 펜 션에 대 한 시간을 허용 (단락 아래 참조). 0.4 µ L 오렌지/레드 형광 플라즈마 막 얼룩 (aliquots-20 ° C에 저장)을 추가 하 고 혼합 5 분 동안 37 ° C에서 품 어.
참고: 층 류 후드 안에 온수 알루미늄 블록 슬라이드를 준비 하는 동안 열 손실을 최소화 하는 데 유용 합니다. 튜브 난방 블록와는 별도의 구멍 우물에 배치 될 수 있습니다 또는 통합, 온수 알루미늄 플레이트를 작업 공간으로 사용할 수 있습니다. - 5 분 잠복기 후 1600 µ L 수정 RPMI 1640 (Hepes) 매체 (2.0 mL microcentrifuge 관을 채우기)를 추가 하 여 첫 번째 세척 단계를 준비 합니다.
- 18 ° C (경험적 설정)에서 5 분에 대 한 300 x g 에서 튜브 원심 소형 빨간 펠 릿 아래쪽 튜브의 벽 (즉, 오프 센터)에 표시 되어야 합니다. 튜브를 회전 하는 펠 릿은 위쪽으로 직면 하 고 있다 고 조심 스럽게 1-1.5 mL 피 펫 팁을 사용 하 여 연속 (2 단계)에 상쾌한의 모든을 제거 합니다.
- 발음은 상쾌한, 후 2000 µ L 수정 RPMI 1640 (Hepes) 중간 혼합 (resuspend 세포), 추가 하 고 위의 원심 분리와 상쾌한 포부 단계를 반복 합니다.
- 수정 된 RPMI 1640 (Hepes) 매체의 400 µ L로 펠 릿 (원형질 막의 스테인드과 2 x 세척 적혈구)를 resuspend. PMS (플라즈마 막 얼룩에 대 한 약어) 튜브 라벨.
참고: 또는, 더는 pH에 민감한 rhodamine 파생의 succinimidyl 에스테 르 산 성 pH에서 형광 인간의 붉은 혈액 세포를 사용 하는 수 강하게. 이 경우에, 형광 강도 또한 역할 phagosome 성숙의 입자 내 면 후.
6. opsonization 인간의 적혈구와 마우스 면역 글로불린 G (IgG)의 (라벨)
- 추가 1 µ L 마우스 (IgG2b) 단일 클로 널 (클론 HIR2) 반대로 인간 CD235a (1 mg/mL) 항 체 (-20 ° C에서 저장 된) 포함 하는 플라즈마 멤브레인 PMS (섹션 5.2-5.5 참조), 표시 된 튜브 얼룩진 인간의 적혈구 400 µ L 매체에. CD235a (glycophorin A 라고도 함)은 erythroid 계보 특정 막 sialoglycoprotein.
-
8 분 참고 IgG 원인 교착 (셀 clumping)와 인간의 적혈구의 그 opsonization 37 ° C에서 품 어. 교착 opsonization 시각적 표시기 역할을 할 수, 하지만 그것은 단일 phagocytic 효과의 이미징에 대 한 바람직하지 않다입니다. 우회 교착, 반복적으로 혼합 사용 하 여, 예를 들어 변수 셀 정지 (1 분 마다) 20-200 µ L 볼륨 피 펫 200 µ L을 설정 합니다.
- 8 분 잠복기의 끝, 원하는, 세척 하는 경우 녹색 붙일 incubated macrophage 슬라이드 안티-F4/80 항 체 라는, 1 mL와 함께 수정 RPMI 1640 (Hepes) 매체. 세척 단계 후 채널 슬라이드의 두 저수지 매체의 무료 인지 확인 합니다.
7. 이미징 원형질 막 먹어서 스테인드 및 인간의 적혈구 세포 IgG-코팅
- 안티-CD235a 항 체 (6.2 단원)로 8 분 부 화 후 플라스틱 원형질 막 얼룩이 지 고 IgG opsonized 인간의 적혈구 세포 형광 녹색 안티-f 4와 함께 표시를 포함 하는 슬라이드의 채널에 포함 된 100 µ L 정지 / 80 항 체 (4 단계) 따라서, 빨간색 형광, IgG opsonized 인간의 적혈구 녹색 형광 식 세포 (macrophages)에 추가 됩니다.
- 최대한 빨리 인간의 적혈구 추가한 탑재 채널 슬라이드 회전 디스크 confocal 현미경에 (37 ° C로 설정 단계 인큐베이터) 60 X 통해, 예를 들어 이미지에 대 한 / 1.49 기름 침수 렌즈. 입자 1 분 이내 정착 하기 시작 하는 때문에, 가능한 한 빨리 이미징 시작 합니다.
참고: 사용 하 여 형광 구슬 100의 직경 nm, 측정, 포인트의 분석에 의해 확산 기능, x의 XY 해상도 = 0.22 μ m, y = 0.23 µ m (488 nm 레이저) 및 x = 0.27 µ m, y = 0.27 µ m (561 nm 레이저). 그러나, 살아있는 세포의 시간 경과 3D 이미징 동안 photobleaching 및 phototoxicity를 줄이기 위해, 우리는 2 x 2 비 닝을 사용 하 여 공간 해상도 타협. 감도 (신호 대 잡음 비율 개선) 및 허용 프레임 속도 증가 binning 하지만 공간적 해상도. - 완벽 한 초점을 사용 하 여 (또는 유사한) 녹음 동안 초점 드리프트를 방지 하기 위해 시스템. 완벽 한 초점 시스템을 활성화 한 후 바로 위에 coverslip macrophage lamellipodial 돌출에 초점을 오프셋된 컨트롤 사용 하 여 (아래 참고 참조) 채널 슬라이드의. 이 초점 수준은 해당 z = 0 µ m. 받기 Z-스택-1 µ m에서 16 µ m 0.8 µ m 단계에서 22의 Z 슬라이스로 금액. Z-스택 얻어질 수 있다, 예를 들어 1 스택 (각 채널)에 대 한의 모든 15 16 분의 총에 대 한 s.
참고: 더 이상 녹음 기간 photobleaching 때문에 주로 이미지 품질의 손실에서 고통. Z-스택 두 채널의 각각에 대 한 인수: 대 식 세포는 488 nm 레이저 (녹색 채널)을 사용 하 여 몇 군데와 인간의 적혈구 561 nm 레이저 (빨강 채널)을 사용 하 여 몇 군데 있다. 이 방법을 사용 하 여, 대 식 세포 IgG opsonized 인간의 적혈구 다른 timepoints에 복용의 다양 한 플레이 얻어질 수 있다 (예를 들어 그림 2참조).
참고: (2 x 2 비 닝)와 시스템의 일반적인 설정 됩니다: 녹색 채널 (20.5% 레이저 (50 mW, 488 nm) 전원, 101 감도 (0-255 범위) 및 200 ms 노출 시간); 빨강 채널 (10.5% 레이저 (50 mW; 561 nm) 전원, 101 감도 (0-255 범위) 및 98 ms 노출 시간).
참고: 채널 슬라이드 하단의 #1.5 유리 coverslip와 유리, 동일한 광 속성으로 동일한 두께와 폴리머 이지만, 특히, 재료는 가스 침투성의 이점이 있다.
8. 이미징 스테인드 원형질 막 및 보수 코팅 인간의 적혈구 세포의 식 균 작용
- 원형질 막 보수 opsonize 얼룩이 지 고 IgG opsonized 인간의 붉은 혈액 세포 마찬가지로 섹션 5와 6을 제외 하 고, 수정 2 mL RPMI 1640 (Hepes) 중간으로 1:1 희석된 적혈구 현 탁 액의 pipetting 4 µ L 대신 섹션 3.3에 설명 된 대로 수정 1 mL RPMI 1640 (Hepes) 매체로 4 µ L 플라스틱 및 그에 따라 튜브 4:1, 000을 레이블. 따라서, 인간의 적혈구는 2 배 더 많은 집중.
- 섹션 4와 5 단계를 진행 하지만 인간의 혈액 세포의 4:2,000 희석 주식 보다는 4:1,000와 함께 시작 (4:1, 000와 4:2,000를 참조 하십시오 처음 1:1 희석된 인간의 적혈구 섹션에 설명 된의 후속 희석 3.1 그리고 3.2)입니다.
- C5 null 마우스 (예를 들어, B10 희생. D2-Hc0 h 2d h 2-T18c/oSnJ; 잭슨 실험실) (> 5% 공기에서) isoflurane 흡입 잘린, 및 수집 혈액에 의해. 우리는 일반적으로 둥근 바닥 14 mL 플라스틱 튜브 isoflurane 흡입 및 잘린 직후에 혈액의 약 0.8 mL 똑.
- 1 시간 후 혈액 응고 완전히 때는 2.0 mL microcentrifuge 튜브 및 실 온에서 5 분에 대 한 300 x g 에서 원심 분리기에 잔여 액체를 전송 합니다. 이후에, 신중 하 게 노란 혈 청을 수집 합니다. 일반적으로, 우리는 적어도 200 µ L C5 null 혈 청을 복구합니다. 얼음에 C5 null 혈 청을 놓습니다.
- 원형질 막의 4 분 인큐베이션 스테인드 IgG와 인간의 적혈구, 후 (집중 x 2에 게 주는), 안티-CD235a 항 체의 또 다른 1 µ L을 추가 셀 서 스 펜 션의 50 µ L를 취할 하 고 50 µ L C5 null을 포함 하는 별도 2.0 mL microcentrifuge 튜브에 혼합 혈 청입니다. 계속 반복적으로 아래로, 6.2 단원에서 또 다른 4 분 pipetting 혼합 (각 1 분). 따라서,이 단계 후 인간의 적혈구 8 분의 총에 대 한 안티-CD235a 항 체와 incubated 되었습니다.
참고: C5 null 혈 청으로 4 분 잠복기 클래식 보완 캐스케이드를 활성화 하 고 opsonize는 죽 습 요인에 의해 나 iC3b 하는 C3b로 인간의 적혈구에 충분 하다.
9. 확인의 IgG-고 C3b-opsonization 인간의 혈액 세포의
-
염소 반대로 마우스 (보조) IgG 항 체로 녹색 또는 빨간색 형광 fluorophore에 활용 된 세포를 배양 하 여 마우스 안티-CD235a (IgG2b; 참조 섹션 6.1) IgG 항 체와 인간의 적혈구의 opsonization를 확인 합니다.
- 인간의 혈액 세포의 400 µ L 정지를 1 µ L 마우스 안티 CD235a IgG 항 체와 1 µ L 붙일 레이블된 반대로 마우스 이차 항 체를 추가 하 고 8 분 동안 37 ° C에서 품 어. 그 후, 두 번 (에서 섹션 5.2-5.5) 씻는 다.
- Resuspend 400 µ L로 셀 펠 릿 수정 RPMI 1640 (Hepes) 채널에 서 스 펜 션의 매체와 피펫으로 100 µ L confocal 형광 이미징 ( 그림 1C참조) 슬라이드.
참고: 셀 것 이다 덩어리 (agglutinate) 세척과 물의 resuspension, 하지만 세척 언바운드 이차 항 체 때문에 배경 형광을 줄일 필요가 있다.
-
인간 적혈구, opsonization 미리 마우스 IgG와 함께 분류 하 고 인 큐베이 팅 C5 null 마우스 혈 청, C3b/iC3b 사용 하 여, 예를 들어,와 쥐 반대로 마우스 C3b/iC3b/C3c 항 체는 이차 항 체, 예를 들어와 염소 반대로 쥐 IgG 항 체 활용 확인 녹색 형광 fluorophore 하.
- 흠 없는 인간의 붉은 혈액 세포를 사용 하 여 섹션 8에서 단계를 반복 합니다.
- 반대로 마우스 C3b/iC3b/C3c 항 체 (50 µ L IgG 라는 인간의 적혈구 + 50 µ L C5 null 마우스 혈 청) 100 µ L 혼합물에 놓여있는지 표시 0.25 µ L을 추가 하 고 8 분 동안 37 ° C에서 품 어.
- 두 번 세척, 100 µ L 수정 RPMI 1640 (Hepes) 매체와 피 펫 채널에 정지 confocal 형광 이미징 (그림 1C 참조) 슬라이드에 펠 릿을 resuspend.
결과
저속 회전 confocal 현미경 검사 법에 의해 식 균 작용의 이미징에 사용 되는 채널 슬라이드의 회로도 그림 1에 표시 됩니다. 인간 적혈구 (hRBCs)는 물 들일 붉은 형광 플라즈마 멤브레인 마커 CellMask 오렌지, 절연된 마우스 주민 복 막 대 식 세포 (Ms) 녹색 형광 알 렉 사 Fluor 488 활용 된 안티-F4/80 항 체 ( 표시 됩니다 반면 그림 2),이 마우스 대 식 세포의 특정 마커로 플라즈마 멤브레인 레이블로 제공. 인간 적혈구 IgG (IgM) 안티-CD235a 항 체 (CD235a, 일컬어 glycophorin, A는 이다 단백질 특히 인간의 붉은 혈액 세포에 표현)과 세포를 배양 하 여 마우스 IgG (mIgG), 또는 마우스 IgM (mIgM), opsonized 될 수 있습니다. 빨간 형광 인간의 적혈구와 제시 하는 녹색 형광 세포의 시간 경과 3D 이미징 단일 입자 phagocytic 이벤트 (그림 2)의 시각화 수 있습니다. 단일 phagocytic 이벤트의 가까운 관측 입자 캡처 및을 섭취 delineated 될을 수 있습니다. 예를 들어 mIgG opsonized 인간의 붉은 혈액 세포의 macrophage filopodium, 얇은, 손가락 같은 투영에 의해 캡처 (그림 3A; Horsthemke 그 외 여러분 참고 관찰 될 수 있다 15). 또한, phagocytic 컵 형성 동안 인간의 적혈구의 압박 관찰 될 수 있다 (그림 3A). MIgG opsonized, 신선한 마우스 혈 청 또는 mIgM opsonized, 인간의 적혈구의 도입에 따라 hemolytic 막 공격 복합물의 대형에 절정 클래식 보충 폭포를 방 아 쇠. 보충 중재 된 용 혈의 활동 CellMask 오렌지와 Calcein 듀얼 스테인드 세포 이미징 하 여 측정할 수 있습니다. 녹색 형광 cytosolic Calcein는 급속 하 게 혈 (그림 3B) 동안 셀에서 발표 됩니다.
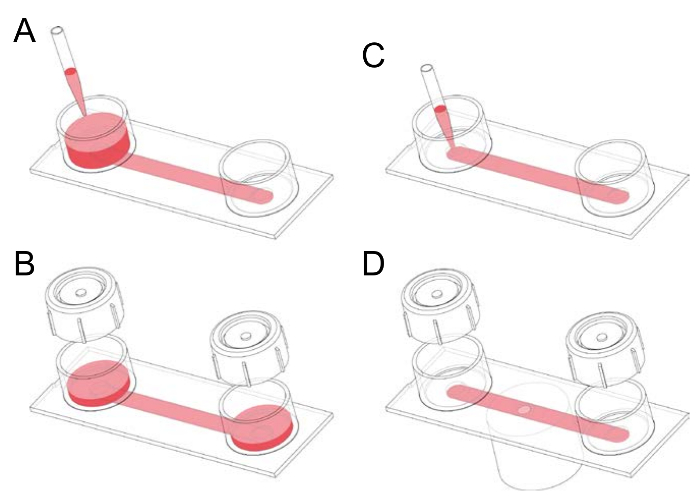
그림 1: 채널 fibronectin 코팅 슬라이드 처리. (A) A 채널 슬라이드 구성 슬라이드 50 m m x 5 m m 0.4 mm. 채널은 두 개의 저수지 중 하나에 1-2 mL 매체를 적용 하 고 슬라이드를 기울이기 prefilled 처음 크기와 채널에 의해 연결 된 두 개의 저수지. (B) 모자 부 화 하기 전에 저수지에 놓일 수 있다. 모자를 편리 하 게 사용할 수 있는 셀과 채널을 뿌리기 전에 원치 않는 공기 방울 밖으로 펌프. (C) 공기 거품 없는 100 µ L 채널 채널의 입으로 직접 매체를 pipetting으로 채울 수 있습니다. 이 단계는, 예를 들어 종자 세포 슬라이드에 또는 추가 gfluorophore (형광 그린)-마우스 대 식 세포 마커 뿐 아니라 막 라벨으로 활용 된 안티-F4/80 항 체. (D)로 붙일 시드 채널로 opsonized 인간의 적혈구, 같은 입자를 pipetting 스테인드 대 식 세포, 슬라이드는 거꾸로 한 현미경의 스테이지에 배치 될 수 있습니다. 및 저속 회전 디스크 confocal 현미경 검사 법 수 수행. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2: 식 균 작용의 시간 경과 3D 이미징. (A) 회로도 마우스 (m) 안티-CD235a 면역 글로불린 G (mIgG) 항 체, 및 레이블된 hRBCs 마우스 대 식 세포 (Ms), 하의 프레 젠 테이 션 스테인드 (레드 형광) 인간의 적혈구 (hRBCs) 플라즈마 멤브레인의 opsonization를 보여주는 녹색 형광 fluorophore 활용 된 안티-F4/80 항 체로 (녹색 형광) 표시. (B) 시간 경과 이미지 (XZ 조회), 회전 디스크 confocal 현미경 검사 법, phagocytic 컵 형성 및 mIgG opsonized hRBCs의 섭취에 의해 얻은. 눈금 막대 = 10 µ m. (C) 3 차원 복원 mIgG opsonized hRBCs을 섭취 하는 세포를 보여주는. B. 그리드 간격 대표 (는 timepoints의 3)에 대 한 해당 XZ 뷰 표시 됩니다 5.07 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3:는 filopodium에 의해 입자의 캡처. 마우스 대 식 세포는 마우스 면역 글로불린 G (mIgG)를 캡처를 보여주는 디스크 confocal 현미경 검사 법을 회전 시켜 얻은 시간 경과 이미지-opsonized 인간의 적혈구 (hRBC) filopodium (상단 패널에서 화살표)를 통해 손가락 같은 투영. Note는 적혈구 phagocytic 컵 형성 동안 일찍 그것의 crenations를 잃는다. 또한, phagocytic 컵 엔벌로프된 붉은 혈액 세포 (낮은 패널에 화살표로 표시 됨)를 집어넣은 것으로 보인다. 눈금 막대 = 10 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
먹어서 분석 실험, 특히 끝점 및 높은 처리량 분석 실험의 대다수 팬 들은 어떻게 입자는 실제로, 덮여 캡처하고 섭취의 시각화의 정보를 제공 하지 않습니다. Munthe 카스 외 에 의해 선구적인 연구 10 과 카 플 란2 는 1970 년대에서 현저 하 게 다른 cytoskeletal 개편 IgG opsonized 보완 opsonized 입자 (양 적혈구) 대의 식 균 작용에 참여 했다 제안 했다. 여기 우리가 먹어서 분석 회전 디스크 confocal 현미경 검사 법을 사용 하 여 단일 phagocytic 이벤트의 고해상도, 실시간 이미징 수 있도록 설명 합니다. 우리의 모델 이것은는 마우스 주민 복 막 대 식 세포, 최소한의 처리와 격리 될 수 있는 그리고 우리가 입자 갓 고립 된 인간의 적혈구 사용. 그러나, 먹어서 분석 실험 마우스 골 수 유래 세포 또는 호 중구, 마우스 대 식 세포 세포 선, 인간 monocyte 파생 된 세포 또는 인간의 말 초 혈액 호 중구 등 다른 식 세포에 적용할 수 있습니다. 인간의 식 세포 또는 마우스 호 중구, 붙일 항 체 라는 대안 붙일 레이블된 안티-CD14 항 체 (인간 monocytes/대 식 세포)16 또는 안티-Gr-1 (Ly-6 G) 항 체 (마우스 등 필요한 것 호 중구)입니다.
Unopsonized 인간 적혈구, 전통적으로 사용 양 적혈구, 같은 점에서이 세포는 하지 (또는, 적어도, 아주 드물게) 섭취 마우스 복 막 대 식 세포에 의해 불활성 있습니다. 이렇게 하면, 폴리스 티 렌 구슬, 달리 낮은 배경 활동. 인간 적혈구는 편리 하 게 마우스 IgG 또는 IgM 단일 클론 항 체에 대 한 CD235a 사용 하 여 면역 글로불린과 opsonized 수 (A glycophorin), 인간의 적혈구 (적혈구) 및 erythroid 선구자17, 의 특정 마커 18. 병렬 분석 실험에 붙일 레이블된 반대로 마우스 IgG 또는 IgM 이차 항 체 opsonization 확인에 적용할 수 있습니다. IgG 및 IgM 항 체 클래스는 hemagglutinins, agglutinate 적혈구를 일으키는 원인이 되는 물질 (항 체). 교착을 피하기 위해, 우리 일시적으로 세포 현 탁 액 8 분 잠복기 동안와 함께 혼합 안티-CD235a 항 체, 다음 우리는 혼합된 정지 직접 슬라이드를 추가 대 식 세포를 포함 하 채널 (fibronectin 코팅 슬라이드) 세척 단계 없이 . 세척 단계 교착을 강력 하 게 촉진 하는 원심 분리 하 여 적혈구의 침전을 포함 한다. 인간 적혈구 opsonizing, 전에 우리 닥터지 오렌지/레드 형광 프로브 플라즈마 멤브레인 레이블을. 이 조사는 시간 경과 기록의 시작 부분에 밝은 형광 하지만 신호 점차적으로 페이드, 아마 크게 photobleaching19때문. 또한, 대 식 세포와 슬라이드의 fibronectin 코팅 약하게 오렌지/레드 형광 녹음 동안 될 수 있습니다. 이 문제는 아마도 때문에 라벨링 후 인간의 혈액 세포의 불충분 한 세척. 닥터지 형광 플라즈마 멤브레인 마커를 사용 하 여, 대신 인간의 적혈구의 아민 반응 succinimidyl 에스테 르15,20를 사용 하 여 pH에 민감한 rhodamine 파생으로 표시 수 있습니다. 이 형광 강도 증가 감소 pH15,20, 하지만이 방법은 반응 에스테 르 준비는 현재 불리는 phagosome 성숙의 시각화를 허용의 이점이 있다 비싼 고 수성 매체에서 재구성 후 불안정.
IgG opsonized 인간의 적혈구 (Fcer1g 녹아웃) 쥐는 NOTAM21 또는 Fcer1g-/-절연 복 막 대 식 세포를 사용 하 여 확인 될 수 있다 FcγRs 통해 섭취 됩니다. NOTAM 세포 IgG opsonized 인간의 적혈구, 바인딩 하지만 부족 ITAM (immunoreceptor 티로신 근거한 활성화 주제)-중재 Fcer1g 녹아웃 세포 표면 FcγRs. IgG를 표현 하지 않는 반면, 식 균 작용을 유도 하는 데 필요한 신호- IgM opsonized 인간의 적혈구 수 수 또한 opsonized C3b (어떤은 iC3b에 죽 습)와 보완 C5 null 마우스에서 갓 고립 된 혈 청을 가진 세포 배양에 의해 또는 (야생 형 혈 청 하면 용 혈). IgG와 IgM opsonins 활성화 클래식 보완 캐스케이드 (막 공격 복합물) 공과 셀 세포의 형성에 이르게 합니다. 쥐 부족 보완 C5, 보충 폭포 C3 분열을 보완 하기 위해 진행 하지만 C5 convertase 터미널 통로 진작 하는 데 필요한 기판 부족. 우리가 간단한 분석 실험 보완 캐스케이드의 활동을 측정 하기 위해 개발. 즉, 인간의 적혈구 형광 레드, 원형질 막 마커 및 녹색 형광, cytosolic fluorophore 공동 레이블이 될 수 있습니다. 막 공격 복합물의 대형, 시 보완 구성 요소 C5-C9에 의해 형성 된 cytosolic fluorophore는 급속 하 게 (초)는 cytosol에서 잃었다. 보충 폭포의 끝-효과 기 (cytolysis) 함수의 시각화 표시 4 분 보육 시간 C3b/iC3b opsonization 인간의 적혈구에 대 한 충분 한. 병렬 분석 실험에서 인간의 혈액 세포의 C3b/iC3b 코팅 쉽게 반대로 마우스 C3b의 혼합물을 적용 한 후 평가 고 붙일 이차 항 체 라는 될 수 있습니다. 이 경우에, 세척 단계는 언바운드 형광 항 체를 제거 해야 합니다. 세척 단계는 교착을 촉진, 원심 분리에 의해 셀 sedimentaion를 포함 한다 비록 성공적인 opsonization confocal 현미경 검사 법에 의해 쉽게 평가 될 수 있다. 보충 수용 체-중재 먹어서 어느 적용 IgG-몇 군데 수 / iC3b opsonized 인간의 붉은 혈액 세포 NOTAM 또는 Fcer1g-/-대 식 세포 또는 IgM-도입 하 여 인간의 붉은 피가 iC3b opsonized 야생-타입 세포에 세포 /. IgM opsonized 혈액 세포는 ITAM 포함 된 FcγRs (FcγRI, FcγRIII 및 FcγRIV) IgG opsonized 입자22의 식 균 작용에 필요한에 의해 인식 되지 않습니다.
Phagocytic 이미지를 이벤트, 대 식 세포의 원형질 막 마우스 대 식 세포의 특정 마커로 역할도 녹색 형광 fluorophore 활용된 안티-F4/80 항으로 표시 수 있습니다. 인간 적혈구 렌더링할 수 있습니다 레드 형광 외피에 의해 오렌지/레드 형광 플라즈마 막 표시와 함께 위에서 설명한 대로. 이 질 성 원형질 막 마커 항 체 기반 라벨의 잠재적인 혼란 효과 방지합니다. 빨간 형광 인간의 적혈구, opsonization, 없이 직접 채널 슬라이드의 100 µ L 채널에 pipetted 수 고 60 X 통해 3D 시간 경과 촬영 / 1.49 오일 침수 (또는 유사한) 렌즈는 488를 사용 하 여 수행 및 561 nm 레이저 라인 회전 디스크 (또는 유사한) confocal 현미경의 각각. 그것은 고해상도 이미징, 하지만 반복된 Z-스택 16 분 이상의 수집에 대 한 시스템을 최적화 하기 위해 유혹 또는 그래서 상당한 photobleaching 및 phototoxicity를 발생할 수 있습니다. 우리는 좋은 신호 대 잡음 비율을 홍보 하 여 자극 강도 및/또는 노출 시간, 하지만 광학 해상도 감소를 허용 binning 2 x 2를 사용 하기로 결정 했습니다. 또한, phototoxicity를 줄이기 위해, 우리는 매체에 반응성 산소 종의 폐품을 추가 합니다. 미래 연구에서는 분석 실험 apoptotic 인간의 혈액 세포의 식 균 작용의 이미지를 수정 수 있습니다. 신호 및 초기 apoptosis24,25의 phosphatidylserine 외부화23을 한 "" 나를 먹는 유도 하 Ca2 + ionophore, A23187, 등의 응용 프로그램을 사용할 수 있습니다.
공개
저자는 공개 없다.
감사의 말
이 작품은 하 3271/4-1과 하 3271/4-2에서 DFG (도이치 가운데), 보조금 및 실 1003 (클러스터의 우수성 1003), 모션 (CiM), DFG 셀에서에서 부여 FF-2016-05에 의해 지원 되었다.
자료
| Name | Company | Catalog Number | Comments |
| 24 G plastic catheter | B Braun Mesungen AG, Germany | 4254503-01 | Used for peritoneal lavage |
| Hank’s buffered salt solution without Ca2+ and Mg2+ | Thermo Fisher Scientific | 14170120 | Used for peritoneal lavage |
| 14 mL polypropylene round bottom tubes | BD Falcon | 352059 | Used to collect peritoneal cells |
| RPMI 1640 medium containing 20 mM Hepes | Sigma-Aldrich | R7388 | Basis medium for assays |
| Heat-inactivated fetal bovine serum | Thermo Fisher Scientific | 10082139 | Used as supplement for RPMI 1640 media |
| 100x penicillin/streptomycin | Thermo Fisher Scientific | 15140122 | Used as supplement for RPMI 1640 media |
| Fibronectin-coated µ-Slide I chambers | Ibidi, Martinsried, Germany | 80102 | Channel slides used for assays |
| µ-Slide (anodized aluminum) rack | Ibidi, Martinsried, Germany | 80003 | Autoclavable stackable rack for channel slides |
| RPMI 1640 medium containing bicarbonate | Sigma-Aldrich | R8758 | Medium for overnight culture |
| N-(2-mercaptopropionyl)glycine | Sigma-Aldrich | M6635 | Scavenger of reactive oxygen species |
| Alexa Fluor 488-conjugated rat (IgG2a) monoclonal (clone BM8) anti-mouse F4/80 antibody | Thermo Fisher Scientific | MF48020 | Mouse macrophage marker and plasma membrane label |
| CellMask Orange | Thermo Fisher Scientific | C10045 | Red fluorescent plasma membrane stain |
| Succinimidyl ester of pHrodo | Thermo Fisher Scientific | P36600 | Amine-reactive succinimidyl ester of pHrodo |
| Mouse (IgG2b) monoclonal (clone HIR2) anti-human CD235a | Thermo Fisher Scientific | MA1-20893 | Used to opsonize human red blood cells with IgG |
| Alexa Fluor 594-conjugated goat anti-mouse (secondary) IgG antibody | Abcam | Ab150116 | Used to confirm opsonization of human red blood cells with mouse IgG |
| Rat anti-mouse C3b/iC3b/C3c antibody | Hycult Biotech | HM1065 | Used to confirm C3b/iC3b opsonization of human red blood cells |
| Alexa Fluor 488-conjugated goat anti-rat IgG antibody | Thermo Fisher Scientific | A-11006 | Used as secondary antibody to confirm C3b/iC3b opsonization |
| Calcein/AM | Thermo Fisher Scientific | C3100MP | Used to load human red blood cells with Calcein |
| UltraVIEW Vox 3D live cell imaging system | Perkin Elmer, Rodgau, Germany | Spinning disk confocal microscope system | |
| Nikon Eclipse Ti inverse microscope | Nikon, Japan | Inverted microscope | |
| CSU-X1 spinning disk scanner | Yokogawa Electric Corporation, Japan | Nipkow spinning disk unit | |
| 14-bit Hamamatsu C9100-50 Electron Multiplying-Charged Couple Device (EM-CCD) peltier-cooled camera | Hamamatsu Photonics Inc., Japan | EM-CCD camera of the spinning disk confocal microscope system | |
| 488 nm solid state laser, 50 mW | Perkin Elmer, Rodgau, Germany | Laser (488 nm) source of spinning disk confocal microscope system | |
| 561 nm solid state laser, 50 mW | Perkin Elmer, Rodgau, Germany | Laser (561 nm) source of spinning disk confocal microscope system |
참고문헌
- Tauber, A. I. Metchnikoff and the phagocytosis theory. Nature reviews. Molecular cell biology. 4, 897-901 (2003).
- Kaplan, G. Differences in the mode of phagocytosis with Fc and C3 receptors in macrophages. Scandinavian journal of immunology. 6, 797-807 (1977).
- Cooper, J. A. Effects of cytochalasin and phalloidin on actin. The journal of cell biology. 105, 1473-1478 (1987).
- Caron, E., Hall, A. Identification of two distinct mechanisms of phagocytosis controlled by different Rho GTPases. Science. 282, 1717-1721 (1998).
- Aderem, A., Underhill, D. M. Mechanisms of phagocytosis in macrophages. Annual review of immunology. 17, 593-623 (1999).
- Chimini, G., Chavrier, P. Function of Rho family proteins in actin dynamics during phagocytosis and engulfment. Nature cell biology. 2, E191-E196 (2000).
- Castellano, F., Chavrier, P., Caron, E. Actin dynamics during phagocytosis. Seminars in immunology. 13, 347-355 (2001).
- Swanson, J. A. Shaping cups into phagosomes and macropinosomes. Nature reviews. Molecular cell biology. 9, 639-649 (2008).
- Underhill, D. M., Goodridge, H. S. Information processing during phagocytosis. Nature reviews. Immunology. 12, 492-502 (2012).
- Munthe-Kaas, A. C., Kaplan, G., Seljelid, R. On the mechanism of internalization of opsonized particles by rat Kupffer cells in vitro. Experimental cell research. , 201-212 (1976).
- Rougerie, P., Miskolci, V., Cox, D. Generation of membrane structures during phagocytosis and chemotaxis of macrophages: role and regulation of the actin cytoskeleton. Immunological reviews. , 222-239 (2013).
- Liu, Z., et al. Nanoscale optomechanical actuators for controlling mechanotransduction in living cells. Nature. 13, 143-146 (2016).
- Valentim, A. M., Guedes, S. R., Pereira, A. M., Antunes, L. M. Euthanasia using gaseous agents in laboratory rodents. Laboratory animals. 50, 241-253 (2016).
- McCarren, H. S., Moore, J. T., Kelz, M. B. Assessing changes in volatile general anesthetic sensitivity of mice after local or systemic pharmacological intervention. Journal of visualized experiments. (80), e51079 (2013).
- Horsthemke, M., et al. Multiple roles of filopodial dynamics in particle capture and phagocytosis and phenotypes of Cdc42 and Myo10 deletion. The Journal of biological chemistry. 292, 7258-7273 (2017).
- Bzymek, R., et al. Real-time two- and three-dimensional imaging of monocyte motility and navigation on planar surfaces and in collagen matrices: Roles of Rho. Scientific reports. 6, 25016 (2016).
- Poole, J. Red cell antigens on band 3 and glycophorin A. Blood reviews. 14, 31-43 (2000).
- Aoki, T. A Comprehensive review of our current understanding of red blood cell (RBC) glycoproteins. Membranes. 7, (2017).
- Song, L., Hennink, E. J., Young, I. T., Tanke, H. J. Photobleaching kinetics of fluorescein in quantitative fluorescence microscopy. Biophysical journal. 68, 2588-2600 (1995).
- Miksa, M., Komura, H., Wu, R., Shah, K. G., Wang, P. A novel method to determine the engulfment of apoptotic cells by macrophages using pHrodo succinimidyl ester. Journal of immunological. 342, 71-77 (2009).
- Boross, P., et al. FcRgamma-chain ITAM signaling is critically required for cross-presentation of soluble antibody-antigen complexes by dendritic cells. Journal of immunology. , 5506-5514 (2014).
- Ehrenstein, M. R., Notley, C. A. The importance of natural IgM: scavenger, protector and regulator. Nature reviews. Immunology. 10, 778-786 (2010).
- Closse, C., Dachary-Prigent, J., Boisseau, M. R. Phosphatidylserine-related adhesion of human erythrocytes to vascular endothelium. British journal of haematology. , 300-302 (1999).
- Barth, N. D., Marwick, J. A., Vendrell, M., Rossi, A. G., Dransfield, I. The "phagocytic synapse" and clearance of apoptotic cells. Frontiers in immunology. 8, 1708 (2017).
- Sivagnanam, U., Palanirajan, S. K., Gummadi, S. N. The role of human phospholipid scramblases in apoptosis: An overview. Biochimica et biophysica acta. 1864, 2261-2271 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유