Method Article
Alveoler Makrophaj ve CD4+ T-Cell Immünophenotyping ve HIV rezervuar değerlendirmesi Için Bronkoalveolar lavaj sıvısı ve eşleştirilen kanın işlenmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Biz Bronkoalveoler Lavaj sıvısı işleme için bir yöntem tarif ve pulmoner HıV rezervuarları değerlendirmek için antiretroviral tedavi kronik HıV enfekte bireylerin periferik kan eşleşen. Bu yöntemler, son derece saf CD4 T hücrelerinin satın alınması ve daha sonra ultrason polimeraz zincir reaksiyonu ile immünofenotipleme ve HIV DNA/RNA ölçülerinde kullanılabilir alveoler makrofajlar sonuçlanır.
Özet
Bronkoskopi, normal salin bir bronkoskopla akciğerlere enjekte edildiği ve daha sonra emme uygulandığında, Bronkoalveoler Lavaj (BAL) sıvısının kaldırılması ile uygulanan tıbbi bir işlemdir. BAL sıvısı hücrelerde zengindir ve böylece pulmoner immün ortamın ' anlık görüntüsünü ' sağlayabilir. CD4 T hücreleri en iyi karakterize HıV rezervuarları, orada alveoler makrofajlar (AMs) dahil olmak üzere doku makrofajlar, ayrıca viral rezervuar olarak hizmet önermek için güçlü bir kanıt varken. Ancak, çok hala HıV rezervuar kurulması ve bakım bağlamında AMs rolü hakkında bilinmiyor. Bu nedenle, virolojik ve immünolojik olarak kullanılan hücreleri elde etmek için BAL sıvısının işlenmesi için bir protokol geliştirmek, akciğer içindeki hücre nüfusunu ve alt setleri karakterize etmek ve değerlendirmek, akciğerlerin HıV rolünü anlamak için ilgilidir. Rezervuar. Burada, basit santrifüjleme ve Akış sitometrisi gibi standart teknikler kullanan bir protokol açıklanmaktadır. CD4 T hücreleri ve AMs daha sonra immünofenotipleme ve HIV DNA ve RNA ölçümü de dahil olmak üzere sonraki uygulamalar için kullanılabilir.
Giriş
HIV enfeksiyonu için bir tedavi karşı karşıya en önemli zorluklardan biri antiretroviral tedavinin kesilmesi sonrasında plazma viremi bir rebound nedenleri gizli HIV rezervuar varlığı (sanat)1,2. Uzun vadeli sanat sırasında HıV rezervuar iyi, ikincil lenfoid organları, bağırsak ilişkili lenfoid doku (GALT) ve merkezi sinir sistemi (CNS) de dahil olmak üzere çeşitli doku bölmeleri, belgelenmiştir, akciğerler çalışma alanı olarak gözden geçti Pre-ART çağından beri3. Ancak, akciğerler HıV patogenezinde merkezi bir rol oynamaktadır. Gerçekten de, pulmoner semptomlar AıDS 'le ilgili fırsatçı enfeksiyonların ilk göstergeleri arasında yer aldı4. Modern sanat döneminde bile, HIV 'li kişiler HıV olmayan kişilerden daha fazla bulaşıcı ve bulaşıcı olmayan akciğer hastalıkları geliştirme riskine sahiptir. Örneğin, HIV enfeksiyonu olan kişiler invazif streptococcal pneumoniae enfeksiyonunun yanı sıra kronik obstrüktif pulmoner hastalık (kod)5,6için de yüksek risk altındadır. Ayrıca, tüberküloz (TB) ve HıV koenfeksiyon dünyanın belirli bölgelerinde önemli bir kamu sağlığı meydan okuma, özellikle de, Sahra-altı Afrika, HıV-enfekte bireyler 16 ila 27 kat daha fazla tüberküloz HıV olmadan kişiler daha olasılığı7. Pulmoner enfeksiyon ve kronik hastalığa bu duyarlılık için bazı açıklamalar8,9,10, HIV bastırılmış olan bireyler tarafından hassas hücresel mekanizmalar önerilmiştir rağmen akciğer komplikasyonları için yüksek risk altında kalan plazma viral yük tamamen elükidated olmamıştır. Önemlisi, HıV akciğer enfeksiyonu ve kronik hastalık için çok güçlü bir risk faktörüdür, Sigara durumu6bağımsız.
Akciğer bağışıklık ortamının analizi, bu nedenle, sağlık ve hastalık rolünü anlamak için çok önemlidir. Noninvaziv, indüklenmiş balgam örnekleri nadir pulmoner lenfositler ve hiçbir AMs ile epitelyal hücreler ve enkaz büyük miktarlarda içeren eğilimindedir rağmen, belirli uygulamalar için rol sınırlamaktadır. Bunun tersine, önemli kanama ve pnömotoraks (akciğerin çöküşü) ile ilgili riskler nedeniyle şüpheli hastalığın yokluğunda büyük miktarda doku biyopsisi elde edilemez. Ayrıca, pulmoner bağışıklık hücrelerinin çoğunluğu özellikle akciğerlerin sürekli solunum sırasında antijenler tarafından uyarılan mukozal düzeyde bulunur. Bu amaçla, BAL sıvısı elde etmek için bronkoskopi lenfositler ve AMs nispeten güvenli erişim sağlayan avantajı vardır (bkz. Şekil 1). Makrofajlar BAL sıvısı içindeki hücrelerin en büyük oranını oluşturmaktadır, ardından lenfositler11. Bu nedenle, BAL sıvısı tarafından immunophenotyping, hücre kültürü, transcriptomics veya başka uygulamalar gibi sonraki uygulamalarda kullanılmak üzere işlenecek bir yöntem oluşturmak için yararlıdır. Burada özetlenen BAL sıvısının işlenmesi için protokol, daha önce açıklanan ve kullanılan çeşitli akış uygulamaları için optimize edilmiş genel prosedürlerden uyarlanmıştır. Bu metodoloji hem pulmoner lenfoid ve miyeloid mukozal bağışıklık hücrelerinin onların fenofonal ve fonksiyonel karakterizasyonu için yalıtım, hem de HIV ile yaşayan yetişkinlerde HıV rezervuar bir değerlendirme sağlar.
Bu protokolü kurmak için, çalışma katılımcıları15' i işe almak için aşağıdaki kriterleri kullandık. Katılımcıların bu araştırmaya katılmalarına uygun olmaları için, aşağıdaki kriterlere uyan HıV enfekte bireyler olmaları gerekiyordu: (1) ART üzerinde en az 3 yıl; (2) bastırılmış viral yük (VL) en az 3 yıl; (3) ≥ 200/mm3CD4 T hücre sayısı; (4) araştırma Spirometri ve bronkoskopi geçmesi istekli. Aşağıdaki kriterlere sahip hastalar çalışma dışında bırakıldı: (1) bronkoskopi için kontrendikasyon (ler); (2) yüksek kanama riski: koagulopati veya warfarin veya klopidogrel tedavisi; (3) trombositopeni (düşük platelets); (4) aktif pulmoner enfeksiyon veya başka bir akut pulmoner süreç; (5) hamile/hamile olmaya çalışıyorum.
Protokol
Bu araştırma protokolü, doğrudan Helsinki beyannamesi 'nde yer alan prensiplere göre kurulmuştur ve McGill Üniversitesi Sağlık Merkezi 'nin (RI-MUHC, #15-031) Kurumsal Inceleme kurulları 'ndan onay aldı ve Université du Québec à Montréal (UQAM, #602) ve Centre de recherche du Centre Hospitalier de l 'Université de Montréal (CR-CHUM, #15-180).
1. Bronkoalveolar lavaj
Not: Bu bölümde, bir solunum terapisti16,17yardım ile lisanslı bir respirolog tarafından gerçekleştirilen bronkoskopi açıklanmaktadır.
- Prosedür için gerekli olan cihaz parçalarını, bronkoskoplar ve tuz dahil hazırlamak. Hastanın boğazının arkasına anestezik sprey yönetin. Topikal anestezi mümkün olduğunda aşırı kullanımı kaçının. Oksijen doygunluğunu izlemek için kalp atışı ve ritmini ve bir elin ilk parmağına bir oksijen sondasını izlemek için göğsüne kardiyak yol açar. Ek oksijen sağlamak için burun delikleri içine nazal kanül ekleyin.
- Hasta, tercihen fitil konumuna konumlandırın. Sedasyon aşağıdaki gibi yönetin: midazolam 0.01-0.04 mg/kg ve fentanil 50-100 μg (hasta konforu kolaylaştırmak ve öksürük refleks en aza indirmek için) intravenöz olarak, bir respirolog veya anestezist varlığında.
- Esnek bronkoskopu, istenilen subsegmentental bronşın içinde sıkışana kadar ilerlet. Şırınga ile tuz (bir defada 50-60 mL) ve daha sonra nazik emiş (50-80 mmHg) uygulayın. Lavaj sıvısı şırıngayı toplar ve sonra bir toplama kapsayıcısına aktarılacaktır.
- Toplam 200-300 mL lavaj için Flush tekrarlayın. Mümkünse en az 100 mL BAL sıvısı toplayın.
- BAL sıvısını buzun üzerine yerleştirin.
2. BAL hücrelerinin yalıtımı
Not: Aşağıdaki prosedür, Biyolojik Güvenlik kabininde, sınıf II (BSL2) veya üzeri steril koşullarda yapılmalıdır.
-
BAL örneklerini işlenene kadar buzda tutun.
- BAL 'ın orijinal toplama tüpüne Vortex ve bir serolojik pipet kullanarak 50 mL tüpüne aktarın. BAL sıvısı çok bulanık görünüyorsa veya filaentous doku tarafından kontamine, yeni bir 50 mL tüp içine 70 μm naylon mesh filtresi ile sıvı filtre.
- 200 x g 'de 4 °c ' de 10 dakika Santrifüjü. Yeni bir 50 ml tüp süpernatant aktarın. Hafifçe pipet ucu ile Pelet kırmak ve rpmi 1640 orta 1 ml içinde pelletini.
- Her 10X 1,5 ml mikrosantrifüjü tüpler ve kalan süpernatant 15 ml tüpler, her 10 ml için süpernatant 1 ml aktarın. Tüm süpernatant tüpleri-80 °c ' de saklayın.
-
BAL hücresi Pellet işlem.
- Orijinal numune her 25 ml için rpmi 1640 10 ml Pelet resuspend. 200 x g 'de 4 °c ' de 10 dakika Santrifüjü. Süpernatant yeni bir 15 ml tüp transfer (pelte yeterli hücre olduğundan emin olduktan sonra atmak).
- 1 ml rpmi 1640 + 10% fetal sığır serumu (FBS) ve tripan mavisi ve hemokytometer kullanarak saymak içinde Pelet resuspend.
Not: BAL sıvısı sıralamadan önce hücrelerin uyumu ile ayrılırsa, Bölüm 4 ' e geçin.
3. BAL hücrelerinin uyumu (opsiyonel)
Not: Bu alternatif protokol, önce veya hücre sıralama yerine gerçekleştirilebilir. Aşağıdaki prosedür, BSL2 kabine (veya üzeri) steril koşullarda yapılmalıdır.
- Yeni bir 15 mL tüpüne sıralama için istenen BAL hücrelerinin sayısını aktarın ve 1,5 x 106 makrofajlar/ml için doğru hacmi yapın. 5% CO2Ile 37 °c ' de 6-kuyu plakasında ve 2 h için inküyeler üzerine 2 ml hücre plaka ve uyum için zaman sağlamak için.
- Kuluçklama işleminden sonra, yapışmaya neden olmayan hücreleri içeren medyayı dikkatlice aspirasyon ve 15 mL tüpüne aktarın. 300 x g 'de oda sıcaklığında 10 dakika Santrifüjü (RT). Fosfat-tamponlu tuz (PBS) +% 2 FBS 'de 1 x 107 hücre/ml 'de süpernatant ve pelletini çıkarın ve süspansiyonu 5 ml yuvarlak dipli polistiren tüpüne aktarın. Bu lenfosit fraksiyonu şimdi hücre sıralama için leke hazır.
- Plakadaki kalan bağlı hücrelere, hücre kesilmesi çözeltisi başına 1 mL ekleyin ( malzeme tablosunabakın) ve 37 °c ' de en az 15 dk. 5% Co2ile, hücreler pipet ucu ile plakadan kolayca ayrı kalır.
- Nazikçe ama iyice bir pipet ucu kullanarak kuyu yüzeyinden yapışkar hücreleri kazımak ve kolunda yardımcı olmak için iyi sıvı 1 mL kullanın. Hücreleri yeni 15 mL tüpüne aktarın. 1 mL PBS ile kuyuları yıkayın ve aynı tüp ekleyin. PBS ile 5 mL tüp içeriğini makyaj.
- 300 x g 'de santrifüjte 10 dk olarak RT. supernatant çıkarın, 1 x 107 hücreler/ml PBS + 2% FBS olarak pelletini, ve süspansiyon 5 ml yuvarlak dipli polistiren tüp aktarmak. Bu miyeloid fraksiyonu şimdi hücre sıralama için leke hazır.
4. periferik kan mononükleer hücrelerin izolasyonu
Not: Aşağıdaki prosedür, BSL2 kabine (veya üzeri) steril koşullarda yapılmalıdır.
- Bronkoskopinin aynı gününde (genellikle doğrudan BAL koleksiyonundan önce), etylenediaminetetraasetik asit (EDTA) tüplerinde bir donörden altı adet venöz kan elde edilir (tüp başına yaklaşık 10 mL).
- 300 x g 'de kan tüplerini santrifüjlenerek kan ile ayırın. plazma 1 ml 'de 1,5 ml mikrosantrifüjlük borulara aktarın ve-80 °c ' de saklayın.
-
Yoğunluk degrade ayrımı gerçekleştirin.
- 2 mL RPMı 1640 her kan tüpüne ekleyin ve iyi bir serolojik pipet kullanarak karıştırın.
- Transfer 3x 50 mL tüpler ve RPMı 1640 ile 25 mL her tüp hacmi makyaj.
- Her biri 20 mL lenfosit ayırma Orta (LSM) içeren 3x 50 mL tüpler, başka bir toplu hazırlamak ( malzeme tablosunaBAKıN) RT. yavaşça ve nazikçe katman 25 ml her üç tüp için LSM üzerinde seyreltilmiş kan, bir 45 ° açı tüp tutarak .
- 600 x g 'de, düşük IVME ile RT 'de 25 dakika ve yavaşlama olmadan Santrifüjü (fren kapalı).
-
Periferik kan mononükleer hücrelerin (PBMCs) yıkamayı gerçekleştirin.
- Bir serolojik pipet kullanarak bir 50 mL tüp için tüp iki sıvı faz arayüzünde hücrelerin katmanını aktarın; 30 mL 'den fazla hacim varsa, iki tüp içine bölün. PBS ile 50 mL her tüp hacmi makyaj.
- 700 x g 'de Santrifüjden RT 'de 5 dakika ve mümkün olduğunca fazla süpernatant çıkarın.
- Pelet resuspend ve PBS ile 25 ml hacmi makyaj. 350 x g 'de Santrifüjden RT 'de 10 dakika ve mümkün olduğunca fazla süpernatant çıkarın.
- Adım 4.4.3 ' de açıklanan yıkama adımını tekrarlayın.
- 5 ml PBS + 2% FBS içinde Pelet resuspend ve hücreleri saymak.
5. tüm BAL hücrelerini ve PBMCs 'Leri sıralama
Not: Aşağıdaki prosedür bir BSL2 (veya üzeri) steril koşullarda yapılmalıdır.
- PBS + 5% FBS + 25 mM HEPES (pH 7,4) içeren sıralama arabelleğini hazırlayın. Sıralanmış hücre alt kümeleri koleksiyonu için 1 mL FBS ile 5 mL yuvarlak dipli polistiren tüpler hazırlayın.
-
Boyama gerçekleştirin.
- Her biri BAL (tüm hücreler veya lenfosit ve miyeloid fraksiyonları) ve PBMCs (bkz. Bölüm 4) için 3x 5 mL yuvarlak dipli polistiren tüpler hazırlayın. Her alt küme için, bir tüpü hücrelerle hazırlamak ve iki tüp 5 x 105 hücre ile lekelenme ve canlılığı leke telafisi kontrolleri için kullanın.
- 350 x g 'de 4 °c ' de 5 dakika Santrifüjü. Supernatants çıkarın, 100 μL PBS kontrolleri için hücreleri yeniden pelletini ve tazminat kontrolleri adım 5.2.6 açıklandığı gibi hazırlanıncaya kadar 4 °c ' de saklayın.
- FC reseptör (FcR) PBS içinde reaktif engelleme 1:20 seyreltme hazırlayın + 5% FBS ( malzeme tablosunabakın-FCR-ifade hücrelerinde FCR için antikor nonspesifik bağlama önlemek için). 250 μL FcR engelleme karışımında 1 x 107 hücrelerde sıralamak için hücreleri yeniden resuspend. 4 °C ' de 1 saat boyunca Inküye yapın.
- Kuluçardıktan sonra, hücrelere uygun antikor kokteyli ekleyin ( Tablo 1' e bakınız) ve karanlıkta 1 saat 4 °c ' de inkübasyon yapın.
- 1 saat boyama sonrası hücrelere 1 mL PBS ekleyin ve 350 x g 'de 4 °c ' de 5 dk santrifüj yapın. 250 μL 'de 1 x 107 hücreye sahip olmak için sıralama arabelleğindeki süpernatant ve pelletini hücrelerini çıkarın. gerekirse, 70 μm filtreli hücreleri filtreleyin.
- Tazminat kontrolleri hazırlayın.
- Üç damla Anti-fare IG, κ, ve negatif kontrol telafisi boncuk ( malzeme tablosunabakın) her 1 ml PBS bir mikrosantrifüjlü tüp ve transfer 100 μL her 5 ml Yuvarlak diplenmiş polistiren tüp tazminat için kullanılmak üzere ekleyin. Kullanılmak üzere kokteyl her fluorokrom mevcut için bir tüp hazırlayın.
- Kokteyl içinde her antikor 1 μL farklı bir tüp boncuk içeren ekleyin. Adım 5.2.1 ' de bir kenara 5 x 105 hücrelerin tüplerinden birine 1 μL canlılığı leke ekleyin. Karanlıkta 4 °C ' de 20 dakika boyunca inküye yapın.
- Her tüp için 1 mL PBS ekleyin ve 4 °C ' de 5 dakika için 350 x g 'de santrifüjün. Süpernatant çıkarın ve PBS 250 μL içinde Pelet pelletini. Gerekli olana kadar karanlıkta 4 °C ' de saklayın.
- Hücreleri floresan-aktif hücre sıralama (FACS) ile 1 mL FBS ile hazırlanan toplama tüplerine sıralayabilir ve tüplerin kenarlarını serum ile kat etmek için hafifçe kıvrın.
- BAL hücrelerini düşük basınçta Sırala. Kapı hücreleri önce gürültüyü dışlamak ve canlı içerir, CD45+ hücreler, ve bu nüfus kapısı içinde Doublet hücreleri (bkz. Şekil 3). AMs olarak büyük miyeloid nüfus sıralama CD206 ve CD169 çift pozitif hücreler içinde; küçük lenfosit nüfus içinde CD3+ hücreleri izole ve hem CD4 ve CD8 tek pozitif nüfus sıralamak (bkz Şekil 3; gating stratejisi temsili sonuçlar bölümünde ayrıntılı).
- PBMCs sıralamada, kapı hücreleri ilk gürültüyü dışlamak ve canlı dahil, CD45+ hücreler, ve bu nüfus kapısı içinde Doublet hücreleri. Sonra, CD3 hücrelerinde kapı ve CD3- nüfus, kapı ilk CD14 ve sıralama tek pozitif monosit içinde, ve sonra CD3+ nüfus kapısı içinde CD4 ve CD8 ve sıralama her iki tek pozitif nüfus (ayrıntılı strateji detaylı Temsili sonuçlar bölümü.
6. AMs ve PBMCs immunophenotyping
Not: Aşağıdaki prosedür, BSL2 kabine (veya üzeri) steril koşullarda yapılmalıdır.
- 1.000.000 her AMs ve PBMCs iki ayrı 5 mL yuvarlak dipli polistiren tüpler için ekleyin. 300 x g 'de 4 °c ' de 5 dakika santrifüjün ve süpernatant çıkarın.
- Antikor lekeleymenin özgüllüğünü iyileştirmek için FcR engelleme gerçekleştirin. Bunun için, 100 μL PBS + 2% FBS hücrelerinde yeniden pelletini ve 1,4 μL FCR engelleme reakajının ekleyin. 4 oC 'de 20 dakika boyunca inküye yapın.
-
Ekstrsellüler boyama gerçekleştirin.
- FcR bloğu ile kuluçku takiben, istenilen ekstreküler antikor kokteyli ekleyin, tüpler Vortex ve karanlıkta 4 °C ' de 1 h için inkük.
- 500 μL PBS ekleyerek ve 4 °C ' de 5 dakika boyunca 350 x g 'de santrifügleme ile 2x yıkayın.
-
Sabitleme ve geçirgen için hazırlanın (kullanılan belirli reaktifler için malzeme tablosu 'na bakın).
- 1 parça geçirgenlik tamponu ve 3 parça seyreltilmeli tampon ile geçirgenlik çözeltisi hazırlayın. 1 ml geçirgen çözeltisi içinde Pelet resuspend ve karanlıkta 4 °c 40 dk için inküye.
- 1 parça yıkama tamponu ve 4 parça H2O kullanarak yıkama solüsyonu hazırlayın. geçirgen hücrelere 2 ml yıkama solüsyonu ekleyin ve 350 x g 'de 4 °c ' de 5 dk santrifüj yapın. Süpernatant çıkarın.
-
Hücre içi boyama gerçekleştirin.
- 100 μL 1x yıkama çözeltisi içindeki hücreleri resuspend, istenilen hücre içi antikorları ekleyin, tüpler Vortex ve karanlıkta en az 1 saat 4 °C için Inküye.
- 2 ml yıkama solüsyonu ekleyin ve 350 x g 'de Santrifüjü RT 'de 5 dakika boyunca kaldırın. süpernatant çıkarın ve PBS 200 μL içinde Pelet pelletini. Hücreleri gerekli olana kadar karanlıkta 4 °C ' de saklayın.
7. BAL hücrelerinin geri kalanı
Not: Aşağıdaki prosedür, BSL2 kabine (veya üzeri) steril koşullarda yapılmalıdır.
- Hücre numaraları izin, BAL hücre Pelet (adım 2.2.2) gelen ağalopreserve canlı hücreler.
- 90% FBS +% 10 dimetil sülfoxid (DMSO) içeren donma medyasını hazırlayın.
- 300 x g 'de hücreleri 4 °c ' de 10 dakika santrifüjler. Bir kriyojenik şişede 1,5 ml donma medyasında süpernatant ve pelletini çıkarın. Kriyojenik şişeleri kontrollü bir donma kabına aktarın ( malzeme tablosunabakın) ve-80 °c ' ye yerleştirin. Sıcaklığa ulaşıldığında hücreleri uzun süreli depolama için sıvı nitrojen olarak aktarın.
-
BAL hücrelerini kuru pelürler olarak koruyun.
- Kalan hücreleri 1,5 mL mikrosantrifüj tüpüne aktarın. 6.000 x g 'de 1 dakika boyunca karşı üst santrifüjte Santrifüjü, Pelet rahatsız etmeden mümkün olduğunca süpernatant çıkarın. Pelet-80 °c ' de saklayın.
8. HıV DNA ve RNA ölçümü
Not: Aşağıdaki prosedür, BSL2 kabine (veya üzeri) steril koşullarda yapılmalıdır.
- Toplam HıV DNA ölçümü
- BAL lysate enkaz ile polimeraz zincir reaksiyonu (PCR) inhibisyonu önlemek için, üretici talimatlarına göre BAL hücrelerinin bir örnekten DNA ayıklamak için bir DNA ekstraksiyon kiti ( malzeme tablosunabakın) kullanın. Bu DNA 'nın 15 μL 'sını aşağıda açıklanan ön amplifikasyon adımında bir ana karışımı ile birlikte kullanın (adım 8.1.3).
- Standart eğrinin seyreltilmeleri hazırlayın.
- Yukarıda olduğu gibi, 2 x 106 ACH-2 hücrelerin bir Pelet DNA ayıklamak için bir DNA ekstraksiyon kiti kullanın ( malzeme tablosunabakın).
- DNA 'nın elüsyonu sonrasında, 3 x 105 hücreden 15 μL başına 3 hücreye kadar değişen altı dilüsyon üretmek için ACH-2 DNA 'nın seri 10 kat seyreltmesi gerçekleştirin.
- Bir ön amplifikasyon adımı gerçekleştirin.
- Ayrı bir odada, 1x polimeraz tampon, 3 mM MgCl2, 300 ΜM dNTPs ve 2,5 U of Taq DNA polimeraz ( malzeme tablosunabakın) ve 300 Nm içeren n + 2 örneklerinin ana karışımını hazırlayın (bkz. Adım 8.1.3.2). Triplicate kuyularında tüm önlemleri gerçekleştirin.
- Kullanım astarlar hCD3OUT5 ', hCD3OUT3 ', ULF1, ve UR1 hem insan CD3 ve HIV amplifikatörleşmiş DNA oluşturmak için ( Tablo 2dizileri bakın). Her iki genin de aynı tüpte önceden güçlendirilmiş olduğunu unutmayın. Karıştırın hafifçe ve tam karıştırma sağlamak için tüp aşağı spin.
- 96-iyi PCR plakasında iyi başına 35 μL ana karışımı dağıtın ve 15 μL standart veya örnek DNA ekleyin. Toplam reaksiyon hacmi 50 μL 'dir.
- Ön amplifikasyon (95 °C ' de 8 dakika, 1 dakika için 95 °C 12 döngü, 40 s için 55 °C, 1 dakika için 72 °C ve 15 dakika boyunca 72 °C ' de uzama) gerçekleştirin.
- Gerçek zamanlı PCR gerçekleştirin.
- CD3 ve HıV DNA değerini ölçmek için, 1x PCR reaksiyon ana karışımı içeren iki ana karışımları hazırlayın ( malzeme tablosunabakın), 1.250 Nm uygun astar ve 100 Nm prob. Kullanım astarlar HCD3IN5 ' ve HCD3IN3 ' ve Probe bir reaksiyon insan CD3 ölçmek için CD3 famzen ve astar UR2 ve lambdat ve araştırma uhiv famzen başka bir reaksiyon HIV DNA ölçmek için ( Tablo 2dizileri bakın). QPCR adaptasyon tüplerinde her karışımın 13,6 μL 'yi dağıtın.
- 1:10 'de steril su, DNase, RNase ve proteaz içermeyen ön amplifikasyon PCR ürününü seyreltin. 20 μL toplam reaksiyon hacmi için qPCR-adapte tüplerde 13,6 μL qPCR karışımı için her seyreltilmiş numune 6,4 μL ekleyin.
- Aşağıdaki programı kullanarak gerçek zamanlı PCR gerçekleştirin: 95 °c ' de 4 dk ve 40 döngüsü için 95 °c ' de 3 s ve 60 °c için 10 s tek satın alma ile denatürasyon.
- Standart eğrilerden her reaksiyon tüpünde HıV kopyaları ve sayı hücresi eşdeğerleri sayısını ekstrapolate. HıV DNA kopyaları/106 hücre sayısını hesaplayın.
- HıV RNA ölçümü
- Bir RNA ekstraksiyon kiti ( malzeme tablosunabakın) kullanarak, üreticinin talimatlarına göre bir bal hücresi örneğinden RNA ayıklayın. Bu RNA 'nın 17 μL 'sını aşağıda açıklanan Ters transkripsiyon ve ön amplifikasyon adımında kullanın (adım 8.2.4).
- LTR-gag RNA in vitro sentezlenmiş ve tam olarak nicelik standart olarak kullanılır; GUSB normalleştirme için sağlıklı donör RNA ekstresi içine çidi olduğunu. Bu standart altı seri 10 kat seyreltme hazırlamak, 3 x 105 hücrelere karşılık gelen üç kopya LTR-gag RNA 17 μL.
- Her Standart seyreltme ve her numunenin 17 μL 'i 96-Well PCR plakasında dağıtın ve numuneleri DNase ile tedavi edin ( malzeme tablosunabakın), kirletici genomik DNA 'yı kaldırmak Için 25 °c ' de 10 dk. 2 μL 25 mM EDTA ekleyerek reaksiyonu durdurun ve 65 °C ' de 10 dak.
- Ters transkripsiyon (RT) ve önamplifikasyon PCR gerçekleştirin.
- Bu adımı, üreticinin talimatlarına göre tek adımlı bir RT-PCR kiti ( malzeme tablosunabakın) kullanarak gerçekleştirin. Kullanım astarlar gusb ileri 1, gusb ters 1, UR1, ve ULF1 temizlik gen ve LTR-gag HIV RNA olarak hem insan gusb amplifikatörden cDNA oluşturmak için ( Tablo 2' deki dizileri bakın). GUSB değerleri HıV değerlerini normalleştirmek için kullanılacaktır.
- DNase tarafından tedavi edilen standartları ve örnekleri içeren aynı 96-Well PCR plakasında iyi başına 31 μL ana karışımı dağıtın. Toplam reaksiyon hacmi 50 μL 'dir.
- 55 °C ' lik bir tavlama sıcaklığında, üreticinin talimatlarına göre 16 döngü için plaka çalıştırın.
- Gerçek zamanlı PCR gerçekleştirin.
- 1 adet PCR reaksiyon ana karışımı (Yukarıdaki adımda 8.1.4.1), 1250 nM uygun astar ve 100 nM prob içeren iki ana karışımları hazırlayın. Bir reaksiyon içinde GUSB cDNA ölçmek için astar gusb ileri 2, GUSB ters 2 ve prob GUSB-HEX kullanın; başka bir reaksiyon HıV cDNA ölçmek için astar UR2, LambdaT ve prob UHIV FamZen kullanın ( Tablo 2' deki dizileri bakın).
- QPCR adaptasyon tüplerinde her bir ana karışımı 13,6 μL dağıtın. RT ön amplifikasyon PCR ürünlerini 1:10 steril su, DNase, RNase ve proteaz ücretsiz olarak seyreltin ve her seyreltilmiş numune veya standart için 6,4 μL 'yi uygun PCR karışımından ekleyin. Toplam reaksiyon hacmi 20 μL 'dir.
- Gerçek zamanlı PCR 'yi aşağıdaki programı kullanarak gerçekleştirin: 95 °c ' de 4 dk ve 40 için 95 °c ' de 3 s ve 60 °c ' ye kadar tek satın alma ile 10 s için denatürasyon (famzen için yeşil kanalı seçin ve hex için sarı).
Sonuçlar
Çoğu sigara içmeyen BAL sıvısı steril bir kabın içinde alınır ve biraz bulanık sarı-turuncu renkli bir sıvıdır. Donör bronkoskopide Endobronşiyal biopsleri uyguluysa ve bazı kanama meydana geldiği takdirde sıvı Pinker renk olabilir. Eğer donör bir sigara içen ise sıvı renk koyu olabilir. Santrifüjden sonra, bal süpernatant neredeyse açık ve biraz turuncu olacak, hücre peletleri renk kapalı-beyaz çok koyu kahverengi olabilir iken, örnek durumuna bağlı olarak ve donör bir sigara içen ya da olmadığını.
Tüm bal numunesi sayırken,18 μm çapında daha büyük, yuvarlak makrofajlar ve yaklaşık 7,3 μm çapında daha küçük yuvarlak lenfositler dahil olmak üzere farklı hücre tipleri görselleştirilebilir (bkz. Şekil 2). Macrofajlar%18yaklaşık 40 tarafından sigara içenler büyütülür. Hücre türleri arasındaki ayrım ayrı olarak macrofajlar ve lenfosit sayımı için izin verir. Ayrıca, özellikle sigara içenlerin örneklerinde, alanda görülebilir bazı enkaz olabilir. Macrofajlar BAL en bol hücre türüdür, yaklaşık% 85 için muhasebe, Sigara içmeyen20hücrelerin, ve onlar neredeyse özel görünebilir böylece sigara içiciler zenginleştirilmiştir.
BAL hücrelerinin toplama eğilimi vardır, bu nedenle tüm manipülasyonlar sırasında iyi karıştırılmalıdır. Pelet birkaç yıkama adımında bile karanlık görünebilir. Eğer filasentöz enkaz hücre sıralama için boyama sonra fraksiyonda belirgindir, hücre Sıralayıcı aracılığıyla çalıştırmadan önce bir 70 μm filtre ile hücreleri geçirin.
BAL hücrelerinin sıralanması, makrofajları barındıracak kadar büyük damlacık boyutlarını sağlamak için düşük basınçta yapılmalıdır. Hücreler ilk olarak tüm CD45+21 hücrelerini içerecek şekilde tutulur ve ardından tüm ölü hücrelerin dışlanabilmesini sağlamak için dayanılabilirlik temelinde (bkz. Şekil 3). Singlet hücreleri sonra seçilir ve bu içinde, iki nüfus boyutu ve morfoloji, yani daha büyük miyeloid hücreler ve daha küçük lenfositler dayalı (bkz. Şekil 3) Gated. Daha büyük hücreler içinde, hücreler CD20622,23 ve CD16922 ve çift pozitif hücreler AMs olarak sıralanır, daha küçük hücreler içinde, CD3+ hücreler seçilir ve, CD4 ve CD8 üzerinde Gated; CD4 tek pozitif ve CD8 tek pozitif hücreler sıralanır (bkz. Şekil 3). Kullanılan işaretçiler, fagositik hücreler23' te bulunan mannoz reseptör CD206 ve sialoyapışan reseptör CD16922gibi AMs 'nin önceden anlatılan fenotipleri üzerine dayalı olarak seçilmiştir.
PBMCs sıralamada, hücreler ilk olarak ileri ve yan dağılımda, homojen bir lenfosit popülasyon göstermelidir, hepsi alınır, sıfır eksenine yakın gürültü hariç (veriler gösterilmez). Nüfus Gated ve CD45, ve canlı CD45+ hücreler kullanılır. Bu nüfus daha sonra CD3 üzerinde Gated; monosit yalıtmak için, CD3- nüfus daha sonra CD14 üzerinde Gated ve tüm tek pozitif hücreler sıralanır. Lenfosit subsets izole etmek için, CD3+ hücreler CD4 ve CD8 üzerinde Gated ve hem tek pozitif ve hücre nüfus sıralanır.
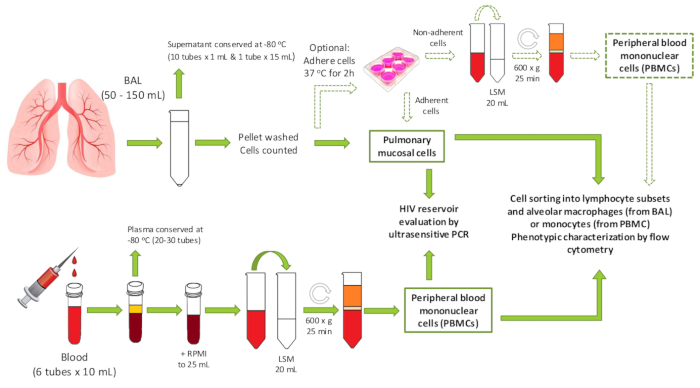
Şekil 1 : Protokole genel bakış. Oluşturulan numunelerin olası aşağı akış kullanımları da dahil olmak üzere protokolün iş akışını gösteren şematik. PBMC = periferik kan mononükleer hücreler; BAL = Bronkoalveoler Lavaj; LSM = lenfosit ayırma orta. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
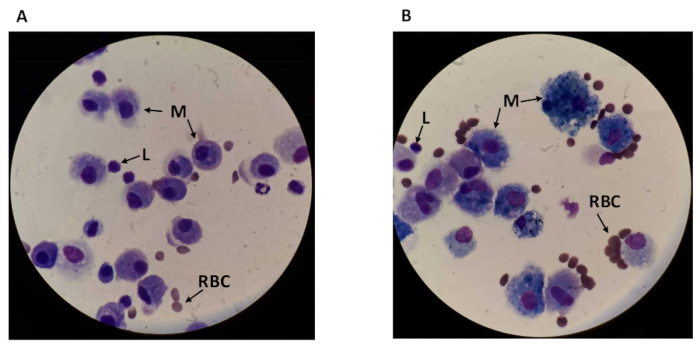
Şekil 2 : Tüm bal sıvısının mikroskop alanı görünümü. (A) bir sigara içmeyen ve (B) görünür lenfositler (L), makrofajlar (M) ve kırmızı kan hücreleri (RBC) ile bir sigarandan mikroskop görüntüleri. Büyütme 1, 000x (yağ daldırma ile 10X oküler ve 100x lens). Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
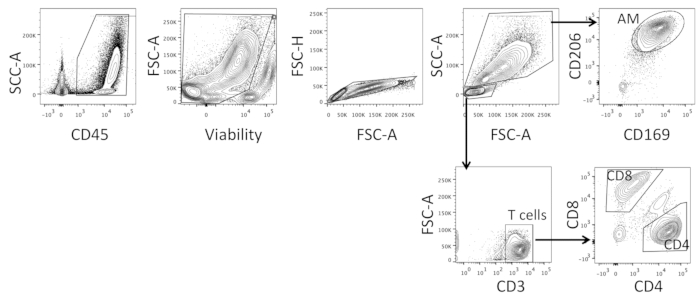
Şekil 3 : Tüm bal hücrelerinin hücre sıralaması Için temsilci gating stratejisi. Alveoler makrofajlar (AM), CD4 ve, tüm BAL hücre örneklerinden CD8 T hücrelerini sıralamak için kullanılan gating stratejisi. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
| Örnek | Antikor | Florokrom | Klon | Test başına hacim (μL) |
| BAL ve PBMC | Canlı/ölü | APC-H7 | - | 1 |
| CD45 | PE-Cy7 | HI30 | 5 | |
| CD3 | Alexa700 | UCHT1 | 2 | |
| CD4 | PE-cy5 | RPA-T4 | 4 | |
| CD8 | BV605 | SK1 | 3 | |
| Sadece BAL | CD206 | Pe | 19,2 | 10 |
| CD169 | BB515 | 7-239 | 5 | |
| Sadece PBMC | CD14 | BV786 | M5E2 | 5 |
Tablo 1: tüm BAL hücrelerinin ve yalıtılmış PBMCs 'lerin sıralanması için akış paneli.
| Hedef | Adım | Primer adı | Primer sıra | |||
| HıV Total DNA veya HıV LTR-gag RNA | Ön amplifikasyon PCR | UR1 | 5 '-CCA TCT CTC TCC TTC ETIKET C-3 ' | |||
| ULF1 | 5 '-ATG CCA CGT AAG CGA AAC TCT GGG TCT CTC TGG TTA GAC-3 ' | |||||
| Gerçek zamanlı PCR | UR2 | 5 '-CTG AGG GAT CTC TAG TTA CC-3 ' | ||||
| LambdaT | 5 '-ATG CCA CGT AAG CGA AAC T-3 ' | |||||
| UHIV FamZen: | 5 '-/56-FAM/CA CTC AAG G/ZEN/C AAG CTT TAT TGA GGC/3IABkFQ/-3 ' | |||||
| CD3 DNA | Ön amplifikasyon PCR | HCD3 dışarı 5 ' | 5 '-ACT GAC ATG GAA CAG GGG AAG-3 ' | |||
| HCD3 dışarı 3 ' | 5 '-CCA GCT CTG AAG TAG GGA ACA TAT-3 ' | |||||
| Gerçek zamanlı PCR | HCD3 içinde 5 ' | 5 '-GGC TAT KEDI TCT TCT TCA AGG T-3 ' | ||||
| 3 ' te HCD 3 ' | 5 '-CCT CTC TTC AGC CAT TTA AGT A-3 ' | |||||
| CD3 FamZen: | 5 '-/56-FAM/AG CAG AGA A/ZEN/C AGT TAA GAG CCT CCA T/3IABkFQ/-3 ' | |||||
| GUSB RNA | Ön amplifikasyon PCR | GUSB Ileri 1: | 5 '-ACC TAG AAT CTG CTG GCT ACT A-3 ' | |||
| GUSB ters 1: | 5 '-GTT CAA ACA GAT CAC ATC CAC ATA C-3 ' | |||||
| Gerçek zamanlı PCR | GUSB Ileri 2: | 5 '-TGC TGG CTA CTA CTT GAA GAT G-3 ' | ||||
| GUSB ters 2: | 5 '-CCT TGT CTG CTG KEDI AGT ETIKET A-3 ' | |||||
| GUSB-HEX: | 5 '-/5HEX/TCGCTCACA/ZEN/CCAAATCCTTGGACC/3IABkFQ/-3 ' | |||||
Tablo 2: HıV DNA ve RNA ölçümü için primer ve prob dizileri.
Tartışmalar
Burada, ciğerleri içinde HıV rezervuar araştırmak için incelenebilir uyumlu PBMCs ile birlikte CD4 T hücreleri ve AMs elde etmek için BAL sıvısı işleme için bir yöntem açıklanmıştır. Biz son zamanlarda HIV DNA kantifikasyon içinde CD4 t hücrelerinde eşleşen periferik kan ve bal örnekleri bildirilen, ve bizim grup HIV olduğunu göstermiştir 13 pulmoner CD4 t hücrelerinde daha bol periferik kan olanlar daha15. Ancak, AMs HıV DNA seviyeleri donör bağımlı ve bu yüzden, şimdiye kadar, macrofajlar15ile karşılaştırıldığında lenfositlerde HIV DNA seviyeleri arasında tutarlı bir korelasyon olmamıştır. Bu birincil makrophaj hücre subsets erişim, ancak, bu soruyu sorgulamak ve HıV rezervuar bağlamında akciğer viral yük daha iyi bir anlayış kazanıyor için hayati bir araç olacaktır.
Ön sanat döneminde ve BAL sıvısı kullanan diğer çeşitli çalışmalarda, katılımcılar şüpheli bir patolojinin teşhisi veya solunum belirtileri için mikrobiyolojik tanı almak amacıyla bronkoskopi yapıldı3. Ancak, herhangi bir Aktif akciğer belirtileri veya patolojileri olmadan katılımcılar işe başardık ve tüm katılımcılar etik onay formu imzaladı15. Obstrüktif akciğer hastalığı24için Spirometri tarama çalışması gibi diğer çalışmalara katılan merkezimizin katılımcılarının yanı sıra lökoferez gibi diğer araştırma prosedürlerini de geçirebiliriz. Kolonoskopi. HıV ile yaşayan insanlar arasında önceki araştırma, bu fedakarlık araştırma çalışmaları25önemli bir faktör motive katılımı olduğunu göstermiştir. Birçok insan numuneleri gibi, biz kişi-to-Person değişkenlik büyük bir kaydetti. Hangi katılımcılar biz iyi karşı kötü hücre verimi ile BAL elde edeceğini "tahmin" için bir yolu yoktu. Periferik kanın aksine, hangi lenfosit oldukça tutarlı sayılar verir, BAL sıvı hücre numaraları çok değişkendir. Akciğer içine normal tuz daha büyük bir hacim enjekte (BAL sıvı daha büyük bir dönüş elde umuduyla ile) normal tuz daha büyük hacimli genellikle daha öksürük ve ateş postbronkoskopi daha yüksek bir risk ile ilişkili olduğu gibi her zaman mümkün değildir. Biz daha küçük bir (yerine daha büyük) çapı bronkoskop kullanarak respirolog bronş daha derin ulaşmak ve hücre daha büyük miktarlarda içeren sıvı elde etmek için etkin olduğunu fark ettik. Tutarlı bir bulgu, tütün içenlerin, AMs 'in enkaz ve partikül maddeyi yutması olarak beklendiği gibi, BAL sıvısı içinde lenfositlerden çok daha büyük orantıları vardı. Ayrıca, sigara içenlerden gelen BAL sıvısının, PCR makineleri ve akış cytometreleri gibi kullanılan donanımı engelleyen enkaz içerdiği gözlenmiştir. Benzer sorunlar, yüksek kirlilik veya bireyler daha sık zayıf hava kalitesine maruz alanlarda görülebilir.
HıV rezervuarlarının kurulması ve viral Kalıcılık ile ilgili olarak, CD4 T hücrelerinin saflığı ve AMs önemli bir önem taşımaktadır. Bu nedenle, son derece saf hücre popülasyonları elde etmek için floresan aktif hücre sıralama (FACS) kullanmayı tercih ettik. Bir bronkoskopi sırasında bazı küçük kanama bekleniyor olarak toplanan BAL sıvısı kan ile kontamine olabilir de mümkündür; naif B hücrelerinin varlığı bunu gösterecektir, ve hücreler bu sorunu aşmak için kırmızı kan hücresi liziz tamponunun içinde yıkanabilir. BAL sıvısının incelenmesi ile ilgili bir diğer zorluk, HıV Kalıcılık26' nın anlaşılması için önemli olan inflamatuar belirteçleri ve sitokinlerin ölçüleceği ile ilgilidir. Sertleştirilen tuz BAL sıvısını seyreltilince, inflamatuar mediatörlerin ve sitokinlerin seviyeleri ölçmek zor olabilir. Seyreltme için bir üre düzeltme faktörü önerilse de, kullanımı27, 28 ' iaçıklayan nispeten az literatür vardır.
AMs son derece autofluorescent, hangi hücre sıralama ve akış sitometri fenotipik analizi sırasında bir sorun oluşturmaktadır. Özellikle, etkisi, AMs tamamen siyah renk olabilir sigara içenler daha belirgindir, önemli ölçüde kendi otomatik yağ etkileyen. Standart mavi 488 nm lazer ile heyecanlı olduğunda, otofloresans yaklaşık 540 NM, fitc ve PE29,30gibi yaygın olarak kullanılan Konjugat floresan spektrumlu ile çakışıyor zirvesinde. İki ayrı lazerin FITC ve PE 'yi heyecanlandırmak için kullanıldığına dikkat çekiyor (örn. mavi 488 lazer tarafından sarı/yeşil ve FITC tarafından PE). FITC ile içsel otomatik yağışların üstesinden gelmek için, otomatik netleme arka planını belirlemek için lekelenmeli AMs kullandık. Buna ek olarak, floresan eksi bir (FMO) kontrolleri kullanımı bu teknik konularda mücadele için çok yararlı olabilir. Daha büyük boncuklar (örn. 7,5 μm), makrofaj nüfusu telafi etmek için daha yakın olan, daha küçük boncuklar (örn., 3,0 μm) ile karşılaştırıldığında, lenfosit nüfusu telafi etmek için kullanılabilir. Daha uygun bir yaklaşım, tek leke kontrolleri olarak hücrelerin küçük bir kısmını kullanmak olacaktır, HLA-DR veya CD45 gibi, alt üzerinde bilinen, yüksek ifade marker kullanarak, her istenilen fluorochromes için conjuated, hangi için izin verecek bir çok daha boncuk ile elde edilebilir daha doğru tazminat. Sigara içenlerin numuneleri durumunda, bu taktik özellikle makrofajlar çok daha büyük ve daha fazla autofluorescent olarak yararlıdır. Buna ek olarak, hazırlık adımından, tüm BAL örnek protokolün Bölüm 3 ' te açıklandığı gibi sıralamadan önce bir plaka kültürlü olabilir, bağlılık tarafından nüfus ayrılması izin. Bu şekilde, bağlı macrofajlar lenfositler gibi diğer yapışmaz hücrelerden izole edilebilir. Lenfosit ve nüfusu birlikte incelendiğinde yerine ayrılırsa, tazminat çok daha az zordur; Ancak, bağlılık güvenmek makrofajlar kaybına neden olur, hangi hücre numaraları zaten sınırlarken önemli bir önem taşımaktadır. Ayrıca, bir yapışma adım bu hücreler kullanılarak oluşturulan aşağı sonuç etkileyebilir yapışan monositlerin istenmeyen aktivasyonuna neden olabilir. Hücrelerde daha az etkili olan hücreleri sıralama değeri, sonraki deneyler için bu tür hücrelerin daha düşük olması kısıtlamasına karşı tartılması gerekir.
Diğer modeller, en önemlisi duvar modelleri, makrophaj immunolojik özellikleri ve biyoloji çalışması için kullanılmıştır. Bu modeller son derece yararlıdır ve manipüle etmek zor bir hücre türü içine büyük anlayış izin verirken, sınırlamalar var. Hücre yüzeyi işaretçileri birçok insan AMs immünofenotip tamamen anlaşılmadı gibi fareler ve insanlar arasında değişir. Ancak, bu model sistemi, her hayvanın kullanılabilir düşük hücre numaraları nedeniyle çeşitli fareler havuzu gerektirir. Buna ek olarak, havuz numuneleri gereksinimi genetik yatkınlık ve cinsiyet hususlarını önler. Son zamanlarda, cinsiyet kısıtlama faktörü SAMHD-131farklı ifade nedeniyle HIV-1 tarafından makrofajların infeksiyonunda bir rol oynar gösterildi. İnsanlık dışı primatlar (NHP) insanlara en yakın modeli temsil eder ve Simian immünyetmezlik virüsü (SıV) enfeksiyonunun ve bağışıklık sistemi üzerindeki etkisinin incelenmesi, doku-yerleşik makrofajların rolüne göre anlayış sağlayan monosit türevi makrofajlar. Rhesus Macaques içinde, aynı zamanda bir çoğaltma-yetkili virüs BAL limanından akciğer makrophage yalıtır gösterildi; bir viral büyüme tahlil (VOA) doku yerleşik hücreler32SIV davranışını analiz etmek için kullanıldı. Böyle bir bulgu önemli bir araştırma değeri ama yine de uygulanabilir önce insanlarda doğrulanmalıdır ve NHPs kullanarak yüksek maliyetli büyük örnek nüfus kullanımını önler. Buna ek olarak, insan AMs in vitro viral/mikrobiyal enfeksiyon ve tüberküloz/HıV koenfeksiyon gibi diğer patojenlerin çalışmaları gibi birçok diğer uygulamalar için yararlı olacaktır.
Açıklamalar
Yazarların ifşa etmesi gereken hiçbir şey yok.
Teşekkürler
Yazarlar onların fon kabul etmek istiyorum: Kanada Sağlık Araştırmaları Enstitüleri (CıCR) (CC, MAJ, NC #153082 hibe); Réseau SıDA et maladies, CC ve MAJ 'a ve CC 'ye fon veren McGill Üniversitesi Tıp Fakültesi 'ne fon veren du Fonds de recherche du Québec-Santé (FRQ-S) ' e bulaşır. Bu çalışmada ayrıca Kanada Sağlık Araştırmaları Enstitüsü (CIR)-Kanadalı HıV Cure Enterprise (CanCURE) Team Grant HB2-164064 MAJ, CC ve NC tarafından finanse edilmiştir. MAJ, Immünviroloji ve CC ve NC 'de, sırasıyla FRQ-S Junior 1 ve Junior 2 araştırma maaş ödülünü taşıyan CıSC Kanada araştırma koltuğu seviye 2 ' ye sahiptir. ET, RI-MUHC Studentship MSc ödülüne sahiptir.
Buna ek olarak, yazarlar Josée Girouard ve tüm klinik personel örnekleri koordine ve alma dahil olmak üzere, yanı sıra respiratuar terapistler kabul etmek istiyorum; Ekaterina ıourtchenko, Hélène Pagé-Veillette, ve Marie-Hélène Lacombe RI-MUHC Immünophenotyping platformunda; ve Dr. Marianna Orlova mikroskopi fotoğrafları sağlanması için. En önemlisi, yazarlar bu araştırma mümkün olmayacaktır kim olmadan birçok gönüllülere teşekkür etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 70 µm Sterile Cell Strainer | Fisher Scientific | 22363548 | Nylon mesh filters with 70 µm pores to remove impurities from BAL sample before sorting |
| ACH-2 Cells | NIH | 349 | HIV-1 latent T cell clone with one integrated proviral copy which do not express CD4 |
| BD FACSAria | BD Biosciences | N/A | Cell sorter (configured to detect 16 colours simultaneously) |
| BD LSRFortessa X-20 | BD Biosciences | N/A | Flow cytometer (configured to detect 14 colours simultaneously) |
| Bronchoscope | Olympus | BF-1TH190 | EEIII HD therapeutic bronchoscope; channel width 2.8 mm; outer diameter 6.0 mm |
| Cell Disassociation Solution | Sigma | C5914 | Non-enzymatic formulation for gently dislodging adherent cell types from plastic or glass surfaces. |
| CD169 BB515 | BD Biosciences | 565353 | Sialic acid-binding molecule antibody used for flow cytometry |
| CD14 BV786 | BD Biosciences | 563698 | Endotoxin receptor antibody used for flow cytometry |
| CD206 PE | BD Biosciences | 555954 | Mannose receptor antibody used for flow cytometry |
| CD3 Alexa700 | BD Biosciences | 557943 | T cell co-receptor antibody used for flow cytometry |
| CD4 PE-Cy5 | BD Biosciences | 555348 | T cell co-receptor antibody used for flow cytometry |
| CD45 PE Cy-7 | BD Biosciences | 557748 | Receptor-linked protein tyrosine phosphatase antibody used for flow cytometry |
| CD8 BV605 | BD Biosciences | 564116 | T cell co-receptor antibody used for flow cytometry |
| CompBead Plus | BD | 560497 | Anti-mouse Ig, κ and negative control polystyrene microparticles used to optimize fluorescence compensation in flow cytometry |
| DNase I | Invitrogen | 18068015 | Digests single- and double-stranded DNA to oligodexyribonuleotides containing a 5' phosphate to remove contamination from RNA |
| dNTP Set 100 mM | Invitrogen | 10297-018 | Consists of four deoxynucleotides (dATP, dCTP, dGTP, dTTP) for use in PCR |
| Dimethyl Sulfoxide (DMSO) | Sigma | D8418 | Apolar, protic solvent used to make media for cryopreserving live cells |
| EDTA | Invitrogen | AM9912 | Used to stop Dnase I enzyme activity |
| FBS | Wisent Bioproducts | 080-150 | Premium fetal bovine serum to supplement media |
| FcR Blocking Reagent, Human | Miltenyi | 130-059-901 | Binds to Fc receptor on the cell surface to prevent non-specific binding of flow antibodies |
| FlowJo v10 | FlowJo LLC | N/A | Flow cytometry analysis software used for all analyses |
| HLA-DR BV650 | BD Biosciences | 564231 | MHC class II cell surface receptor antibody used for flow cytometry |
| HyClone HEPES solution | Fisher Scientific | SH3023701 | Buffer providing maintenance of physiological pH |
| Live/Dead APC-H7 | Invitrogen | L34975 | Viability marker used for flow cytometry |
| Lymphocyte Separation Medium (LSM) | Wisent Bioproducts | 350-000-CL | Polysucrose for isolation of PBMC from whole blood |
| Mr. Frosty Freezing Container | ThermoFisher | 5100-0001 | Freezing container ensuring rate of cooling very close to -1 °C/min, the optimal rate for cell preservation |
| OneComp eBeads | Invitrogen | 01-1111-41 | Anti-mouse, rat and hamster antibodies for compensation of PBMC samples |
| PBS 1x | Wisent Bioproducts | 311-010-CL | Phosphate buffered saline for cell washing and staining |
| PCR Tubes Corbett Rotor-Gene | Axygen | PCR-0104-C | 4-strip PCR tubes with 0.1 mL capacity for use with Corbett Rotor-Gene |
| PerfeCTa qPCR ToughMix | Quantabio | 95112 | 2x concentrated ready-to-use reaction cocktail for PCR amplification of DNA templates |
| QiaAmp DNA Mini Kit | Qiagen | 51304 | Kit for isolation of genomic, mitochondrial, bacterial, parasite or viral DNA. Includes QIAamp Mini Spin Columns, QIAGEN Proteinase K, Reagents, Buffers, Collection Tubes |
| RNeasy Mini Kit | Qiagen | 74104 | Kit for purification of up to 100 µg total RNA from cells, tissues, and yeast. Includes RNeasy Mini Spin Columns, Collection Tubes, RNase-free Reagents and Buffers |
| Rotor-Gene Q | Qiagen | 9001550 | Real-time PCR cycler |
| RPMI 1640 1x | Wisent Bioproducts | 350-000-CL | Cell culture media |
| Sterile Water | Wisent Bioproducts | 809-115-CL | DNase, RNase & protease free |
| Superscript™ III One-Step RT-PCR System | Invitrogen | 12574018 | RT-PCR kit which performs both cDNA synthesis and PCR amplification in a single tube. Includes SuperScript III RT/Platinum Taq Mix, 2x Reaction Mix (containing 0.4 mM of each dNTP, 3.2 mM MgSO4), magnesium sulfate |
| Taq DNA Polymerase | Invitrogen | 18038-042 | Thermostable enzyme that synthesizes DNA from single-stranded templates in the presence of dNTPs and a primer. Includes Taq DNA Polymerase, 10x PCR buffer, magnesium chloride |
| Transcription Factor Buffer Set | BD Biosciences | 562725 | Buffers for intracellular staining for flow cytometry. Includes fixation/permeabilization buffer, diluent buffer, perm/wash buffer |
| Trypan Blue | Sigma | T8154 | Viability dye to count cells using haemacytometer |
Referanslar
- Chun, T. W., Fauci, A. S. Latent reservoirs of HIV: obstacles to the eradication of virus. Proceedings of the National Academy of Sciences of the United States of America. 96, 10958-10961 (1999).
- Finzi, D., et al. Latent infection of CD4+ T cells provides a mechanism for lifelong persistence of HIV-1, even in patients on effective combination therapy. Nature Medicine. 5, 512-517 (1999).
- Costiniuk, C. T., Jenabian, M. A. The lungs as anatomical reservoirs of HIV infection. Reviews in Medical Virology. 24, 35-54 (2014).
- Center for Disease Control and Prevention. A cluster of Kaposi's sarcoma and Pneumocystis carinii pneumonia among homosexual male residents of Los Angeles and Orange Counties, California. Morbidity and Mortality Weekly Report. 31, 305-307 (1982).
- Fitzpatrick, M., Crothers, K., Morris, A. Future directions: lung aging, inflammation, and human immunodeficiency virus. Clinics in Chest Medicine. 34, 325-331 (2013).
- Kunisaki, K. M. Will expanded ART use reduce the burden of HIV-associated chronic lung disease?. Current Opinion in HIV and AIDS. 9, 27-33 (2014).
- World Health Organization. . WHO | Tuberculosis and HIV. , (2018).
- Jambo, K. C., et al. Small alveolar macrophages are infected preferentially by HIV and exhibit impaired phagocytic function. Mucosal Immunology. 7, 1116-1126 (2014).
- Yeligar, S. M., et al. Dysregulation of Alveolar Macrophage PPARγ, NADPH Oxidases, and TGFβ. AIDS Research and Human Retroviruses. 33, 1018-1026 (2017).
- Cribbs, S. K., Lennox, J., Caliendo, A. M., Brown, L. A., Guidot, D. M. Healthy HIV-1-infected individuals on highly active antiretroviral therapy harbor HIV-1 in their alveolar macrophages. AIDS Research and Human Retroviruses. 31, 64-70 (2015).
- Holt, P. G., et al. Extraction of immune and inflammatory cells from human lung parenchyma: evaluation of an enzymatic digestion procedure. Clinical & Experimental Immunology. 66, 188-200 (1986).
- Brenchley, J. M., et al. High frequencies of polyfunctional HIV-specific T cells are associated with preservation of mucosal CD4 T cells in bronchoalveolar lavage. Mucosal Immunology. 1, 49 (2007).
- Mwandumba, H. C., et al. Mycobacterium tuberculosis; Resides in Nonacidified Vacuoles in Endocytically Competent Alveolar Macrophages from Patients with Tuberculosis and HIV Infection. The Journal of Immunology. 172, 4592 (2004).
- Gordon, S. B., et al. Inhaled delivery of 23-valent pneumococcal polysaccharide vaccine does not result in enhanced pulmonary mucosal immunoglobulin responses. Vaccine. 26, 5400-5406 (2008).
- Costiniuk, C. T., et al. HIV persistence in mucosal CD4+ T cells within the lungs of adults receiving long-term suppressive antiretroviral therapy. AIDS. 32, 2279-2289 (2018).
- American Thoracic Society. . American Thoracic Society - Bronchoalveolar Lavage. , (2004).
- King, T. E. . Basic principles and technique of bronchoalveolar lavage - UpToDate. , (2018).
- Lea, S., Dungwa, J., Ravi, A., Singh, D. Alveolar macrophage size is increased in COPD patients compared to controls. European Respiratory Journal. 50, (2017).
- Kuse, R., Schuster, S., Schübbe, H., Dix, S., Hausmann, K. Blood lymphocyte volumes and diameters in patients with chronic lymphocytic leukemia and normal controls. Blut. 50, 243-248 (1985).
- Heron, M., et al. Bronchoalveolar lavage cell pattern from healthy human lung. Clinical & Experimental Immunology. 167, 523-531 (2012).
- Rheinländer, A., Schraven, B., Bommhardt, U. CD45 in human physiology and clinical medicine. Immunology Letters. 196, 22-32 (2018).
- Yu, Y. R. A., et al. Flow Cytometric Analysis of Myeloid Cells in Human Blood, Bronchoalveolar Lavage, and Lung Tissues. American Journal of Respiratory Cell and Molecular Biology. 54, 13-24 (2015).
- Geiser, M. Update on Macrophage Clearance of Inhaled Micro- and Nanoparticles. Journal of Aerosol Medicine and Pulmonary Drug Delivery. 23, 207-217 (2010).
- Costiniuk, C. T., et al. Prevalence and predictors of airflow obstruction in an HIV tertiary care clinic in Montreal, Canada: A cross sectional study. HIV Medicine. , (2019).
- Balfour, L., et al. Altruism motivates participation in a therapeutic HIV vaccine trial (CTN 173). AIDS Care. 22, 1403-1409 (2010).
- Vandergeeten, C., Fromentin, R., Chomont, N. The role of cytokines in the establishment, persistence and eradication of the HIV reservoir. Cytokine & Growth Factor Reviews. 23, 143-149 (2012).
- Rennard, S. I., et al. Estimation of volume of epithelial lining fluid recovered by lavage using urea as marker of dilution. Journal of Applied Physiology (1985). 60, 532-538 (1986).
- Twigg, H. L., et al. Effect of highly active antiretroviral therapy on viral burden in the lungs of HIV-infected subjects. The Journal of Infectious Diseases. 197, 109-116 (2008).
- Duan, M., et al. Distinct Macrophage Subpopulations Characterize Acute Infection and Chronic Inflammatory Lung Disease. The Journal of Immunology. 189, 946 (2012).
- Garn, H. Specific aspects of flow cytometric analysis of cells from the lung. Experimental and Toxicologic Pathology. 57, 21-24 (2006).
- Szaniawski, M. A., Spivak, A. M., Bosque, A., Planelles, V. Sex influences SAMHD1 activity and susceptibility to HIV-1 in primary human macrophages. The Journal of Infectious Diseases. , (2018).
- Avalos, C. R., et al. Quantitation of Productively Infected Monocytes and Macrophages of Simian Immunodeficiency Virus-Infected Macaques. Journal of Virology. 90, 5643-5656 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır