Method Article
Trattamento del bronchoalveolar Lavage Fluid e del sangue abbinato per il macrofago alveoere e CD4- Immunofenotyping a cellule T e valutazione del serbatoio dell'HIV
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Descriviamo un metodo per la lavorazione del fluido di lavaggio bronchoalveolar e corrisponde al sangue periferico di individui cronicamente affetti da HIV sulla terapia antiretrovirale per valutare i serbatoi polmonari di HIV. Questi metodi portano all'acquisizione di cellule T CD4 altamente pure e macrofagi alveolar che possono successivamente essere utilizzati per immunofenofizzazione e quantificazioni HIV DNA/RNA mediante reazione a catena di polimerasi ultrasensibili.
Abstract
La broncoscopia è una procedura medica per cui la normale salina viene iniettata nei polmoni attraverso un broncoscopio e quindi viene applicata l'aspirazione, rimuovendo il liquido bronchoalveolar lavage (BAL). Il liquido BAL è ricco di cellule e può quindi fornire un'istantanea dell'ambiente immunitario polmonare. Le cellule T CD4 sono i serbatoi HIV più caratterizzati, mentre ci sono forti prove che suggeriscono che i macrofagi tissutali, compresi i macrofagi alveolar (AM), fungono anche da serbatoi virali. Tuttavia, molto è ancora sconosciuto sul ruolo delle AM nel contesto dell'istituzione e della manutenzione del serbatoio dell'HIV. Pertanto, lo sviluppo di un protocollo per l'elaborazione del fluido BAL per ottenere cellule che possono essere utilizzate in saggi virologici e immunologici per caratterizzare e valutare le popolazioni cellulari e sottoinsiemi all'interno del polmone è rilevante per comprendere il ruolo dei polmoni come HIV Serbatoi. Qui, descriviamo un tale protocollo, impiegando tecniche standard come la semplice centrifugazione e la citometria di flusso. Le cellule T CD4 e i AM possono quindi essere utilizzati per applicazioni successive, tra cui immunofenotipizzazione e HIV e quantificazione dell'RNA.
Introduzione
Una delle sfide più significative che devono affrontare una cura per l'infezione da HIV è la presenza del serbatoio HIV latente che provoca un rimbalzo della viremia plasmatica a seguito dell'interruzione della terapia antiretrovirale (ART)1,2. Mentre il serbatoio dell'HIV durante l'ART a lungo termine è ben documentato in diversi compartimenti tissutali, tra cui organi linfoidi secondari, tessuto linfoide associato all'intestino (GALT) e sistema nervoso centrale (SNC), i polmoni sono stati trascurati come un'area di studio dall'era pre-ART3. Tuttavia, i polmoni svolgono un ruolo centrale nella patogenesi dell'HIV. Infatti, i sintomi polmonari sono stati tra i primi indicatori di infezioni opportunistiche legate all'AIDS4. Anche nell'era moderna dell'ART, le persone con HIV sono maggiormente a rischio di sviluppare malattie polmonari infettive e non infettive rispetto alle persone senza HIV. Ad esempio, le persone con infezione da HIV sono a rischio elevato di infezione da pneumoniae da Streptococcal invasiva, così come la broncopneumomazione cronica ostruttiva (BPCO)5,6. Inoltre, la coinfezione della tubercolosi (TB) e dell'HIV è una sfida significativa per la salute pubblica in alcune regioni del mondo, in particolare nell'Africa subsahariana, poiché gli individui affetti da HIV hanno da 16 a 27 volte più probabilità di avere la tubercolosi rispetto alle persone senza HIV7. Sebbene siano state proposte alcune spiegazioni per questa suscettibilità all'infezione polmonare e alle malattie croniche8,9,10, i meccanismi cellulari precisi con cui gli individui con HIV soppresso il carico virale al plasma a rischio di complicanze polmonari non è stato completamente chiarito. È importante sottolineare che l'HIV è un fattore di rischio molto forte per l'infezione polmonare e la malattia cronica, indipendentemente dall'essere fumatori6.
L'analisi dell'ambiente immunitario del polmone è quindi cruciale per comprendere il suo ruolo nella salute e nella malattia. Anche se non invasivi, i campioni di espettorato indotti tendono a contenere grandi quantità di cellule epiteliali e detriti con linfociti polmonari rari e nessun AM, limitando il loro ruolo ad applicazioni specifiche. Al contrario, grandi biopsie di tessuto non possono essere ottenute in assenza di sospetta malattia a causa dei rischi associati di sanguinamento significativo e pneumotorace (collasso del polmone). Inoltre, la maggior parte delle cellule immunitarie polmonari si trovano principalmente a livello mucosale dove i polmoni sono continuamente stimolati dagli antigeni durante la respirazione. A tal fine, la broncoscopia per ottenere il fluido BAL ha il vantaggio di fornire un accesso relativamente sicuro a linfociti e AM (vedere la figura1). I macrofagi costituiscono la più grande percentuale di cellule all'interno del fluido BAL, seguiti dai linfociti11. È quindi utile stabilire un metodo con cui il fluido BAL può essere elaborato per l'uso in applicazioni successive, come l'immunofenotipizzazione, la coltura cellulare, la trascrittomica o qualsiasi altra applicazione. Il protocollo per l'elaborazione del fluido BAL qui descritto è adattato dalle procedure generali descritte in precedenza e ottimizzate per i vari saggi a valle impiegati. Questa metodologia consente l'isolamento delle cellule immunitarie mucosali sia polmonari che mieloidi per la loro caratterizzazione fenotipica e funzionale, nonché una valutazione del serbatoio dell'HIV negli adulti che vivono con l'HIV.
Per stabilire questo protocollo, abbiamo utilizzato i seguenti criteri per reclutare i partecipanti allo studio15. Per i partecipanti idonei a partecipare a questo studio, dovevano essere individui affetti da HIV che soddisfacevano i seguenti criteri: (1) sull'ART per almeno 3 anni; (2) carico virale soppresso (VL) per un minimo di 3 anni; (3) Numero di celle T CD4 di 200/mm3; (4) disposti a sottoporsi alla spirometria e alla broncoscopia. I pazienti con i seguenti criteri sono stati esclusi dallo studio: (1) controindicazione(e) alla broncoscopia; 2 elevato rischio di sanguinamento: coagulopatia o terapia warfarin o clopidogrel; (3) trombocitopenia (piastrine basse); (4) infezione polmonare attiva o un altro processo polmonare acuto; (5) incinta/cercando di rimanere incinta.
Protocollo
Questo protocollo di ricerca è stato istituito direttamente sulla base dei principi inclusi nella Dichiarazione di Helsinki e ha ricevuto l'approvazione dai comitati di revisione istituzionale del McGill University Health Centre (RI-MUHC, #15-031), l'Università Montréal (UQAM, #602) e il Centre de Recherche du Centre Hospitalier de l'Université de Montréal (CR-CHUM, #15-180).
1. Lavage Bronchoalveolar
NOT: Questa sezione descrive la broncoscopia eseguita da un respirologo autorizzato con l'assistenza di un terapeuta respiratorio16,17.
- Preparare i pezzi di apparato necessari per la procedura, tra cui un broncoscopio e salina. Somministrare spray anestetico alla parte posteriore della gola del paziente. Evitare l'uso eccessivo di anestesia topica quando possibile. Applicare i cavi cardiaci al torace per monitorare la frequenza cardiaca e il ritmo e una sonda di ossigeno al primo dito di una mano al fine di monitorare la saturazione di ossigeno. Inserire la cannula nasale nelle narici per fornire ossigeno supplementare.
- Posizionare il paziente, preferibilmente in posizione supina. Somministrare la sedazione come segue: midazolam 0.01-0.04 mg/kg e fentanil 50-100 g (per facilitare il comfort del paziente e ridurre al minimo il riflesso della tosse) per via endovenosa, in presenza di un respirologo o anestesista.
- Avanzare il broncoscopio flessibile fino a quando non è incastrato nel bronco sottosegmentale desiderato. Instillare la salina (50-60 mL alla volta) con la siringa, quindi applicare un'aspirazione delicata (50-80 mmHg). Il fluido di lavage raccoglierà nella siringa e poi sarà trasferito in un contenitore di raccolta.
- Ripetere lo sciacquone per un totale di 200-300 mL di lavaggio. Raccogliere almeno 100 mL di liquido BAL, se possibile.
- Posizionare il liquido BAL sul ghiaccio.
2. Isolamento delle cellule BAL
NOT: La seguente procedura deve essere eseguita in condizioni sterili in un armadio di sicurezza biologica, classe II (BSL2) o superiore.
-
Conservare i campioni di BAL sul ghiaccio fino a quando non vengono elaborati.
- Vorticare il BAL nel tubo di raccolta originale e trasferirlo in un tubo da 50 mL utilizzando una pipetta sierologica. Se il liquido BAL appare molto torbido o contaminato da tessuto filamentoso, filtrare il fluido attraverso un filtro a rete di nylon da 70 m in un nuovo tubo da 50 mL.
- Centrifuga a 200 x g per 10 min a 4 gradi centigradi. Trasferire il supernatante in un nuovo tubo da 50 mL. Rompere delicatamente il pellet con una punta di pipetta e resospenderlo in 1 mL di mezzo RPMI 1640.
- Trasferire 1 mL del supernatante a ciascuno dei tubi di microcentrifuga da 10x 1,5 ml e il rimanente supernatante a tubi da 15 mL, 10 mL in ciascuno. Conservare tutti i tubi supernatanti a -80 gradi centigradi.
-
Elaborare il pellet a cellule BAL.
- Risospendere il pellet in 10 mL di RPMI 1640 per ogni 25 mL del campione originale. Centrifuga a 200 x g per 10 min a 4 gradi centigradi. Trasferire il supernatante in un nuovo tubo da 15 mL (scartare dopo aver assicurato che ci siano abbastanza cellule nel pellet).
- Risospendere il pellet in 1 mL di RPMI 1640 - 10% siero bovino fetale (FBS) e contare utilizzando trypan blu e un emocitometro.
NOT: Se il liquido BAL non è separato dall'aderenza delle cellule prima dello smistamento, procedere alla sezione 4.
3. Aderenza delle cellule BAL (facoltativo)
NOT: Questo protocollo alternativo può essere eseguito prima o al posto dell'ordinamento delle celle. La seguente procedura deve essere eseguita in condizioni sterili in un cabinet BSL2 (o superiore).
- Trasferire il numero desiderato di celle BAL per l'ordinamento in un nuovo tubo da 15 mL e fare il volume corretto per 1,5 x 106 macrofagi /mL. Piastra 2 mL di cellule per pozzo in piastre a 6 pozzetti e incubare per 2 h a 37 gradi centigradi con 5 % CO2, per consentire il tempo per l'aderenza.
- Dopo l'incubazione, aspirare attentamente i supporti contenenti cellule non aderenti e trasferirli in un tubo da 15 mL. Centrifuga a 300 x g per 10 min a temperatura ambiente (RT). Rimuovere il supernatante e risospendere a 1 x 107 celle/mL in salina con buffer fosfato (PBS) - 2 % FBS e trasferire la sospensione in un tubo di polistirolo dal fondo rotondo da 5 mL. Questa frazione di linfociti è ora pronta per macchiare per lo smistamento cellulare.
- Alle restanti cellule aderenti nella piastra, aggiungere 1 mL per pozzo di soluzione di dissociazione cellulare (vedi la Tabella dei Materiali) e incubare per almeno 15 minuti a 37 gradi centigradi con 5% CO2, fino a quando le cellule si separano facilmente dalla piastra con una punta di pipetta.
- Raschiare delicatamente ma accuratamente le cellule aderenti dalla superficie del pozzo utilizzando una punta pipetta e utilizzare 1 mL di liquido nel pozzo per aiutare con il distacco. Trasferire le celle in un nuovo tubo da 15 mL. Lavare i pozze con 1 mL di PBS e aggiungerlo allo stesso tubo. Comvestire il contenuto del tubo a 5 mL con PBS.
- Centrifuga a 300 x g per 10 min a RT. Rimuovere il supernatante, remettere in sospensione a 1 x 107 celle / mL PBS - 2% FBS, e trasferire la sospensione a un tubo di polistirolo dal fondo rotondo da 5 mL. Questa frazione mieloide è ora pronta per macchiare per lo smistamento delle cellule.
4. Isolamento delle cellule mononucleari del sangue periferico
NOT: La seguente procedura deve essere eseguita in condizioni sterili in un cabinet BSL2 (o superiore).
- Lo stesso giorno della broncoscopia (generalmente direttamente prima della raccolta BAL), ottenere sei tubi di sangue velenoso da un donatore in tubi di acido etilenediamineatraacetica (EDTA) (circa 10 mL per tubo).
- Separare il sangue centrifugando i tubi del sangue a 300 x g per 15 min a RT. Trasferire il plasma a tubi di microcentrifuga da 1,5 mL in 1 mL e conservarlo a -80 gradi centigradi.
-
Eseguire la separazione del gradiente di densità.
- Aggiungere 2 mL di RPMI 1640 ad ogni tubo sanguigno e mescolare bene utilizzando una pipetta sierologica.
- Trasferire a tubi da 3x 50 mL e fare il volume in ogni tubo a 25 mL con RPMI 1640.
- Preparare un altro lotto di tubi 3x 50 mL, ciascuno contenente 20 mL di mezzo di separazione dei linfociti (LSM) (vedi la tabella deimateriali) a RT. Lentamente e delicatamente strato 25 mL di sangue diluito sulla parte superiore del LSM per ciascuno dei tre tubi, tenendo il tubo ad un angolo di 45 gradi .
- Centrifuga a 600 x g per 25 min a RT con bassa accelerazione e nessuna decelerazione (freno off).
-
Eseguire un lavaggio delle cellule mononucleari del sangue periferico (PBMC).
- Trasferire lo strato di cellule all'interfaccia delle due fasi liquide nel tubo in un tubo da 50 mL utilizzando una pipetta sierologica; se ci sono più di 30 ml di volume, dividerlo in due tubi. Fare il volume in ogni tubo a 50 mL con PBS.
- Centrifuga a 700 x g per 5 min a RT e rimuovere il maggior numero di supernatali possibile.
- Risospendere il pellet e fare il volume a 25 mL con PBS. Centrifuga a 350 x g per 10 min a RT e rimuovere il maggior numero possibile di supernatali.
- Ripetere il passaggio di lavaggio descritto nel passaggio 4.4.3.
- Risospendere il pellet in 5 mL di PBS - 2% FBS e contare le celle.
5. Ordinamento di celle BAL intere e PBMC
NOT: La seguente procedura deve essere eseguita in condizioni sterili in un BSL2 (o superiore).
- Preparare il buffer di ordinamento contenente PBS - 5% FBS - 25 mM HEPES (pH 7.4). Preparare 5 mL di tubi in polistirolo a fondo rotondo con 1 mL di FBS per la raccolta di sottoinsiemi di cellule ordinate.
-
Eseguire la colorazione.
- Preparare tubi in polistirolo a fondo rotondo da 3x5 mL, ciascuno per BAL (cellule intere o frazioni di linfociti e mieloidi dopo l'aderenza) e PBMCC (vedi sezione 4). Per ogni sottoinsieme, preparare un tubo con celle da ordinare e due tubi di 5 x 105 celle da utilizzare per i controlli di compensazione delle macchie instainate e vitali.
- Centrifuga a 350 x g per 5 min a 4 gradi centigradi. Rimuovere i supernatanti, risospendere le celle per i controlli in 100 L di PBS, e conservarle a 4 gradi centigradi fino a quando i controlli di compensazione non possono essere preparati come descritto nel passaggio 5.2.6.
- Preparare un reagente di blocco 1:20 del recettore Fc (FcR) in PBS - 5% FBS (vedere la Tabella dei Materiali- per evitare il legame non specifico dell'anticorpo a FcR sulle cellule che esprimono FcR). Risospendere le cellule per ordinarle a 1 x 107 celle in 250 - L di miscela di blocco FcR. Incubarli per 1 h a 4 gradi centigradi.
- Dopo l'incubazione, aggiungere il cocktail anticorpo appropriato (vedi Tabella 1) alle cellule e incubare per 1 h a 4 gradi centigradi al buio.
- Dopo 1 h di colorazione, aggiungere 1 mL di PBS alle cellule e centrifugare a 350 x g per 5 min a 4 gradi centigradi. Rimuovere il supernatante e risospendere nuovamente le celle nel buffer di ordinamento per avere 1 x 107 celle in 250 .
- Preparare i controlli di compensazione.
- Aggiungere tre gocce ciascuna di perline anti-tono Ig, z e di compensazione di controllo negativo (vedere la Tabella dei Materiali) per 1 mL di PBS in un tubo di microcentrifuga e trasferire 100 L a ogni tubo di polistirolo a fondo rotondo da 5 mL da utilizzare per la compensazione. Preparare un tubo per ogni fluorocro presente nel cocktail da utilizzare.
- Aggiungere 1 -L di ogni anticorpo nel cocktail a un tubo diverso contenente perline. Aggiungere 1 ol di colorazione di vitalità a uno dei tubi di 5 x 105 celle messi da parte al punto 5.2.1. Incubare per 20 min a 4 gradi centigradi al buio.
- Aggiungere 1 mL di PBS ad ogni tubo e centrifugare a 350 x g per 5 min a 4 gradi centigradi. Rimuovere il supernatante e sospendere il pellet in 250 gradi l di PBS. Conservare al buio fino a quando necessario.
- Ordinare le cellule per smistamento cellulare attivato dalla fluorescenza (FACS) in tubi di raccolta preparati con 1 mL di FBS e vortice delicatamente per rivestire i lati dei tubi con siero.
- Ordinare le celle BAL a bassa pressione. Le celle del cancello prima di escludere il rumore e includere le cellule live, CD45, e all'interno di questa popolazione cancello fuori doppietto cellule (Vedere Figura 3). All'interno della popolazione di mieloidi più grande sorta CD206 e CD169 cellule doppio positivo come AM; all'interno della popolazione di linfociti più piccola isolare CD3- cellule e ordinare sia CD4 che CD8 singole popolazioni positive (vedere Figura 3; strategia di gating descritta nella sezione dei risultati rappresentativi).
- Quando si ordinano i PBMC, le celle cancello prima di escludere il rumore e includere le celle live, CD45 e all'interno di questa popolazione cancello fuori doppietta. Successivamente, cancello sulle celle CD3 e all'interno del CD3- popolazione, cancello prima su CD14 e ordinare monociti uni positivi, e poi all'interno del CD3- porta della popolazione su CD4 e CD8 e ordinare entrambe le singole popolazioni positive (strategia di gating dettagliata nel nella sezione Risultati rappresentativi.
6. Immunofenotipizzazione di AM e PBMC
NOT: La seguente procedura deve essere eseguita in condizioni sterili in un cabinet BSL2 (o superiore).
- Aggiungere fino a 1 milione ciascuno di AM e PBMC a due tubi di polistirolo a fondo rotondo da 5 mL separati. Centrifuga a 300 x g per 5 min a 4 gradi centigradi e rimuovere il super-natante.
- Eseguire il blocco FcR per migliorare la specificità della colorazione dell'anticorpo. A tale scopo, risospendere le celle in 100 : L di PBS - 2% FBS e aggiungere 1,4 L di reagente di blocco FcR. Incubare per 20 min a 4 oC.
-
Eseguire la colorazione extracellulare.
- Dopo l'incubazione con il blocco FcR, aggiungere il cocktail anticorpale extracellulare desiderato, vorticare i tubi e incubare per 1 h a 4 gradi centigradi al buio.
- Lavare 2x aggiungendo 500 ll l of PBS e centrifugando a 350 x g per 5 min a 4 gradi centigradi.
-
Prepararsi per la fissazione e la permeabilizzazione (vedere la Tabella dei materiali per i reagenti specifici utilizzati).
- Preparare la soluzione di permeabilizzazione con 1 parte di buffer permeabilizzazione e 3 parti diluente buffer. Risospendere il pellet in 1 mL di soluzione di permeabilizzazione e incubare per 40 min a 4 gradi centigradi al buio.
- Preparare la soluzione di lavaggio utilizzando 1 tampone di lavaggio parte e 4 parti H2O. Aggiungere 2 mL di soluzione di lavaggio alle cellule permeabilizzate e centrifugare a 350 x g per 5 min a 4 gradi centigradi. Togliete il super-acletterante.
-
Eseguire la colorazione intracellulare.
- Risospendere le cellule in una soluzione di lavaggio 100 ol di 1x, aggiungere gli anticorpi intracellulari desiderati, vorticare i tubi e incubare per almeno 1 h a 4 gradi centigradi al buio.
- Aggiungere 2 mL di soluzione di lavaggio e centrifugare a 350 x g per 5 min a RT. Rimuovere il supernatante e risospendere il pellet in 200 gradi di PBS. Conservare le celle a 4 gradi centigradi al buio fino a quando necessario.
7. Residuo di cellule BAL
NOT: La seguente procedura deve essere eseguita in condizioni sterili in un cabinet BSL2 (o superiore).
- Numero di cellule permettendo, crioconservare le cellule vive dal pellet di cellule BAL (dal punto 2.2.2).
- Preparare i supporti congelanti contenenti il 90% di FBS - 10% di zolfo dimetilo (DMSO).
- Centrifugare le cellule a 300 x g per 10 min a 4 gradi centigradi. Rimuovere il supernatante e risospendere in 1,5 mL di congelare i supporti in una fiala criogenica. Trasferire le fiale criogeniche in un contenitore di congelamento a velocità controllata (si veda la Tabella deiMateriali) e posizionarle a -80 gradi centigradi. Trasferire le cellule in azoto liquido per la conservazione a lungo termine una volta raggiunta la temperatura.
-
Conservare le cellule BAL come pellet secchi.
- Trasferire le cellule rimanenti in un tubo di microcentrifuga da 1,5 mL. Centrifuga in una centrifuga contro-top a 6.000 x g per 1 min. Rimuovere quanto più supernatante possibile senza disturbare il pellet. Conservare il pellet a -80 gradi centigradi.
8. Quantificazione del DNA e dell'RNA dell'HIV
NOT: La seguente procedura deve essere eseguita in condizioni sterili in un cabinet BSL2 (o superiore).
- Quantificazione totale del DNA HIV
- Per evitare l'inibizione della reazione a catena della polimerasi (PCR) con detriti di lisa BAL, utilizzare un kit di estrazione del DNA (vedere la tabella dei materiali) per estrarre il DNA da un campione di cellule BAL secondo le istruzioni del produttore. Utilizzare 15 l di questo DNA combinato con un master mix nella fase di preamplificazione descritta di seguito (passaggio 8.1.3).
- Preparare le diluizioni curve standard.
- Come sopra, utilizzare un kit di estrazione del DNA per estrarre il DNA da un pellet di 2 x 106 cellule ACH-2 (vedere la Tabella dei Materiali).
- Dopo l'eluizione del DNA, eseguire diluizioni seriali di 10 volte del DNA ACH-2 per generare sei diluizioni, che vanno da 3 x 105 cellule a 3 cellule per 15 .
- Eseguire una fase di preamplificazione.
- In una stanza separata, preparare il master mix per n - 2 campioni che comprendono 1x buffer di polimerasi, 3 mM di MgCl2, 300 dNTP e 2.5 U di Taq DNA polimerasi (vedi tabella dei materiali ) e 300 nM di ciascuno dei quattro primer (vedi tabella dei materiali) 8.1.3.2). Eseguire tutte le misure in pozzi triplicati.
- Utilizzare primers hCD3OUT5', hCD3OUT3', ULF1 e UR1 per generare DNA amplificato sia da CD3 umano che da HIV (vedere le sequenze nella tabella 2). Si noti che entrambi i geni sono preamplificatore nello stesso tubo. Mescolare delicatamente e ruotare il tubo per garantire una miscelazione completa.
- Distribuire 35 l di master mix per pozzo in una piastra PCR da 96 pozzetti e aggiungere 15 l di DNA standard o campione. Il volume di reazione totale è di 50.
- Eseguire la preamplificazione (denaturazione a 95 gradi centigradi per 8 min, seguita da 12 cicli di 95 gradi centigradi per 1 min, 55 gradi centigradi per 40 s, 72 gradi centigradi per 1 min e allungamento a 72 gradi centigradi per 15 min).
- Eseguire PCR in tempo reale.
- Per quantificare CD3 e HIV DNA, preparare due miscele master contenenti 1x PCR reaction master mix (vedi la tabella dei materiali), 1.250 nM appropriati primer e sonda da 100 nM. Utilizzare i primer HCD3IN5' e HCD3IN3' e sondare CD3 Fam ' per quantificare il CD3 umano in una reazione, e primer UR2 e LambdaT e sonda UHIV Famè per quantificare il DNA dell'HIV in un'altra reazione (vedi le sequenze nella tabella 2). Distribuire 13,6 ll di ogni miscela in tubi qPCR adattati.
- Diluire il prodotto PCR di preamplificazione a 1:10 in acqua sterile, DNase, RNase e proteasi libera. Aggiungere 6,4 l di ciascun campione diluito a 13,6 litri di mix qPCR in tubi adattati qPCR per un volume di reazione totale di 20 gradi.
- Eseguire la PCR in tempo reale utilizzando il seguente programma: denaturazione a 95 gradi centigradi per 4 min e 40 cicli di 95 s per 3 s e 60 gradi centigradi per 10 s con singola acquisizione.
- Estrapolare il numero di copie dell'HIV e gli equivalenti delle celle numeriche in ogni tubo di reazione dalle curve standard. Calcolare il numero di copie del DNA HIV/106 cellule.
- Quantificazione dell'RNA HIV
- Estrarre l'RNA da un campione di cellule BAL, utilizzando un kit di estrazione dell'RNA (vedere la tabella deimateriali) secondo le istruzioni del produttore. Usare 17 l di questo RNA nella fase di trascrizione inversa e preamplificazione descritta di seguito (passaggio 8.2.4).
- LTR-gag RNA sintetizzato in vitro e precisamente quantificato viene utilizzato come standard; è a spillo in un estratto di RNA donatore sano per la normalizzazione GUSB. Preparare sei diluizioni seriali di 10 volte di questo standard, corrispondenti a 3 x 105 cellule a tre copie di RNA LTR-gag in 17 .
- Distribuisci 17 l di ciascuna diluizione standard e ogni campione in una piastra PCR a 96 pozze e tratta i campioni con DNase (vedi la tabella deimateriali) per 10 min a 25 gradi centigradi per rimuovere il DNA genomico contaminante. Fermare la reazione aggiungendo 2 : L di 25 mM EDTA e incubare i campioni per 10 min a 65 gradi centigradi.
- Eseguire la trascrizione inversa (RT) e la PCR di preamplificazione.
- Eseguire questo passaggio utilizzando un kit RT-PCR in un solo passaggio (vedere la tabella dei materiali) secondo le istruzioni del produttore. Utilizzare i primer GUSB in avanti 1, GUSB reverse 1, UR1 e ULF1 per generare cDNA amplificato sia da GUSB umano come gene di pulizia che da RNA HIV LTR-gag (vedere le sequenze nella tabella 2). I valori GUSB verranno utilizzati per normalizzare i valori HIV.
- Distribuire 31 l di master mix per bene nella stessa piastra PCR da 96 po' contenente gli standard e i campioni trattati con DNase e mescolare bene. Il volume di reazione totale è di 50.
- Eseguire la piastra per 16 cicli secondo le istruzioni del produttore, con una temperatura di annealing di 55 gradi centigradi.
- Eseguire PCR in tempo reale.
- Preparare due miscele master contenenti 1x PCR reaction master mix (come sopra nel passo 8.1.4.1), 1250 nM primer appropriati, e 100 nM sonda. Utilizzare primer GUSB forward 2, GUSB reverse 2 e sonda GUSB-HEX per quantificare GUSB cDNA in una reazione; utilizzare primers UR2, LambdaT, e sonda UHIV Famè per quantificare IL cDNA dell'HIV in un'altra reazione (vedere le sequenze nella tabella 2).
- Distribuire 13,6 ll di ogni miscela master in tubi adattati qPCR. Diluire i prodotti PCR di preamplificazione RT 1:10 in acqua sterile, DNase, RNase e proteasi e aggiungere 6,4 l di ogni campione diluito o standard al mix PCR appropriato. Il volume di reazione totale è di 20.
- Eseguire la PCR in tempo reale utilizzando il seguente programma: denaturazione a 95 gradi centigradi per 4 min e 40 cicli di 95 s per 3 s e 60 s per 10 s con singola acquisizione (selezionare il canale verde per Fame e giallo per HEX).
Risultati
Nella maggior parte dei non fumatori, il liquido BAL viene ricevuto in un contenitore sterile ed è un liquido leggermente torbido di colore giallo-arancio. Il fluido può essere di colore più rosa se il donatore è stato sottoposto a biopsie endobronchiali durante la broncoscopia e si è verificato qualche sanguinamento. Il fluido può essere di colore più scuro se il donatore è un fumatore. Dopo la centrifugazione, il supernatante BAL sarà quasi chiaro e leggermente arancione, mentre il pellet cellulare può variare di colore dal bianco sporco al marrone molto scuro, a seconda delle condizioni del campione e se il donatore era un fumatore o meno.
Durante il conteggio dell'intero campione DI BAL, è possibile visualizzare diversi tipi di cellule, tra cui macrofagi più grandi e rotondi di circa 17 m di diametro e linfociti rotondi più piccoli intorno a i 7,3 m di diametro18,19 (vedere la figura2). I macrofagi sono ingranditi nei fumatori di circa il 40%18. La distinzione tra i tipi di cellule consente di contare i macrofagi e i linfociti separatamente. Ci possono essere anche alcuni detriti visibili sul campo, soprattutto nei campioni di fumatori. I macrofagi sono il tipo di cellula più abbondante nel BAL, che rappresenta circa l'85% delle cellule nei non fumatori20, e sono arricchiti in fumatori in modo che possano sembrare quasi esclusivi.
Le cellule BAL hanno la tendenza ad aggregarsi, quindi devono essere mescolate bene durante tutte le manipolazioni. Il pellet può apparire scuro anche dopo diversi passaggi di lavaggio. Se i detriti filamentosi sono evidenti nella frazione dopo la colorazione per lo smistamento delle cellule, passare le cellule attraverso un filtro di 70 m prima di passarle attraverso la selezionatrice di celle.
Lo smistamento delle cellule BAL deve essere fatto a bassa pressione per garantire che le dimensioni delle goccioline siano sufficientemente grandi da ospitare i macrofagi. Le celle vengono prima gated per includere tutte le celle CD45e21, e quindi in base alla fattibilità per garantire che tutte le celle morte siano escluse (vedere la figura 3). Vengono quindi scelte le cellule singlet e all'interno di questo, due popolazioni sono gated in base alle dimensioni e morfologia, vale a dire le cellule mieloidi più grandi e linfociti più piccoli (vedi Figura 3). All'interno delle celle più grandi, le cellule sono gated su CD20622,23 e CD16922 e le cellule doppie positivi sono ordinate come AM, mentre all'interno delle celle più piccole, le cellule CD3sono scelte e gated su CD4 e CD8; Le celle monopositivo CD4 e CD8 a positivo singolo (vedere la figura 3). I marcatori utilizzati sono stati scelti sulla base di fenotipi di AM descritti in precedenza, come il recettore del mannosio CD206, trovato sulle cellule fagocitiche23, e il recettore sialoadhesin CD16922.
Quando si smistano i PBMC, le celle vengono prima sbarrate sulla dispersione laterale e in avanti che dovrebbe mostrare una popolazione omogenea di linfociti, tutte prese, escluso il rumore vicino all'asse zero (dati non mostrati). La popolazione è recintato sulla vitalità e CD45, e cd45 dal vivovengono utilizzati. Questa popolazione è poi gated su CD3; per isolare i monociti, la popolazione CD3- viene successivamente gated su CD14 e tutte le singole cellule positive vengono ordinate. Per isolare i sottoinsiemi di linfociti, le cellule CD3sono gated su CD4 e CD8 e sia singole popolazioni positive che cellulari sono ordinate.
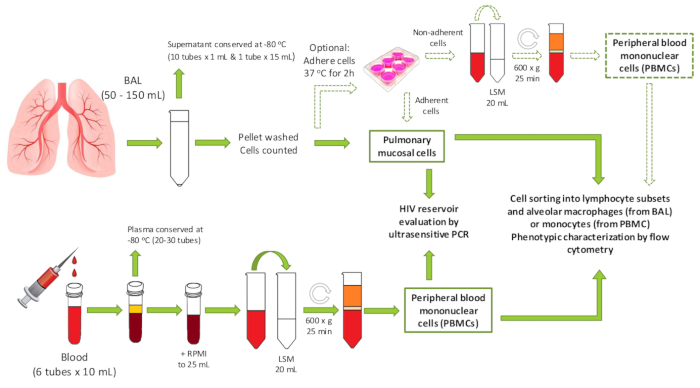
Figura 1 : Panoramica del protocollo. Schema che mostra il flusso di lavoro del protocollo, inclusi i potenziali utilizzi a valle degli esempi generati. PBMC - cellule mononucleari del sangue periferiche; BAL - lavaggio bronchoalveolar; LSM - Mezzo di separazione dei linfociti. Fare clic qui per visualizzare una versione più grande di questa figura.
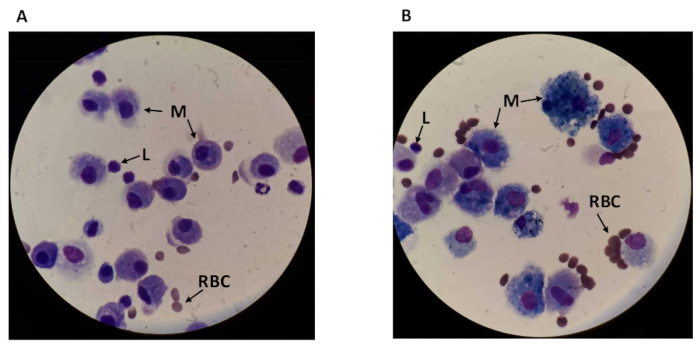
Figura 2 : vista sul campo del microscopio dell'intero fluido BAL. Immagini al microscopio da (A) un non fumatore e (B) un fumatore con linfociti visibili (L), macrofagi (M) e globuli rossi (RBC). L'ingrandimento è 1.000x (10x oculare e 100x lente con immersione olio). Fare clic qui per visualizzare una versione più grande di questa figura.
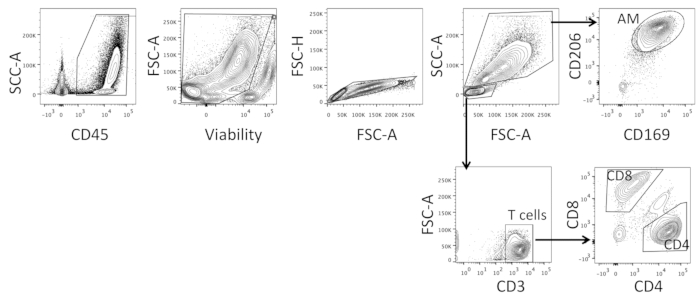
Figura 3 : Strategia di gating rappresentativa per l'ordinamento cellulare di intere celle BAL. Strategia di Gating utilizzata per ordinare macrofagi alveolare (AM), CD4 e cellule T CD8 da campioni interi di cellule BAL. Fare clic qui per visualizzare una versione più grande di questa figura.
| campione | anticorpo | Fluorocromo | clone m | Volume per test (L) |
| BAL e PBMC | Live/Morto | APC-H7 | - | 1 : il nome del |
| CD45 (informazioni in stato indue) | PE-Cy7 | HI30 (in questo MODO 30) | 5 Del numero 3( | |
| CD3 (in questo caso) | Aleksej 700 | UCHT1 (in modo non introito | 2 Il nome del sistema | |
| CD4 (in questo caso) | PE-cy5 | NUMERO di giochi di posta elettronica | 4 DEL psu' | |
| CD8 (in questo caso) | BV605 (in inglese) | SK1 | 3 (COM del nome | |
| SOLO BAL | CD206 (informazioni in inglese) | Pe | 19.2 19.2 | 10 del sistema |
| CD169 (informazioni in inglese) | BB515 | 7-239 | 5 Del numero 3( | |
| Solo PBMC | CD14 (informazioni in due) | BV786 (in inglese) | M5E2 (in questo stato del sistema) | 5 Del numero 3( |
Tabella 1: pannello di flusso per l'ordinamento di cellule BAL intere e PBC isolate.
| bersaglio | passo | Nome Primer | Sequenza Primer | |||
| HIV DNA totale o HIV LTR-Gag RNA | PCR pre-amplificazione | UR1 | 5'-CCA TCT TCC TTC TAG C-3' | |||
| ULF1 | 5'-ATG CCA CGT AAG CGA AAC TCT GGG TCTCTCT TGG TTA GAC-3' | |||||
| PCR in tempo reale | UR2 | 5'-CTG AGG GAT CTC TAG CT CC-3' | ||||
| LambdaT | 5'-ATG CCA CGT AAG CGA AAC T-3' | |||||
| UHIV Famzen: | 5'-/56-FAM/CA CTC AAG G/'e/C AAG CTT TAT TGA GGC/3IABkFQ/-3' | |||||
| CD3 DNA | PCR pre-amplificazione | HCD3 su 5' | 5'-ACT GAC ATG GAA CAG GGG AAG-3' | |||
| HCD3 su 3' | 5'-CCA GCT CTG AAG TAG GGA ACA TAT-3' | |||||
| PCR in tempo reale | HCD3 in 5' | 5'-GGC TAT CAT TCT TCT TCA AGG T-3' | ||||
| HCD 3 in 3' | 5'-CCT CTC TTC AGC CAT TTA AGT A-3' | |||||
| CD3 Famzen: | 5'-/56-FAM/AG CAG AGA A/'e/C AGT TAA GAG CCT CCA T/3IABkFQ/-3' | |||||
| RNA GUSB | PCR pre-amplificazione | GUSB Avanti 1: | 5'-ACC TAG AAT CTG CTG GCT ACT A-3' | |||
| GUSB Reverse 1: | 5'- GTT CAA ACA GAT CAC ATC CAC ATA C-3' | |||||
| PCR in tempo reale | GUSB Avanti 2: | 5'-TGC TGG CTA CTT GAA GAT G-3' | ||||
| GUSB Reverse 2: | 5'- CCT TGT CTG CTG CAT AGT TAG A-3' | |||||
| GUSB-HEX: | 5'-/5HEX/TCGCTCACACA/'/IT/CCAAATCCTTGGACC/3IABkFQ/-3' | |||||
Tabella 2: Sequenze di primer e sonda per la quantificazione del DNA e dell'RNA dell'HIV.
Discussione
Qui abbiamo descritto un metodo per l'elaborazione del fluido BAL per ottenere cellule T e AM CD4, insieme a PBMC abbinati, che possono essere studiati per studiare il serbatoio dell'HIV all'interno dei polmoni. Recentemente abbiamo riportato la quantificazione del DNA dell'HIV nelle cellule T CD4 da campioni di sangue periferico e BAL corrispondenti, e il nostro gruppo ha dimostrato che l'HIV è 13 volte più abbondante nelle cellule T polmonari CD4 rispetto a quelle del sangue periferico15. Tuttavia, i livelli di HIV DNA negli AM dipendono dai donatori e quindi, finora, non c'è stata una correlazione coerente tra i livelli di DNA dell'HIV nei linfociti rispetto ai macrofagi15. L'accesso a questi sottoinsiemi di cellule macrofagi primari, tuttavia, sarà uno strumento vitale per interrogare questa questione e ottenere una migliore comprensione del carico virale nel polmone nel contesto del serbatoio dell'HIV.
Nell'era pre-ART e in molti altri studi che utilizzano il liquido BAL, i partecipanti sono stati sottoposti a broncoscopia al fine di diagnosticare una patologia sospetta o ottenere una diagnosi microbiologica per i sintomi respiratori3. Tuttavia, siamo stati in grado di reclutare partecipanti senza sintomi polmonari attivi o patologie e tutti i partecipanti hanno firmato un modulo di consenso etico15. Siamo stati in grado di reclutare partecipanti dal nostro centro che hanno partecipato ad altri studi, come uno studio di screening spirologico per la malattia polmonare ostruttiva24, così come quelli sottoposti a altre procedure di ricerca, come la leucapheresis e Colonscopia. Ricerche precedenti tra le persone affette da HIV hanno dimostrato che l'altruismo è un fattore chiave che motiva la partecipazione agli studi di ricerca25. Come con molti esemplari umani, abbiamo notato una grande quantità di variabilità da persona a persona. Non c'era modo di "prevedere" da quali partecipanti avremmo ottenuto BAL con buone e scarse rese cellulari. A differenza del sangue periferico, che produce un numero abbastanza costante di linfociti, i numeri delle cellule nel liquido BAL sono molto variabili. Iniettare un volume salina maggiore nei polmoni (con la speranza di ottenere un maggiore ritorno del liquido BAL) non è sempre possibile in quanto grandi volumi di salina normale sono spesso associati a più tosse e un maggiore rischio di postbronoscopia della febbre. Abbiamo notato che l'uso di un broncoscopio di diametro più piccolo (piuttosto che più grande) ha permesso al respirologo di raggiungere più in profondità i bronchi e ottenere il fluido contenente maggiori quantità di cellule. Una scoperta coerente è stata che i fumatori di tabacco avevano proporzioni molto più grandi di AM rispetto ai linfociti all'interno del loro fluido BAL, che ci si aspetta come AR inghiottire i detriti e particolato. Inoltre, abbiamo osservato che il fluido BAL dei fumatori conteneva detriti che possono bloccare l'apparecchiatura utilizzata, come le macchine PCR e i citometri di flusso. Problemi simili possono essere osservati nelle aree ad alto inquinamento o gli individui esposti più frequentemente a una scarsa qualità dell'aria.
Per quanto riguarda il loro ruolo nella creazione di serbatoi di HIV e la persistenza virale, la purezza delle cellule T CD4 e dei AM è una considerazione chiave. Per questo motivo, abbiamo scelto di utilizzare lo smistamento delle cellule attivato dalla fluorescenza (FACS) per ottenere popolazioni cellulari altamente pure. È anche possibile che il liquido BAL raccolto possa essere contaminato dal sangue come qualche sanguinamento minore è previsto durante una broncoscopia; la presenza di cellule B ingenue indiche lo indicherebbe, e le cellule possono essere lavate in un buffer di lisi dei globuli rossi per aggirare questo problema. Un'altra sfida con lo studio del fluido BAL riguarda la quantificazione dei marcatori infiammatori e delle citochine, che sono importanti per comprendere la persistenza dell'HIV26. Poiché la saliera instillata diluisce il fluido BAL, i livelli di mediatori infiammatori e citochine possono essere difficili da misurare. Anche se è stato proposto un fattore di correzione dell'urea per tenere conto della diluizione, vi è relativamente poca letteratura che ne descrive l'uso27,28.
Gli AM sono altamente autofluorescenti, il che pone un problema durante lo smistamento delle cellule e l'analisi fenotipica della citometria del flusso. In particolare, l'effetto è più pronunciato nei fumatori i cui AM possono essere di colore completamente nero, influenzando significativamente la loro autofluorescenza. Quando viene utilizzata da un laser blu standard da 488 nm, l'autofluorescenza AM è al suo apice a circa 540 nm, che si sovrappone agli spettri di fluorescenza di coniugati comunemente usati come FITC e PE29,30. Vale la pena notare che due laser separati possono essere utilizzati per eccitare FITC e PE (ad esempio, PE dal giallo/verde e FITC dal laser blu 488). Per superare l'autofluorescenza intrinseca con FITC, abbiamo usato AM incontaminati per determinare lo sfondo dell'autofluorescenza. Inoltre, l'uso dei controlli di fluorescenza meno uno (FMO) può essere molto utile per combattere questi problemi tecnici. Possono essere utilizzate perline più grandi (ad es. 7,5 m), che sono più vicine per compensare le popolazioni di macrofagi, rispetto alle perle più piccole (ad es., 3,0 m), che possono essere utilizzate per compensare le popolazioni di linfociti. Un approccio ancora più appropriato sarebbe quello di utilizzare una piccola frazione di celle come controlli a singola macchia, utilizzando un marcatore noto e altamente espresso sul sottoinsieme, come HLA-DR o CD45, coniugato a ciascuno dei fluorocromi desiderati, il che consentirebbe un compensazione accurata di quanto può essere raggiunto con perline. Nel caso dei campioni dei fumatori, questa tattica è particolarmente utile in quanto i macrofagi sono molto più grandi e più autofluorescenti. Inoltre, dalla fase di preparazione, l'intero campione BAL potrebbe essere coltivato in una piastra prima dello smistamento, come descritto nella sezione 3 del protocollo, per consentire una separazione delle popolazioni per aderenza. In questo modo, i macrofagi aderenti possono essere isolati da altre cellule non aderenti come i linfociti. La compensazione è molto meno impegnativa se le popolazioni di linfociti e AM sono separate piuttosto che esaminate insieme; tuttavia, basandosi sull'aderenza si tradurrà in una perdita di macrofagi, che è una considerazione importante quando i numeri di cellule sono già limitanti. Inoltre, un passo di aderenza potrebbe provocare l'attivazione indesiderata di monociti aderenti, che possono influenzare i risultati a valle generati utilizzando queste cellule. Il valore di smistare le cellule in modo efficiente in popolazioni più pure deve essere ponderato rispetto alla restrizione di avere meno di tali cellule per esperimenti successivi.
Altri modelli, in particolare i modelli murini, sono stati utilizzati per studiare le caratteristiche immunologiche e la biologia del macrofago. Mentre questi modelli sono estremamente utili e consentono una grande comprensione di un tipo di cella che è difficile da manipolare, hanno limitazioni. Molti dei marcatori di superficie cellulare variano tra topi e esseri umani in modo tale che l'immunofenotipo delle AM umane non sia completamente compreso. Tuttavia, questo sistema modello richiede la messa in comune di diversi topi per i saggi a causa dei bassi numeri di cellulare disponibili da ogni animale. Inoltre, la necessità di mettere in comune gli esemplari preclude considerazioni di predisposizione genetica e sesso. Recentemente, è stato dimostrato che il sesso svolge un ruolo nell'infettività dei macrofagi da HIV-1 a causa dell'espressione disparata del fattore di restrizione SAMHD-131. I primati non umani (NHP) rappresentano il modello più vicino agli esseri umani e hanno facilitato lo studio dell'infezione da virus dell'immunodeficienza simiana (SIV) e del suo effetto sul sistema immunitario, fornendo informazioni sul ruolo dei macrofagi residenti nei tessuti rispetto macrofagi derivati da monociti. Nei macachi rhesus, è stato anche dimostrato che il macrofago polmonare si isola dal virus BAL che ospita un virus competente per la replicazione; un saggio di escrescenza virale (VOA) è stato utilizzato per analizzare il comportamento della SIV nelle cellule residenti nei tessuti32. Tale scoperta è di notevole valore di ricerca, ma deve ancora essere convalidata negli esseri umani prima di poter essere applicata, e l'alto costo dell'uso di NHPs preclude l'uso di grandi popolazioni campione. Inoltre, i MICROBI umani saranno utili per molte altre applicazioni come i saggi di infezione virale/microbica in vitro e negli studi di altri patogeni come la tubercolosi/coinfezione dell'HIV.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori desiderano riconoscere i loro finanziatori: i Canadian Institutes of Health Research (CIHR) (grant #153082 a CC, MAJ, NC); il Réseau SIDA et maladies infectieuses du Fonds de recherche du Québec-Santé (FRQ-S) che ha concesso finanziamenti a CC e MAJ e alla Facoltà di Medicina dell'Università McGill che hanno concesso finanziamenti a CC. Questo studio è stato anche sostenuto in parte dal Canadian Institutes of Health Research (CIHR) - finanziato Canadian HIV Cure Enterprise (CanCURE) Team Grant HB2 – 164064 a MAJ, CC e NC. MAJ detiene il CIHR Canada Research Chair livello 2 in immunovirology e CC e NC hanno un premio FRQ-S Junior 1 e Junior 2 stipendio di ricerca, rispettivamente. ET detiene il premio RI-MUHC Studentship MSc.
Inoltre, gli autori desiderano riconoscere Josée Girouard e tutto il personale clinico coinvolto nel coordinamento e nell'ottenimento dei campioni, nonché i terapisti respiratori; Ekaterina Iourtchenko, Hélène Pagé-Veillette e Marie-Hélène Lacombe presso la piattaforma RI-MUHC Immunophenotyping; e la dott.ssa Marianna Orlova per la fornitura delle foto di microscopia. Ancora più importante, gli autori desiderano ringraziare i molti volontari senza i quali questa ricerca non sarebbe possibile.
Materiali
| Name | Company | Catalog Number | Comments |
| 70 µm Sterile Cell Strainer | Fisher Scientific | 22363548 | Nylon mesh filters with 70 µm pores to remove impurities from BAL sample before sorting |
| ACH-2 Cells | NIH | 349 | HIV-1 latent T cell clone with one integrated proviral copy which do not express CD4 |
| BD FACSAria | BD Biosciences | N/A | Cell sorter (configured to detect 16 colours simultaneously) |
| BD LSRFortessa X-20 | BD Biosciences | N/A | Flow cytometer (configured to detect 14 colours simultaneously) |
| Bronchoscope | Olympus | BF-1TH190 | EEIII HD therapeutic bronchoscope; channel width 2.8 mm; outer diameter 6.0 mm |
| Cell Disassociation Solution | Sigma | C5914 | Non-enzymatic formulation for gently dislodging adherent cell types from plastic or glass surfaces. |
| CD169 BB515 | BD Biosciences | 565353 | Sialic acid-binding molecule antibody used for flow cytometry |
| CD14 BV786 | BD Biosciences | 563698 | Endotoxin receptor antibody used for flow cytometry |
| CD206 PE | BD Biosciences | 555954 | Mannose receptor antibody used for flow cytometry |
| CD3 Alexa700 | BD Biosciences | 557943 | T cell co-receptor antibody used for flow cytometry |
| CD4 PE-Cy5 | BD Biosciences | 555348 | T cell co-receptor antibody used for flow cytometry |
| CD45 PE Cy-7 | BD Biosciences | 557748 | Receptor-linked protein tyrosine phosphatase antibody used for flow cytometry |
| CD8 BV605 | BD Biosciences | 564116 | T cell co-receptor antibody used for flow cytometry |
| CompBead Plus | BD | 560497 | Anti-mouse Ig, κ and negative control polystyrene microparticles used to optimize fluorescence compensation in flow cytometry |
| DNase I | Invitrogen | 18068015 | Digests single- and double-stranded DNA to oligodexyribonuleotides containing a 5' phosphate to remove contamination from RNA |
| dNTP Set 100 mM | Invitrogen | 10297-018 | Consists of four deoxynucleotides (dATP, dCTP, dGTP, dTTP) for use in PCR |
| Dimethyl Sulfoxide (DMSO) | Sigma | D8418 | Apolar, protic solvent used to make media for cryopreserving live cells |
| EDTA | Invitrogen | AM9912 | Used to stop Dnase I enzyme activity |
| FBS | Wisent Bioproducts | 080-150 | Premium fetal bovine serum to supplement media |
| FcR Blocking Reagent, Human | Miltenyi | 130-059-901 | Binds to Fc receptor on the cell surface to prevent non-specific binding of flow antibodies |
| FlowJo v10 | FlowJo LLC | N/A | Flow cytometry analysis software used for all analyses |
| HLA-DR BV650 | BD Biosciences | 564231 | MHC class II cell surface receptor antibody used for flow cytometry |
| HyClone HEPES solution | Fisher Scientific | SH3023701 | Buffer providing maintenance of physiological pH |
| Live/Dead APC-H7 | Invitrogen | L34975 | Viability marker used for flow cytometry |
| Lymphocyte Separation Medium (LSM) | Wisent Bioproducts | 350-000-CL | Polysucrose for isolation of PBMC from whole blood |
| Mr. Frosty Freezing Container | ThermoFisher | 5100-0001 | Freezing container ensuring rate of cooling very close to -1 °C/min, the optimal rate for cell preservation |
| OneComp eBeads | Invitrogen | 01-1111-41 | Anti-mouse, rat and hamster antibodies for compensation of PBMC samples |
| PBS 1x | Wisent Bioproducts | 311-010-CL | Phosphate buffered saline for cell washing and staining |
| PCR Tubes Corbett Rotor-Gene | Axygen | PCR-0104-C | 4-strip PCR tubes with 0.1 mL capacity for use with Corbett Rotor-Gene |
| PerfeCTa qPCR ToughMix | Quantabio | 95112 | 2x concentrated ready-to-use reaction cocktail for PCR amplification of DNA templates |
| QiaAmp DNA Mini Kit | Qiagen | 51304 | Kit for isolation of genomic, mitochondrial, bacterial, parasite or viral DNA. Includes QIAamp Mini Spin Columns, QIAGEN Proteinase K, Reagents, Buffers, Collection Tubes |
| RNeasy Mini Kit | Qiagen | 74104 | Kit for purification of up to 100 µg total RNA from cells, tissues, and yeast. Includes RNeasy Mini Spin Columns, Collection Tubes, RNase-free Reagents and Buffers |
| Rotor-Gene Q | Qiagen | 9001550 | Real-time PCR cycler |
| RPMI 1640 1x | Wisent Bioproducts | 350-000-CL | Cell culture media |
| Sterile Water | Wisent Bioproducts | 809-115-CL | DNase, RNase & protease free |
| Superscript™ III One-Step RT-PCR System | Invitrogen | 12574018 | RT-PCR kit which performs both cDNA synthesis and PCR amplification in a single tube. Includes SuperScript III RT/Platinum Taq Mix, 2x Reaction Mix (containing 0.4 mM of each dNTP, 3.2 mM MgSO4), magnesium sulfate |
| Taq DNA Polymerase | Invitrogen | 18038-042 | Thermostable enzyme that synthesizes DNA from single-stranded templates in the presence of dNTPs and a primer. Includes Taq DNA Polymerase, 10x PCR buffer, magnesium chloride |
| Transcription Factor Buffer Set | BD Biosciences | 562725 | Buffers for intracellular staining for flow cytometry. Includes fixation/permeabilization buffer, diluent buffer, perm/wash buffer |
| Trypan Blue | Sigma | T8154 | Viability dye to count cells using haemacytometer |
Riferimenti
- Chun, T. W., Fauci, A. S. Latent reservoirs of HIV: obstacles to the eradication of virus. Proceedings of the National Academy of Sciences of the United States of America. 96, 10958-10961 (1999).
- Finzi, D., et al. Latent infection of CD4+ T cells provides a mechanism for lifelong persistence of HIV-1, even in patients on effective combination therapy. Nature Medicine. 5, 512-517 (1999).
- Costiniuk, C. T., Jenabian, M. A. The lungs as anatomical reservoirs of HIV infection. Reviews in Medical Virology. 24, 35-54 (2014).
- Center for Disease Control and Prevention. A cluster of Kaposi's sarcoma and Pneumocystis carinii pneumonia among homosexual male residents of Los Angeles and Orange Counties, California. Morbidity and Mortality Weekly Report. 31, 305-307 (1982).
- Fitzpatrick, M., Crothers, K., Morris, A. Future directions: lung aging, inflammation, and human immunodeficiency virus. Clinics in Chest Medicine. 34, 325-331 (2013).
- Kunisaki, K. M. Will expanded ART use reduce the burden of HIV-associated chronic lung disease?. Current Opinion in HIV and AIDS. 9, 27-33 (2014).
- World Health Organization. . WHO | Tuberculosis and HIV. , (2018).
- Jambo, K. C., et al. Small alveolar macrophages are infected preferentially by HIV and exhibit impaired phagocytic function. Mucosal Immunology. 7, 1116-1126 (2014).
- Yeligar, S. M., et al. Dysregulation of Alveolar Macrophage PPARγ, NADPH Oxidases, and TGFβ. AIDS Research and Human Retroviruses. 33, 1018-1026 (2017).
- Cribbs, S. K., Lennox, J., Caliendo, A. M., Brown, L. A., Guidot, D. M. Healthy HIV-1-infected individuals on highly active antiretroviral therapy harbor HIV-1 in their alveolar macrophages. AIDS Research and Human Retroviruses. 31, 64-70 (2015).
- Holt, P. G., et al. Extraction of immune and inflammatory cells from human lung parenchyma: evaluation of an enzymatic digestion procedure. Clinical & Experimental Immunology. 66, 188-200 (1986).
- Brenchley, J. M., et al. High frequencies of polyfunctional HIV-specific T cells are associated with preservation of mucosal CD4 T cells in bronchoalveolar lavage. Mucosal Immunology. 1, 49 (2007).
- Mwandumba, H. C., et al. Mycobacterium tuberculosis; Resides in Nonacidified Vacuoles in Endocytically Competent Alveolar Macrophages from Patients with Tuberculosis and HIV Infection. The Journal of Immunology. 172, 4592 (2004).
- Gordon, S. B., et al. Inhaled delivery of 23-valent pneumococcal polysaccharide vaccine does not result in enhanced pulmonary mucosal immunoglobulin responses. Vaccine. 26, 5400-5406 (2008).
- Costiniuk, C. T., et al. HIV persistence in mucosal CD4+ T cells within the lungs of adults receiving long-term suppressive antiretroviral therapy. AIDS. 32, 2279-2289 (2018).
- American Thoracic Society. . American Thoracic Society - Bronchoalveolar Lavage. , (2004).
- King, T. E. . Basic principles and technique of bronchoalveolar lavage - UpToDate. , (2018).
- Lea, S., Dungwa, J., Ravi, A., Singh, D. Alveolar macrophage size is increased in COPD patients compared to controls. European Respiratory Journal. 50, (2017).
- Kuse, R., Schuster, S., Schübbe, H., Dix, S., Hausmann, K. Blood lymphocyte volumes and diameters in patients with chronic lymphocytic leukemia and normal controls. Blut. 50, 243-248 (1985).
- Heron, M., et al. Bronchoalveolar lavage cell pattern from healthy human lung. Clinical & Experimental Immunology. 167, 523-531 (2012).
- Rheinländer, A., Schraven, B., Bommhardt, U. CD45 in human physiology and clinical medicine. Immunology Letters. 196, 22-32 (2018).
- Yu, Y. R. A., et al. Flow Cytometric Analysis of Myeloid Cells in Human Blood, Bronchoalveolar Lavage, and Lung Tissues. American Journal of Respiratory Cell and Molecular Biology. 54, 13-24 (2015).
- Geiser, M. Update on Macrophage Clearance of Inhaled Micro- and Nanoparticles. Journal of Aerosol Medicine and Pulmonary Drug Delivery. 23, 207-217 (2010).
- Costiniuk, C. T., et al. Prevalence and predictors of airflow obstruction in an HIV tertiary care clinic in Montreal, Canada: A cross sectional study. HIV Medicine. , (2019).
- Balfour, L., et al. Altruism motivates participation in a therapeutic HIV vaccine trial (CTN 173). AIDS Care. 22, 1403-1409 (2010).
- Vandergeeten, C., Fromentin, R., Chomont, N. The role of cytokines in the establishment, persistence and eradication of the HIV reservoir. Cytokine & Growth Factor Reviews. 23, 143-149 (2012).
- Rennard, S. I., et al. Estimation of volume of epithelial lining fluid recovered by lavage using urea as marker of dilution. Journal of Applied Physiology (1985). 60, 532-538 (1986).
- Twigg, H. L., et al. Effect of highly active antiretroviral therapy on viral burden in the lungs of HIV-infected subjects. The Journal of Infectious Diseases. 197, 109-116 (2008).
- Duan, M., et al. Distinct Macrophage Subpopulations Characterize Acute Infection and Chronic Inflammatory Lung Disease. The Journal of Immunology. 189, 946 (2012).
- Garn, H. Specific aspects of flow cytometric analysis of cells from the lung. Experimental and Toxicologic Pathology. 57, 21-24 (2006).
- Szaniawski, M. A., Spivak, A. M., Bosque, A., Planelles, V. Sex influences SAMHD1 activity and susceptibility to HIV-1 in primary human macrophages. The Journal of Infectious Diseases. , (2018).
- Avalos, C. R., et al. Quantitation of Productively Infected Monocytes and Macrophages of Simian Immunodeficiency Virus-Infected Macaques. Journal of Virology. 90, 5643-5656 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon